实时荧光环介导等温扩增技术检测牛乳中的蜡样芽孢杆菌
贾雅菁1,付博宇1,王 羽1,马晓燕1,张先舟1,苑 宁2,张 伟1,*
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北农业大学理工学院,河北 沧州 061100)
摘 要:建立牛乳中蜡样芽孢杆菌便捷可靠的检测方法,根据已公布的蜡样芽孢杆菌hblA基因序列设计内外引物,并向反应体系中加入荧光染料SYBRGreen Ⅰ,利用实时荧光监测仪,建立实时荧光环介导等温扩增技术(real-time fluorescence loop-mediated isothermal ampli cation,RealAmp)检测蜡样芽孢杆菌的方法,扩增产物经电泳和酶切鉴定。通过21 株致病菌验证RealAmp特异性,并比较了RealAmp与普通环介导等温扩增技术的敏感性,对人工污染的检出限进行了测定。结果表明对21 株致病菌进行特异性实验,4 株蜡样芽胞杆菌呈阳性结果,17 株非蜡样芽胞杆菌均呈阴性结果。RealAmp检测纯菌的灵敏度为8.2 CFU/mL,比普通环介导等温扩增技术的灵敏度高10 倍,人工污染牛乳RealAmp的检出限为8.2 CFU/mL。并且在20 min左右即可判定结果。该方法快速、准确、灵敏度高、操作便捷、可实时监控检测蜡样芽孢杆菌,有望成为快速检测蜡样芽孢杆菌的有效方法。
关键词:实时荧光环介导等温扩增检测技术;蜡样芽胞杆菌;检测;牛乳
贾雅菁, 付博宇, 王羽, 等. 实时荧光环介导等温扩增技术检测牛乳中的蜡样芽孢杆菌[J]. 食品科学, 2016, 37(6): 184-189. DOI:10.7506/spkx1002-6630-201606033. http://www.spkx.net.cn
JIA Yajing, FU Boyu, WANG Yu, et al. Detection of Bacillus cereus in milk by real-time fluorescence loop-mediated isothermal ampli cation method[J]. Food Science, 2016, 37(6): 184-189. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201606033. http://www.spkx.net.cn
蜡样芽孢杆菌(Bacillus cereus)是革兰氏阳性兼性厌氧菌,产芽孢,生存范围广,一些菌株具有致病性[1-2]。食品受其污染的几率很高,特别是蛋白质和碳水化合物含量丰富的食品,人们一旦摄入被致病性蜡样芽孢杆菌污染的食品容易引发食物中毒[3]。在我国由蜡样芽孢杆菌引起的食物中毒在细菌性中毒中排前4 位[4]。
Notomi等[5]研发的环介导等温扩增技术(loopmediated isothermal amplification,LAMP)针对靶基因的6 个区域设计4 种特异引物,利用具有链置换活性的DNA聚合酶,在恒温条件下几十分钟内完成靶基因的高效扩增,该法在微生物检测领域有广泛的应用前景[6-8]。LAMP反应产物的检测可以通过肉眼观察法观察是否有白色焦磷酸镁沉淀,该法直观、操作便捷,但是结果的准确性受观察者自身影响比较大,当产物的浓度低时,肉眼观察易产生误差[9];也可采用电泳法观察是否有梯形条带产生,但是该方法不仅需要繁琐的电泳步骤,而且吸取产物时需要打开反应管,从而增加了检测过程中被污染的几率;由于缺乏适当的基础设施和昂贵的价格,利用先进的设备,如实时浊度检测仪检测LAMP产物是在许多检测机构中是不可行的[10]。
Lucchi等[11]成功用RealAmp技术建立疟原虫基因的检测方法。Yamazaki等[12]运用RealAmp技术成功检测了副溶血弧菌。本研究尝试利用LAMP反应原理与反应产物与荧光染料结合发出荧光的特点[13],在反应体系中加入荧光染料SYBRGreen Ⅰ,随着反应产物的增加与其结合的荧光染料也越来越多,荧光信号强度也随之增加,通过实时荧光监测仪对荧光强度的搜集,实现实时定性检测,建立实时荧光环介导等温扩增技术(realtime fluorescence loop-mediated isothermal ampli cation,RealAmp)检测蜡样芽孢杆菌的方法。
1 材料与方法
1.1 材料
1.1.1 菌种
本实验所用的21 株菌种见表1所示。其中9 株来自中国医学细菌保藏管理中心,6 株来自中国工业微生物菌种保藏管理中心,3 株蜡样芽孢杆菌和3 株ATCC菌株实验室分离保存。
表1 实验用菌种
Table 1 Bacterial strains used in this experiment

序号 菌株名称 拉丁文 编号1 蜡样芽孢杆菌菌 Bacillus cereus CMCC63302 2 蜡样芽孢杆菌菌 Bacillus cereus 实验室保存3 蜡样芽孢杆菌菌 Bacillus cereus 实验室保存4 蜡样芽孢杆菌菌 Bacillus cereus 实验室保存5 甲型副伤寒沙门氏菌 Salmonella schottmuelleri CMCC50001 6 乙型副伤寒沙门氏菌 Salmonella paratyphi b CICC21495 7 鼠伤寒沙门氏菌 Salmonella typhimurium CMCC50115 8肠炎沙门氏菌 Salmonella enteritis CMCC50041 9 宋内氏志贺氏菌 Shigella sonnei CMCC51334 10 痢疾志贺氏菌 Shigella dysenteriae CMCC51135 11 鲍氏志贺氏菌 Shigella boydii CMCC51522 12 单核增生性李斯特氏菌 Listeria monocytogenes CMCC54001 13 绵羊李斯特氏菌 Listeria ivanovii CICC21663 14 小肠结肠炎耶尔森氏菌 Yeysinia enterocolitica CICC21669 15 肺炎克雷伯氏菌 Klebsiella pneumoniae CICC21519 16 阪崎肠杆菌 Enterobacter sakazakii ATCC51024 17 变形杆菌 Proteusbacillus vulgaris CMCC49027 18 出血性大肠埃希氏菌 Escherichia coli O157:H7 CICC21530 19 产气荚膜梭菌 Clostridium perfringens ATCC13124 20 副溶血性弧菌 Vibrio parahaemolyticus ATCC 17802 21 金黄色葡萄球菌 Staphylococcus aureus CICC21600
1.1.2 试剂
MgSO4、dNTPs 北京全式金公司;Van91I内切酶及DNAMarker(100 bp) 大连宝生物公司;10×TheromoPol Reaction Buffer、DNA聚合酶(Bst DNA polymerase large fragment) New England Biolab公司;LAMP引物 北京华大基因研究中心合成;SYBRGreenⅠ荧光染料 北京天恩泽公司。
1.1.3 仪器与设备
实时荧光监测仪 德国ESE Gmbh公司;DYY-10C型电泳仪 北京市六一仪器厂;UVIpro凝胶成像系统 英国UVItec公司;Whatman T Gradient PCR扩增仪德国Biometra公司;QYC-200全温培养摇床 上海新苗医疗器械制造有限公司;TGL-16G离心机 上海安亭科学仪器厂;DH6000AB型电热恒温培养箱 天津市泰斯特仪器有限公司;数显超级恒温水浴锅 金坛市杰瑞尔电器有限公司。
1.2 方法
1.2.1 引物设计
引物是RealAmp反应体系中不可缺少的一种反应物质,而引物设计的好坏又与RealAmp反应的特异性和扩增效率有着直接的关系[14-15]。在GenBank上选取蜡样芽孢杆菌溶血素hblA基因序列,在线设计(http:// primerexplorer.jp/elamp4.0.0/index.html)引物包括外引物(F3和B3)和内引物(FIP和BIP)。引物信息见表2。
表2 RealAmp引物
Table 2 RealAmp primers

引物名称5’位置3’位置 序列(5’→3’)F3 86 107 GGGTTTAATGTAATGAAGGGTG B3 275 294 TTAATAGCATCATCAAGCGC FIP AGGCTCTAACTTACCTAAGTTGTCTGGTCTACCAATAATTGGCGG BIP TTAGCAGAATTACGTCAGACCGTTACTATAAGCAACTCCAACTACAC F2 116 135 GGTCTACCAATAATTGGCGG F1c 157 181 AGGCTCTAACTTACCTAAGTTGTCT B2 231 254 TACTATAAGCAACTCCAACTACAC B1c 185 207 TTAGCAGAATTACGTCAGACCGT
1.2.2 细菌DNA模板的制备
采用热裂解法。将保存的蜡样芽孢杆菌菌种接种于营养肉汤,置于37 ℃、220 r/min的摇床培养12 h。取菌液1.5 mL 11 000 r/min离心1 min弃上清液。用100 μL灭菌水洗涤沉淀2 次,之后加100 μL灭菌水充分悬浮菌体,放入沸水浴中10 min后取出。离心11 000 r/min,1 min取上清液即为所提DNA,保存温度-20 ℃。
1.2.3 RealAmp反应体系
10 ømol/L的F3与B3各0.5 μL,10 ømol/L BIP与FIP 各2.5 μL,50 mmol/L MgSO40.5 μL,2.5 mmol/L dNTPs 3 øL,10×TheromoPol Reaction Buffer 2.5 μL,BstDNA聚合酶(8 000 U/mL)l.5 μL,DNA模板2 μL,荧光染料1.5 μL,无菌双蒸水补足体积到25 μL。扩增反应条件:63 ℃、80 min。
1.2.4 产物电泳验证
取RealAmp扩增产物5 μL,与1 μL的10×loading buffer混合均匀,进行2%琼脂糖凝胶电泳,观察梯形条带,证实是否发生了反应。
1.2.5 产物的酶切验证
1 μL RealAmp扩增产物,1 μL内切酶Van91I,2 μL 10×K Buffer混合,无菌双蒸水补至20 μL,在37 ℃水浴锅中酶切1 h。用2.0%的琼脂糖凝胶进行电泳,观察并分析结果。
1.2.6 RealAmp的特异性验证
用1.1.1节所示的菌种热裂解法提取细菌DNA后,按照1.2.3节中的反应条件进行RealAmp反应,验证该检测方法的特异性。
1.2.7 RealAmp反应的灵敏度实验
取新鲜的无菌营养肉汤接种蜡样芽孢杆菌标准菌株,37 ℃培养过夜并计数,用灭菌的生理盐水对菌液进行10 倍系列的梯度稀释,用热裂解法提取每个稀释度菌液的模板DNA,按照1.2.3节中的反应条件进行RealAmp反应。
1.2.8 普通LAMP灵敏度实验
10 ømol/L的F3与B3各0.5 μL,10 ømol/L BIP与FIP各2.5 μL,50 mmol/L MgSO40.5 μL,2.5 mmol/L dNTPs 3 øL,10×TheromoPol Reaction Buffer 2.5 μL,BstDNA聚合酶(8 000 U/mL)l.5 μL,DNA模板2 μL,灭菌双蒸水补足体积到25 μL。扩增反应条件:63 ℃反应60 min ,终止反应80 ℃,10 mi n。然后将扩增产物在2%琼脂糖凝胶上电泳。
1.2.9 人工污染牛乳
在人工污染前,按照国标法检测证实样品不含蜡样芽孢杆菌。取25 mL样品加入225 mL无菌生理盐水中充分振荡摇匀,然后对混合液污染不同浓度的蜡样芽孢杆菌,依次为8.2×107~8.2×10-1CFU /mL。从每个稀释度样品中取1 mL分别加入l mL无水乙醇、l mL氨水和l mL石油醚,混匀,12 000 r/min离心10 min。除上清液,剩余的沉淀分别用1 mL 10 mmol/L TE (pH 7.8)溶解。再用热裂解法提取 基因组DNA,进行RealAmp实验。
2 结果与分析
2.1 RealAmp检测蜡样芽孢杆菌方法的建立

图1 蜡样芽孢杆菌RealAmp检测结果
Fig.1 Detection of Bacillus cereus by RealAmp
1.试验管;2.阳性对照;3.阴性对照。
如图1所示,随着反应的进行,试验管与阳性管荧光强度缓慢增加,当反应进行至20 min时,试验管与阳性管的荧光强度开始大幅增加,荧光曲线斜率增加,反应至40 min时,荧光信号增加强度逐渐变缓,直至反应结束,仪器判定为阳性,说明发生了扩增反应。阴性对照管荧光曲线一直 处于相对平滑的状态,直到反应终止没有曲线斜率的变化,仪器判定为阴性,说明没有发生扩增反应。
2.2 产物的电泳结果分析
如图2所示,1、2泳道都有梯形条带产生说明试验管、阳性对照发生了扩增反应,3泳道没有条带说明没有发生扩增反应。检测结果与RealAmp检测结果一致。

图2 产物电泳结果
Fig.2 Agarose gel electrophoresis of amplification products
M. 100 bp Marker;1.试验管;2.阳性对照;3.阴性对照。
2.3 产物的酶切结果分析
RealAmp反应虽然过程比较复杂,但是产物是按照一定的方式生成的,通过酶切反应产物,将不同片段大小的反应产物的大小单一化,进而可以确定扩增是否准确[16-18]。本实验选取Van91I内切酶,主要产生205 bp和175 bp的DNA片段。酶切结果如图3所示,片段大小与理论值相符。
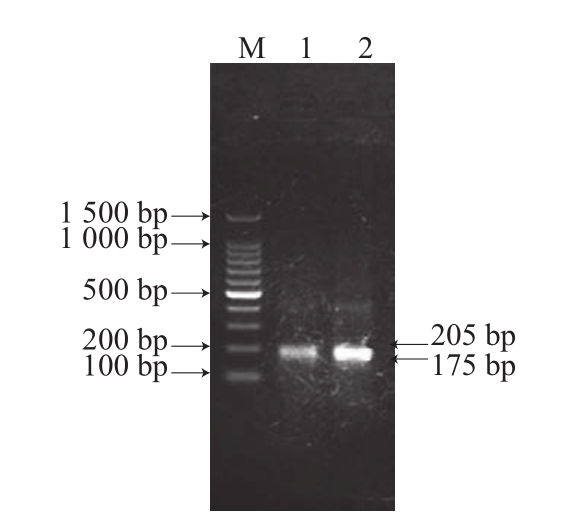
图3 酶切分析 结果
Fig.3 Electrophoresis of fragments produced by restriction enzyme digestion
M. 100 bp DNA Marker;1、2.酶切后的产物。
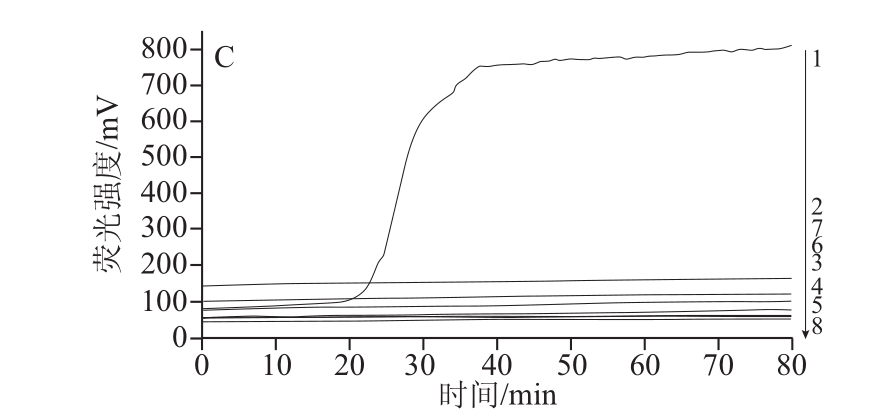
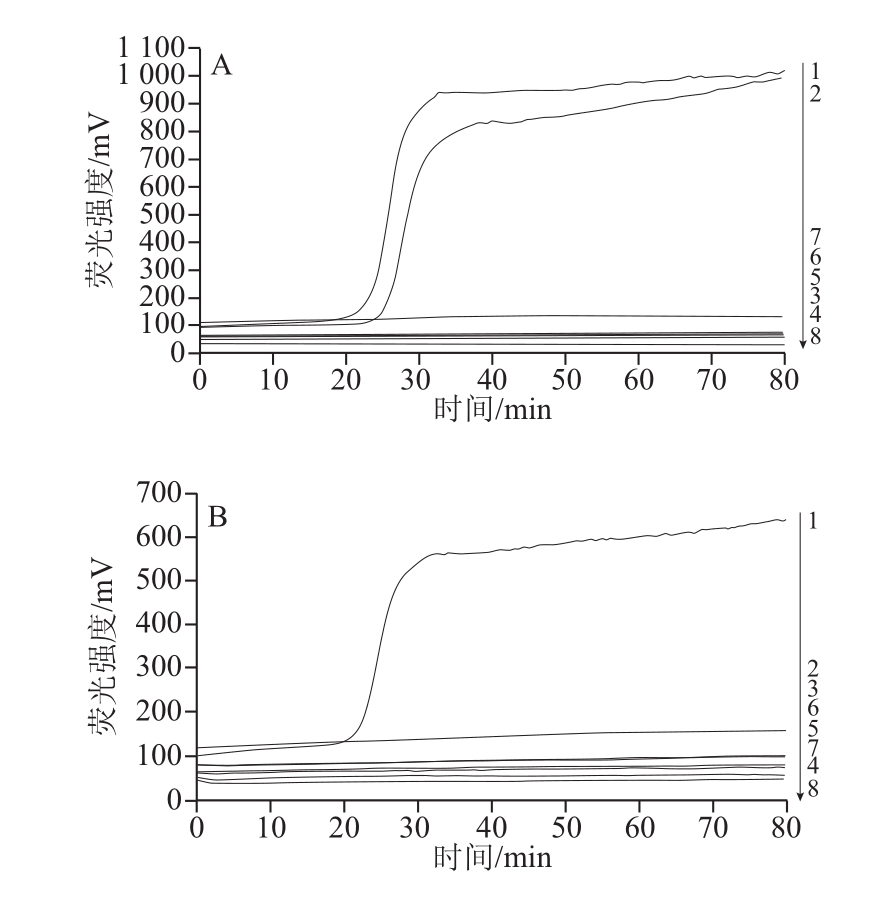
图4 RealAmp反应的特异性检测结果
Fig.4 Speci city of RealAmp
city of RealAmp
A:1.蜡样芽孢杆菌菌(CMCC 63302);2.蜡样芽孢杆菌菌(实验室保存);3.甲型副伤寒沙门氏菌(CMCC50001);4.乙型副伤寒沙门氏菌(CICC21495);5.鼠伤寒沙门氏菌(CMCC50115);6.肠炎沙门氏菌(CMCC50041);7.宋内氏志贺氏菌(CMCC 51334);8.阴性对照;B:1.蜡样芽孢杆菌菌(实验室保存);2.痢疾志贺氏菌(CMCC51135);3.鲍氏志贺氏菌(CMCC51522);4.单核细胞增生李斯特氏菌CMCC54001);5.绵羊李斯特氏菌(CICC21663);6.小肠结肠炎耶尔森氏菌(CICC21669);7.肺炎克雷伯氏菌(CICC21519);8.阴性对照;C:1.蜡样芽孢杆菌菌(实验室保存);2.阪崎肠杆菌(ATC C51024);3.普通变形杆菌(CMCC4 9027); 4.出血性大肠埃希氏菌(CICC21530);5.产气荚膜梭菌(ATCC13124);6.副溶血性弧菌(ATCC17802);7.金黄色葡萄球菌(CICC21600);8阴性对照。
2.4 RealAmp检测方法的特异性如图4所示,4 株蜡样芽孢杆菌有明显的扩增峰出现,其他17 株细菌检测均未产生扩增峰。表明本实验建立的方法特异性强。
2.5 RealAmp与普通LAMP检测蜡样芽孢杆菌方法的灵敏度比较
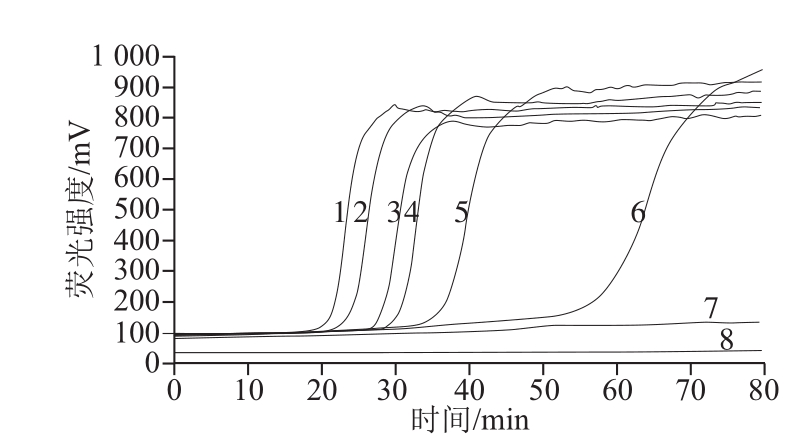
图5 RealAmp反应的灵敏度检测结果
Fig.5 Sensitivity of RealAmp
1~7.培养浓度分别为8.2×105、8.2×104、8.2×103、8.2×102、8.2×101、8.2×100、8.2×10-1CFU/mL;8.阴性对照。
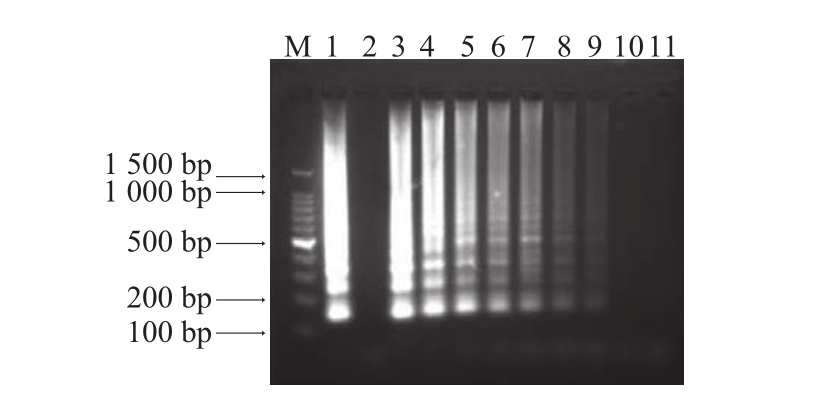
图6 LAM普P通反应的灵敏 度检测结果
Fig.6 Sensitivity of LAMP
M.100 bp DNA Marker;1.阳性对照;2.阴性对照;3~11.分别为8.2×107、8.2×106、8.2×105、8.2×104、8.2×103、8.2×102、8.2×101、8.2×100、8.2×10-1CFU/mL。
经平板计数测得原始菌液浓度为8.2×107CFU/mL,10 倍倍比稀释,进行RealAmp与普通LAMP灵敏度检测,结果见图5和图6。图5显示,1~6号管出现明显的扩增峰,仪器判定为阳性,即本实验建立的RealAmp检测蜡样芽孢杆菌的灵敏度达到8.2 CFU/mL。图6显示,当纯菌培养浓度为8.2×100CFU/mL时,没有出现梯形条带,说明本实验普通LAMP的灵敏度为8.2×101CFU/mL。RealAmp灵敏度是普通LAMP的10 倍。
2.6 RealAmp检测人工污染牛乳中的蜡样芽孢杆菌的检出限
人工污染的牛乳中蜡样芽孢杆菌的纯培养物浓度为8.2×107~8.2×10-1CFU/mL,每个稀释度分别提取DNA,进行RealAmp扩增,结果见图7,1~6号管出现扩增峰,仪器判定为阳性,即本实验建立的RealAmp检测人工污染牛乳中蜡样芽孢杆菌的检出限为8.2 CFU/mL。

图7 RealAmp检测人工污染牛乳的检出限
Fig.7 Determination of detection limit of RealAmp for artificially polluted milk powder
1~7.培养浓度分别为8.2×105、8.2×104、8.2×103、8.2×102、8.2×101、8.2×100、8.2×10-1CFU/mL;8.阴性对照。
3 讨 论
蜡样芽孢杆菌生长所需条件不苛刻,生命力强,是食品安全卫生必检的致病菌之一[19-21],并且在原料乳中污染较为严重[22]。本研究建立的RealAmp是在LAMP技术的基础上,对hblA基因的6 个区域设计引物保证了方法的可靠性[23],向体系中添加荧光染料,通过实时荧光监测仪对荧光信号的捕捉,成功建立了RealAmp检测蜡样芽孢杆菌方法。该方法特异性高,与普通LAMP相比灵敏度是其10 倍。人工污染实际样品检出限为8.2 CFU/mL。此外该方法不仅可以直接读取反应结果,而且在结果给出后可直接终止反应,节约了时间。同时避免了观察沉淀的不确定性和用电泳检测的繁琐、易被污染。因此本研究探索了一种特异性强、灵敏度高、便捷的分子检测蜡样芽孢杆菌的新技术,为蜡样芽孢杆菌的快速检测提供了新的发展方向。
溶血素基因是我国食源性蜡样芽孢杆菌主要毒力基因之一[24],即产生溶血素又产生肠毒素,本研究选择蜡样芽孢杆菌的溶血素hblA基因为扩增的靶基因,可以对一类致病性蜡样芽孢杆菌进行检测[25-26]。在引物设计时应对引物的碱基含量、引物大小、退火温度、二级结构、自由能进行筛选,确保引物的高特异性和扩增效率。RealAmp实验需要在反应体系中添加荧光染料SYBRGreenⅠ,SYBRGreenⅠ的浓度对反应影响很大,浓度过高会抑制反应的进行,浓度过低则荧光信号不明显不易被仪器搜集,因此SYBRGreenⅠ的添加浓度需要经过实验摸索后确定。由于RealAmp反应的灵敏度极高,操作时一旦污染了微量的DNA容易造成假阳性的结果。因此,为了避免假阳性的产生,在操作时应划分区域进行操作,实验器材不能混用,试剂尽量要分装后再使用。
RealAmp为蜡样芽孢杆菌的检测提供了新的方向,但是怎样有效避免反应中的假阳性结果,除了规范操作以外,有待进一步研究;RealAmp目前只能进行定性检测,如何通过RealAmp对样品进行定量,也是今后需要改进的方向。
参考文献:
[1] MANTYNEN V, LINDSTROM K. A rapid PCR-based DNA test for enterotoxic Bacillus cereus[J]. Applied and Environmental Microbiology, 1998, 64(5): 1634-1639.
[2] 张志鸿, 王力均, 甘蓓, 等. 基于QPCR快速检测米饭中产呕吐毒素蜡样芽孢杆菌的研究[J]. 中国粮油学报, 2014, 29(2): 100-104. DOI:10.3969/j.issn.1003-0174.2014.02.020.
[3] 赵宁, 吕琦, 姚丽艳, 等. 原料乳中蜡样芽孢杆菌的快速检测[J]. 中国乳品工业, 2009, 37(9): 43-45. DOI:10.3969/ j.issn.1001-2230.2009.09.013.
[4] 蒋建明. 一起蜡样芽孢杆菌污染饮水引起食物中毒调查[J]. 浙江预防医学, 2009, 21(2): 38-39. DOI:10.3969/ j.issn.1007-0931.2009.02.022.
[5] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63. DOI:10.1093/nar/28.12.e63.
[6] 李秀桂, 刘巍. 环介导等温核酸扩增技术快速检测食源性致病菌应用进展[J]. 应用预防医学, 2010, 16(1):60-63. DOI:10.3969/ j.issn.1673-758X.2010.01.022.
[7] HAN F, GE B. Quantitative detection of Vibrio vulnificus in raw oysters by real-time loop-mediated isothermal amplification[J]. International Journal of Food Microbiology, 2010, 142(1/2): 60-66. DOI:10.1016/j.ijfoodmicro.2010.05.029.
[8] WANG F, JIANG L, GE B L. Loop-mediated isothermal amplification assay for detecting shiga toxin-producing Escherichia coli in ground beef and human stools[J]. Journal of Clinical Microbiology, 2012, 50(1): 91-97. DOI:10.1128/JCM.05612-11.
[9] MAEDA H, KOKEGUCHI S, FUJIMOTO C, et al. Detection of periodontal pathogen Porphyromonas gingivalis by loopmediated isothermal amplification method[J]. FEMS Immunology Medical Microbiology, 2005, 43(2): 233-239. DOI:10.1016/ j.femsim.2004.08.005.
[10] MORI Y, KITAO M, TOMITA N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. Journal of Biochemical and Biophysical Methods, 2004, 59(2): 145-157. DOI:10.1016/j.jbbm.2003.12.005.
[11] LUCCHI N W, DEMAS A, NARAYANAN J, et al. Real-time fluorescence loop mediated isothermal amplification for the diagnosis of malaria[J]. PLOS ONE, 2010, 5(10): e13733. DOI:10.1371/journal. pone.0013733.
[12] YAMAZAKI W, KUMEDA Y, MISAWA N, et al. Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of the tdh and trh genes of Vibrio parahaemolyticus and related Vibrio species[J]. Applied and Environmental Microbiology, 2010, 76(3): 820-828. DOI:10.1128/AEM.02284-09.
[13] SMITH C J, OSBORN A M. Advantages and limitations of qua ntitative PCR (Q-PCR)-based approaches in microbial ecology[J]. FEMS Microbiology Ecology, 2009, 67(1): 6-20. DOI:10.1111/j.1574-6941.2008.00629.x.
[14] 黄火清, 郁昂. 环介导等温扩增技术的研究进展[J]. 生物技术, 2012, 22(3): 90-94. DOI:10.3969/j.issn.1004-311X.2012. 03.76
[15] 李玉锋, 李帅, 黄丽娟, 等. LAMP技术在食品致病菌检测中的研究进展[J]. 西华大学学报(自然科学版), 2011, 30(1): 16-18. DOI:10.3969/j.issn.1673-159X.2011.01.005.
[16] IWAMOTO T, SONOBE T, HAYASHI K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex, M. avium, and M. intracellulare in sputum samples[J]. Journal of Clinical Microbiology, 2003, 41(6): 2616-2622. DOI:10.1128/JCM.41.6.2616-2622.2003.
[17] IHIRA M, YOSHIKAWA T, ENOMOTO Y, et al. Rapid diagnosis of human herpesvirus 6 infection by a novel DNA amplification method,loop-mediated isothermal amplification[J]. Journal of Clinical Microbiology, 2004, 42(1): 140-145. DOI:10.1128/JCM.42.1.140-145.2004.
[18] DAS A, BABIUK S, MCINTOSH M T. Development of a loopmediated isothermal amplification assay for rapid detection of capripoxviruses[J]. Journal of Clinical Microbiology, 2012, 50(5): 1613-1620. DOI:10.1128/JCM.06796-11.
[19] 王红, 唐振柱, 黄彦, 等. 荧光PCR检测蜡样芽孢杆菌及溶血素基因应用研究[J]. 广西医学, 2011, 33(7): 885-887. DOI:10.3969/ j.issn.0253-4304.2011.07.040.
[20] 程池. 食源性致病菌快速分子学检测方法探讨[J]. 食品安全导刊, 2011(9): 28-29. DOI:10.16043/j.cnki.cfs.2011.09.026.
[ 21] 郑秋月, 傅俊范, 孙哲平, 等. 变性高效液相色谱检测食品中蜡样芽孢杆菌[J]. 中国卫生检验杂志, 2009, 19(2): 255-257.
[22] 刘新梅, 程逸宇, 张弛, 等. 乳制品及婴幼儿配方食品中蜡样芽孢杆菌的快速检测[J]. 中国乳品工业, 2015, 43(5): 51-53. DOI:10.3969/ j.issn.1001-2230.2015.05.012.
[23] 赵明月, 任国谱. 乳制品中蜡样芽孢杆菌的研究进展[J]. 中国乳品工业, 201 4, 42(4): 46-49. DOI:10.3969/j.issn.1001-2 230.2014.04.012.
[24] 秦丽云, 吕国平, 郭玉梅, 等. 石家庄市市售婴幼儿食品中蜡样芽胞杆菌的监测及溶血素基因的分析[J]. 中国食品卫生杂志, 2014, 26(4): 388-390. DOI:10.13590/j.cjfh.2014.04.021.
[25] 张志鸿, 许恒毅, 魏华. 基于PCR方法检测蜡样芽孢杆菌的研究进展[J]. 食品工业科技, 2013, 34(22): 335-338. DOI:10.13386/ j.issn1002-0306. 2 013.22.087.
[26] 周巍, 张薇, 刘亮, 等. 环介导等温扩增技术检测酸乳中蜡样芽孢杆菌[J]. 乳业科学与技术, 2013, 36(5): 29-31. DOI:10.15922/j.cnki. jdst.2013.05.009.
Detection of Bacillus cereus in Milk by Real-Time Fluorescence Loop-Mediated Isothermal Ampli cation Method
JIA Yajing1, FU Boyu1, WANG Yu1, MA Xiaoyan1, ZHANG Xianzhou1, YUAN Ning2, ZHANG Wei1,*
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China; 2. College of Science and Technology, Agricultural University of Hebei, Cangzhou 061100, China)
Abstract: This study aimed to establish a real-time fluorescence loop-mediated isothermal amplification assay to det ect Bacillus cereus. Based on the published Bacillus cereus hblA gene sequence, primers were designed, and the intercalating dye SYBR-Green I was added to the reaction system, which allowed the reaction products to be measured by ESE-Quant Tube Scanner. The products were identified by restriction digestion followed by electrophoresis. The performance of the assay was evaluated with respect to specificity and sensitivity in comparison with the ordinary LAMP, and the limit of detection (LOD) for artificially contaminated milk was tested. Among 21 strains tested, four Bacillus cereus strains were identified, the other 17 strains were negative. The sensitivity for Bacillus cereus was 8.2 CFU/mL in pure cultures, which was 10 times more sensitive than the ordinary LAMP. The LOD for artificially contaminated milk was 8.2 CFU/mL. The result could be obtained in 20 minutes. This method has high specificity and sensitivity and is less time-consuming, requiring only simple equipment and allowing real-time monitoring. It is expected to be applied as an effective method for rapid detection of B. cereus.
Key words: real-time fluorescence loop-mediated isothermal ampli cation (RealAmp); Bacillus cereus; detection; milk
DOI:10.7506/spkx1002-6630-201606033
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2016)06-0184-06引文格式:
*通信作者:张伟(1963—),男,教授,学士,研究方向为食品病原菌检测技术。E-mail:zhangwei631126@163.com
作者简介:贾雅菁(1989—),女,硕士研究生,研究方向为食品安全。E-mail:704183911@qq.com
基金项目:河北省自然科学基金项目(C2008000216)
收稿日期:2015-05-19






 city of RealAmp
city of RealAmp

