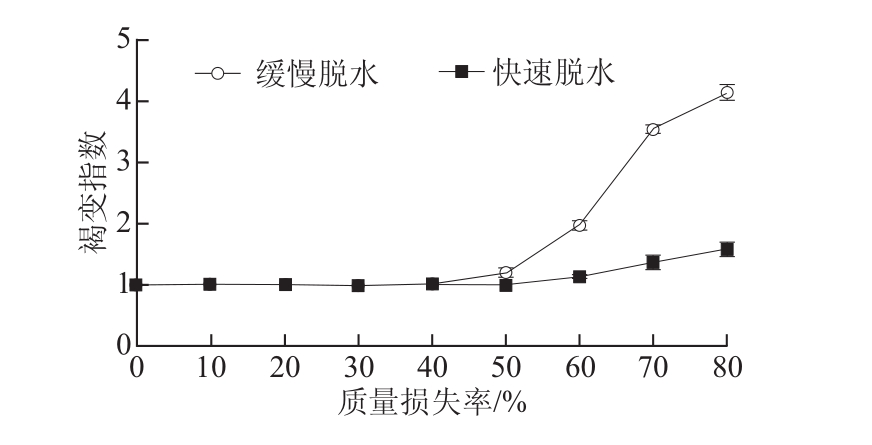
图1 ‘无核白’葡萄在脱水过程中褐变指数的变化
Fig.1 Changes in browning index of Thompson seedless grapes during dehydration
刘峰娟1,2,冯作山1,2,孟 阳2,王玉红2,朱春丽2,黄文书2,*
(1.新疆农业大学林学与园艺学院,新疆 乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
摘 要:为探索脱水速度对‘无核白’葡萄干制过程中细胞超微结构及褐变的影响,以新疆‘无核白’葡萄为材料,采用快速和缓慢两种脱水方式,观察‘无核白’葡萄脱水过程中细胞超微结构及褐变指数的变化。结果表明:缓慢脱水质量损失50%及快速脱水质量损失60%‘无核白’葡萄细胞线粒体、叶绿体、液泡膜等遭到破坏,同时褐变指数明显上升,因此认为,‘无核白’葡萄脱水过程中褐变与细胞区室化作用被打破密切相关。与缓慢脱水相比,快速脱水处理可以有效地抑制细胞内线粒体、叶绿体、液泡等细胞器膜结构的破坏,保持细胞膜结构的完整性,且快速脱水褐变指数显著低于缓慢脱水。研究结果可为快速脱水在‘无核白’葡萄干制中的应用提供理论依据。
关键词:脱水速度;‘无核白’葡萄;细胞超微结构;褐变
刘峰娟, 冯作山, 孟阳, 等. 脱水速度对‘无核白’葡萄果皮褐变和细胞超微结构的影响[J]. 食品科学, 2016, 37(6): 220-225. DOI:10.7506/spkx1002-6630-201606040. http://www.spkx.net.cn
LIU Fengjuan, FENG Zuoshan, MENG Yang, et al. Effect of dehydration rate on browning and cell ultrastructure of Thompson seedless grapes[J]. Food Science, 2016, 37(6): 220-225. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606040. http://www.spkx.net.cn
葡萄(Vitis vinifera)系葡萄科葡萄属落叶藤本植物,是世界上栽培最广泛的重要经济果树之一。据统计[1],2013年新疆栽培面积达14.48万 hm2,产量223.9万 t,其中‘无核白’葡萄产量114.5万 t,占全疆水果总产量的14.62%。‘无核白’葡萄采后90%用于脱水干制为绿葡萄干[2],产量巨大,在我国葡萄干产业中占有极其重要的地位[3]。而脱水干制过程中的褐变相当普遍[4-5]。据调查吐鲁番地区褐变率为40%,哈密地区褐变率为60%,和田地区可达65%。‘无核白’葡萄采后脱水褐变严重影响果实的外观品质和商品价值[6-8],已成为制约新疆绿葡萄干产业发展的一个重要因素。
大多数研究[9-11]认为,果蔬采后加工及贮藏过程中的褐变主要是多酚氧化酶与酚类物质反应而发生的酶促褐变。但是在完整的果实中,多酚氧化酶与酚类物质是分区室化存在的,多酚氧化酶主要存在于细胞质体中,而酚类物质则定位于细胞液泡中,两者并不接触。只有细胞受到机械损伤或者逆境胁迫使得细胞区室化作用打破,才会使多酚氧化酶与酚类物质接触从而发生褐变[12-13]。
‘无核白’葡萄采后脱水干制过程,对葡萄来说是一种脱水胁迫的过程,在这个过程中葡萄不仅外部形态发生了明显的变化,其内部的细胞超微结构也会发生变化,这些变化可能会对褐变产生影响。目前研究表明,细胞超微结构与果实发育[14]、硬度[15]、病害[16]及采后贮藏期间褐变[17-18]、冷害[19]等密切相关,而对于葡萄采后脱水干制过程中细胞超微结构变化与褐变关系尚未见报道。且根据前人研究的结果[20]和当地农民的经验发现脱水速度与褐变的关系密切。本实验以‘无核白’葡萄为研究对象,采用快速和缓慢两种脱水方式,研究不同脱水速度对‘无核白’葡萄褐变及超微结构的影响,以期阐明‘无核白’葡萄采后脱水干制的过程中超微结构变化与褐变的关系,为控制‘无核白’葡萄脱水褐变,提高‘无核白’葡萄干绿品级率提供理论和实践依据。
1.1 材料与试剂
供试‘无核白’葡萄采自新疆鄯善葡萄瓜果研究所。挑选完全成熟、果实色泽碧绿、大小均匀、无病害、无损伤的果实为实验材料,葡萄果实可溶性固形物质量分数为20%~22%,湿基含水率为(79.82±0.13)%,果实直径为(10.25±0.98) mm,长度为(13.85±0.75) mm。
2.3%葡萄促干剂(主要成分为碳酸盐、脂类和乳化剂) 新疆惠普园艺新技术公司。
1.2 仪器与设备
LKB-2188型超薄切片机 瑞典LKB公司;JEOLM-1230型透射电镜 日本电子株式会社;CS101型电热恒温恒湿干燥箱 乌鲁木齐电器设备制造厂。
1.3 方法
1.3.1 实验处理
在预实验的基础上,筛选出快速和缓慢脱水处理的条件。挑选的‘无核白’葡萄经2.3%葡萄促干剂,浸泡1 min处理后随机分为2组,每组约10 kg果实。快速脱水组工艺条件:将葡萄平铺于干燥箱中,热风处理温度40 ℃,相对湿度<20%,风速1 m/s;缓慢脱水组工艺条件:将葡萄平铺干燥箱中室温条件下自然脱水,环境平均温度为25℃,平均相对湿度45%,平均风速0.1 m/s。快速脱水处理所用时间为5.25 d,平均干燥速率1.45 kg/(kg·d),缓慢脱水处理所用时间约为24 d,平均干燥速率0.28 kg/(kg·d),快速脱水处理‘无核白’葡萄的平均干燥速率为缓慢脱水处理的5.18 倍。根据干燥箱实时质量检测,可随时计算葡萄质量损失,当葡萄脱水质量损失率达到80%时结束脱水,在此过程中葡萄质量损失率0%、20%、50%、60%和80%时取样,每个处理重复3 次。
1.3.2 果皮褐变指数计算
参照林河通等[21]介绍的方法。每次随机取50 粒‘无核白’葡萄,根据观察,按照果皮表面褐变面积大小把果皮褐变程度分为6 级:
1级:无褐变发生;2级:0%<褐变面积<25%;3级:25%≤褐变面积<50%;4级:50%≤褐变面积<75%;5级:75%≤褐变面积<100%;6级:全部褐变。统计褐变发生率,按下式计算褐变指数:
果皮褐变指数= Σ(褐变级数×该级果数)/总果数
1.3.3 果皮细胞超微结构的观察
用双面刀片将‘无核白’葡萄果皮切成1 mm×1 mm×2 mm大小的块,用4%戊二醛溶液(0.1 mol/L磷酸缓冲液配制,pH 7.2)在4 ℃条件下前固定2 h。用pH 7.2的磷酸缓冲液漂洗3 次,每次15 min。用1%饿酸溶液(磷酸缓冲配制)4 ℃后固定2 h,用磷酸缓冲液冲洗漂洗3 次,每次30 min。用50%、70%、80%、90%、100%丙酮溶液梯度脱水,各级30 min。环氧树脂Epon-812渗透包埋,37 ℃烘箱聚合12 h 后,于45 ℃聚合12 h,最后于60 ℃聚合24 h。用LKB-2188型超薄切片机切成60 nm的薄片,再经铅铀电子染色后,在JEOLM-1230型透射电镜观察拍照。
1.4 数据处理与统计分析
实验数据采用Origin 8.5软件作图,并采用SPSS统计软件进行单因素方差分析和相关性分析,邓肯氏多重差异比较,当P<0.05时,表示差异显著;当P<0.01时,表示差异极显著。
2.1 ‘无核白’葡萄脱水过程中果皮褐变指数的变化
由图1可知,‘无核白’葡萄褐变指数在质量损失40%以后随着脱水的进行而逐渐升高。在果实质量损失40%之前,2 种处理的‘无核白’葡萄褐变指数均为1。缓慢脱水处理‘无核白’葡萄在质量损失50%时褐变指数迅速增加,与‘无核白’葡萄出现明显的褐变现象相吻合,之后随着脱水的进行,褐变指数进一步增加,脱水结束时,‘无核白’葡萄褐变指数由最初的1增大到脱水结束时的4.15,增大了3.15 倍。而快速脱水处理的‘无核白’葡萄在质量损失60%时出现明显褐变现象,之后褐变发展的较为缓慢,在脱水结束时,褐变指数为1.57,是缓慢脱水处理的37.83%(P<0.01)。说明快速脱水可以极显著地减少‘无核白’葡萄褐变的发生。

图1 ‘无核白’葡萄在脱水过程中褐变指数的变化
Fig.1 Changes in browning index of Thompson seedless grapes during dehydration
2.2 新鲜‘无核白’葡萄超微结构观察
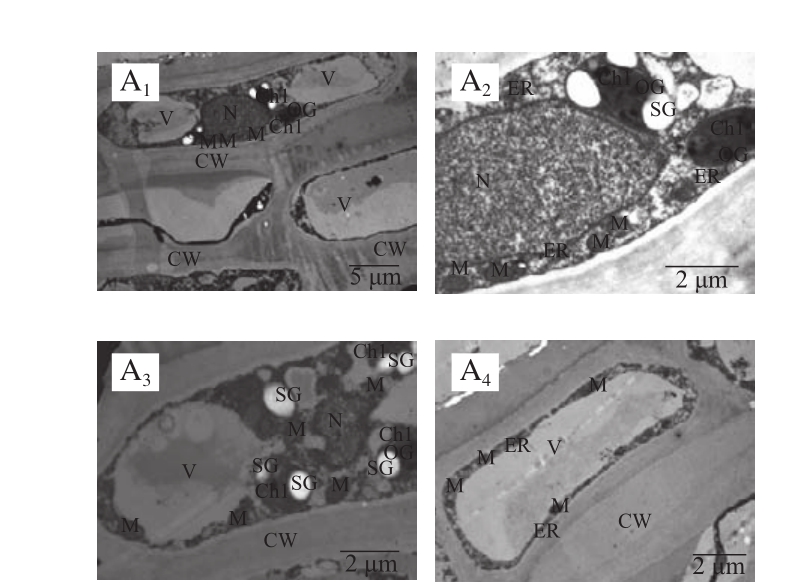
图2 新鲜‘无核白’葡萄果皮超微结构
Fig.2 Cell ultrastructure of pericarp of fresh Thompson seedless grapes
A1~A4.下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;ER.内质网;M.线粒体;N.细胞核;OG.嗜锇球;Chl.叶绿体;V.液泡;SG.淀粉颗粒。
由图2可见,在透射电镜下可见到新鲜的‘无核白’葡萄果皮细胞呈扁平状,液泡占细胞体积的90%以上。细胞壁整齐致密,厚度均匀,有清晰的明暗明结构;细胞膜结构完整,细胞壁和细胞膜结合紧密,细胞内有丰富的细胞器。细胞内线粒体数目较多,双层膜结构清晰可见,内有管状脊结构;叶绿体有清晰的片层结构,完整的细胞膜,叶绿体内有嗜饿球颗粒以及较多的淀粉颗粒;液泡和细胞质膜结构完整;细胞质中有内质网;细胞核结构完整,具有清晰的双层膜结构;染色质均匀地分散在细胞质中(图2)。
2.3 快速及缓慢脱水质量损失20%时‘无核白’葡萄超微结构观察

图3 快速及缓慢脱水质量损失20%‘无核白’葡萄果皮超微结构
Fig.3 Cell ultrastructure of pericarp of dried Thompson seedless grapes with mass loss of 20% by fast and slow dehydration
B1~B4.快速脱水质量损失20%;C1~C4.缓慢脱水质量损失20%;下脚标数字表示电镜倍数不同。CW细胞壁;Cy.细胞质;ER.内质网;M.线粒体;N.细胞核;OG.嗜锇球;Chl.叶绿体;V.液泡;SG.淀粉颗粒;VE.囊泡。图4、5、6同。
由图3B1~3B4可见,快速脱水‘无核白’葡萄质量损失20%时,细胞壁结构整齐,但开始松懈,有明暗明结构,细胞膜结构完整,细胞内细胞器丰富,各细胞器结构基本完整。细胞出现质壁分离现象;个别叶绿体细胞膜出现降解。细胞内有较多线粒体,液泡膜结构完整,细胞内各细胞器有序排列,与新鲜葡萄相比,细胞结构无明显差异。
由图3C1~3C4可见,在透射电镜下观察缓慢脱水‘无核白’葡萄质量损失20%时,可见细胞壁整齐,个别细胞壁稍有变形;细胞膜结构完整,细胞壁和细胞膜出现质壁分离现象。细胞内有丰富的细胞器,细胞内线粒体数目较多,但部分线粒体膜已有降解;叶绿体有清晰的片层结构,部分叶绿体细胞膜降解,叶绿体内有嗜饿球颗粒;液泡膜结构完整;细胞质中有内质网;细胞核结构完整,具有清晰的双层膜结构。总体来看,缓慢脱水质量损失20%‘无核白’葡萄与新鲜葡萄相比,细胞结构已经有明显差别,线粒体膜和叶绿体膜开始降解,细胞内出现囊泡。
2.4 快速及缓慢脱水质量损失50%时‘无核白’葡萄超微结构观察

图4 快速及缓慢脱水质量损失50%‘无核白’葡萄果皮超微结构
Fig.4 Cell ultrastructure of pericarp of dried Thompson seedless grapes with mass loss of 50% by fast and slow dehydration
D1~D4.快速脱水质量损失50%;E1~E4.缓慢脱水质量损失50%;下脚标数字表示电镜倍数不同。
由图4D1~4D4可见,快速脱水质量损失50%时,‘无核白’葡萄果皮细胞细胞壁整齐,但结构松懈,个别地方稍有变形。细胞膜结构完整,出现明显的质壁分离现象。细胞内线粒体数目较多,叶绿体片层结构模糊,叶绿体细胞膜结构出现降解,轮廓不清晰,细胞内出现囊泡。液泡和细胞质膜结构完整;细胞核结构完整,具有清晰的双层膜结构。总体来看,快速脱水质量损失50%时‘无核白’葡萄果皮细胞微结构与新鲜葡萄相比,出现变化,但差别较小。
由图4E1~4E4可见,缓慢脱水质量损失50%时,‘无核白’葡萄果皮细胞细胞壁结构松散,细胞膜结构完整,细胞壁和细胞膜质壁分离现象进一步加剧。细胞内细胞器数量较少,叶绿体细胞膜出现明显降解,其片层结构松散,不再清晰,淀粉颗粒解体为无规则小淀粉颗粒。线粒体内容物出现空洞,不再致密,线粒体细胞膜结构部分缺失。个别液泡膜不再完整,出现断裂及多液泡融合的现象。细胞内出现大量囊泡。细胞核内容物致密度下降,细胞核膜结构完整。总体来看,缓慢脱水质量损失50%时‘无核白’葡萄与新鲜及快速脱水质量损失50%时葡萄相比,果皮细胞结构差异明显。此时‘无核白’葡萄褐变指数较质量损失40%有一个明显的上升,可能是由于细胞液泡膜出现断裂,细胞的区室化作用被打破,液泡内的酚类物质溶出,与定位在质体及其他细胞器中的多酚氧化酶接触,从而使褐变指数增大。
2.5 快速及缓慢脱水质量损失60%时‘无核白’葡萄超微结构观察

图5 快速及缓慢脱水质量损失60%‘无核白’葡萄果皮超微结构
Fig.5 Cell ultrastructure of pericarp of dried Thompson seedless grapes with mass loss of 60% by fast and slow dehydration
F1~F4.快速脱水质量损失60%;G1~G4.缓慢脱水质量损失60%;下脚标数字表示电镜倍数不同。
由图5F1~5F4可见,快速脱水质量损失60%时,‘无核白’葡萄果皮细胞细胞壁结构松驰,细胞膜结构完整,细胞壁和细胞膜质壁分离现象明显。细胞内细胞器数量减少,叶绿体细胞膜出现明显降解,淀粉颗粒较少。线粒体内容物出现空洞,不再致密,线粒体细胞膜出现降解。液泡膜受损,出现断裂及多液泡融合的现象。细胞内出现囊泡。细胞核内容物致密度下降,细胞核膜结构完整。总体来看,快速脱水质量损失60%时‘无核白’葡萄与新鲜葡萄相比,果皮细胞结构差异明显。此时‘无核白’葡萄褐变指数较质量损失50%有一个明显的上升,与缓慢脱水质量损失50%相同的是液泡膜结构破坏,各细胞器细胞膜出现明显降解,因此也从侧面证明了细胞区室化分布打破,酚类物质与多酚氧化酶接触,从而产生褐变的推测。
由图5G1~5G4可见,缓慢脱水质量损失60%时,‘无核白’葡萄果皮细胞壁结构变形,细胞膜结构完整,细胞壁和细胞膜质壁分离现象显著。细胞内细胞器均不同程度受损,叶绿体细胞膜出现明显降解,个别叶绿体已不存在片层结构。线粒体细胞膜出现降解。液泡膜受损,细胞内较多出现囊泡。总体来看,缓慢脱水质量损失60%时‘无核白’葡萄与快速脱水质量损失60%时相比,果皮细胞结构差异比较明显,各细胞器降解严重,细胞膜遭到破坏。
2.6 快速及缓慢脱水质量损失80%时‘无核白’葡萄超微结构观察

图6 快速及缓慢脱水质量损失80%‘无核白’葡萄果皮超微结构
Fig.6 Cell ultrastructure of pericarp of dried Thompson seedless grapes with mass loss of 80% by fast and slow dehydration
H1~H4.快速脱水质量损失80%;I1~I4.缓慢脱水质量损失80%;下脚标数字表示电镜倍数不同。
由图6H1~6H4可见,快速脱水质量损失80%时,‘无核白’葡萄果皮细胞壁结构变形,细胞膜结构受到破坏,个别地方出现断裂,细胞壁和细胞膜质壁分离现象显著。细胞内细胞器受损严重,大部分叶绿体细胞膜出现明显降解,个别叶绿体结构解体。线粒体明显减少。液泡膜受损,细胞内出现大量囊泡。总体来看,快速脱水质量损失80%时‘无核白’葡萄与快速脱水质量损失60%时相比,果皮细胞结构进一步解体,各细胞器降解严重,细胞膜被破坏。
由图6I1~6I4可见,缓慢脱水质量损失80%时,‘无核白’葡萄果皮细胞壁严重变形,细胞膜结构受到破坏,个别地方出现断裂和凸起,细胞壁和细胞膜质壁分离现象显著。细胞内细胞器已经基本全部降解,细胞器降解产生的絮状物遍布整个细胞,原生质脱水凝聚,细胞中只剩下固态的细胞核及个别解体的叶绿体,其他细胞器已不存在。总体来看,缓慢脱水质量损失80%时‘无核白’葡萄与快速脱水质量损失80%时相比,果皮细胞结构严重解体,各细胞器基本全部降解,缓慢脱水不能很好地保持细胞结构,从而使褐变的发生程度比快速脱水严重。
许多学者研究表明,逆境如水分胁迫[22]、低温胁迫[19]等可以破坏植物细胞的细胞膜、使细胞膜的通透性增强,细胞内线粒体、叶绿体、液泡等细胞器破坏,最终细胞区室化作用被打破。其原因在于,植物遭到逆境胁迫后,细胞内产生大量的活性氧自由基[23],从而使活性氧代谢失调,导致细胞膜脂过氧化作用加剧,从而使细胞膜系统受到伤害[24]。
‘无核白’葡萄在采后脱水的过程中,因受到脱水胁迫,细胞内活性氧清除系统遭到破坏,使细胞膜脂过氧化作用增强[25],细胞超微结构受到不同程度的损伤。同时,由于叶绿体是植物体内产生活性氧的主要功能区,叶绿体类囊体膜含有大量的不饱和脂肪酸,对活性氧导致的膜脂过氧化作用十分敏感[26-27]。因此,一旦活性氧代谢失衡,叶绿体首先被破坏。在本研究中发现,快速脱水与缓慢脱水相比,叶绿体细胞膜受损程度较轻,说明快速脱水可以减轻细胞活性氧的侵害,从而保持‘无核白’葡萄内部超微结构的完整性。
在本研究中,新鲜‘无核白’葡萄细胞规则,排列整齐,液泡占整个细胞的90%以上,细胞壁结构整齐致密,细胞内细胞器丰富,叶绿体、线粒体、细胞核、内质网、液泡结构完整,排列有序。快速脱水‘无核白’葡萄在5.25 d就达到了葡萄干水分含量的要求,而缓慢脱水所用时间大约为24 d,快速脱水质量损失20%,所用的时间为0.42 d,水分含量为67.69%,‘无核白’葡萄细胞结构与新鲜‘无核白’葡萄差异不明显,而缓慢脱水质量损失20%,所用时间为2.7 d,水分含量为66.64%,‘无核白’葡萄细胞结构与新鲜‘无核白’葡萄已经有较明显的差异。说明快速和缓慢脱水处理的‘无核白’葡萄在达到相同的质量损失时,虽然含水量差异不明显,但是由于脱水速度不同,‘无核白’葡萄内部超微结构已经有了明显的差别,快速脱水可以较好地保持细胞的超微结构。
快速脱水质量损失60%以及缓慢脱水质量损失50%时,褐变指数的突然增大与果实叶绿体、线粒体等膜系统的破坏以及液泡膜的断裂同时出现,且快速脱水质量损失80%的‘无核白’葡萄与缓慢脱水质量损失80%的‘无核白’葡萄相比,可以较好地保持细胞的超微结构及较低的褐变指数,说明细胞褐变与细胞结构的完整性密切相关。此研究与林河通等[12]对龙眼的研究结果相一致。但是,与李桂峰[18]对苹果的研究结果不同。李桂峰[18]研究发现,苹果在采 后气调贮藏过程中轻微褐变的果实,其并未发现细胞膜的破裂现象,而只有在3级以上褐变果细胞中才发现膜的破裂现象。因此在苹果的贮藏过程中细胞膜和液泡膜的破坏并不与果实褐变同时出现,而使晚于褐变现象。原因可能是在苹果贮藏过程中初期褐变并不是由于细胞胞区室化功能丧失造成酶和底物接触引起的,而在‘无核白’葡萄脱水过程中褐变主要是由于区室化作用破坏,使定位于质体和其他细胞器的多酚氧化酶与定位于液泡的酚类物质接触而引起的酶促褐变。
综上所述,‘无核白’葡萄脱水过程中的褐变与细胞超微结构密切相关,同时快速脱水处理‘无核白’葡萄可以较好地保持细胞超微结构的完整性,从而使‘无核白’葡萄具有较低的褐变指数。
参考文献:
[1] 新疆维吾尔自治区统计局. 新疆统计年鉴[M]. 北京: 中国统计出版社, 2014.
[2] 张明智. 吐鲁番无核白葡萄如何实现制干向鲜食的转变[J].新疆农业科学, 2006, 43(增刊1): 164-166. DOI:10.3969/ j.issn.1001-4330.2006.z1.051.
[3] FANG Y L, ZHANG A, WANG H, et al. Health risk assessment of trace elements in Chinese raisins produced in Xinjiang province[J]. Food Control, 2010, 21(5): 732-739. DOI:10.1016/ j.foodcont.2009.10.018.
[4] 林向东, 李冀新. 无核白葡萄荫干过程中褐变原因探析[J]. 食品科学, 1999, 20(6): 72-74. DOI:10.3321/j.issn:1002-6630.1999.06.025.
[5] 张利娟. 葡萄干的抗氧化特性及防褐变工艺研究[D]. 杨凌: 西北农林科技大学, 2013.
[6] LI L L, WANG Z F, HU X S, et al. Drying effects of two airdrying shelters in a pilot test on sultana grapes[J]. Journal of Food Process Engineering, 2010, 33(1): 162-178. DOI:10.1111/j.1745-4530.2008.00266.x.
[7] THAKUR A K, SAHARAN V K, GUPTA R K. Drying of ‘Perlette’grape under different physical treatment for raisin making[J]. Journal of Food Science and Technology, 2010, 47(6): 626-631. DOI:10.1007/ s13197-010-0095-0.
[8] LICHTERA A, KAPLUNOVA T, ZUTAHYA Y A, et al. Physical and visual properties of grape rachis as affected by water vapor pressure deficit[J]. Postharvest Biology and Technology, 2011, 59(1): 25-33. DOI:10.1016/j.postharvbio.2010.07.009.
[9] JIANG Y M, DUAN X W, JOYCE D, et al. Advances in understanding of enzymatic browning in harvested litchi fruit[J]. Food Chemistry, 2004, 88(3): 443-446. DOI:10.1016/j.foodchem.2004.02.004.
[10] 刘军伟, 胡志和, 苏莹. 紫薯中多酚氧化酶活性的研究及褐变控制[J].食品科学, 2012, 33(17): 207-211.
[11] 曲留柱. 香蕉多酚氧化酶特性及其催化褐变防控的研究[D]. 北京:北京林业大学, 2014.
[12] 林河通, 陈莲, 孔祥佳, 等. 包装对龙眼果实贮藏期间果皮失水褐变和细胞超微结构的影响[J]. 农业工程学报, 2007, 23(12): 237-241. DOI:10.3321/j.issn:1002-6819.2007.12.045.
[13] JANG J H, MOON K D. Inhibition of polyphenol oxidase and peroxidase activities on fresh-cut apple by simultaneous treatment of ultrasound and ascorbic acid[J]. Food Chemistry, 2011, 124(2): 444-449. DOI:10.1016/j.foodchem.2010.06.052.
[14] 张大鹏, 李珉, 王毅. 葡萄果实发育过程中果肉细胞超微结构的观察[J]. 植物学报, 1997, 39(5): 389-396.
[15] 王仁才, 熊兴耀, 谭兴和, 等. 美味猕猴桃果实采后硬度与细胞壁超微结构变化[J]. 湖南农业大学学报(自然科学版), 2000, 26(6): 457-460. DOI:10.3321/j.issn:1007-1032.2000.06.016.
[16] 崔文静, 刘丽丹, 曾凯芳. 采后柑橘生理病害与果皮超微结构变化的关系[J]. 食品科学, 2011, 32(19): 284-287.
[17] 段学武, 蒋跃明, 苏新国, 等. 纯氧对荔枝果实贮藏期间果皮褐变和细胞超微结构的影响[J]. 热带亚热带植物学报, 2004, 12(6): 565-568. DOI:10.3969/j.issn.1005-3395.2004.06.014.
[18] 李桂峰. 苹果果肉褐变中细胞超微结构和氧化酶活性的变化[C]// Proceedings of 2010 First International Conference on Cellular, Molecular Biology, Biophysics and Bioengineering, 2010.
[19] 朱璇, 侯媛媛, 贾燕, 等. 水杨酸处理对冷藏杏果实细胞超微结构的影响[J]. 食品科学, 2014, 35(14): 193-197. DOI:10.7506/spkx1002-6630-201414038.
[20] 郑永菊. 绿葡萄干加工的关键技术研究[D]. 杨凌: 西北农林科技大学, 2012.
[21] 林河通, 陈绍军, 席玙芳, 等. 龙眼果皮微细结构的扫描电镜观察及其与果实耐贮性的关系[J]. 农业工程学报, 2002, 18(3): 95-99. DOI:10.3321/j.issn:1002-6819.2002.03.024.
[22] 谢深喜. 水分胁迫下柑橘超微结构及生理特性研究[D]. 长沙: 湖南农业大学, 2006.
[23] WANG H B, ZHANG Z Q, XU L Y, et al. The effect of delay between heat treatment and cold storage on alleviation of chilling injury in banana fruit[J]. Journal of the Science of Food and Agriculture, 2012, 92(13): 2624-2629. DOI:10.1002/jsfa.5676.
[24] DUAN X W, LIU T, ZHANG D D, et al. Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J]. Food Research International, 2011, 44(7): 1905-1911. DOI:10.1016/j.foodres.2010.10.027.
[25] 刘峰娟, 孟阳, 白羽嘉, 等. 快速脱水抑制葡萄干制过程中膜脂过氧化及褐变[J]. 农业工程学报, 2014, 30(17): 285-294. DOI:10.3969/ j.issn.1002-6819.2014.17.036.
[26] PESSARAKLI M. Hand book of plant and crop stress[M]. 2nd ed. New York: Marcel Dekker, 1999.
[27] NILSEN E T, ORCUTT D M. The physiology of plant under stress[M]. New York: John Wiley&Sons, 1996.
LIU Fengjuan1,2, FENG Zuoshan1,2, MENG Yang2, WANG Yuhong2, ZHU Chunli2, HUANG Wenshu2,*
(1. College of Forestry and Horticulture, Xinjiang Agricultural University, Ürümqi 830052, China; 2. College of Food Science and Pharmacology, Xinjiang Agricultural University, Ürümqi 830052, China)
Abstract: The objective of this study was to investigate the effect of rapid versus slow dehydration on cell ultrastructure and browning during the drying of Thompson seedless grapes. The results showed that the index of browning increased simultaneously with destruction of vacuole cell membranes during drying with both slow and rapid dehydration, leading to a mass loss of 50% and 60%, respectively. Therefore, the browning during the dehydration process of Thompson seedless grapes was closely related to the breaking of cellular compartmentalization. Meanwhile, compared with the slow dehydration, rapid dehydration treatment effectively inhibited the destruction of int racellular mitochondria, chloroplasts, vacuoles and other organelles and also maintained the integrity of the cell membrane structure, and the index of browning during rapid dehydration was significantly lower than that during slow dehydration. These results can provide a theoretic reference for the application of rapid dehydration in the drying of Thompson seedless grapes.
Key words: dehydration rate; Thompson seedless grapes; cell ultrastructure; browning
中图分类号:S663.1;TS255
文献标志码:A
文章编号:1002-6630(2016)06-0220-06引文格式:
DOI:10.7506/spkx1002-6630-201606040
*通信作者:黄文书(1975—),女,副教授,博士,研究方向为农产品贮藏及加工。E-mail:xjnd-hws@126.com
作者简介:刘峰娟(1985—),女,博士研究生,研究方向为果蔬采后生理及贮运。E-mail:liufengjuan2050@126.com
基金项目:国家自然科学基金青年科学基金项目(31201448);新疆维吾尔自治区高校科研计划科学研究重点项目(XJEDU2012I16);2014年国家级大学生创新创业训练计划项目(201410758023);新疆农业大学博士后经费资助项目
收稿日期:2015-06-02