张美丽,何 玲*,苑希蕊,杜芳梦,赵凯茜
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:用类黄酮含量分别为0.25、0.50、0.75 mg/mL的银杏叶提取液(extract of Ginkgo biloba leaves,EGb)通过损伤接种的方法处理猕猴桃,以无菌水为对照,24 h后接种扩展青霉(Penicillium expansum)孢子悬浮液,通过测定病斑直径和发病率观察EGb诱导猕猴桃抗性的效果;用类黄酮含量为0.50 mg/mL的EGb处理猕猴桃后接种青霉孢子悬浮液,定期取样测定抗病相关防御酶、病程相关蛋白、类黄酮、总酚及丙二醛含量的变化。结果表明:0.50 mg/mL的EGb能有效控制猕猴桃果实接种青霉菌后的发病率,抑制病斑扩展,提高猕猴桃果肉多酚氧化酶(PPO)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、几丁质酶(CHI)和β-1,3-葡聚糖酶(GLU)活性,促进总酚和类黄酮的积累,同时降低膜脂过氧化程度,减少丙二醛的产生,其中以EGb处理后再接种青霉菌的抗性诱导效果最好,表明0.50 mg/mL的EGb可能以Priming机制诱导猕猴桃对青霉菌的抗性。
关键词:‘秦美’猕猴桃;扩展青霉;银杏叶提取液;诱导抗性
张美丽, 何玲, 苑希蕊, 等. 银杏叶提取液诱导采后猕猴桃对青霉病的抗性机制[J]. 食品科学, 2016, 37(6): 242-247. DOI:10.7506/spkx1002-6630-201606044. http://www.spkx.net.cn
ZHANG Meili, HE Ling, YUAN Xirui, et al. Induction of resistance in kiwifruit (Actinidia chinensis) against Penicillum expansum by Ginkgo biloba L. leaf extract[J]. Food Science, 2016, 37(6): 242-247. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606044. http://www.spkx.net.cn
猕猴桃(Actinidia chinensis)果实含有人体必需的多种维生素、氨基酸和矿物质等,在人体中利用率高达94%[1]。猕猴桃属于浆果类果实,在采摘及贮运过程中易受机械损伤而引起病菌侵染,及在田间的潜伏侵染,导致贮藏过程中的腐烂损失严重。由扩展青霉(Penicillium expansum)引起的青霉病是猕猴桃贮藏期常见的病害之一[2],扩展青霉在环境中广泛存在,可由果实伤口或者自然孔口侵入,引发猕猴桃腐烂[3]。化学药剂结合冷藏是目前防治猕猴桃贮藏病害的常用方法[4],但由于扩展青霉属于嗜冷性真菌,冷藏难以有效防治,而过量使用杀菌剂将导致耐药菌株产生以及化学药剂残留等问题的出现,甚至引发扩展青霉次级代谢提高,引起毒素积累,威胁人体健康[5]。通过一定的激发子处理,激活植物自身的防御体系从而产生对病原菌广谱的抗病性,称为植物的诱导抗性,被认为是果蔬采后病害防治中最有发展前景的途径之一[6-8]。目前研究较多的激发子有水杨酸(salicylic acid,SA)、苯并噻二唑(S-methyl benzothiadiazole-7-carbothioate,BTH)、茉莉酸甲酯(methyl jasmonate,MeJA)等,它们来源于植物或者根据植物体内的物质经人工合成[9]。植物源保鲜剂成分复杂,功能多样,诱导抗性是植物源保鲜剂的防腐保鲜机理之一,如芦荟粗提物能诱导苹果对Botrytis cinerea的抗性[10]、茶叶粗提物能诱导桃防御酶活性升高,提高对Botrytis cinerea的抗性[11]等。银杏叶乙醇提取物(extraction of of Ginkgo biloba L. leaves,EGb)富含黄酮类物质,具有良好的离体抑菌效果[12-13],活体实验研究表明EGb能有效控制柑橘贮藏期青霉病的发生[14],同时对鲜切苹果具有良好的保鲜作用[15-16],但有关EGb诱导抗性的研究目前还鲜见报道。
本研究以‘秦美’猕猴桃为试材,研究EGb对猕猴桃抗性诱导的效果及其机理,为开发EGb在猕猴桃贮藏保鲜中的应用提供理论依据。
1.1 材料与试剂
‘秦美’猕猴桃,2014年10月10日采自陕西周至一管理良好的果园,采收时可溶性固形物含量为7.0%~7.5%,采摘当天运回实验室,选择果型端正、无病虫害、无机械损伤、统一大小的果实,预冷后0 ℃冷库贮藏。
病原菌为扩展青霉,课题组从发病的‘秦美’猕猴桃果实病健交接处分离纯化,PDA培养基中4 ℃冰箱保存。使用前在PDA培养基中25 ℃培养活化7 d后,用含0.05% Tween-20的无菌水洗下孢子,采用血球计数板计数,用无菌水调整孢子含量至1×104spores/mL,现配现用。
L-苯丙氨酸、硼酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、浓盐酸、无水乙醇、冰醋酸、牛血清蛋白、葡萄糖、30%过氧化氢、邻苯二甲酸氢钾、硼砂、无水醋酸钠、愈创木酚、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTANa2);聚乙二醇(polyethylene glycol,PEG)6000、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、聚乙二醇辛基苯基醚(TritonX-100)、β-巯基乙醇均为国产分析纯。芦丁生化试剂(质量分数≥95%) 美国Sigma公司。
1.2 仪器与设备
RE-52AA型旋转蒸发仪、SHZ-Ⅲ型循环水真空泵上海市亚荣生化仪器厂;KQ-500DB数控超声波清洗器昆山市超声仪器有限公司;BCD-236DT型海尔冰箱青岛海尔股份有限公司;紫外无菌操作台 苏净集团安泰公司;3K15型高速冷冻离心机 美国Sigma公司;UV-1800型紫外-可见分光光度计 科大中佳公司;IKA A11 基本型分析研磨机 德国IKA公司。
1.3 方法
1.3.1 EGb的制备
参照冯金霞等[15]的方法,以类黄酮含量确定EGb的质量浓度。
1.3.2 样品处理
猕猴桃果实用2%次氯酸钠溶液浸泡2 min,蒸馏水冲洗3~5 次,自然晾干,每个猕猴桃果实的赤道部位用无菌不锈钢铁钉(Φ=4 mm)形成一个统一大小的伤口(4 mm×5 mm)。
将果实分为两组:一组用于抗性诱导效果的研究:每个伤口分别加入25 μL质量浓度为0(对照)、0.25、0.50、0.75 mg/mL的EGb,24 h后接种20 μL孢子悬浮液,接种后用PE塑料袋密封保湿(相对湿度85%~90%),室温(23 ℃)放置,待病斑直径明显时(大约第4天)每天定时测定病斑直径和发病率。每个处理3 个重复、每个重复30 个果实,实验重复2 次。另一组果实用于诱导抗性机理研究:实验设4 个处理,每个伤口分别加入:A组25 μL无菌水(对照);B组25 μL 0.50 mg/mL的EGb(表示为EGb处理);C组20 μL青霉菌孢子悬浮液(表示为P. expansum处理);D组25 μL 0.50 mg/mL的EGb,24 h后接种20 μL青霉孢子悬浮液(表示为EGb+P. expansum处理)。分别在接菌后0、12、24、36、48、72、96、120 h取病斑周围1.5 cm范围内果肉组织混匀,用液氮研磨仪研成粉末后-80 ℃保存进行各项指标测定。每个处理3 个重复,每个重复4 个果实。
1.3.3 指标测定
1.3.3.1 病斑直径和发病率测定
病斑直径采用十字交叉法,取平均值;以病斑直径不小于0.50 mm确定为发病。
1.3.3.2 酶液提取与酶活性测定
准确称取1 g果肉样品加入不同的提取缓冲液中测定相应酶活性。对多酚氧化酶(polyphenol oxidase,PPO)加入5 mL预冷(4 ℃)的50 mmol/L含1 mmol EDTA、2% PVPP和0.3% TritonX-100的磷酸缓冲液(pH 7.8);对过氧化物酶(peroxidase,POD)加入5 mL预冷(4 ℃)的100 mmol/L含1 mmol PEG 6000、4%聚乙烯聚吡咯烷酮(polyvinyl-polypyrrolidone,PVPP)和1% TritonX-100的乙酸-乙酸钠缓冲液(pH 5.5);对苯丙氨酸解氨酶(phenylalanine amonialyase,PAL)加入5 mL预冷(4 ℃)的100 mmol/L含4% PVPP、2 mmol EDTA 和5 mmol β-巯基乙醇的硼酸缓冲液(pH 8.8);对几丁质酶(chitinase,CHI)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)加入5 mL预冷(4 ℃)的100 mmol/L 含1 mmol EDTA、2% PVPP、5 mmol β-巯基乙醇的乙酸缓冲液(pH 5.0)。
将果肉样品和提取液充分混匀后静置提取1 h,期间摇动数次,然后在4 ℃、12 000 r/min条件下离心20 min,取上清液作为粗酶液测定相应酶活性。
PPO活性测定:在2.9 mL邻苯二酚溶液(用50 mmol/L、pH 5.5的磷酸-柠檬酸缓冲液配制)中加入100 μL粗酶液,立即混匀,迅速测定420 nm波长处吸光度的连续变化。以1 min内吸光度上升1为一个酶活性单位(U),结果以U/g表示。
POD活性测定:参考曹健康等[17]的方法,以1 min内470 nm波长处吸光度上升1为一个酶活性单位(U),结果以U/g表示。
PAL活性测定:参照曹健康等[17]的方法,略改动:对照以蒸馏水代替L-苯丙氨酸,37 ℃水浴1 h后以对照为参比调零,测定290 nm波长处吸光度,以每小时酶促反应体系吸光度增加1作为一个酶活性单位(U),结果以U/g表示。
CHI活性测定:参照曹健康等[17]的方法,以每小时酶促反应体系从胶状几丁质中释放1 μg N-乙酰葡萄糖胺为一个酶活性单位(U),结果以U/g表示。
GLU活性测定:参照Zong Yuanyuan等[18]的方法,以每小时酶促反应体系分解昆布多糖产生1 mg葡萄糖为一个酶活性单位(U),结果以U/g表示。
1.3.3.3 丙二醛含量的测定
参考高俊凤[19]的方法。
1.3.3.4 总酚和类黄酮含量测定
参考Pirie等[20]的方法略加修改。称取1.0 g猕猴桃果肉粉末样品,加入9 mL 经4 ℃预冷的1% HCl-甲醇溶液后充分混匀,4 ℃避光提取20 min,期间摇动数次,4 ℃、12 000 r/min离心15 min,取上清液于280 nm和325 nm波长处比色测定吸光度。总酚含量用A280 nm/g表示;类黄酮物质含量用A325 nm/g表示。
1.4 数据处理
数据统计分析应用SPSS 17.0进行单因素方差分析,作图采用Microsoft Excel 2007,差异显著性测定采用邓肯氏多重比较法,P<0.05为差异显著。
2.1 不同质量浓度EGb对猕猴桃果实损伤接种青霉菌发病率和病斑直径的影响
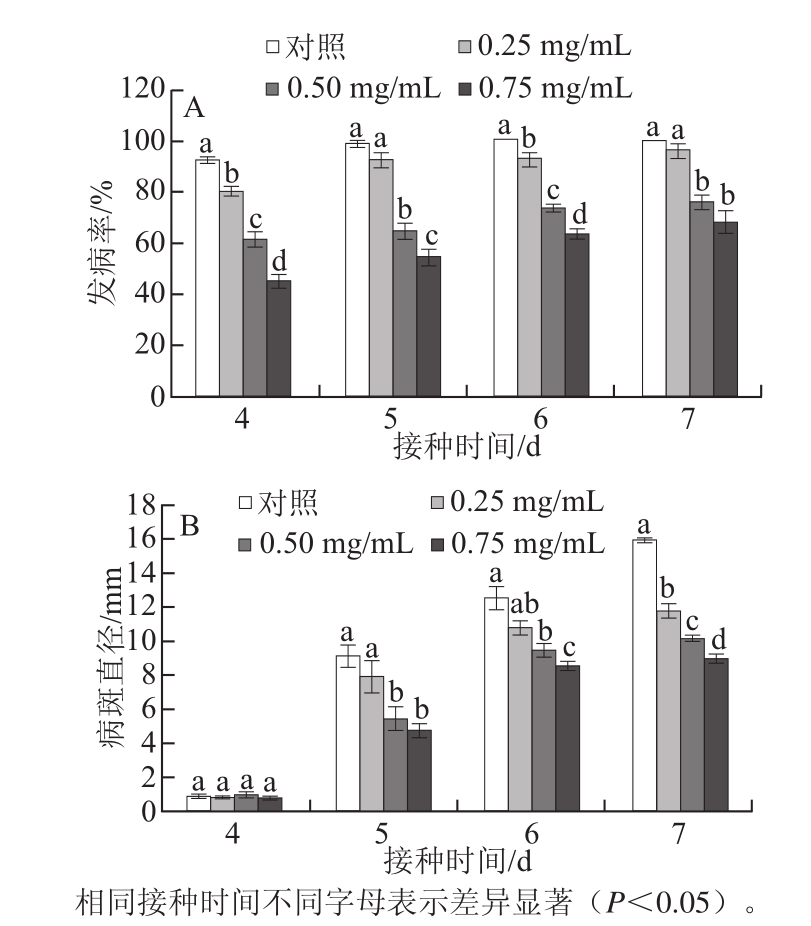
图1 不同质量浓度EGb对猕猴桃果实损伤接种青霉菌发病率(A)和病斑直径(B)的影响
Fig.1 Changes in disease incidence (A) and lesion diameter (B) in kiwifruit treated with different concentrations of EGb and then inoculated with P. expansum during incubation at 23 ℃ for 7 days
如图1 A所示,接种后第4天,对照发病率为92.22%,0.25、0.50、0.75 mg/mL 的EGb处理分别为80%、61.11%、44.44%,均显著低于对照,处理之间差异显著(P<0.05);对照接种第6天发病率达100%,0.25 mg/mL的EGb处理第7天发病率为96.67%,与对照差异不显著(P>0.05),0.50 mg/mL和0.75 mg/mL的处理分别为75.56%和67.78%,均显著低于对照(P<0.05),二者之间无明显差异(P>0.05)。如图1B所示,接菌后第4天各组处理病斑直径在1 mm以内,处理之间差异不显著(P>0.05),第5天开始病斑迅速扩展,对照病斑直径达9.14 mm,显著高于0.50 mg/mL处理的5.48 mm及0.75 mg/mL处理的4.85 mm(P<0.05),至第7天,病斑直径随着EGb质量浓度升高而降低,各组处理差异达到显著水平(P<0.05)。
2.2 EGb处理对猕猴桃果实防御相关酶活性的影响

图2 EGb处理对猕猴桃果实PPO(A)、POD(B)、PAL(C)活性的影响
Fig.2 Effect of EGb treatment on PPO (A), POD (B) and PAL (C) activities in kiwifruit
由图2A可知,PPO活性总体呈上升的趋势,各实验组在接种12 h后PPO活性最高,其中EGb+P. expansum最大值为12.54 U/g,显著高于EGb和P. expansum单独接种处理(P<0.05);EGb+P. expansum从12 h开始显著高于对照,EGb和P. expansum分别从24、48 h开始才与对照差异达到显著水平(P<0.05),表明EGb+P. expansum能快速诱导猕猴桃果实PPO活性升高。
如图2B所示,各组POD活性在处理后12 h达到最高峰,其中EGb+P. expansum为6.74 U/g,比对照高出了3.2 U/g,显著高于EGb和P. expansum单独处理(P<0.05)。12 h以后,对照POD活性平缓下降,EGb+P. expansum、EGb和P. expansum在48 h出现了第二次高峰,在处理期内,EGb+P. expansum处理POD活性一直保持相对较高的趋势。
如图2C所示,对照组PAL活性变化幅度较小,EGb+P. expansum在处理后24 h诱导PAL酶活性持续升高,至24 h达到最大值0.77 U/g,是对照的2.08 倍、P. expansum的2.4 倍,此后一直保持较高的PAL活性;EGb处理分别在24、36、72 h及96 h显著诱导提高了PAL活性(P<0.05),在24 h和72 h出现了两个高峰,值分别为0.504 U/g和0.48 U/g。
2.3 EGb处理对猕猴桃果实病程CHI和GLU活性的影响
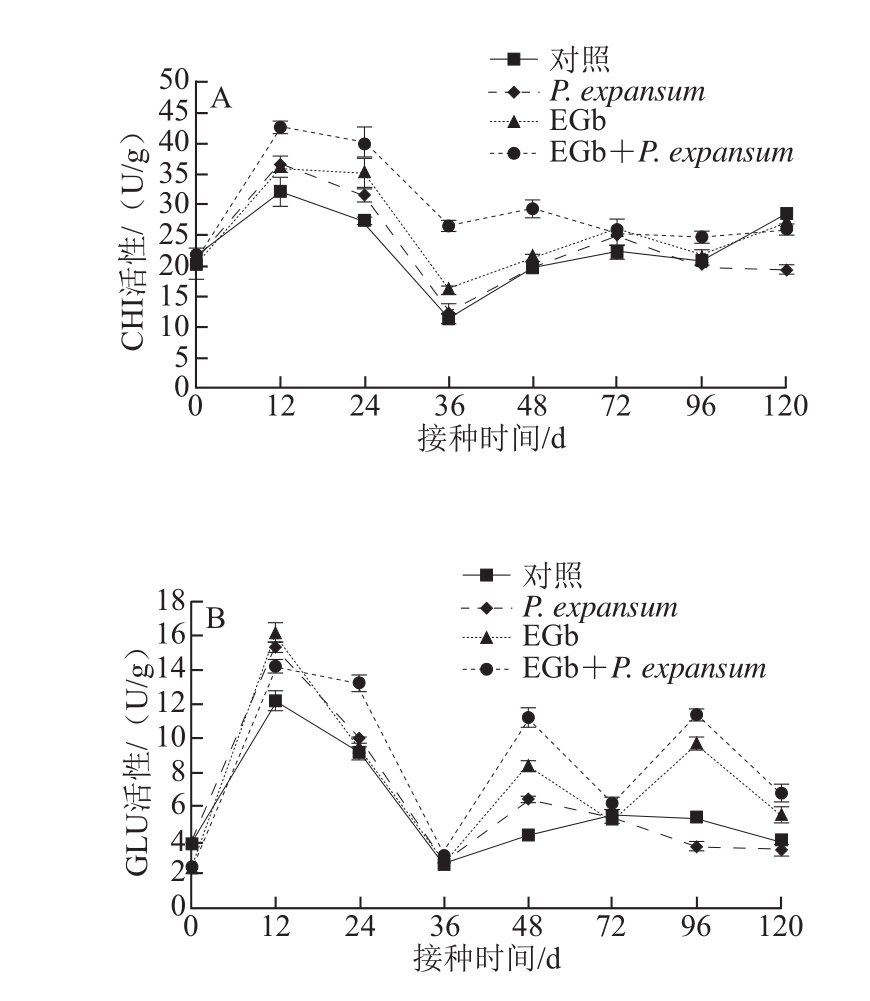
图3 EGb处理对猕猴桃果实CHI(A)、GLU(B)活性的影响
Fig.3 Effect of EGb treatment on CHI (A) and GLU (B) activities in kiwifruit
如图3A所示,各处理CHI活性呈先升高后降低的趋势,12 h达到最大值,其中EGb+P. expansum最大值为42.67 U/g,是对照的1.33 倍,EGb和P. expansum单独处理组与对照差异不显著(P>0.05);随后各处理CHI活性逐渐下降,EGb+P. expansum处理一直高于单独接种EGb 和P. expansum的处理。
如图3B所示,EGb+P. expansum和EGb处理GLU活性在12、48、96 h有3 个高峰,P. expansum分别在12、48 h出现2 个高峰,最大值均出现在接种后12 h,不同接种处理GLU活性显著高于对照(P<0.05),EGb+P. expansum处理在24、48、96、120 h显著高于EGb和P. expansum单独的处理(P<0.05)。
2.4 EGb处理对猕猴桃类黄酮和总酚含量的影响

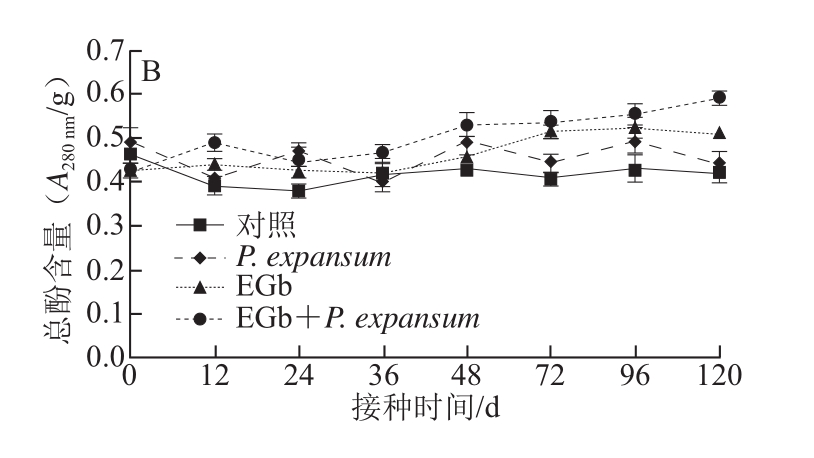
图4 EGb处理对猕猴桃果肉类黄酮(A)和总酚(B)含量的影响
Fig.4 Effect of EGb treatment on total flavonoid (A) and phenolics (B) contents in kiwifruit
如图4A所示,对照类黄酮含量基本保持不变,EGb+P. expansum从12 h类黄酮含量显著高于对照(P<0.05),并高于EGb和P. expansum单独处理,EGb在处理后48 h开始与对照差异显著(P<0.05),P. expansum在接种12 h达到第一个高峰,48 h开始显著低于EGb和EGb+P. expansum(P<0.05);如图4B所示,总酚含量在处理周期内变化幅度不大,EGb+P. expansum处理在12 h达到第一个高峰,48 h开始一直高于EGb和P. expansum单独处理(P<0.05)。
2.5 EGb处理对猕猴桃接种青霉菌后果肉丙二醛含量的影响

图5 EGb处理对猕猴桃果肉丙二醛含量的影响
Fig.5 Effect of EGb treatment on MDA content in kiwifruit
如图5所示,对照丙二醛含量呈现上升趋势,在24 h达到高峰,这主要是由于损伤处理造成细胞膜结构破坏所致;P. expansum处理的丙二醛含量在24 h和48 h出现了两个高峰,48~72 h显著高于对照(P<0.05);EGb和EGb+P. expansum处理丙二醛含量基本保持不变,表明银杏叶提取液处理有效抑制了猕猴桃果肉膜脂过氧化的进程。
EGb的主要有效成分是黄酮类化合物,以类黄酮含量表示不同质量浓度的EGb,研究其对猕猴桃诱导抗性的作用,结果表明随着EGb质量浓度增加,诱导抗病性的效果变好,0.50 mg/mL的EGb能够明显抑制猕猴桃青霉病的发生,至处理后第7天,0.50 mg/mL的EGb处理发病率比对照降低了24%,病斑直径比对照减少36%。与袁仲玉等[10]以类黄酮含量表示芦荟粗提物质量浓度研究其对苹果抗病性诱导的结果相一致。
PPO、POD、PAL是植物体内与抗病相关的重要防御酶, PPO和POD参与果实的活性氧代谢,并参与酚类物质的氧化合成毒性更强的醌类物质,植物体内大多数的酚类化合物通过苯丙烷代谢途径产生,而PAL是植物苯丙烷代谢途径的关键酶,具有较强的诱导合成特性,本实验研究发现,在病原菌侵染初期,PPO和POD的合成速率大于PAL的合成速率,PPO和POD活性在处理后12 h达到最大值,而PAL活性最高值则出现在24 h,表明PPO 和POD促进酚类物质氧化进一步增强了PAL活性,可能是三者协同作用增强果实对病原菌的抗性; CHI和GLU是植物建立系统抗病性的标志酶,是植物病程相关蛋白(PRs)的主要成员。许多的抗病诱导剂诱导的抗病反应与上述酶活性的升高有关,如苯并噻重氮(ASM/BTH)诱导芒果对炭疽病菌的抗性[21],SA诱导枣对黑斑病的抗性[22]以及MeJA诱导香蕉的抗病反应[23]等。总酚和类黄酮是植物体内重要的植保素类物质,ASM诱导厚皮甜瓜和芒果的抗病反应伴随总酚和类黄酮含量的增加[24-25],NO处理促进了总酚和类黄酮的积累诱导芒果对炭疽病菌的抗病性。EGb富含黄酮类化合物,本实验研究结果显示,EGb单独处理在处理后48 h类黄酮含量与对照达到差异显著水平(P<0.05),而EGb+P. expansum处理在处理后12 h就与对照差异达到显著水平,表明果肉组织中类黄酮含量的升高不是由于EGb渗入而引起。
本实验研究结果显示,EGb+P. expansum、EGb和P. expansum均能在一定程度上诱导猕猴桃果实PPO、POD、PAL、CHI、GLU活性的升高,促进总酚和类黄酮的积累,从诱导酶活性升高的幅度以及诱导反应的速度来说以EGb+P. expansum处理效果最好,与Yu Chen等[26]研究GABA诱导梨对青霉病的抗性机制以及其他研究[27-28]用10 μmol/L的MeJA诱导甜樱桃和杨梅对青霉病的抗性机制相似,表明0.50 mg/mL的EGb可能是通过Priming机制诱导猕猴桃对P. expansum的抗性,即经0.50 mg/mL的EGb处理后,猕猴桃果实内的防御反应处于待激发态,当受到病原菌刺激时立即启动防御反应,快速诱导防御酶活性升高,抗病物质迅速积累。一般通过Priming机制诱导抗性的诱导剂其使用浓度相对较低[29],Wang Kaituo等[30]研究表明10 μmol/L的MeJA通过Priming机制诱导葡萄对灰霉病的抗性,其诱导抗性的效果与50~100 μmol/L的MeJA通过直接诱导抗性机制的效果相同,但后者会造成葡萄可溶性物质含量降低,因而Priming机制在果蔬采后抗病性诱导方面被认为是一种经济高效的途径。
本实验研究结果表明,EGb能够诱导猕猴桃对青霉菌侵染的抗性,结合前人研究[12-13]结果,EGb在离体条件下具有良好的抑菌活性,这可能是由于EGb作为一种粗提物,其中含有很多物质,有的有抑菌作用,有的有诱导抗性作用,其中的抑菌成分可能有银杏叶类脂[31]、银杏酚酸[32]及银杏叶黄酮[12]等,银杏叶黄酮中的槲皮素和芦丁等可能兼具有抗性诱导及抑菌的功能[33-35],在果实的抗病诱导中有效成分的跟踪研究将是下一步研究的重点。
0.50、0.75 mg/mL的EGb能有效降低猕猴桃果实接种青霉菌后的发病率和抑制病斑的扩展。0.50 mg/mL的EGb通过诱导猕猴桃果实PPO、POD、PAL、CHI、GLU活性升高,促进总酚和类黄酮的合成来提高猕猴桃对青霉菌的抗性,其诱导抗性的机制可能为Priming途径。
参考文献:
[1] 周玲艳, 潘伟明, 伍宇雁, 等. 猕猴桃三子叶突变体的形态特征研究[J]. 广西植物, 2013, 33(4): 547-551. DOI:10.3969/ j.issn.1000-3142.2013.04.021.
[2] 段爱莉, 雷玉山, 孙翔宇, 等. 猕猴桃果实贮藏期主要真菌病害的rDNA-ITS鉴定及序列分析[J]. 中国农业科学, 2013, 46(4): 810-818. DOI:10.3864/j.issn.0578-1752.2013.04.015.
[3] NERI F, DONATI I, VERONESI F, et al. Evaluation of Penicillium expansum isolates for aggressiveness, growth and patulin accumulation in usual and less common fruit hosts[J]. International Journal of Food Microbiology, 2010, 143(3): 109-117. DOI:10.1016/ j.ijfoodmicro.2010.08.002.
[4] 张美芳, 何玲, 张美丽, 等. 猕猴桃鲜果贮藏保鲜研究进展[J]. 食品科学, 2014, 35(11): 343-347. DOI:10.7506/spkx1002-6630-201411066.
[5] SANZANI S, REVERBERI M, PUNELLI M, et al. Study on the role of patulin on pathogenicity and virulence of Penicillium expansum[J]. International Journal of Food Microbiology, 2012, 153(3): 323-331. DOI:10.1016/j.ijfoodmicro.2011.11.021.
[6] 李淼, 产祝龙, 田世平, 等. 果实采后病害诱导抗性研究进展[J]. 保鲜与加工, 2010, 10(5): 1-7.
[7] RUIZ-GARCÍA Y, GÓMEZ-PLAZA E. Elicitors: a tool for improving fruit phenolic content[J]. Agriculture, 2013, 3(1): 33-52. DOI:10.3390/ agriculture3010033.
[8] TERRY L A, JOYCE D C. Elicitors of induced disease resistance in postharvest horticultural crops: a brief review[J]. Postharvest Biology and Technology, 2004, 32(1): 1-13. DOI:10.1016/ j.postharvbio.2003.09.016.
[9] BI Yang, LI Yongcai, GE Yonghong. Induced resistance in postharvest fruits and vegetables by chemicals and its mechanism[J]. Stewart Postharvest Review, 2007, 3(6): 1-7. DOI:10.2212/spr.2007.6.1.
[10] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-263. DOI:10.3969/ j.issn.1002-6819.2014.04.031.
[11] 张绍珊, 陈娇娇, 杨晓萍. 茶叶提取物对采后桃果苯丙氨酸解氨酶、多酚氧化酶、过氧化物酶活性的诱导[J]. 食品科学, 2013, 34(10): 304-307. DOI:10.7506/spkx1002-6630-201310067.
[12] 豁银强, 尹杰, 陈雪, 等. 银杏叶黄酮的超声波提取及其抗菌研究[J].食品工业, 2012, 33(5): 47-49.
[13] 李虎, 徐奇, 李文静, 等. 银杏叶黄酮粗提物提取及其抑菌性质研究[J].中国酿造, 2011, 30(10): 107-110.
[14] 喻林华, 李晓烈, 蓝华, 等. 银杏叶提取物对柑橘青霉病菌的抑菌效果[J]. 食品与机械, 2010(6): 60-62. DOI:10.3969/ j.issn.1003-5788.2010.06.001.
[15] 冯金霞, 何玲, 蒲雪梅. 银杏叶提取液对鲜切‘红富士’苹果品质的影响[J]. 食品科学, 2013, 34(20): 302-306. DOI:10.7506/spkx1002-6630-201320063.
[16] 张美芳, 何玲, 冯金霞, 等. 银杏叶提取液复合涂膜对鲜切苹果品质的影响[J]. 食品科学, 2014, 35(10): 263-267. DOI:10.7506/spkx1002-6630-201410049.
[17] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 101-154.
[18] ZONG Yuanyuan, LIU Jia, LI Boqiang, et al. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit[J]. Biological Control, 2010, 54(3): 316-321. DOI:10.1016/j.biocontrol.2010.06.003.
[19] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 210.
[20] PIRIE A, MULLINS M G. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose, nitrate, and abscisic acid[J]. Plant Physiology, 1976, 58(4): 468-472.
[21] ZHU X, CAO J, WANG Q, et al. Postharvest infiltration of BTH reduces infection of mango fruits (Mangifera indica L. cv. tainong) by Colletotrichum gloeosporioides and enhances resistance inducing compounds[J]. Journal of Phytopathology, 2008, 156(2): 68-74. DOI:10.1111/j.1439-0434.2007.01320.x.
[22] CAO Jiankang, YAN Jiaqi, ZHAO Yumei, et al. Effects of postharvest salicylic acid dipping on Alternaria rot and disease resistance of jujube fruit during storage[J]. Journal of the Science of Food and Agriculture, 2013, 93(13): 3252-3258. DOI:10.1002/jsfa.6167.
[23] 麻宝成, 朱世江. 苯并噻重氮和茉莉酸甲酯对采后香蕉果实抗病性及相关酶活性的影响[J]. 中国农业科学, 2006, 39(6): 1220-1227.
[24] LIU Yaoyao, GE Yonghong, BI Yang, et al. Effect of postharvest acibenzolar-S-methyl dipping on phenylpropanoid pathway metabolism in muskmelon (Cucumis melo L.) fruits[J]. Scientia Horticulturae, 2014, 168: 113-119. DOI:10.1016/j.scienta.2014.01.030.
[25] PAN Yonggui, LIU Xinhua. Effect of benzo-thiadiazole-7-carbothioic acid s-methyl ester (BTH) treatment on the resistant substance in postharvest mango fruits of different varieties[J]. African Journal of Biotechnology, 2011, 10(69): 15521-15528. DOI:10.5897/AJB11.2150.
[26] YU Chen, ZENG Lizhen, SHENG Kuang, et al. γ-Aminobutyric acid induces resistance against Penicillium expansum by priming of defence responses in pear fruit[J]. Food Chemistry, 2014, 159: 29-37. DOI:10.1016/j.foodchem.2014.03.011.
[27] WANG Lei, JIN Peng, WANG Jing, et al. Methyl jasmonate primed defense responses against Penicillium expansum in sweet cherry fruit[J]. Plant Molecular Biology Reporter, 2015, 33(5): 1463-1471. DOI:10.1007/s11105-014-0844-8.
[28] WANG Kaituo, JIN Peng, HAN Lin, et al. Methyl jasmonate induces resistance against Penicillium citrinum in Chinese bayberry by priming of defense responses[J]. Postharvest Biology and Technology, 2014, 98: 90-97. DOI:10.1016/j.postharvbio.2014.07.009.
[29] WANG Kaituo, LIAO Yunxia, CAO Shifeng, et al. Effects of benzothiadiazole on disease resistance and soluble sugar accumulation in grape berries and its possible cellular mechanisms involved[J]. Postharvest Biology and Technology, 2015, 102: 51-60. DOI:10.1016/ j.postharvbio.2015.02.011.
[30] WANG Kaituo, LIAO Yunxia, KAN Jianquan, et al. Response of direct or priming defense against Botrytis cinerea to methyl jasmonate treatment at different concentrations in grape berries[J]. International Jour nal of Food Microbiology, 2015, 194: 32-39. DOI:10.1016/ j.ijfoodmicro.2014.11.006.
[31] 陶冉, 王成章, 孔振武. 银杏叶类脂成分与聚戊烯醇的协同抑菌作用[J]. 中国实验方剂学杂志, 2013, 19(17): 203-210. DOI:10.11653/ syfj2013170203.
[32] 杨小明, 朱伟, 陈钧, 等. 银杏酸单体的抗菌活性研究[J]. 中药材, 2004, 27(9): 661-663.
[33] SANZANI S M, SCHENA L, NIGRO F, et al. Effect of q uercetin and umbelliferone on the transcript level of Penicillium expansum genes involved in patulin biosynthesis[J]. European Journal of Plant Pathology, 2009, 125(2): 223-233. DOI:10.1007/s10658-009-9475-6.
[34] 徐晓楠, 李明, 丁新华, 等. 芦丁作为激发子提高烟草对病害的抗性[C]//中国植物病理学会2011年学术年会. 北京: 中国农业科学技术出 版社, 2011: 453.
[35] SANZANI S M, de GIROLAMO A, SCHENA L, et al. Control of Penicillium expansum and patulin accumulation on apples b y quercetin and umbelliferone[J]. European Food Research and Technology, 2009, 228(3): 381-389. DOI:10.1007/s00217-008-0944-5.
ZHANG Meili, HE Ling*, YUAN Xirui, DU Fangmeng, ZHAO Kaixi
(College of Horticulture, Northwest A&F University, Yangling 712100, China)
Abstract: The present work was conducted to investigate the effects of treatment with Ginkgo biloba L. leaf extract (EGb) on disease resistance against Penicillum expansum infection and the possible mechanisms involved. The kiwifruit were treated with EGbs containing 0.25, 0.50 and 0.75 mg/mL fl avonoids and distilled water (control) after harvest, respectively. Twenty-four hours after the treatment with EGb, the fruit were inoculated with 20 μL of conidial suspension of Penicillium expansum (1×104spores/mL) and incubated at 23 ℃ and 85%–90% relative humidity (RH) for disease development. In addition, to investigate the resistance mechanism against Penicillum expansum infection, kiwifruit with four treatments namely EGb, P. expansum, EGb + P. expansum and control were tested. Results showed that disease incidence and lesion diameter in kiwifruit after the inoculation were signifi cantly (P < 0.05) reduced by 0.50 mg/mL EGb during the incubation. Moreover, the activities of polyphenol oxidase, peroxidase, phenylalnine ammonialyase, chitinase and β-1,3-glucanase as well as the content of total phenolics and fl avonoids were markedly and/or promptly enhanced in the EGb + P. expansum treatment compared with those treated with EGb or inoculated with pathogen alone. Besides, the content of MDA was decreased by EGb treatment. Its mechanisms may be closely correlated with the induction of fruit resistance by priming activation upon challenge with pathogen. These results suggest that the effi cacy of EGb at 0.50 mg/mL on controlling blue mold decay in kiwifruit may be related to the priming of defense responses.
Key words: ‘Qinmei’ kiwifruit; Penicillum expansum; Ginkgo biloba L. leaf extract (EGb); induced resistance
中图分类号:S663.4
文献标志码:A
文章编号:1002-6630(2016)06-0242-06引文格式:
DOI:10.7506/spkx1002-6630-201606044
*通信作者:何玲(1965—),女,副教授,博士,研究方向为果蔬加工及园艺产品采后贮藏保鲜。E-mail:heliurui@nwsuaf.edu.cn
作者简介:张美丽(1990—),女,硕士研究生,研究方向为园艺产品采后生理与贮藏保鲜。E-mail:zhangmeili@nwsuaf.edu.cn
基金项目:国家大学生创新训练计划项目(201510712010);杨陵示范区科技计划项目(2015NY-14)
收稿日期:2015-07-20