程玉娇,李云云,张 敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:以‘塔罗科’血橙为试材,采用48、52、56 ℃的热水分别短时处理1 min和2 min,研究其在贮藏期(3 ℃、相对湿度(relative humidity,RH)90%~95%条件下21 d)、模拟运输期(10 ℃、RH 60%~70%条件下7 d)和货架期(20 ℃、RH 60%~70%条件下7 d)3 个物流变温阶段的保鲜效果。结果表明,适宜的热水处理能明显减缓物流过程温度变化引起的不利影响,提高血橙果皮中多酚氧化酶、过氧化物酶、超氧化物歧化酶、过氧化氢酶的活性,使其维持在较高水平;同时,也能够保持很好的色泽(柑橘色泽指数、色相)、硬度和营养品质(花色苷含量、总酸含量、可溶性固形物含量)。然而处理温度超过56 ℃造成血橙产生不可逆的热损伤,物流过程中的温度变化促进了其腐烂。综合分析,52 ℃、2 min条件下血橙的保鲜效果最佳。
关键词:热处理;热损伤;‘塔罗科’血橙;抗氧化酶;物流
程玉娇, 李云云, 张敏. 热处理对‘塔罗科’血橙物流变温环境下的保鲜效果[J]. 食品科学, 2016, 37(6): 254-260. DOI:10.7506/spkx1002-6630-201606046. http://www.spkx.net.cn
CHENG Yujiao, LI Yunyun, ZHANG Min. Effect of hot water treatment on the quality preservation of ‘Tarocco’ oranges in logistic environments under varying temperature conditions[J]. Food Science, 2016, 37(6): 254-260. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201606046. http://www.spkx.net.cn
‘塔罗科’(‘Tarocco’)血橙,原产于意大利,其果肉色深、汁多味浓、具玫瑰香味并富含花色苷、类黄酮等多酚化合物,具有抗氧化、预防心血管疾病等保健功能[1],深受消费者喜爱。然而,由于血橙皮薄,易受机械损伤,导致病菌(主要为青霉菌、绿霉菌)侵染,引起果蔬腐烂变质[2],大大缩短了其货架期,极大地制约了血橙相关产业的发展。传统的保鲜方法主要是化学保鲜[3](如噻菌灵、抑霉唑、2-羟基联苯钠盐等)和打蜡[4]处理。但化学保鲜剂的残留问题也逐渐受到消费者的质疑;而不适当的蜡液进行的打蜡处理[5]会使柑橘表面形成白色斑块或龟裂并出现碎片脱落,同时也会导致异味物质的产生,严重影响血橙的风味。
果蔬物流过程包括贮藏期、运输期和货架期3 个阶段,由于我国冷链运输体系不完善,果蔬在整个物流过程中存在一定的温度变化情况。低温贮藏可以有效调节果蔬呼吸代谢,延缓其成熟衰老,更好地保持生理代谢及营养物质的稳定,然而出库后温度的升高却会加剧柑橘的腐烂[6-7],其机理尚不清楚,通过采取措施有效减缓柑橘采后腐烂显得尤为重要。热处理技术[8]是采取适宜温度(一般为38~60 ℃)的介质(热水、热空气或热蒸汽)对果蔬进行处理,杀死或抑制果蔬病原菌生长,调节其生理代谢,从而达到果蔬保鲜目的的一种物理保鲜方法。该技术具有无化学残留、安全性高、操作方便且经济的优点,逐渐成为国内外研究热点。目前,热处理技术已经广泛应用于枇杷[9]、香蕉[10]、桃[11]、草莓[12]、黄瓜[13]等的保鲜,但热处理技术对‘塔罗科’血橙物流变温环境下保鲜品质影响的研究较少。因此,本实验主要研究热处理技术对‘塔罗科’血橙贮藏期、运输期、货架期3 个阶段保鲜品质的影响,为‘塔罗科’血橙在变温物流情况下保鲜技术的开发提供理论依据。
1.1 材料与试剂
血橙品种为‘塔罗科’血橙,当果实七、八成熟时在不同树上进行随机采收,采摘后放入塑料周转筐中在36 h内运至重庆北碚。挑选无病害、表面无损伤、大小均匀、成熟度一致的果实清水清洗后进行晾干备用。
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(分析纯)、二硫苏糖醇(生化试剂)、福林酚(生物试剂) 成都科龙化工试剂厂;愈创木酚、TritonX-100、聚乙二醇(polyethylene glycol,PEG)6000(均为分析纯) 重庆北碚化学试剂厂;L-蛋氨酸(生化试剂)、核黄素(生化试剂)、氯化硝基氮蓝四唑(生物染色剂) 重庆川东化工试剂公司。
1.2 仪器与设备
RXZ-8000智能人工气候箱 宁波东南仪器有限公司;UltraScan®PRO测色仪 美国HunterLab公司;H1650R台式高速冷冻离心机 湖南湘仪公司;UV-2450PC紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 样品处理
首先采用自来水清洗血橙表面,晾干后随机分为7 组:C K组(未经热处理);热处理组:48 ℃、 1 min;48 ℃、2 min;52 ℃、1 min;52 ℃、2 min;56 ℃、1 min;56 ℃、2 min。热处理后将各个处理组放置室温条件下进行晾干,并冷却至室温。随后进行单果包装,在2 ℃、相对湿度(relative humidity,RH)90%~95%人工气候箱中贮藏21 d,放入10 ℃、RH 60%~70%人工气候箱中7 d来模拟物流运输,最后放入20 ℃、RH 60%~70%中7 d来模拟货架期。每隔7 d随机取样一次,进行各项指标测定,结果取其平均值。
1.3.2 腐烂率的测定
在货架期后统计各个处理组的烂果数,血橙腐烂率采用式(1)进行计算:
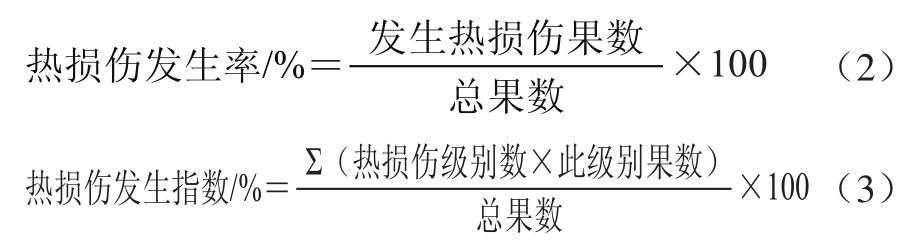
1.3.3 热损伤发生率和热损伤发生指数的计算
热损伤就是果蔬表面有轻微的水渍状或褐变失色凹陷区域,并且在贮藏期间区域面积不会扩大。热损伤发生程度可以划分为4 个级别:0级:无热损伤;1级:热损伤发生面积≤5%;2级:热损伤发生面积≤25%;3级:热损伤发生面积≤50%;4级:热损伤发生面积≥50%。在货架期后进行统计,血橙热损伤发生率和血橙热损伤发生指数采用式(2)、(3)进行计算:
1.3.4 质量损失率的计算
1.3.5 色差测定
在柑橘果实赤道部位均匀取4 点,根据CIE L*、a*、b*颜色标准采用UltraScan®PRO色差仪于室温条件下测得。参考Chen Ming等[14]采用柑橘色泽指数(citrus color index,CCI)和色相(Hue)表示柑橘颜色变化的方法。其中,CCI是反应柑橘颜色变化的综合指标,正值代表红色,负值代表蓝绿色,0值是红、黄和蓝绿的复合色;Hue值变化范围是从0°~360°,0°代表紫红色,90°代表黄色,180°代表蓝绿色。CCI和Hue值计算如式(5)、(6)所示:
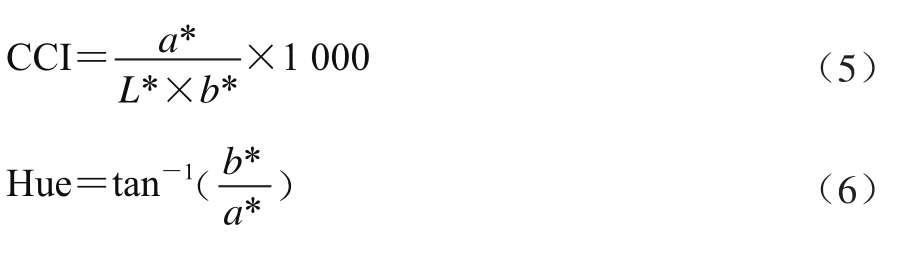
1.3.6 硬度测定
果实硬度由GY-1硬度计进行测定,探头直径为35 mm。在柑橘果实赤道部位均匀取4 点,削去果皮及内部白皮层,保留完整囊衣,不损伤内果皮进行测定,取平均值。
1.3.7 花色苷含量测定
采用pH差示法[15]。
1.3.8 总酸(total acid,TA)含量和可溶性固形物含量(soluble solids content,SSC)的测定
TA含量测定采用酸碱滴定法[9];SSC测定采用手持糖度计法[9]。
1.3.9 酶活性测定
1.3.9.1 多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性测定
称取0.5 g血橙果皮样品,置于研钵中,加入5 mL提取缓冲液(1 mmol PEG、4%交联聚乙烯吡咯烷酮和1% Triton X-100),在冰浴条件下研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液,即为PPO和POD提取液,4 ℃低温保存备用。
PPO活性测定:参考Zhou Yahan等[16]方法,向试管中加入4.0 mL 0.1 mol/L、pH 5.5乙酸钠缓冲液和1.0 mL 50 mmol/L邻苯二酚溶液、100 øL酶提取液,在420 nm波长处测吸光度。以每克果蔬样品在420 nm波长处每分钟吸光度增加0.01为1 个PPO活性单位。
POD活性测定:参考Chance等[17]方法,向试管中加入3 mL 25 mmol/L愈创木酚溶液、0.2 mL酶提取液、200 øL 0.5 mol/L H2O2溶液后开始计时,在470 nm波长处测吸光度。以每克果蔬样品在470 nm波长处每分钟吸光度增加0.01为1 个POD活性单位。
1.3.9.2 超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(cactalase,CAT)活性测定
称取0.5 g血橙果皮样品,置于研钵中,加入5 mL提取缓冲液(5 mmol/L二硫苏糖醇(DL-dithiothreitol,DTT)、5%聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、pH 7.5磷酸钠缓冲液),在冰浴条件下研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液,即为SOD和CAT提取液,4 ℃低温保存备用。
SOD活性测定:参考Zhang Xinhua等[18]方法,取一指形玻璃管,分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3 mL 130 mmol/L L-蛋氨酸、0.3 mL 750 ømol/L氮蓝四唑溶液、0.3 mL 100 ømol/L EDTA-Na2溶液,最后加入0.3 mL 20 ømol/L核黄素溶液和0.1 mL酶提取液。两支对照管中加入50 mmol/L pH 7.8磷酸缓冲液,一支置于暗处,另一支和其他管置于30 W日光灯下反应30 min后立即取出,放于暗处终止反应。以不照光管为参比调零,于560 nm波长处测吸光度。每克果蔬样品在560 nm波长处每分钟的反应体系对氮蓝四唑光化还原的抑制为50% 为1 个SOD活性单位。
CAT活性测定:参考Bassal等[7]方法,向试管中加入0.2 mL酶液、2.9 mL H2O2,在240 nm波长处测吸光度。以每克果蔬样品在240 nm波长处每分钟吸光度减少0.01 为1 个CAT活性单位。
1.4 数据处理与分析
采用Origin 8.0软件绘图和SPSS 13.0软件进行相关性和差异性分析。
2.1 热处理对‘塔罗科’血橙腐烂率的影响
表1 热处理对‘塔罗科’血橙腐烂率和热损伤的影响
Table 1 Effect of hot water treatment on decay rate and heat damage of ‘Tarocco’ orange
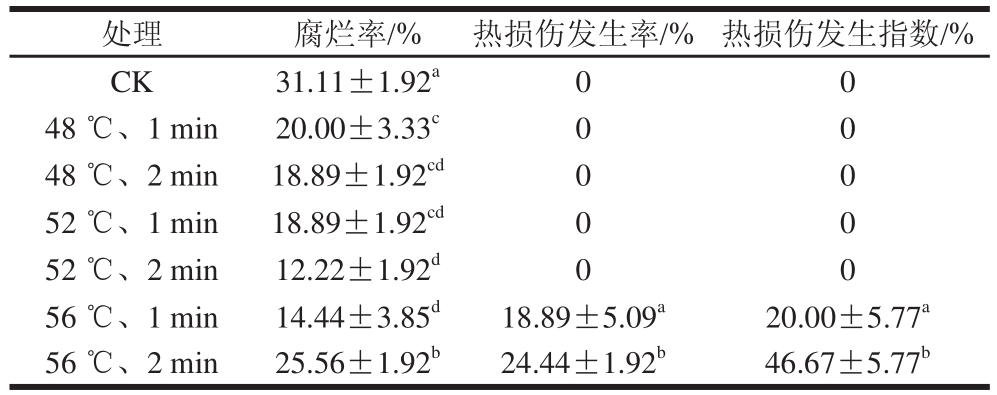
注:同列字母不同表示有显著性差异,P<0.05。
腐烂率是衡量果蔬保鲜效果的重要指标,而果蔬的腐烂主要是由病原菌的侵染造成的。如表1所示,在货架末期,CK组和热处理组之间差异显著(P<0.05),CK组腐烂率高达(31.11±1.92)%,同时56 ℃、2 min处理组也出现了较高的腐烂率(25.56±1.92)%。然而,在处理组中,52 ℃、2 min处理组腐烂率最低。
2.2 热处理对‘塔罗科’血橙保鲜过程中热损伤发生率的影响
每种果蔬都存在一个热处理安全阈值,当热处理温度和时间超过其安全阈值时,不仅会减弱热激积极效应,且果蔬已不能修复热处理对其的破坏,从而出现热损伤现象。如表1所示,在本实验中,当温度超过56℃时血橙表皮就会出现热损伤,其中,56 ℃、1 min处理组表面出现轻微的热损伤症状,褐变失色凹陷区域面积较小,而56 ℃、2 min处理组热损伤面积相对较大。
2.3 热处理对‘塔罗科’血橙质量损失率的影响
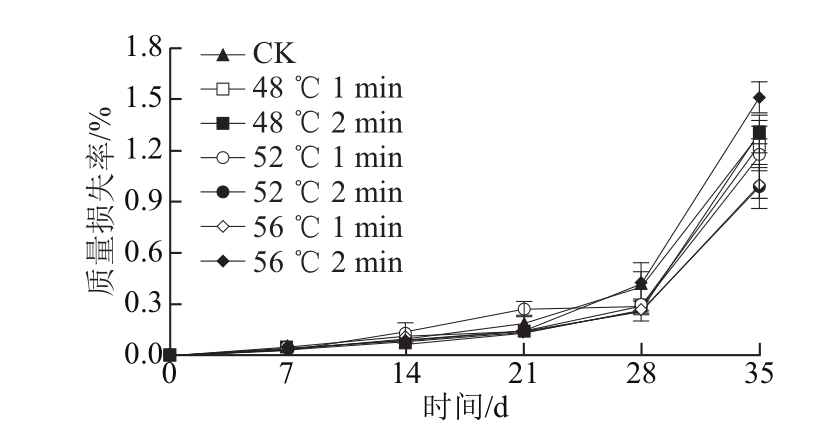
图1 热处理对‘塔罗科’血橙质量损失率的影响
Fig.1 Effect of hot water treatment on weight loss of ‘Tarocco’ orange

图2 热处理对‘塔罗科’血橙保鲜过程中CCI值和Hue值的影响
Fig.2 Effect of heat treatment on CCI and Hue of ‘Tarocco’ orange
如图2所示,在整个物流保鲜时期,各个处理组的CCI值基本呈现上升趋势。在贮藏期末期,CK组和56 ℃、2 min处理组CCI值处于较高水平,与48 ℃、1 min,48 ℃、2 min和52 ℃、2 min处理组差异极显著(P<0.01),在货架末期,52 ℃、2 min处理组的CCI值上升幅度最小,且与CK组差异显著(P<0.05)。然而,在整个物流保鲜过程,Hue值大致呈现下降趋势;其中,CK组和56 ℃、2 min处理组Hue值变化较快;此外,在货架末期,48 ℃、1 min,52 ℃、1 min和52 ℃、2 min处理组维持了较高的Hue值,且与56 ℃、2 min处理组之间差异极显著(P<0.01)。
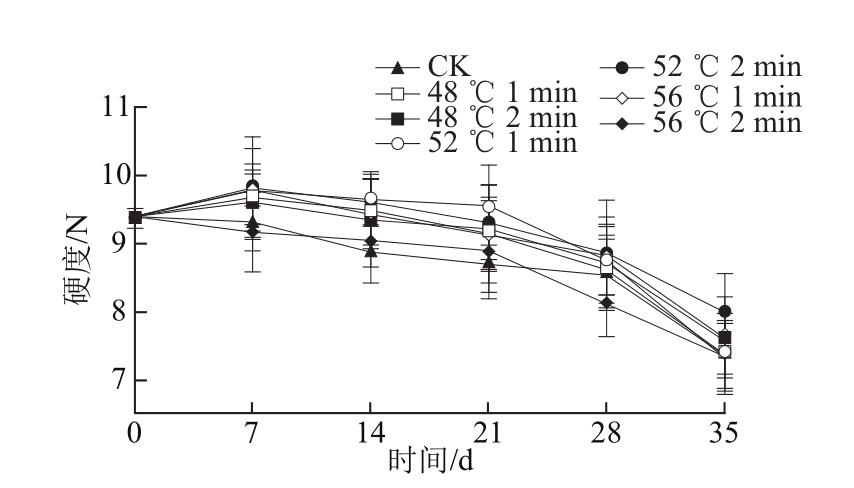
图3 热处理对‘塔罗科’血橙保鲜过程硬度的影响
Fig.3 Effect of heat treatment on firmness of ‘Tarocco’ orange
2.5 热处理对‘塔罗科’血橙硬度的影响由图3可见,在整个物流保鲜过程,各处理组硬度值呈下降趋势,而且物流过程中温度的变化加快了各个处理组硬度的下降幅度。然而在货架末期,52 ℃、2 min处理组维持了较好的硬度值,且与各个处理组之间差异显著(P<0.05),其中56 ℃、2 min处理组硬度值比较低。
2.6 热处理对‘塔罗科’血橙花色苷含量的影响
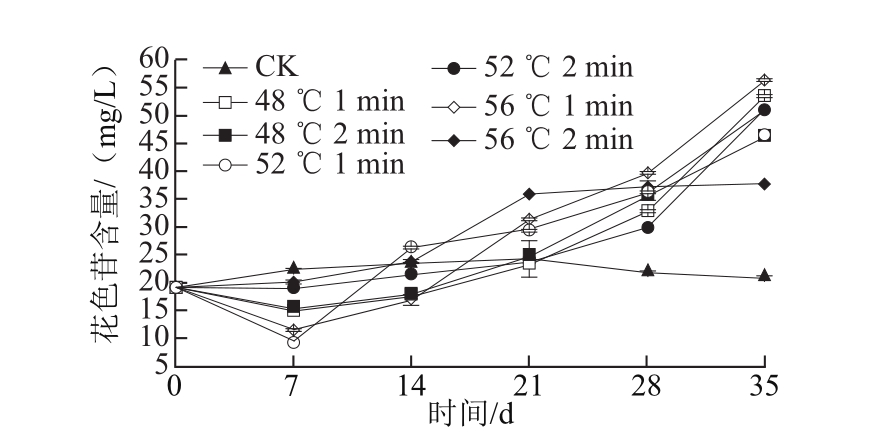
图4 热处理对‘塔罗科’血橙花色苷含量的影响
Fig.4 Effect of heat treatment on anthocyanin content of ‘Tarocco’ orange
花色苷含量是‘塔罗科’血橙的重要品质指标,如图4所示,在模拟运输期和货架期,CK组花色苷含量呈现下降趋势,而热处理组花色苷含量呈上升趋势,特别是48 ℃、1 min,52 ℃、2 min,56 ℃、1 min处理组具有较高的花色苷含量,且与CK组差异极显著(P<0.01)。
2.7 热处理对‘塔罗科’血橙TA含量和SSC的影响
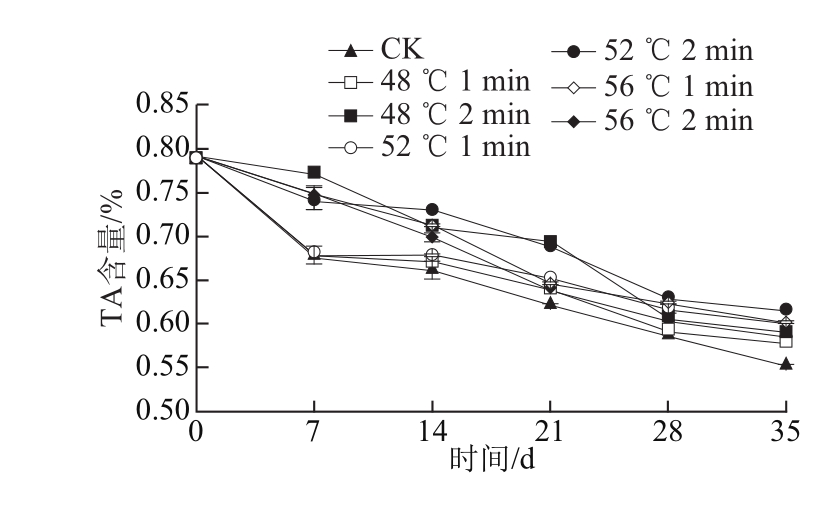

图5 热处理对‘塔罗科’血橙TA含量、SSC和SSC/TA值的影响
Fig.5 Effect of heat treatment on total acid content, soluble solids content (SSC) and SSC/TA ratio of ‘Tarocco’ orange
如图5所示,血橙保鲜过程中,在整个物流保鲜过程TA含量大致呈下降趋势,与CK组相比,热处理组下降相对较慢。其中,在模拟运输期和货架期,52 ℃、2 min处理组的TA含量高于其他处理组,且与CK组差异极显著(P<0.01)。在贮藏期14 d时,‘塔罗科’血橙的SSC达到最大值,CK组为11.8%,而热处理组SSC相对较小,在11.3%~11.6%之间。在货架末期,除了48 ℃、1 min处理组外,其他热处理组的SSC相对高于CK组,且差异性显著(P<0.05);在热处理组中,52 ℃、2 min与其他热处理组差异极显著(P<0.01),其中,56 ℃、2 min处理组SSC最高。
果蔬中SSC/TA值代表着果实的成熟度指数,‘塔罗科’保鲜期间SSC/TA值成上升趋势,且在货架末期,除了56 ℃、2 min处理组外,其他热处理组的成熟度指数普遍小于CK组,且差异性显著(P<0.05),其中,52 ℃、2 min处理组效果最佳,且与48 ℃、1 min,48 ℃、2 min,56 ℃、1 min和56 ℃、2 min处理组差异极显著(P<0.01),说明52 ℃、2 min的热处理条件可以很好的延缓血橙果实成熟衰老进程。
2.8 酶活性分析
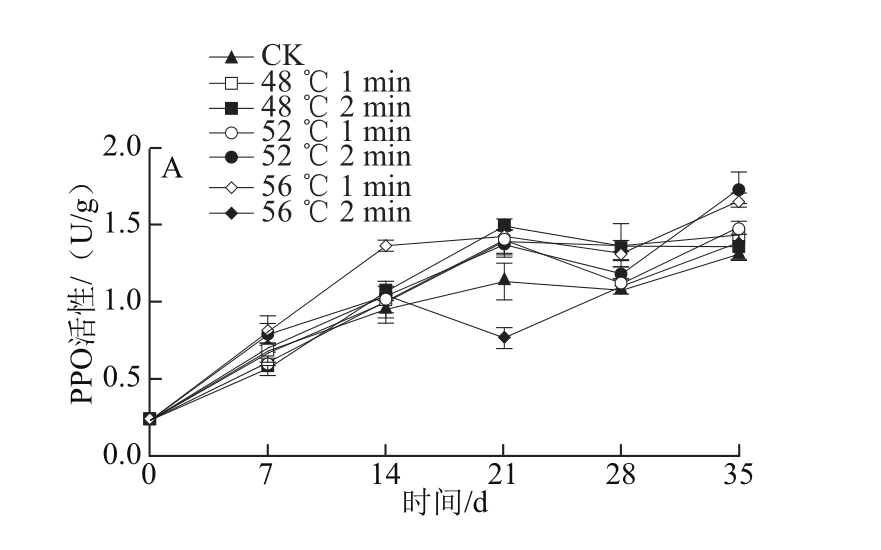
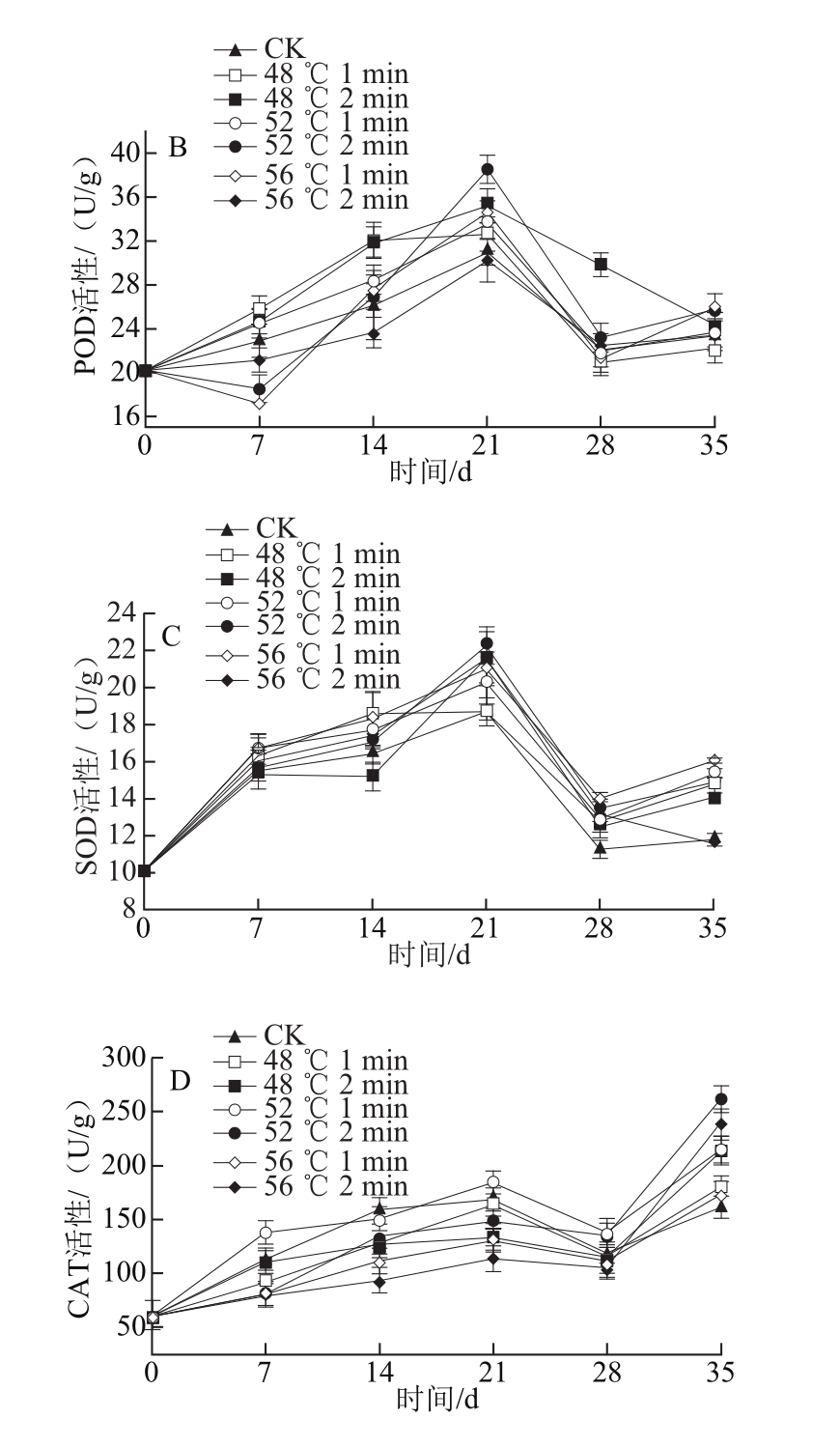
图6 热处理对‘塔罗科’血橙PPO(A)、POD(B)、SOD(C)、CAT(D)活性的影响
Fig.6 Effect of heat treatment on the activities of PPO, POD, SOD, and CAT of ‘Tarocco’ orange
如图6A所示,各组PPO酶活性都呈先上升后下降再上升的趋势。其中,在贮藏期14 d时,56 ℃、2 min处理组最先出现PPO高峰,提高了果蔬体内的PPO活性。而其他处理组在贮藏末期PPO活性达到最大值,且热处理组与CK组差异极显著(P<0.01),在模拟运输期,除56 ℃、2 min处理组外,其他处理组呈现下降趋势。在货架末期,52 ℃、2 min和56 ℃、1 min处理组与其他处理组差异极显著(P<0.01),并且维持了较高的PPO活性。
如图6B所示,在贮藏末期,各个处理组的POD活性达到最大值。热处理组和CK组之间差异显著(P<0.05),其中,52 ℃、2 min处理组活性较高,且与其他处理组差异极显著(P<0.01);而56 ℃、2 min处理组活性相对较低。在模拟运输期,各个处理组的POD活性呈下降趋势。在货架末期,除48 ℃、2 min处理组外,各个处理组POD活性均呈现上升趋势,其中52 ℃、2 min和56 ℃、1 min处理组上升幅度较高,且与各个处理组差异显著(P<0.05)。
如图6C所示,在贮藏末期,各个处理组SOD活性达到最大值,52 ℃、2 min处理组SOD活性最高,与CK组差异极显著(P<0.01),在模拟运输期,各个处理组的SOD活性下降,52 ℃、2 min处理组活性下降幅度最小,且与CK组差异极显著(P<0.01)。在货架期,各个处理组的SOD活性升高,可能是体内自由基大量产生,过量的超氧阴离子自由基诱导了SOD活性,其中52 ℃、1 min处理组活性升高幅度最大,且与CK组差异显著(P<0.05)。
如图6D所示,在整个贮藏期间,各个处理组CAT活性基本呈现上升趋势,且热处理组与CK组之间差异显著(P<0.05)。在模拟运输期,各个处理组CAT酶活性降低,其中52 ℃、2 min处理组CAT活性下降幅度最小,且与各个处理组之间差异极显著(P<0.01)。在货架末期,各个处理组CAT活性升高,且56 ℃、2 min处理组CAT活性上升幅度最大,考虑到其热损伤和腐烂现象,主要是因为细胞膜破损,过多的自由基引发了CAT的积累,是衰老的象征;同时56 ℃、2 min处理组也维持了较高的CAT活性。
本实验通过不同的热处理参数设置来研究‘塔罗科’在贮藏期、运输期和货架期3 个阶段保鲜效果。研究表明,物流过程中的温度变化对‘塔罗科’自身的酶体系和营养品质有着巨大的影响,促进了血橙的代谢衰老和腐烂的发生。然而热处理可以减缓物流过程温度变化所带来的不利影响,保持血橙的营养品质。在货架末期,热处理组腐烂率相对较低,这与热处理利用热效应直接杀死或抑制果蔬表面的病原菌有关[8],Zong Yuanyuan等[19]采用42 ℃、40 min热空气处理番茄,结果表明热效应能杀死番茄表面的灰霉菌,使其腐烂率从58.3%降低到33.3%。在热处理过程中,过高的温度或过长的处理时间产生较大的热应力,其对果蔬的破坏超出了果蔬的修复能力从而引起热损伤,Ghasernnezhad等[20]对无核小蜜橘进行保鲜研究发现,温度超过50 ℃就会给蜜橘表皮带来损伤;而在本实验中,当温度超过56 ℃时血橙表皮就会出现热损伤。热损伤降低了自身的防御能力和促进了病原菌的侵入,造成果蔬的高腐烂率(表1),这个结论与Maxin等[21]在苹果热处理方面的研究一致。同时,热损伤也提高了血橙自身的蒸腾作用[22],导致血橙质量损失率升高(图1)。热处理利用热效应来改变血橙果皮表面的蜡质层,使其重新分配,导致血橙表面气孔数的减少[23],降低了血橙果实水分的蒸发,从而减缓了血橙质量损失率的上升速率。
‘塔罗科’血橙保鲜过程中色差的变化主要是因为血橙表皮叶绿素的分解,类胡萝卜素的积累造成的,是果蔬逐渐成熟衰老的一个标志[24]。在整个物流保鲜时期,各个处理组的CCI值基本呈现上升趋势,这与Chen Ming等[14]发现椪柑在贮藏过程中CCI值升高结论一致;Hue值下降缓慢,可能与适宜热处理提高了抗氧化酶的活性,清除果蔬体内的活性氧自由基,延缓了其成熟衰老有关。Vicente等[25]发现热处理可以改变草莓细胞壁分解酶活性,保持较高的硬度。在本实验货架末期,52 ℃、2 min处理组维持了较好的硬度值,且与各个处理组之间差异显著(P<0.05),可能与热处理抑制了细胞壁分解酶活性,减少了纤维素和半纤维素的分解有关。但56 ℃、2 min处理组硬度比较低,可能与热处理造成的热损伤有关,热损伤提高了血橙的蒸腾作用,导致血橙失水加强,失水引起的细胞膨压下降促进了血橙的软化。
在贮藏期间,各处理组花色苷含量总体呈现上升趋势,这可能是因为在2 ℃的低温条件下贮藏使血橙中苯丙氨酸解氨酶、查耳酮合酶、二氢黄酮醇还原酶和5-糖苷转移酶的基因表达加速,提高了血橙中酶的含量及其活性,促进花色苷的生物合成[26-27]。血橙体内TA含量、SSC是重要的营养指标,常作为果蔬呼吸过程中的底物被消耗而导致其含量下降[28],从而影响血橙风味的变化。热处理组中TA含量、SSC变化缓慢,与热处理调节果蔬的生理代谢有关。陈楚英等[29]在蜜橘贮藏中研究发现,适宜的热处理可以延缓蜜橘呼吸代谢速率,降低TA含量的下降速率。而在货架末期,56 ℃、2 min处理组SSC最高,可能与热损伤导致质量损失率升高有关[30]。
PPO是苯丙烷代谢路径中的终端酶,有利于木质素和酚类物质的合成,同时也能催化醌类化合物形成,为果蔬提供一道保护性屏蔽[31]。POD也是苯丙烷代谢路径中的终端酶,参与了细胞膜的构建,促进了木栓化和木质化的形成,同时可以清除植物体内的过氧化氢(H2O2),降低果实体内活性自由基的积累,是一种防御膜脂过氧化和提高抗病性的重要保护酶。此外,SOD、CAT是果蔬体内抗氧化体系中重要的防御酶之一,能够清除果蔬体内的超氧阴离子自由基和H2O2,减轻自由基对膜的损伤,延缓果蔬衰老。在热处理中,特别是52 ℃、2 min,可以明显提高POD、SOD、CAT和PPO的活性,使其维持在较高的水平,保持了物流过程中果蔬体内的活性氧簇代谢平衡和增强了果蔬的自身抗病性,延缓了其成熟衰老。
适宜的热处理能明显减缓物流过程温度变化引起的不利影响,提高血橙果皮中PPO、POD、SOD、CAT的活性,使其维持在较高水平;同时,也能够保持很好的色泽(柑橘色泽指数、色相)、硬度和营养品质(花色苷含量、TA含量、SSC)。然而热处理温度超过56 ℃给血橙带来了不可逆的热损伤,物流过程中的温度变化诱使了其腐烂。热处理是一种操作简单、无化学残留、具有明显保鲜效果的物理保鲜方式,但在物流过程中果蔬保鲜最佳参数和机理变化还需进一步的深入研究,同时,热处理作为一种前处理,与其他物理保鲜方式,如微孔膜、低压气调等方式复合也是未来发展的主要方向。此外,热处理对果蔬表面蜡质层的影响,对其维护果蔬的营养品质和抗菌方面具有较高的研究价值。
参考文献:
[1] 袁久坤, 周英. 万州塔罗科血橙果实花色苷的影响因素分析[J]. 中国园艺文摘, 2014(7): 4-5; 165. DOI:10.3969/ j.issn.1672-0873.2014.07.002.
[2] 何建, 陈克玲, 刘建军, 等. 几种保鲜处理对塔罗科血橙贮藏效果的影响[J]. 中国南方果树, 2013(3): 37-39.
[3] SMILANICK J L, MANSOUR M F, MARGOSAN D A, et al. Influence of pH and NaHCO3on effectiveness of imazalil to inhibit germination of Penicillium digitatum and to control postharvest green mold on citrus fruit[J]. Plant Disease, 2005, 89(6): 640-648. DOI:10.1094/PD-89-0640.
[4] 王日葵, 邵蒲芬, 周炼, 等. 涂蜡对柑橘生理变化及商品性的影响[J]. 保鲜与加工, 2005(2): 21-22. DOI:10.3969/ j.issn.1009-6221.2005.02.010.
[5] 吴方方. 打蜡对温州蜜柑(Citrus unshiu Marc)果实异味物质积累的影响[D]. 武汉: 华中农业大学, 2010. DOI:10.7666/d.y1799788.
[6] SCHIRRA M, MULAS M, FADDA A, et al. Cold quarantine responses of blood oranges to postharvest hot water and hot air treatments[J]. Postharvest Biology and Technology, 2004, 31(2): 191-200. DOI:10.1016/j.postharvbio.2003.09.002.
[7] BASSAL M, EL-HAMAHMY M. Hot water dip and preconditioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J]. Postharvest Biology and Technology, 2011, 60(3): 186-191. DOI:10.1016/ j.postharvbio.2011.01.010.
[8] FALLIK E. Prestorage hot water treatments (immersion, rinsing and brushing)[J]. Postharvest Biology and Technology, 2004, 32(2): 125-134. DOI:10.1016/j.postharvbio.2003.10.005.
[9] SHAO Xingfeng, TU Kang. Air treatment improved the chilling resistance of loquat fruit under cold storage[J]. Journal of Food Processing and Preservation, 2014, 38(2): 694-703. DOI:10.1111/ jfpp.12019.
[10] ALVINDIA D G. Revisiting hot water treatments in controlling crown rot of banana cv. Bungulan[J]. Crop Protection, 2012, 33: 59-64. DOI:10.1111/jfpp.12019.
[11] SPADONI A, GUIDARELLI M, SANZANI S M, et al. Influence of hot water treatment on brown rot of peach and rapid fruit response to heat stress[J]. Postharvest Biology and Technology, 2014, 94: 66-73. DOI:10.1016/j.postharvbio.2014.03.006.
[12] VICENTE A R, MARTINEZ G A, CIVELLO P M, et al. Quality of heat-treated strawberry fruit during refrigerated storage[J]. Postharvest Biology and Technology, 2002, 25(1): 59-71. DOI:10.1016/S0925-5214(01)00142-9.
[13] ZHANG Na, YANG Zhao, CHEN Aiqing, et al. Effects of intermittent heat treatment on sensory quality and antioxidant enzymes of cucumber[J]. Scientia Horticulturae, 2014, 170: 39-44. DOI:10.1016/ j.scienta.2014.02.032.
[14] CHEN Ming, JIANG Qian, YIN Xenren, et al. Effect of hot air treatment on organic acid- and sugar-metabolism in Ponkan (Citrus reticulata) fruit[J]. Scientia Horticulturae, 2012, 147: 118-125. DOI:10.1016/j.scienta.2012.09.011.
[15] HONDA C, BESSHO H, MURAI M, et al. Effect of temperature on anthocyanin synthesis and ethylene production in the fruit of earlyand medium-maturing apple cultivars during ripening stages[J]. Hortscience, 2014, 49(12): 1510-1517.
[16] ZHOU Yanhan, DENG Lili, ZENG Kaifang. Enhancement of biocontrol efficacy of Pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J]. Crop Protection, 2014, 63: 89-96. DOI:10.1016/j.cropro.2014.05.015.
[17] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases[J]. Methods in Enzymology, 1955, 2: 764-775. DOI:10.1016/S0076-6879(55)02300-8.
[18] ZHANG Xinhua, SHEN Lin, LI Fujun, et al. Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J]. Postharvest Biology and Technology, 2013, 79: 1-8. DOI:10.1016/ j.postharvbio.2012.12.019.
[19] ZONG Yuanyuan, LIU Jia, LI Boqiang, et al. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit[J]. Biological Control, 2010, 54(3): 316-321. DOI:10.1016/j.biocontrol.2010.06.003.
[20] GHASERNNEZHAD M, MARSH K, SHILTON R, et al. Effect of hot water treatments on chilling injury and heat damage in ‘satsuma’ mandarins: antioxidant enzymes and vacuolar ATPase, and pyrophosphatase[J]. Postharvest Biology and Technology, 2008, 48(3): 364-371. DOI:10.1016/j.postharvbio.2012.12.019.
[21] MAXIN P, WEBER R W S, PEDERSEN H L, et al. Control of a wide range of storage rots in naturally infected apples by hot-water dipping and rinsing[J]. Postharvest Biology and Technology, 2012, 70: 25-31. DOI:10.1016/j.postharvbio.2012.04.001.
[22] LYDAKIS D, AKED J. Vapour heat treatment of Sultanina table grapes. Ⅱ: Effects on postharvest quality[J]. Postharvest Biology and Technology, 2003, 27(2): 117-126. DOI:10.1016/S0925-5214(02)00092-3.
[23] SHEN Yan, ZHONG Liezhou, SUN Yujing, et al. Influence of hot water dip on fruit quality, phenolic compounds and antioxidant capacity of Satsuma mandarin during storage[J]. Food Science and Technology International, 2013, 19(6): 511-522. DOI:10.1177/1082013212457669.
[24] ZHOU Jingyi, SUN Congde, ZHANG Lanlan, et al. Preferential accumulation of orange-colored carotenoids in Ponkan (Citrus reticulata) fruit peel following postharvest application of ethylene or ethephon[J]. Scientia Horticulturae, 2010, 126(2): 229-235. DOI:10.1016/j.scienta.2010.07.019.
[25] VICENTE A R, COSTA M L, MARTINEZ G A, et al. Effect of heat treatments on cell wall degradation and softening in strawberry fruit[J]. Postharvest Biology and Technology, 2005, 38(3): 213-222. DOI:10.1016/j.postharvbio.2008.01.013.
[26] lo PIERO A R, PUGLISI I, RAPISARDA P, et al. Anthocyanins accumulation and related gene expression in red orange fruit induced by low temperature storage[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9083-9088. DOI:10.1021/jf051609s.
[27] RAPISARDA P, lo BIANCO M, PANNUZZO P, et al. Effect of cold storage on vitamin C, phenolics and antioxidant activity of five orange genotypes Citrus sinensis (L.) Osbeck[J]. Postharvest Biology and Technology, 2008, 49(3): 348-354. DOI:10.1016/ j.postharvbio.2008.02.002.
[28] BAL E. Effects of essential oil treatments combined with hot water treatment on improving postharvest life of sweet cherry[J]. Fruits, 2012, 67(4): 285-291. DOI:10.1051/fruits/2012022.
[29] 陈楚英, 陈明, 郭娟华, 等. 两个采收期的新余蜜桔贮藏特性及品质研究[J]. 中国南方果树, 2013(1): 43-48. DOI:10.1051/fruits/2012022.
[30] RODOV V, AGAR T, PERETZ J, et al. Effect of combined application of heat treatments and plastic packaging on keeping quality of ‘Oroblanco’ fruit (Citrus grandis L.×C. paradisi Macf.)[J]. Postharvest Biology and Technology, 2000, 20(3): 287-294. DOI:10.1016/S0925-5214(00)00129-0.
[31] MOHAMMADI M, KAZEMI H. Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated with Fusarium graminearum and induced resistance[J]. Plant Science, 2002, 162(4): 491-498. DOI:10.1016/S0168-9452(01)00538-6.
CHENG Yujiao, LI Yunyun, ZHANG Min*
(Laboratory of Quality & Safety Risk Assessment for Argo-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing Special Food Programme and Technology Research Center, College of Food Science, Southwest University, Chongqing 400715, China)
Abstract: In this study, the effect of hot water treatments under varying conditions temperature and time (at 48, 52 and 56 ℃ for 1 and 2 min, respectively) in maintaining the quality of ‘Tarocco’ orange was evaluated during subsequent cold storage (at 3 ℃ and relative humidity (RH) of 90%? 95% for 21 days), simulated transportation (at 10 ℃ and 60%? 70% RH for 7 days), and shelf life (at 20 ℃ and 60%? 70% RH for 7 days). The results showed that some appropriate hot treatments could significantly mitigate the negative influences of temperature shifts in logistics and enhance the activities of antioxidant enzymes in fruit peel, such as polyphenol oxidase (PPO), peroxidase (POD), superoxide dismutase (SOD), and cactalase (CAT), which remained at high levels. At the same time, hot water treatment (HWT) also had positive effects on color (including citrus color index and Hue), firmness and quality attributes (anthocyanins content, total acid and soluble solids content). Nevertheless, treatment at temperatures higher than 56 ℃ caused irreversible thermal damage to orange and temperature shifts in logistics accelerated fruit decay. Collectively, our results showed that the preservative effect of treatment with hot water for 2 min at 52 ℃ was the best.
Key words: hot water treatment; ‘Tarocco’ orange; antioxidant enzymes; logistics
中图分类号:TS205.9
文献标志码:A
文章编号:1002-6630(2016)06-0254-07引文 格式:
DOI:10.7506/spkx1002-6630-201606046
*通信作者:张敏(1975—),男,副教授,硕士,研究方向为食品包装保鲜材料及技术。E-mail:zmqx123@163.com
作者简介:程玉娇(1990—),女,硕士研究生,研究方向为食品保鲜技术。E-mail:haixyzi@sina.com
基金项目:重庆市科技攻关应用技术研发类重点项目(cstc2012gg-yyjsB80003);中央高校基本科研业务费专项(XDJK2013C130)
收稿日期:2015-06-15