龙葵果花色苷的分离与鉴定
腾 飞,郑 悦,王 萍
*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
摘 要:采用硅胶柱层析技术分离制备龙葵果花色苷。分离得到的2 个花色苷馏分经紫外-可见光谱、高效液相色谱-电喷雾串联质谱(high performance liquid chromatography electrosprary ionization-mass spectrometry,HPLC-DADESI-MS/MS)进行结构鉴定,并结合酸水解分析糖苷种类。最终确定馏分Ⅰ为飞燕草素-3-琥珀酰阿拉伯糖苷,根据峰面积归一化法计算其纯度为94%;馏分Ⅱ为矢车菊素-3-半乳糖苷和矢车菊素-3-乙酰半乳糖苷,峰面积归一化法计算其纯度分别为45.67%和13.97%。
关键词:龙葵;花色苷;分离;鉴定;高效液相色谱-电喷雾质谱联用;酸水解
龙葵(Solanum nigrum L.)为一年生草本植物,属于茄科(Solanaceae)茄属(Solanum),又名黑星星、黑呦呦、黑天天、野葡萄等。龙葵全草高30~120 cm,白色聚伞花序,球形浆果,其果实未成熟时为绿色,成熟后为黑紫色
[1]。龙葵全草含矿物质、氨基酸、维生素等营养成分,还含有苷类甾体生物碱、多糖、酯、酚类化合物和皂苷等活性成分
[2]。龙葵在全国范围内均有分布,且已有成熟的栽培技术。成熟的龙葵果含有丰富的红色素,是一种极具开发价值的资源
[3]。龙葵全草均可入药,研究发现龙葵具有抗肿瘤,抗菌和抗病毒,抗炎与抗休克等功能,同时还对神经系统和泌尿系统有药理作用
[4]。
目前对龙葵的研究大多集中在对龙葵生物碱和多糖的研究
[5],而对龙葵色素的研究起步较晚。目前已开展了对该色素提取及稳定性方面的研究,张贺等
[6]通过正交试验确定龙葵果红色素提取最优工艺,建立了以提取温度、提取时间为影响因素的提取龙葵果红色素影响因素统计模型。范翠丽等
[7]研究了常温提取、水浴锅热提取、微波辅助提取和超声波辅助提取对龙葵果色素的影响,并对龙葵果红色素的浸提条件及浸提方法进行了系统研究,筛选出龙葵果红色素的最佳提取方法及工艺条件。木合塔尔·吐尔等
[8]研究了戈壁野生龙葵果紫红色素的提取条件和理化性质,得出该色素在酸性条件下具有较好的稳定性,并且对光、热和常用食品添加剂都比较稳定。然而对于龙葵花色苷的成分及结构还未见报道,本实验利用柱层析将龙葵果花色苷分离,并采用高效液相色谱-电喷雾串联质谱联用仪(high performance liquid chromatography electrosprary ionization-mass spectrometry,HPLC-DAD-ESI-MS/MS)对分离得到的龙葵果花色苷分子质量和分子结构进行鉴定,为开发和综合利用龙葵资源提供理论依据。
1 材料与方法
1.1 材料与试剂
龙葵果于2014年9月采于东北农业大学校园内,采摘的新鲜龙葵果于-18 ℃冷冻保藏。
甲醇(色谱纯) 美国Fisher公司;纯净水 娃哈哈集团;D-葡萄糖、D-半乳糖、D-果糖、L-鼠李糖、D-甘露糖、D-木糖、L-阿拉伯糖(色谱纯) 上海源叶生物技术有限公司;柱层析硅胶(200~300 目) 青岛海洋化工厂;X-5大孔树脂 南开大学化工厂;其他试剂均为国产分析纯。
1.2 仪器与设备
Agilent1100型高效液相色谱-电喷雾质谱联用仪、Agilent1260型高效液相色谱仪(配有示差折光检测器)、Agilent Plus C
18色谱柱(150 mmh3.0 mm,1.8 μm) 美国安捷伦公司;氨基柱(250 mmh 4.6 mm,5.0 μm) 美国Waters公司;薄层层析板(5 cmh20 cm) 青岛海洋化工厂;玻璃层析柱(1.0 cmh40 cm)、HL-2型恒流泵 上海精科试业有限公司。
1.3 方法
1.3.1 样品的制备
参考文献:[5,9],准确称取龙葵鲜果,按1∶25的料液比(m/V)用pH1.0,体积分数为60%的乙醇室温浸提3 次,每次2 h。合并滤液,真空旋转浓缩除去乙醇,过X-5大孔吸附树脂,用蒸馏水洗脱以除去糖、氨基酸等物质,用手持糖量计检测无可溶性固形物后再用pH 2.0,体积分数为60%的乙醇洗脱,收集洗脱液,减压浓缩后得龙葵果花色苷精制物,冷藏备用。
1.3.2 展开剂的筛选
分别在11 种展开系统中进行薄层层析实验,选择适合分离龙葵果花色苷的展开剂系统,展开剂系统的组成见表1。
表1 不同展开剂的组成
Table 1 Composition of different developers

展开剂名称 展开剂馏分体积比BAW
1V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶1 BAW
2V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶2 BAW
3V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶3 BAW
4V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶4(上层)BAW
5V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶5(上层)BAH V(正丁醇)∶V(冰乙酸)∶V(盐酸)=1∶4∶5 BH V(正丁醇)∶V(盐酸(2 mol/L))=1∶1 EAW V(乙酸乙酯)∶V(冰乙酸)∶V(水)=3∶1∶1 MWA V(甲醇)∶V(水)∶V(冰乙酸)=11∶5∶1 BE V(正丁醇)∶V(乙酸乙酯)=3∶1 MH V(甲醇)∶V(HCl)=4∶1
1.3.3 硅胶柱层析分离龙葵果花色苷
称取25.0 g硅胶湿法装柱,湿法上样后用薄层层析选择的最佳展开剂进行洗脱,分别收集不同颜色的洗脱液,利用薄层层析检验相同馏分并合并,40 ℃条件下减压旋转蒸发将溶剂旋出
[10]。
1.3.4 高效液相色谱条件
将分离得到的馏分真空浓缩后用体积分数为0.1%冰乙酸甲醇溶液溶解后,过0.45 μm滤膜。参照Simirgiosts等
[11]的方法并做适当修改,得到色谱条件为:Agilent Eclipse Plus C
18色谱柱(150 mmh3.0 mm,1.8 μm);流动相A:0.1%冰乙酸溶液,流动相B:甲醇;洗脱流速为0.4 mL/min,柱温30 ℃,进样量5 μL。线性梯度洗脱条件:0~3 min,10%~50% B;3~5 min,50%~85% B;5~8 min,85%~10% B;9~12 min,10% B等度洗脱。
1.3.5 质谱条件
参照Lee等
[12]的方法并做适当修改,采用HPLCDAD-ESI-MS/MS技术电喷雾电离离子源(electrospray ionization,ESI),雾化气压35 psi;干燥气体氮气流速10.0 L/min;干燥气体温度300 ℃;毛细管电压4 000 V;碎裂电压110 V;碰撞能量5~45 V;采用正离子模式,在m/z 100~1 000范围内扫描。
1.3.6 花色苷的糖苷类型分析
将分离得到的花色苷馏分溶解于2 mol/L的HCl中,100 ℃回流提取2 h,得到棕色溶液后,用异戊醇萃取直至水层无色
[13]。异戊醇层为花色苷苷元,水层则为水解得到的糖苷。将水解得到的糖苷浓缩后用乙腈溶解并过0.45 μm滤膜。用配有示差折光检测器的Agilent1260型高效液相色谱仪分析。色谱条件为:Waters氨基柱(250 mmh4.6 mm,5.0 μm),柱温35 ℃,流动相为乙腈-水(75∶25,V/V),流速1.0 mL/min,进样量20 μL。用质量浓度均为10.0 mg/mL的D-葡萄糖、D-半乳糖、D-果糖、L-鼠李糖、D-甘露糖、D-木糖和L-阿拉伯糖溶液做标准品
[14]。
1.3.7 糖苷键位置的测定
取适量分离得到的花色苷馏分,以相应展开剂做空白,用紫外分光光度仪于200~700 nm进行光谱扫描,测其最大吸收峰和在440 nm波长处的吸光度,计算

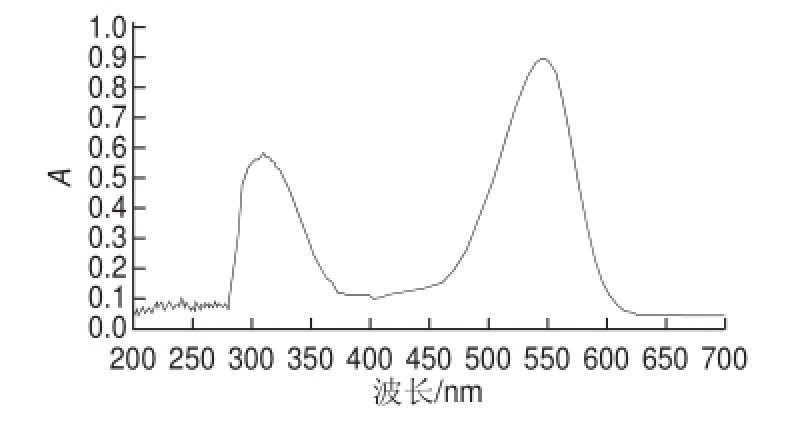
图1 馏分Ⅰ紫外吸收光谱图Fig.1 UV spectrum of fraction Ⅰ
2 结果与分析
2.1 展开剂的筛选结果与分析
实验选择常见花色苷的展开体系对龙葵果花色苷进行分离,结果如表2所示。
表2 不同展开剂的展开效果
Table 2 Efficiency of different developers

展开剂 展开效果BAW
1出现1 个红斑点,1 个蓝斑点,1 个黄色斑点拖尾严重BAW
2出现1 个红斑点,1 个蓝斑点,1 个黄色斑点拖尾严重BAW
3出现1 个红斑点,1 个蓝斑点,1 个黄色斑点清晰无拖尾BAW
4出现1 个红斑点,1 个蓝斑点,1 个黄色斑点拖尾严重BAW
5出现1 个红斑点,1 个蓝斑点,1 个黄色斑点拖尾严重BAH 未分开BH 未分开EAW 未分开MWA 未分开BE 未分开MH 未分开
由表2可知,BAW
3(V(正丁醇)∶V(冰乙酸)∶V(水)=4∶1∶3)为最优展开剂。用薄层色谱法分离龙葵果花色苷时,用BAW
3展开出现3 条色带,各色带在色谱上的比移值(Rf)见表3。
表3 龙葵果花色苷薄层色谱分离的Rf值
Table 3Rf values of Solanum nigrum L. anthocyanins
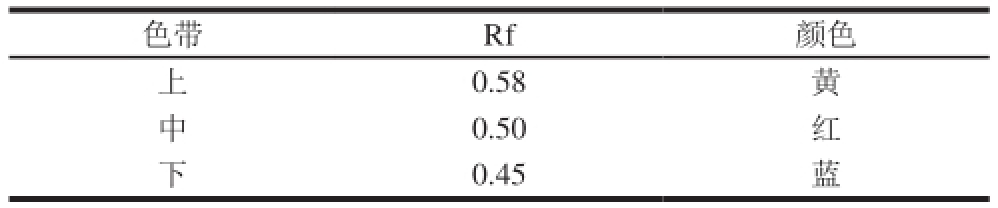
色带 Rf 颜色上0.58 黄中0.50 红下0.45 蓝
由表3可知,中间色带和下色带为主要花色苷,上色带颜色很浅表现为黄色,经检验为非花色苷物质,因此不做进一步研究。
2.2 最大吸收波长的确定
将硅胶柱层析分段洗脱得到的馏分薄层层析点样,合并相同馏分后得到馏分Ⅰ和馏分Ⅱ。对馏分Ⅰ和馏分Ⅱ做紫外全波长扫描。由图1、2可知,馏分Ⅰ的最大吸收波长在547 nm和321 nm处,馏分Ⅱ的最大吸收波长在525 nm和315 nm处。两个花色苷馏分均在300~330 nm处有吸收峰,说明花色苷分子内有酰基
[15]。
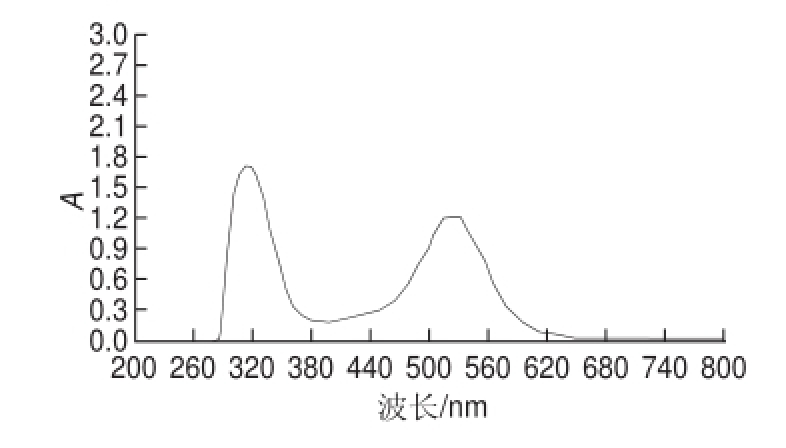
图2 馏分Ⅱ紫外吸收光谱图
Fig.2 UV spectrum of fraction Ⅱ
2.3 HPLC-DAD-ESI-MS/MS检测结果与分析
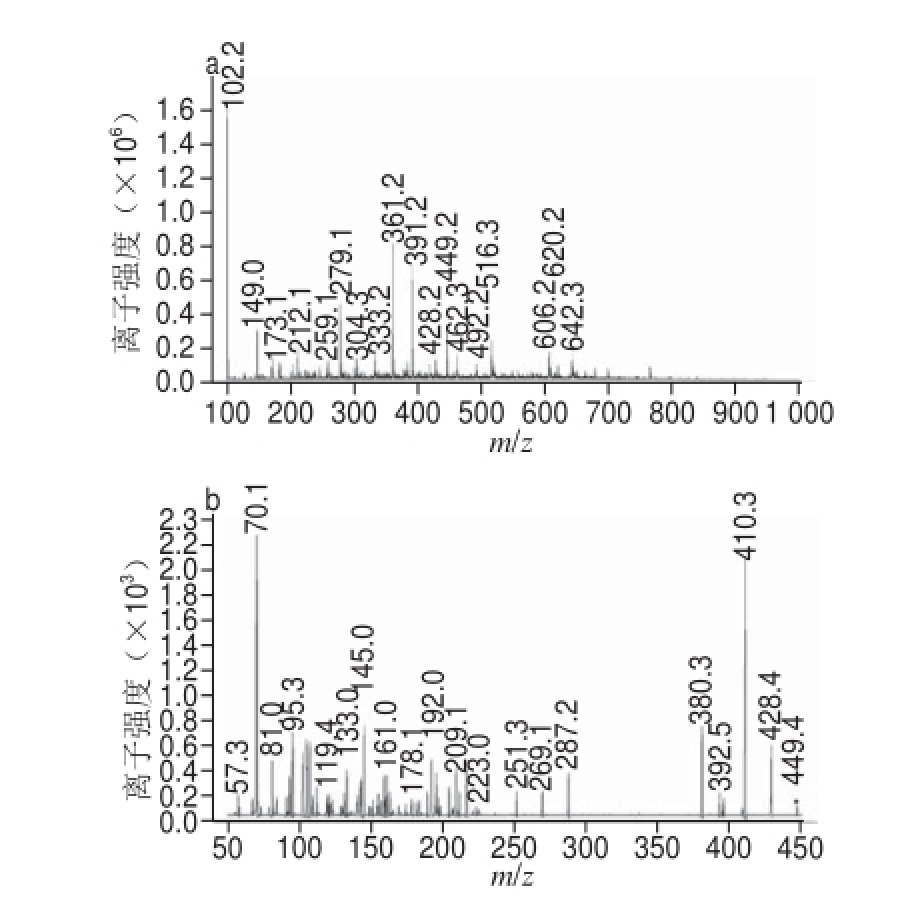
馏分Ⅰ经过HPLC-DAD-ESI-MS/MS分析得到总离子流图和质谱图。由图3可知,馏分Ⅰ共有3 个峰,峰1和峰2经质谱分析为非花色苷类物质,峰3为花色苷类物质。
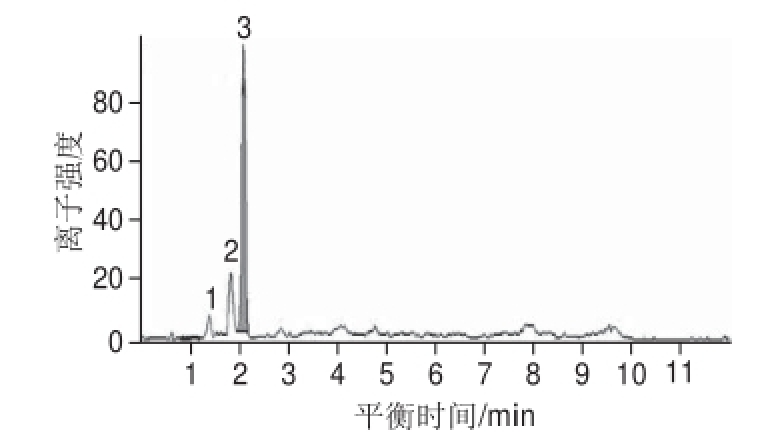
图3 馏分Ⅰ的总离子流图
Fig.3 Total ion chromatogram of fraction Ⅰ
由图3可知,馏分Ⅰ只有一个主要峰(峰3),出峰时间为2.09 min,峰面积为3 607,峰面积归一化法计算得出峰3占馏分Ⅰ含量为94%。由图4a可知,该物质的分子离子峰[M+H]
+的质荷比(m/z)为537,由图4b可知其中一个碎片离子的m/z为436,二者相差一个质荷比为100的基团,根据da Silva等
[16]研究该基团为琥珀酸。此外图1显示馏分Ⅰ在321 nm处有一个尖峰,Escribano-Bailón等
[15]研究认为若花色苷分子有酰化基团,则在300~330 nm处会存在一个尖峰。另一个碎片离子[M+H]
+的m/z为304对应6种花色素中的飞燕草素,与碎片离子m/z 436相比又丢失了一个m/z为132的基团,即为戊糖苷,由此推断该物质为飞燕草素的衍生物,可能是飞燕草素-3-琥珀酰戊糖苷
[16]。

图4 馏分Ⅰ的质谱图
Fig.4 Molecular ion and fragment ion mass spectra of fraction I
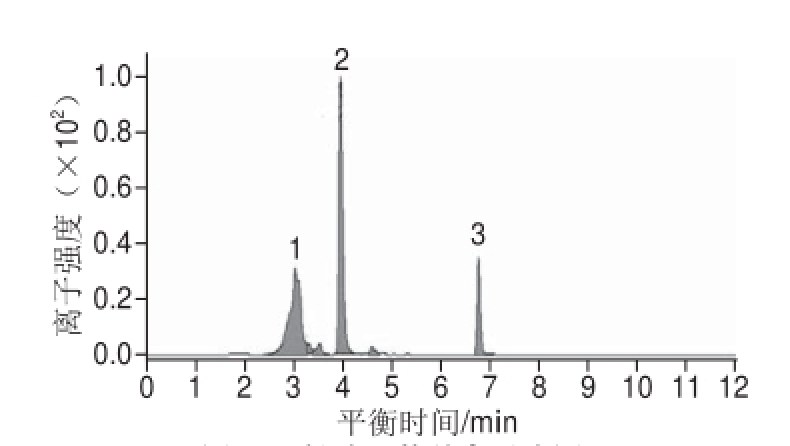
图5 馏分Ⅱ的总离子流图
Fig.5 Total ion chromatogram of fraction Ⅱ
馏分Ⅱ经HPLC-DAD-ESI-MS/MS分析得到总离子流图和质谱图。由图5可知,该馏分有3 种物质,分别为峰1、峰2、峰3,出峰时间分别为3.05、3.97、6.78 min。其中峰1经紫外全波长扫描和二级质谱分析后显示为非花色苷类物质,因此不做进一步的研究。
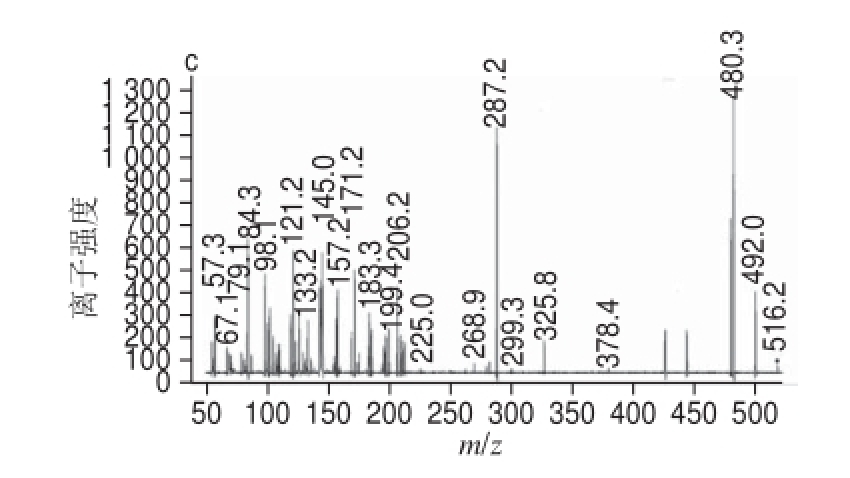
图6 馏分Ⅱ的质谱图
Fig.6 Molecular ion and fragment ion mass spectra of fraction Ⅱ
a.峰2分子离子质谱图;b. 峰2碎片离子质谱图;c. 峰3碎片离子质谱图。
由图5可知,峰2的出峰时间为3.97 min,峰面积归一化法计算得出相对馏分Ⅱ含量为45.67%,由图6a可知,该物质分子离子峰[M]
+的m/z为449,图6b显示其碎片离子峰[M]
+的m/z为287,二者相差162,为己糖脱去一分子水所得,这是典型的矢车菊素-3-己糖苷的质谱信息
[17-18]。峰3的出峰时间为6.78 min,峰面积归一化法计算得出相对馏分Ⅱ含量为13.97%,由图6c可知,此物质分子离子峰[M]
+的m/z为492,碎片离子的m/z为287,表明该物质为矢车菊素的衍生物,二者m/z相差205为乙酰己糖脱去一分子水所得,因此推断该物质为矢车菊素-3-乙酰己糖苷
[18],在315 nm波长处检测的尖峰也证实了酰基的存在
[19]。
2.4 花色苷糖苷类型的分析

图7 馏分Ⅰ糖苷(a)与阿拉伯糖(b)的色谱图
Fig.7 HPLC-RID chromatogram of fraction Ⅰ (a) and arabinose (b)
市售的花色苷标准品种类不全,此外花色苷的不稳定性,导致购买标准品分析花色苷的组成可行性不大。因此,经常采用将其酸水解后,分别分析花色苷的苷元和糖苷的方法。由图7、8可知,馏分Ⅰ中糖苷出峰时间为5.041 min,馏分Ⅱ中糖苷出峰时间为5.821 min。标准品的出峰时间分别为D-葡萄糖5.643 min、D-半乳糖为5.858 min、果糖5.288 min、L-鼠李糖4.442 min、D-甘露糖5.416 min、D-木糖4.806 min、L-阿拉伯糖5.089 min。由此推测馏分Ⅰ携带的糖苷为L-阿拉伯糖,馏分Ⅱ所携带糖苷为D-半乳糖。
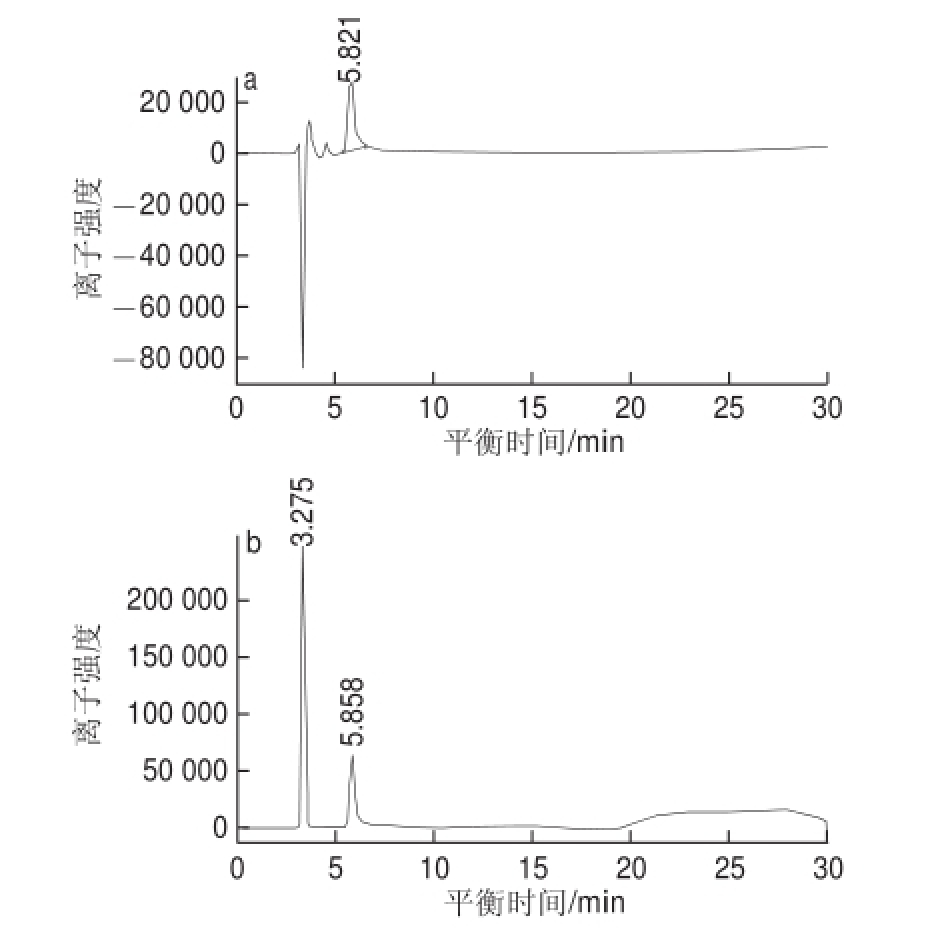
图8 馏分Ⅱ糖苷(a)与半乳糖(b)的色谱图
Fig.8 HPLC-RID chromatogram of fraction Ⅱ (a) and galactose (b)
2.5 花色苷糖苷键位置的确定
馏分Ⅰ和馏分Ⅱ的A
440
nm/A
max分别为18.5%和25%,证明糖苷键的位置在C3位
[20]。该糖基可与有机酸发生酰化反应,常见的芳香酸有p-香豆酸、咖啡酸、阿魏酸、芥子酸、没食子酸或p-羟基苯甲酸;脂肪酸有丙二酸、醋酸、苹果酸、琥珀酸或草酸等。这些酸通常与C环3位上糖基的6位羟基或者少数也与4位羟基发生酰化
[21]。因此,推断馏分Ⅰ为飞燕草素-3-琥珀酰阿拉伯糖苷,馏分Ⅱ包含2 种花色苷,分别为矢车菊素-3-半乳糖苷和矢车菊素-3-乙酰半乳糖苷。
3 结 论
花色苷作为替代化学合成的食品着色剂已经受到了社会各界的高度关注,然而,花色苷在食品加工、运输和贮藏过程中所表现出的极不稳定性限制了其在食品工业中的应用。研究显示酰化的花色苷在pH值变化、温度升高和光照存在时表现出了比非酰化的花色苷更好的稳定性
[21]。因此,酰化的花色苷有着更加广泛的应用
[22]。酰化的花色苷广泛存在于水萝卜、红薯、紫甘薯、红甘蓝和黑胡萝卜中。Correa-Betanzo等
[23]分析了野生蓝莓中的12 种花色苷,结果仅有2 种为酰化的花色苷。Wu Xiangyang等
[24]在桑葚中分离得到4 种花色苷,仅有1 种为酰化的花色苷。在草莓和红树莓中则不存在酰化的花色苷
[25-26]。而本实验则找到了一种富含酰化花色苷的来源广泛价格低廉的植物原料。
经硅胶柱层析分离得到2 个花色苷馏分,通过HPLCDAD-ESI-MS/MS分析,馏分Ⅰ为单体花色苷,峰面积归一化法计算得出纯度为94%,推断为飞燕草素-3-琥珀酰阿拉伯糖苷;馏分Ⅱ包含2 种花色苷分别为矢车菊素-3-半乳糖苷和矢车菊素-3-乙酰半乳糖苷,峰面积归一化法计算二者总含量占馏分Ⅱ的59.64%。此分离方法简便易行,为龙葵的精深加工提供了实验依据。
参考文献:
[1] 卞勇, 吕冬霞. 龙葵的室内栽培及利用[J]. 生物学杂志, 2003, 20(4): 40-43. DOI:10.3969/j.issn.2095-1736.2003.04.015.
[2] 季宇彬, 王胜惠, 高世勇, 等. 龙葵活性成分的研究[J]. 哈尔滨商业大学学报(自然科学版), 2004, 20(6): 637-641. DOI:10.3969/ j.issn.1672-0946.2004.06.001.
[3] 曹熙敏. 微波辅助浸提法提取野生龙葵果红色素的工艺筛选[J]. 江苏农业科学, 2011, 39(3): 378-379. DOI:10.3969/ j.issn.1002-1302.2011.03.149.
[4] 卢汝梅, 谭新武, 周媛媛. 龙葵的研究进展[J]. 时珍国医国药, 2009, 20(7): 1820-1822. DOI:10.3969/j.issn.1008-0805.2009.07.138.
[5] 腾飞, 赵福杰, 郑洪亮, 等. 龙葵果花色苷的提取工艺研究[J].食品工业科技, 2014, 35(7): 240-245; 267. DOI:10.13386/ j.issn1002-0306.2014.07.014.
[6] 张贺, 王晖, 袁博. 提取龙葵果红色素影响因素的统计模型建立[J]. 湖北农业科学, 2013, 52(22): 5553-5555. DOI:10.3969/ j.issn.0439-8114.2013.22.047.
[7] 范翠丽, 李向东, 曹熙敏, 等. 野生龙葵果红色素最佳提取工艺筛选[J]. 广东农业科学, 2011(4): 103-104. DOI:10.3969/j.issn.1004-874X.2011.04.040.
[8] 木合塔尔·吐尔, 洪木尼热·阿不都克力木. 戈壁野生龙葵果紫红色素的提取及其理化性质研究[J]. 陕西师范大学学报(自然科学版), 2004, 32(4): 120-121. DOI:10.3321/j.issn:1672-4291.2004.04.031.
[9] 腾飞, 郑洪亮, 王萍. 龙葵果花色苷纯化工艺[J]. 食品与发酵工业, 2014, 40(4): 95-100. DOI:10.13995/j.cnki.11-1802/ts.2014.04.019.
[10] 腾飞, 刘召君, 郑洪亮, 等. 龙葵果花色苷降解动力学[J]. 食品与生物技术学报, 2014, 33(5): 548-559.
[11] SIMIRGIOTIS M J, SILVA M, BECERRA J, et al. Direct characterisation of phenolic antioxidants in infusions from four Mapuche medicinal plants by liquid chromatography with diode array detection (HPLCDAD) and electrospray ionisation tandem mass spectrometry(HPLC-ESI-MS)[J]. Food Chemistry, 2012, 131(1): 318-327. DOI:10.1016/j.foodchem.2011.07.118.
[12] LEE J H, LIM J D, CHOUNG M G. Studies on the anthocyanin profile and biological properties from the fruits of Acanthopanax senticosus(Siberian Ginseng)[J]. Journal of Functional Foods, 2013, 5(1): 380-388. DOI:10.1016/j.jff.2012.11.010.
[13] 张琳琳. 黑加仑色素分离、结构初步鉴定及稳定性研究[D]. 哈尔滨: 东北农业大学, 2008: 28.
[14] HUANG Xinting, LIU Jianqiu, PENG Qi. Studies on separation and chemical structure identification of red pigment of Adinandra millettii fruit[J]. Journal of Plant Resources and Environment, 2007, 16(1): 31-34.
[15] ESCRIBANO-BAILÓN M T, SANTOS-BUELGA C, RIVASGONZALO J C. Anthocyanins in cereals[J]. Journal of Chromatography A, 2004, 1054(1/2): 129-141. DOI:10.1016/ j.chroma.2004.08.152.
[16] da SILVA F L, ESCRIBANO-BAILÓN M T, ALONSO J J P, et al. Anthocyanins pigments in strawberry[J]. LWT-Food Science and Technology, 2007, 40(2): 374-382. DOI:10.1016/j.lwt.2005.09.018.
[17] CUI Chun, ZHANG Shaomin, YOU Lijun, et al. Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa (Ait.) and identification of the major anthocyanins[J]. Food Chemistry, 2013, 139(1/2/3/4): 1-8. DOI:10.1016/j.foodchem.2013.01.107.
[18] YANG Zhendong, ZHAI Weiwei. Optimization of microwaveassisted extraction of anthocyanins from purple corn (Zea mays L.) cob and identification with HPLC-MS[J]. Innovative Food Science and Emerging Technologies, 2010, 11(3): 470-476. DOI:10.1016/ j.ifset.2010.03.003.
[19] REBELLO L P G, LAGO-VANZELA E S, BARCIA M T, et al. Phenolic composition of the berry parts of hybrid grape cultivar BRS Violeta (BRS RubeahIAC 1398-21) using HPLC-DAD-ESIMS/MS[J]. Food Research International, 2013, 54(1): 354-366. DOI:10.1016/j.foodres.2013.07.024.
[20] 李永强. 白刺果实色素结构及性质的研究[D]. 泰安: 山东农业大学, 2004: 47.
[21] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Biochemical Engineering Journal, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
[22] JING Pu, ZHAO Shujuan, RUAN Siyu, et al. Anthocyanin and glucosinolate occurrences in the roots of Chinese red radish (Raphanus sativus L.), and their stability to heat and pH[J]. Food Chemistry, 2012,133(4): 1569-1576. DOI:10.1016/j.foodchem.2012.02.051.
[23] CORREA-BETANZO J, ALLEN-VERCOE E, MCDONALD J, et al. Stability and biological activity of wild blueberry (Vaccinium angustifolium) polyphenols during simulated in vitro gastrointestinal digestion[J]. Food Chemistry, 2014, 165: 522-531. DOI:10.1016/ j.foodchem.2014.05.135.
[24] WU Xiangyang, LIANG Linghong, ZOU Ye, et al. Aqueous two-phase extraction, identification and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.)[J]. Food Chemistry, 2011,129(2): 443-453. DOI:10.1016/j.foodchem.2011.04.097.
[25] GONZÁLEZ-GÓMEZ D, LOZANO M, FERNÁNDEZ-LEÓN M, et al. Sweet cherry phytochemicals: identification and characterization by HPLC-DAD/ESI-MS in six sweet-cherry cultivars grown in Valle del Jerte (Spain)[J]. Journal of Food Composition and Analysis, 2010,23(6): 533-539. DOI:10.1016/j.jfca.2009.02.008.
[26] CHEN Fang, SUN Yangzhao, ZHAO Guanghua, et al. Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J]. Ultrasonics Sonochemistry, 2007, 14(6): 767-778. DOI:10.1016/j.ultsonch.2006.12.011.
Isolation and Identification of Anthocyanins from Solanum nigrum L. Fruits
TENG Fei, ZHENG Yue, WANG Ping
*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract:The objective of this study was to isolate anthocyanins from Solanum nigrum L. fruits by silica gel column chromatography and identify them by UV-visible spectroscopy and high performance liquid chromatography-electrospray ionization tandem mass spectrometry (HPLC-DAD-ESI-MS/MS). Acid hydrolysis was applied for the identification of glucosides. Three anthocyanins were identified for the first time in Solanum nigrum L. fruits. Only delphinidin-3-succinylarabinoside was detected in fraction I (the purity was 94%), while both cyanidin-3-galactoside (the purity was 45.67%) and cyanidin-3-acetylgalactoside (the purity was 13.97%) were found to be present in fraction II. The presented method is simple and reliable to isolate and identify the anthocyanins from Solanum nigrum L. fruits.
Key words:Solanum nigrum L.; anthocyanins; isolation; identification; high performance liquid chromatography electrosprary ionization-mass spectrometry (HPLC-DAD-ESI-MS/MS); acid hydrolysis
DOI:10.7506/spkx1002-6630-201607011
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)07-0056-06
引文格式:
腾飞, 郑悦, 王萍. 龙葵果花色苷的分离与鉴定[J]. 食品科学, 2016, 37(7): 56-61. DOI:10.7506/spkx1002-6630-201607011. http://www.spkx.net.cn
TENG Fei, ZHENG Yue, WANG Ping. Isolation and identification of anthocyanins from Solanum nigrum L. fruits[J]. Food Science, 2016, 37(7): 56-61. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607011. http://www.spkx.net.cn
收稿日期:2015-05-11
基金项目:黑龙江省卓越农林人才教育培养计划改革试点项目(41110211)
作者简介:腾飞(1990—),女,硕士,研究方向为功能食品。E-mail:tengfeisiyu@126.com
*通信作者:王萍(1964—),女,教授,博士,研究方向为植物活性成分提取及功能。E-mail:wangpingnefu@126.com