王 颖 1,2,何 禾 1,胡发根 1,齐 斌 1,王立梅 1,朱益波 1, *
(1.常熟理工学院 苏州市食品生物技术重点实验室,江苏 常熟 215500;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:研究利用重组大肠杆菌Escherichia coli BL21(DE3)/pET-28a-ldhD全细胞生物转化苯丙酮酸(phenylpyruvic acid,PPA)合成D-苯基乳酸(D-phenyllactic acid,D-PLA)的条件。通过Plackett-Burman试验设计,从影响细胞转化的6 种因素中筛选得出转化温度、底物浓度和磷酸钠缓冲液pH值对底物PPA摩尔转化率有显著影响;采用Box-Behnken试验设计和响应面优化,对该重组菌全细胞转化合成D-PLA的条件进行了优化。最佳分批转化条件:转化温度为38 ℃、底物浓度为42 mmol/L、磷酸钠缓冲液pH 7.0、菌体质量浓度20 g/L、葡萄糖质量浓度20 g/L。在该条件下反应0.5 h,底物摩尔转化率为65.32%。根据此最佳转化条件,经4 h的间歇补加底物转化获得D-PLA最终浓度为119 mmol/L(19.75 g/L),生产率为4.94 g/(Lgh)。
关键词:D-苯基乳酸;苯丙酮酸;重组大肠杆菌;生物转化;响应面优化
苯基乳酸(phenyllactic acid,PLA),即2-羟基-3-苯基丙酸,是一种小分子的天然防腐剂,存在于蜂蜜和乳酸菌的发酵产物中 [1-3]。近年来,PLA作为一种新颖的天然抑菌物质,引起食品行业普遍关注 [4]。PLA具有两种手性对映异构体 [5],D-PLA和L-PLA,可以作为手性中间体广泛应用于化工、医药和生物合成等领域 [6]。大量研究表明,PLA具有广谱而高效的抗菌活力,对引起食物腐败的革兰氏阳性菌、革兰氏阴性菌、酵母菌和霉菌等多种微生物具有抑制作用 [7-10]。PLA作为乳酸菌苯丙氨酸的代谢产物,对人体和动物细胞均无毒性 [11-12]。此外,PLA具有水溶性和热稳定性好、有效pH值范围宽、使用方便等优点,有利于其未来在食品工业中的普遍应用 [13]。
目前,PLA的制备方法有化学合成法、微生物发酵法和酶催化法。化学合成法虽然具有较高的生产效率,但存在合成过程复杂、大量使用有机溶剂、产物为内消旋混合物等缺点 [14]。酶催化法存在酶分离纯化过程繁琐、酶稳定性差、转化过程中需要添加昂贵的辅因子等问题,尚不能大规模应用。利用微生物法合成PLA具有条件温和、底物转化率高和产物光学纯度高等优点,受到了相关研究者的重视。
已报道多种微生物具有催化苯丙酮酸(phenylpyruvic acid,PPA)合成PLA的能力,主要有真菌(Geotrichum candidum ATCC 204307 [15])、乳酸菌(Lactobacillus [16-19]、Enterococcus faecalis TH10 [20]、Weissella cibaria FMF4B16 [21]、Leuconostoc mesenteroides subsp. mesenteroides ITMY30 [22])、丙酸菌(Propionibacterium jensenii DSMZ 20535、P. acidipropionici DSMZ 4900) [23]等。其中,乳酸脱氢酶是微生物合成PLA的一种关键酶,但由于微生物细胞内乳酸脱氢酶的表达受到严格调控,限制苯基乳酸合成 [24]。因此,利用基因工程手段获得高效过表达乳酸脱氢酶的重组菌是提高苯基乳酸产量的有效途径。
在前期工作中,本实验室从Lactobacillus pentosus中克隆得到了D-乳酸脱氢酶(D-lactate dehydrogenase,D-ldh)的编码基因,并利用原核表达载体pET-28a(+)构建一株能够高效表达D-ldh的基因工程菌E. coli BL21(DE3)/pET-28a-ldhD [24]。此重组菌具有较高的还原PPA生产PLA能力,但是对于底物的转化率还需要进一步提高。
采用高效表达D-乳酸脱氢酶的微生物全细胞合成D-PLA,可避免酶的分离纯化,保证酶的活性,无需添加辅因子,简化后处理工序,缩短生产周期,保证产物光学纯度。本研究拟在Plackett-Burman试验的基础上,采用响应面分析法对重组大肠杆菌E. coli BL21(DE3)/ pET-28a-ldhD全细胞合成D-PLA的反应条件进行优化,以期为进一步提高微生物合成PLA的生产率和底物转化率提供借鉴。
1.1 材料与试剂
D-苯基乳酸和一水苯丙酮酸钠 国药集团化学试剂有限公司。
酵母提取物和胰蛋白胨 英国Oxoid公司;卡那霉素 生工生物工程(上海)股份有限公司;其他试剂均为分析纯。
1.2 菌株和培养基
重组大肠杆菌Escherichia coli BL21(DE3)/pET-28a-ldhD [24]为苏州市食品生物技术重点实验室保藏。
Luria-Bertani(LB)培养基:酵母粉5 g/L、蛋白胨10 g/L、NaCl 10 g/L。根据需要,在培养基中添加50 μg/mL的卡那霉素。
基础全细胞转化体系为含全细胞重组大肠杆菌20 g/L、葡萄糖20 g/L、苯丙酮酸钠40 mmol/L和体积分数1%吐温-80的磷酸钠缓冲液(0.1 mol/L,pH 7.0)。
1.3 仪器与设备
CR22GⅡ高速冷冻离心机 日本Hitachi公司;SC100水浴控制器 德国Thermo公司;CTO-20AC高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;HZQ-F280恒温振荡培养箱 太仓市华美生化仪器厂。
1.4 方法
1.4.1 重组大肠杆菌培养及D-PLA合成
菌体活化:从固体培养基上挑取E. coli BL21(DE3)/pET-28a-ldhD单菌落接种至装有10 mL新鲜LB培养基(含50 μg/mL卡那霉素)的100 mL三角瓶中培养,37 ℃、200 r/min过夜培养。
重组菌诱导及D-PLA合成 [24]:将活化好的重组菌E. coli BL21(DE3)/pET-28a-ldhD按1%的接种量接种至装有100 mL新鲜LB培养基(含50 μg/mL卡那霉素)的500 mL三角瓶中,摇床转速200 r/min、37 ℃培养至OD 600 nm值为1.2,加入诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactopyranoside,IPTG)至0.2 mmol/L,25 ℃诱导4 h后,4 ℃、6 000 r/min离心10 min收集菌体。菌体用pH值为7.0的磷酸钠缓冲液洗涤2 次,重悬于10 mL磷酸钠缓冲液中,反应0.5 h后取样用高效液相色谱检测转化产物D-PLA和底物PPA。
1.4.2 转化液样品制备
取500 µL转化液于4 ℃、12 000 r/min离心5 min,取上清液100 µL,与流动相按1∶9的体积比混合均匀,经0.22 μm滤膜过滤后用HPLC法检测。转化反应体系中的菌体浓度以OD 600 nm值表示。
1.4.3 高效液相色谱条件
色谱柱:Bio-Rad Aminex HPX-87H;流动相为5.0 mmol/L稀硫酸;流速0.6 mL/min;柱温30 ℃;进样体积5.0 µL,检测波长210 nm。
1.4.4 Plackett-Burman试验优化
前期工作中,对此重组大肠杆菌全细胞转化反应进行了初步研究,得到最佳诱导条件 [25]:将过夜培养的种子培养液按1%的体积比接种至含100 mL新鲜LB培养基(含50 μg/mL卡那霉素)的500 mL三角瓶中,37 ℃、200 r/min,培养至OD 600 nm值为1.2时添加IPTG至终浓度为0.2 mmol/L,25 ℃诱导4 h后收集菌体。此外,还对全细胞转化条件的各影响因素进行了单因素试验 [25],结果表明:磷酸钠缓冲液pH 7.0、转化温度为37 ℃,底物浓度为40 mmol/L,菌体质量浓度为20 g/L时,D-PLA产量较高 [25]。
为进一步优化全细胞转化条件,利用Plackett-Burman试验设计,选择菌体质量浓度(X 1)、转化温度(X 2)、转化时间(X 4)、葡萄糖质量浓度(X 5)、底物浓度(X 7)和缓冲液pH值(X 8)6 个因素,并设置X 3和X 6两个空白作为误差分析项。每个因素分别选取低(-1)和高(1)两个水平,共12 个试验组合,以全细胞转化反应中PPA摩尔转化率为响应值。
1.4.5 响应面分析法试验设计
为了确定影响重组大肠杆菌全细胞转化合成D-PLA的各参数的水平以及不同参数之间的交互作用,将PPA有效地转化为产物,因此,在相同诱导条件 [24]下,并且给定转化反应时间为0.5 h、摇床转速为200 r/min、菌体质量浓度为20 g/L和葡萄糖质量浓度为20 g/L,本试验采用三因素三水平的Box-Behnken设计原理进行响应面试验设计,以磷酸钠缓冲液pH值、转化温度和底物浓度为自变量,通过Design-Expert软件对试验数据进行回归分析,预测全细胞转化过程的最佳反应条件。
1.4.6 PPA分批补料合成D-PLA
将过夜培养的种子培养液按1%的体积比接种至含100 mL新鲜LB培养基(含50 μg/mL卡那霉素)的500 mL三角瓶中,37 ℃、200 r/min,培养至OD 600 nm值为1.2时添加IPTG至终浓度为0.2 mmol/L,25 ℃诱导4 h后收集菌体。将适量菌体悬浮于含1%吐温-80和20 g/L葡萄糖的50 mL磷酸钠缓冲液(0.1 mol/L,pH 7.0),在250 mL三角瓶中37 ℃、200 r/min进行转化反应。分别在0、0.5、1、1.5、2、3 h补加2 mol/L苯丙酮酸钠母液1、1、0.75、0.75、0.5、0.5 mL。每次补料前后各取200 μL菌液经10 000 r/min、4 ℃离心2 min,上清进行PPA和D-PLA的浓度检测,菌泥沉淀进行OD 600 nm值检测。
1.4.7 PPA摩尔转化率计算
PPA摩尔转化率按如下公式计算。
2.1 Plackett-Burman试验结果
Plackett-Burman试验设计方案及结果见表1。每个处理重复3 次,取平均值为试验结果。采用Design-Expert 8.0.6软件处理试验数据,比较各因素的F值和可信度,选择可信度>95%的因素作为显著影响因素,采用Box-Behnken响应面法进行下一步试验。
影响全细胞转化合成D-PLA的因素有菌体浓度、转化温度、转化时间、葡萄糖质量浓度、底物浓度,确定各影响因素水平,利用Design-Expert 8.0.6软件进行Plackett-Burman试验设计,并对Plackett-Burman试验结果进行方差分析,结果见表2。可知,转化温度、底物浓度和缓冲液pH值对PPA摩尔转化率有显著影响,采用响应面分析法中Box-Behnken设计法建立多元二次模型方程,对其关键因子进一步研究。
表1 Plackett-Burman试验设计及结果
Table 1 Plackett-Burman design and experimental response obtained for PPA conversion efficiency
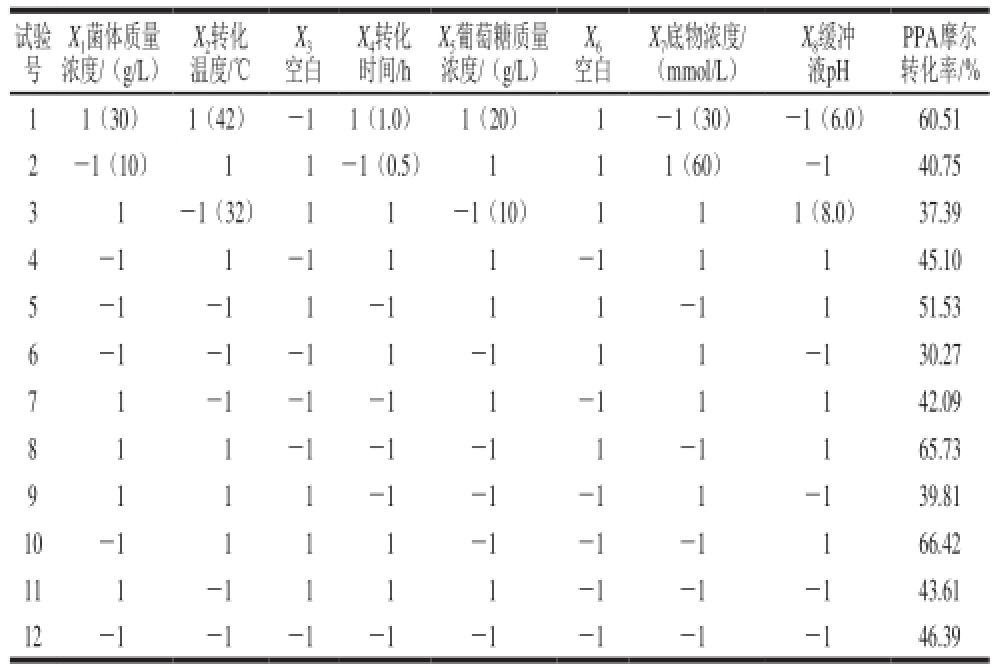
试验号PPA摩尔转化率/% 1 1(30) 1(42) -1 1(1.0) 1(20) 1 -1(30) -1(6.0) 60.51 2 -1(10) 1 1-1(0.5) 1 1 1(60) -1 40.75 3 1 -1(32) 1 1 -1(10) 1 1 1(8.0) 37.39 4 -1 1-1 1 1 -1 1 1 45.10 5 -1 -1 1 -1 1 1 -1 1 51.53 6 -1 -1 -1 1 -1 1 1 -1 30.27 7 1 -1 -1 -1 1 -1 1 1 42.09 8 1 1 -1 -1 -1 1 -1 1 65.73 9 1 1 1 -1 -1 -1 1 -1 39.81 10 -1 1 1 1 -1 -1 -1 1 66.42 11 1 -1 1 1 1 -1 -1 -1 43.61 12 -1 -1 -1 -1 -1 -1 -1 -1 46.39 X 1菌体质量浓度/(g/L)X 2转化温度/℃X 3X 6空白X 4转化时间/h X 5葡萄糖质量浓度/(g/L) 空白X 7底物浓度/(mmol/L)X 8缓冲液pH
表2 Plackett-Burman试验设计方差分析
Table 2 Analysis of variance (ANOVA) of Plackett-Burman design
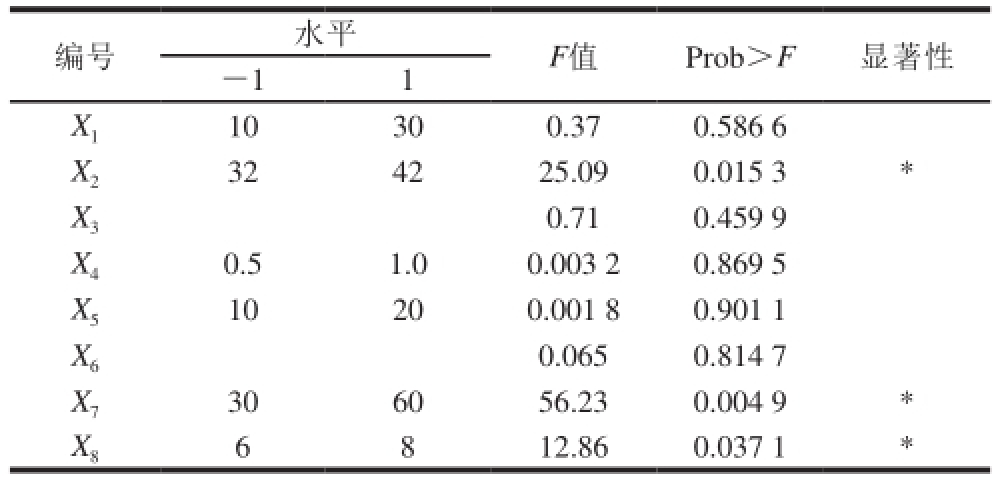
注: *.P<0.05,表示差异显著。下同。
编号 水平 F值 Prob>F 显著性-1 1 X 110 30 0.37 0.586 6 X 232 42 25.09 0.015 3 *X 30.71 0.459 9 X 40.5 1.0 0.003 2 0.869 5 X 510 20 0.001 8 0.901 1 X 60.065 0.814 7 X 730 60 56.23 0.004 9 *X 86 8 12.86 0.037 1 *
2.2 重组大肠杆菌全细胞转化合成D-PLA的多元二次模型方程的建立
根据Plackett-Burman试验设计结果进行Box-Behnken试验设计,Box-Behnken试验设计方案及结果见表3,列出了Box-Behnken试验设计和结果,其中第13~17次试验为5 次重复的中心点试验,用于考察模型的误差。以PPA摩尔转化率为响应指标,利用Design-Expert 8.0.6软件对表3进行二次多元回归拟合,结果见表4。
表3 Box-Behnken试验设计及结果
Table 3 Box-Behnken design and experimental response obtained for PPA conversion efficiency
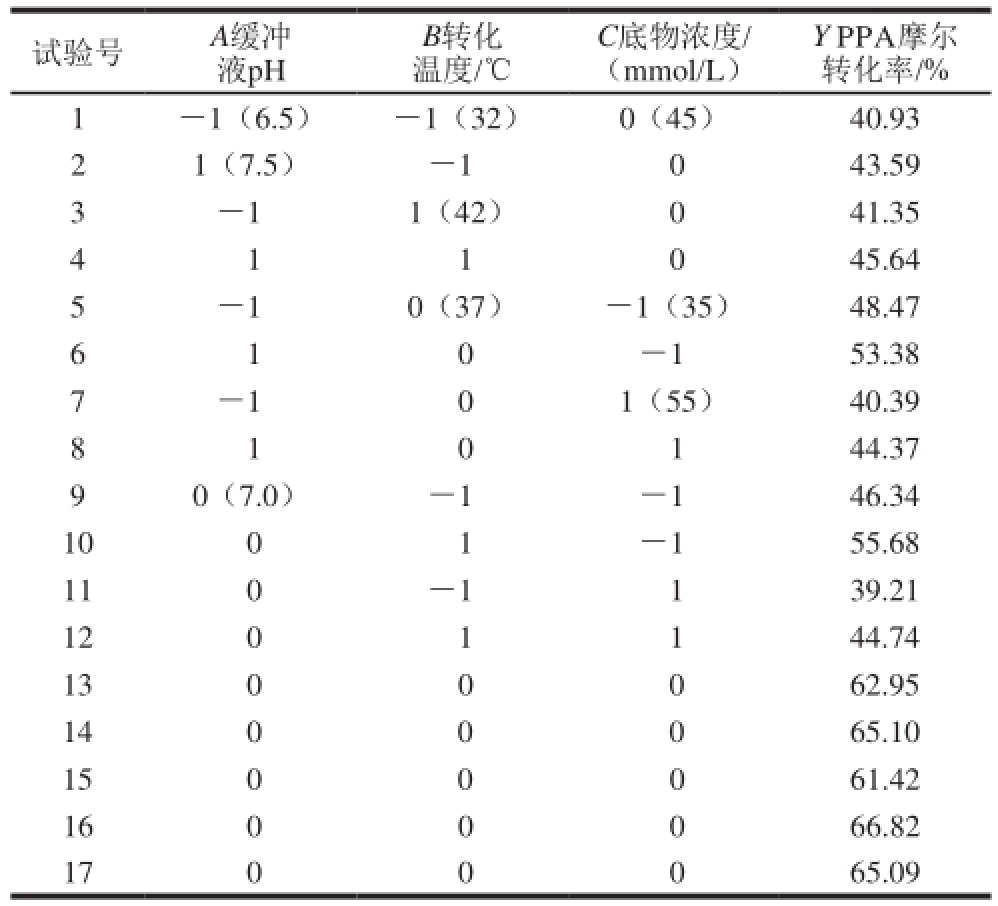
试验号 A缓冲液pH B转化温度/℃C底物浓度/(mmol/L)Y PPA摩尔转化率/% 1 -1(6.5) -1(32) 0(45) 40.93 2 1(7.5) -1 0 43.59 3 -1 1(42) 0 41.35 4 1 1 0 45.64 5 -1 0(37) -1(35) 48.47 6 1 0-1 53.38 7 -1 0 1(55) 40.39 8 1 0 1 44.37 9 0(7.0) -1 -1 46.34 10 0 1 -1 55.68 11 0 -1 1 39.21 12 0 1 1 44.74 13 0 0 0 62.95 14 0 0 0 65.10 15 0 0 0 61.42 16 0 0 0 66.82 17 0 0 0 65.09
表4 Box-Behnken试验结果方差分析
Table 4 Analysis of variance (ANOVA) of regression equation
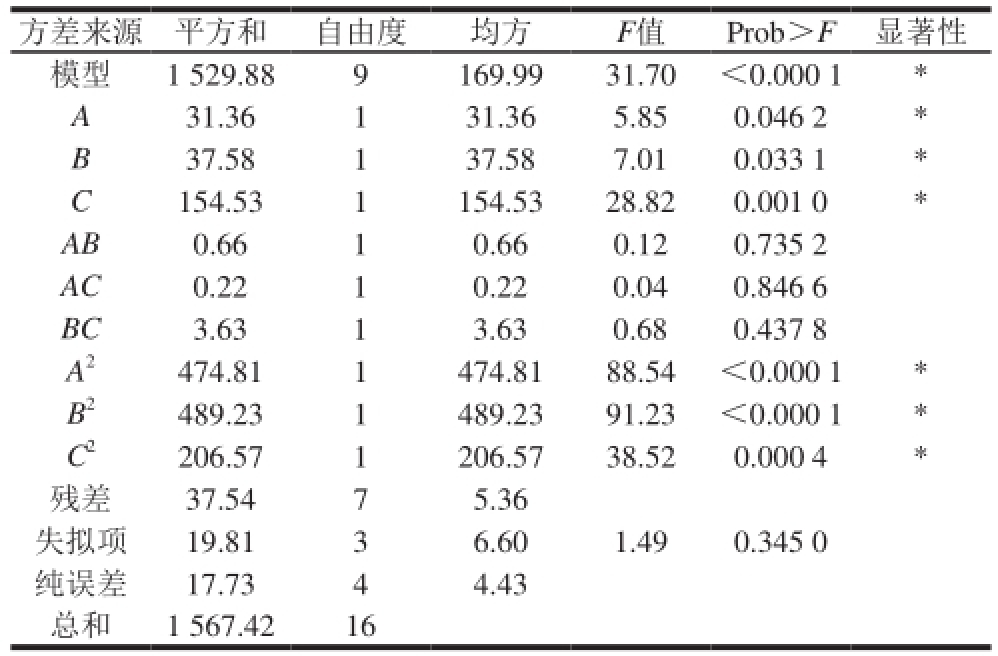
方差来源 平方和 自由度 均方 F值 Prob>F 显著性模型 1 529.88 9 169.99 31.70 <0.000 1 *A 31.36 1 31.36 5.85 0.046 2 *B 37.58 1 37.58 7.01 0.033 1 *C 154.53 1 154.53 28.82 0.001 0 *AB 0.66 1 0.66 0.12 0.735 2 AC 0.22 1 0.22 0.04 0.846 6 BC 3.63 1 3.63 0.68 0.437 8 A 2474.81 1 474.81 88.54 <0.000 1 *B 2489.23 1 489.23 91.23 <0.000 1 *C 2206.57 1 206.57 38.52 0.000 4 *残差 37.54 7 5.36失拟项 19.81 3 6.60 1.49 0.345 0纯误差 17.73 4 4.43总和 1 567.42 16
经二次多项回归拟合后,得到以全细胞转化反应中PPA摩尔转化率为响应值(Y)的回归方程预测模型为:Y=64.28+1.98A+2.17B-4.40C+0.41AB-0.23AC-0.95BC-10.62A 2-10.78B 2-7.00C 2。
表4方差分析表明,对摩尔转化率所建立的回归模型达到显著水平(P<0.05),失拟项不显著(P=0.345 0),回归方程可用。各因素对摩尔转化率影响大小顺序:底物浓度>转化温度>缓冲液pH值。一次项C极显著,二次项A 2、B 2、C 2极显著。回归方程决定系数R 2=0.976 1,说明该回归方程拟合程度高,能准确地反映各因素与响应值之间的真实关系,可以用于分析和预测最佳全细胞转化反应条件。
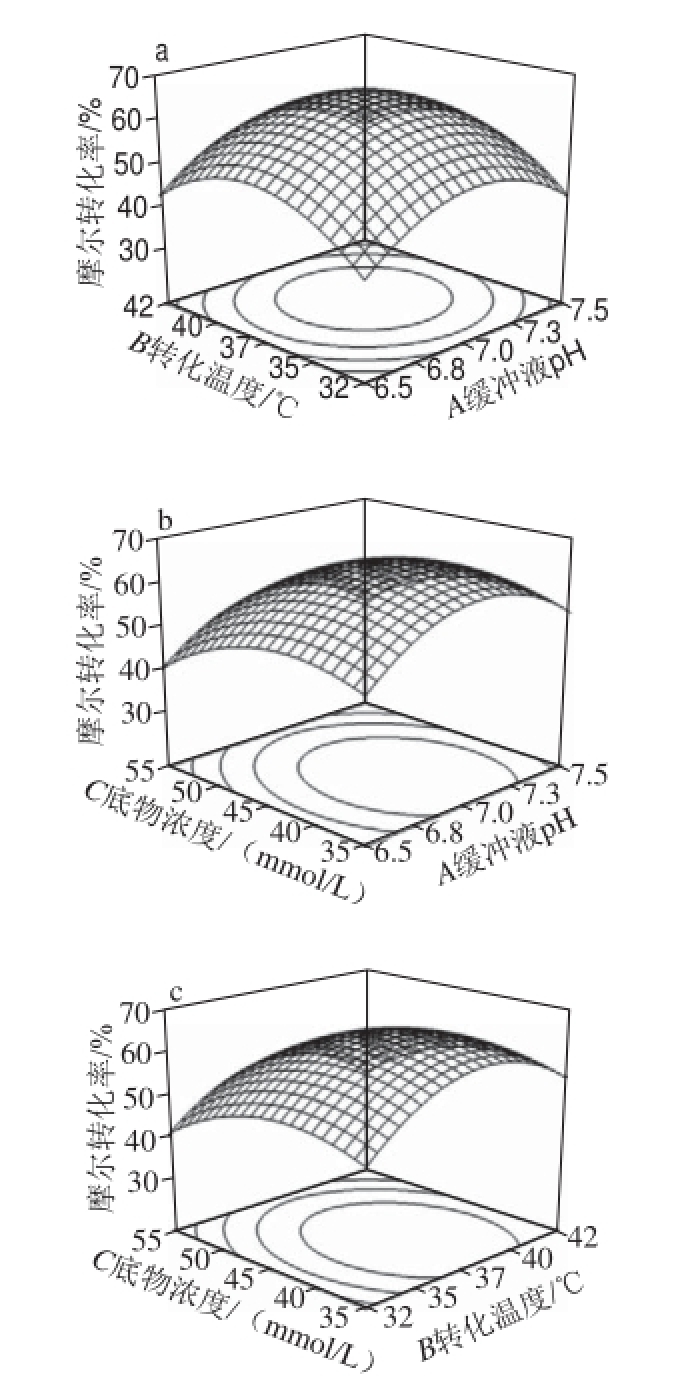
图1 转化温度、底物PPA浓度和缓冲液pH值对摩尔转化率影响的响应曲面图
Fig.1 Response surface plots for the effects of temperature, PPA concentration and phosphate buffer pH on PPA conversion efficiency
结合图1和Design-Expert 8.0.6软件分析得到的全细胞转化反应最佳条件是磷酸钠缓冲液pH7.05、转化温度37.59 ℃、底物浓度41.77 mmol/L,此时PPA摩尔转化率为65.21%。考虑到实际操作的可行性,对预测反应条件进行如下修正:磷酸钠缓冲液pH值为7.0、转化温度为38 ℃、底物浓度为42 mmol/L。
在以上优化条件下进行了4 次验证实验。验证实验结果平均值为65.32%,预测值与实验值的相对偏差为0.17%。说明采用响应面优化全细胞转化反应条件是可行的,为进一步提高底物利用效率提供了依据。
2.3 底物分批补料强化D-PLA合成
通过响应面试验获得最适转化条件,在此条件的基础上进行底物分批补料实验(图2)。经4 h转化,D-PLA最终浓度为119 mmol/L,生产率达到4.94 g/(Lgh),平均摩尔转化率达62.96%。相比Bacillus coagulans SDM [25]全细胞转化合成PLA(转化时间20 h,转化率70%,产量37.3 g/L),此重组大肠杆菌在合成D-PLA的产量和转化率上有所不足,但是在生产率上有显著提高。
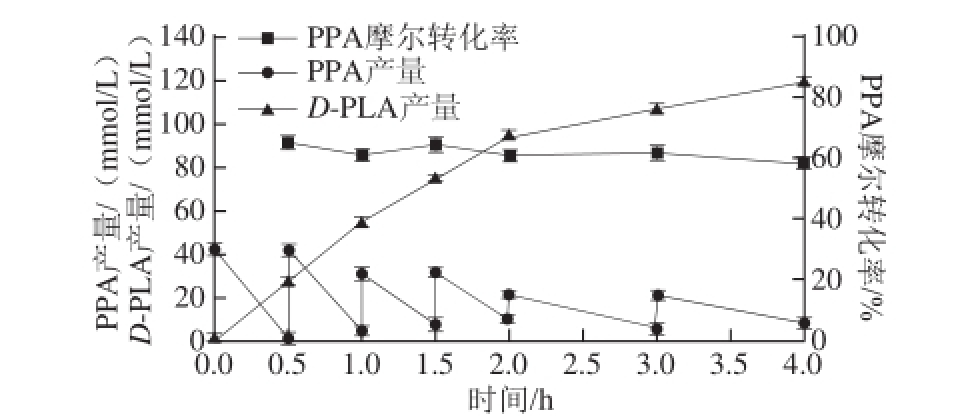
图2 底物分批补料转化生产D-PLA的时间曲线
Fig.2 Time course of D-PLA production in fed-batch fermentation with intermittent PPA feeding
本研究通过Plackett-Burman试验设计筛选出影响重组大肠杆菌全细胞转化PPA合成D-PLA的关键因素,以二次多项数学模型的响应面法优化获得分批最佳反应条件为:磷酸钠缓冲液pH 7.0、转化温度38 ℃、底物浓度42 mmol/L,菌体质量浓度20 g/L、葡萄糖质量浓度20 g/L。在该条件下反应0.5 h,底物的分批摩尔转化率为65.32%,较优化前提高了约9%。底物分批补料实验获得D-PLA最终浓度为119 mmol/L,即19.75 g/L,生产率达4.94 g/(Lgh),平均摩尔转化率达62.96%,较优化前D-PLA产量提高了2.5 g/L,底物的平均摩尔转化率提高了接近9%。底物转化率和产物生产率较优化前均有显著提高,为进一步提高D-PLA产量提供理论依据。
参考文献:
[1] DIEULEVEUX V, VANDERPYL D, CHATAUD J, et al. Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J]. Applied and Environmental Microbiology, 1998, 64(2): 800-803.
[2] TUBEROSO C I, BIFULCO E, CABONI P, et al. Lumichrome and phenyllactic acid as chemical markers of thistle (Galactites tomentosa Moench) honey[J]. Journal of Agricultural and Food Chemistry, 2010, 59(1): 364-369. DOI:10.1021/jf1039074.
[3] LI Xingfeng, JIANG Bo, PAN Beibei. Biotransformation of phenylpyruvic acid to phenyllactic acid by growing and resting cells of a Lactobacillus sp.[J]. Biotechnology Letters, 2007, 29(4): 593-597. DOI:10.1007/s10529-006-9275-4.
[4] WANG J, YOO J, LEE J, et al. Effects of phenyllactic acid on production performance, egg quality parameters, and blood characteristics in laying hens[J]. The Journal of Applied Poultry Research, 2009, 18(2): 203-209. DOI:10.3382/japr.2008-00071.
[5] 贾江花. 乳酸脱氢酶的克隆表达及酶学性质的研究[D]. 无锡: 江南大学, 2009.
[6] WANG J, LEE J, YOO J, et al. Effects of phenyllactic acid on growth performance, intestinal microbiota, relative organ weight, blood characteristics, and meat quality of broiler chicks[J]. Poultry Science, 2010, 89(7): 1549-1555. DOI:10.3382/ps.2009-00235.
[7] DIEULEVEUX V, GUEGUEN M. Antimicrobial effects of D-3-phenyllactic acid on Listeria monocytogenes in TSB-YE medium, milk, and cheese[J]. Journal of Food Protection, 1998, 61(10): 1281-1285.
[8] DIEULEVEUX V, LEMARINIER S, GUEGUEN M. Antimicrobial spectrum and target site of D-3-phenyllactic acid[J]. International Journal of Food Microbiology, 1998, 40(3): 177-183. DOI:10.1016/ S0168-1605(98)00031-2.
[9] VALERIO F, LAVERMICOCCA P, PASCALE M, et al. Production of phenyllactic acid by lactic acid bacteria: an approach to the selection of strains contributing to food quality and preservation[J]. FEMS Microbiology Letters, 2004, 233(2): 289-295. DOI:10.1111/j.1574-6968.2004.tb09494.x.
[10] LAVERMICOCCA P, VALERIO F, VISCONTI A. Antifungal activity of phenyllactic acid against molds isolated from bakery products[J]. Applied and Environmental Microbiology, 2003, 69(1): 634-640. DOI:10.1128/AEM.69.1.634-640.2003.
[11] ALLEN K, MOLAN P, REID G. A survey of the antibacterial activity of some New Zealand honeys[J]. Journal of Pharmacy and Pharmacology, 1991, 43(12): 817-822. DOI:10.1111/j.2042-7158.1991.tb03186.x.
[12] WILKINS A, LU Y, MOLAN P. Extractable organic substances from New Zealand unifloral manuka (Leptospermum scoparium) honeys[J]. Journal of Apicultural Research, 1993, 32(1): 3-9.
[13] 李兴峰, 江波, 潘蓓蕾. 新型生物防腐剂: 苯乳酸在食品中的研究与应用[J]. 食品与发酵工业, 2007, 33(5): 87-91. DOI:10.3321/ j.issn:0253-990X.2007.05.022.
[14] 李远颂. 生物合成R-3-苯基乳酸的研究[D]. 儋州: 华南热带农业大学, 2006.
[15] NAZ S, GUEGUEN M, CRETENET M, et al. Aromatic amino acids as precursors of antimicrobial metabolites in Geotrichum candidum[J]. FEMS Microbiology Letters, 2013, 344(1): 39-47. DOI:10.1111/1574-6968.12152.
[16] LAVERMICOCCA P, VALERIO F, EVIDENTE A, et al. Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J]. Applied and Environmental Microbiology, 2000, 66(9): 4084-4090. DOI:10.1016/ S0038-0717(97)00088-6.
[17] STROM K, SJOGREN J, BROBERG A, et al. Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-LPro) and cyclo(L-Phe-trans-4-OH-L-Pro) and 3-phenyllactic acid[J]. Applied and Environmental Microbiology, 2002, 68(9): 4322-4327. DOI:10.1128/AEM.68.9.4322-4327.2002.
[18] WANG Haikuan, YAN Yanhua, WANG Jiaming, et al. Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J]. PLoS ONE, 2012, 7(1): e29452. DOI:10.1371/journal.pone/oo29452.
[19] PREMA P, SMILA D, PALAVESAM A, et al. Production and characterization of an antifungal compound (3-phenyllactic acid) produced by Lactobacillus plantarum strain[J]. Food Bioprocess Technology, 2010, 3(3): 379-386. DOI:10.1007/s11947-008-0127-1.
[20] OHHIRA I, KUWAKI S, MORITA H, et al. Identification of 3-phenyllactic acid as a possible antibacterial substance produced by Enterococcus faecalis TH10[J]. Biocontrol Science, 2004, 9(3): 77-81. DOI:10.4265/bio.9.77.
[21] NDAGANO D, LAMOUREUX T, DORTU C, et al. Antifungal activity of 2 lactic acid bacteria of the Weissella genus isolated from food[J]. Journal of Food Science, 2011, 76(6): 305-311. DOI:10.1111/ j.1750-3841.2011.02257.x.
[22] VALERIO F, LACERMICOCCA P, PASCALE M, et al. Production of phenyllactic acid by lactic acid bacteria: an approach to the selection of strains contributing to food quality and preservation[J]. FEMS Microbiology Letters, 2004, 233(2): 289-295. DOI:10.1016/ j.femsle.2004.02.020.
[23] LIND H, SJOGREN J, GOHIL S, et al. Antifungal compounds from cultures of dairy propionibacteria type strains[J]. FEMS Microbiology Letters, 2007, 271(2): 310-315. DOI:10.1111/j.1574-6968.2007.00730.x.
[24] 胡发根, 沈丽, 季华兰, 等. 重组大肠杆菌全细胞合成苯基乳酸的研究[J]. 食品工业科技, 2015, 36(9): 149-151. DOI:10.13386/ j.issn1002-0306.2015.09.024.
[25] ZHENG Zhaojuan, MA Cuiqing, GAO Chao, et al. Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J]. PLoS ONE, 2011, 6(4): e19030. DOI:10.1007/s10529-015-1778-4.
Optimization of D-Phenyllactic Acid Production by Whole Cells of Recombinant Escherichia coli Using Response Surface Methodology
WANG Ying
1,2, HE He
1, HU Fagen
1, QI Bin
1, WANG Limei
1, ZHU Yibo
1,
*
(1. Key Laboratory of Food and Biotechnology of Suzhou, Changshu Institute of Technology, Changshu 215500, China; 2. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:The bioconversion conditions for the production of D-3-phenyllactic acid from phenylpyruvic acid (PPA) using whole cells of Escherichia coli BL21(DE3)/pET-28a-ldhD were studied. Using Plackett-Burman design, buffer pH, substrate concentration and temperature were selected as the factors with significant influence on substrate conversion efficiency out of 6 factors. Subsequently, the optimization of the three factors was carried out using Box-Behnken design and response surface analysis. Results indicated that the optimal bioconversion conditions that provided the maximum molar conversion efficiency of PPA (65.32%) during 30 min were buffer pH 7.0, substrate concentration 42 mmol/L, and temperature 38 ℃, cell concentration 20 g/L and glucose concentration 20 g/L. Under these conditions, 119 mmol/L (19.75 g/L) of D-PLA with a productivity of 4.94 g/(L·h) was obtained after 4 h transformation with intermittent PPA feeding.
Key words:D-phenyllactic acid; phenylpyruvic acid; recombinant Escherichia coli; biotransformation; response surface optimization
DOI:10.7506/spkx1002-6630-201607017
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)07-0088-05
引文格式:
王颖, 何禾, 胡发根, 等. 响应面法优化重组大肠杆菌全细胞合成D-苯基乳酸[J]. 食品科学, 2016, 37(7): 88-92.
DOI:10.7506/spkx1002-6630-201607017. http://www.spkx.net.cn
WANG Ying, HE He, HU Fagen, et al. Optimization of D-phenyllactic acid production by whole cells of recombinant Escherichia coli using response surface methodology[J]. Food Science, 2016, 37(7): 88-92. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607017. http://www.spkx.net.cn
收稿日期:2015-04-30
基金项目:国家自然科学基金面上项目(31470092);江苏省自然科学基金青年基金项目(BK20130380);江苏省高校自然科学研究面上项目(13KJB550002);江苏省“六大高峰人才”资助计划项目(NY-021);苏州市科技支撑计划项目(SNG201354);常熟市科技计划项目(CN201412);科技部农业科技成果转化资金项目(2013GB2C100176)
作者简介:王颖(1990—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:278478330@qq.com
*通信作者:朱益波(1980—),男,副教授,博士,研究方向为食品生物技术。E-mail:centuryrain@126.com