万 骥,王 丹,傅 婷,李蕊伽,廖海君,唐云明 *
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:新鲜韭菜经匀浆、缓冲液提取、硫酸铵分级沉淀、羧甲基离子交换层析(carboxymethyl-sepharose,CMSepharose)再通过Superdex-200凝胶过滤层析,从而获得电泳纯的β-木糖苷酶。该酶的比活力达到18.25 U/mg,纯化倍数为12.59,回收率为1.83%,分子质量为123.02 kD,亚基分子质量为61.51 kD。通过对β-木糖苷酶的酶学性质研究得到最适温度为65 ℃,最适pH值为4。该酶在25~55 ℃及pH 3.0~5.0的范围内有较好的稳定性;在最适条件下测得其米氏常数(K m)值为0.28 mmol/L;甲醇、乙醇、异丙醇及十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和Ag +对该酶具有抑制作用,Mn 2+和Co 2+对该酶具有一定的激活作用。
关键词:韭菜;β-木糖苷酶;分离纯化;酶学性质
β-木糖苷酶(β-D-xylosidase,EC 3.2.1.37)是一种外切酶,催化水解木糖苷并且以外切方式从非还原性末端水解木寡糖以及木二糖以上的低聚木糖,分解产生木糖 [1]。β-木糖苷酶广泛存在于微生物和高等植物中 [2]。目前,β-木糖苷酶在能源、造纸、化工、环保、食品等行业有很高的应用价值 [3-6]。特别是在食品行业中,通过β-木糖苷酶分解作用得到的木糖可以成为木糖醇的生产原料或者是作为食品配料、风味改善剂 [7]。国内外对β-木糖苷酶的研究主要集中在微生物源,对植物中的β-木糖苷酶的研究较少,特别是对植物中β-木糖苷酶的分离纯化相对更少,限制了β-木糖苷酶的广泛应用。而本实验选取了植物材料韭菜(Allium tuberosum Rottl) [8],为获取植物性来源的β-木糖苷酶提供了一种纯化方法,并对其性质进一步探究,可以为β-木糖苷酶进一步工业生产和研究提供参考。
1.1 材料与试剂
韭菜,购自重庆市北碚区天生路永辉超市。
丙烯酰胺、甲叉-双丙烯酰胺 美国Bio-Rad公司;对硝基苯基-β-D-木糖苷、考马斯亮蓝R-250、牛血清白蛋白 美国Sigma公司;CM-Sephrose、Superdex-200分子质量标准品、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白质标准品 美国GE公司;其余试剂均为国产分析纯。
1.2 仪器与设备
AL204精密电子天平、Seven Easy pH计 瑞士Mettler-Toledo公司;UV-2550型紫外分光光度计日本岛津公司;AKTA Prime plus 美国GE公司;Mill-Q plus纯水仪 美国Millipore公司;GL-21M 高速冷冻离心机 长沙湘仪仪器有限公司;MC4L冷冻干燥机德国Uni-Equip公司。
1.3 方法
1.3.1 粗酶液的制备
取韭菜650.00 g清洗干净,擦干水分后剪碎,加入2.6 L预冷的0.1 mmol/L pH 4.8的乙酸-乙酸钠的提取缓冲液;放入组织匀浆机中匀浆,放置在4 ℃冰箱提取2 h,经8 层纱布过滤得到滤液后,在4 ℃条件下12 000 r/min离心30 min,收集上清液即为粗酶液。
1.3.2 硫酸铵分级沉淀粗酶液
向粗酶液中缓慢加入硫酸铵粉末至20%饱和度,在4 ℃冰箱中静置盐析2 h,4 ℃条件下12 000 r/min离心30 min,收集上清液;再继续缓慢向上清液加入硫酸铵粉末至75%饱和度,在4 ℃冰箱中静置盐析3 h,4 ℃条件下12 000 r/min离心30 min,收集沉淀;沉淀用预冷的100 mmol/L pH4.8乙酸-乙酸钠缓冲液完全溶解,再用10 mmol/L pH 4.8的乙酸-乙酸钠透析液,在4 ℃条件下透析24 h得到酶液并保存。
1.3.3 CM-Sepharose离子交换层析
用100 mmol/L pH 4.8的乙酸-乙酸钠缓冲液平衡层析柱后,取10 mL 1.3.2节中得到的酶液上柱,分别用含有0、0.1、0.2、0.3、0.4、0.5 mol/L NaCl的100 mmol/L pH 4.8的乙酸-乙酸钠缓冲液进行线性梯度洗脱,每管收集5 mL,流速设定为0.5 mL/min,共收集60 管后停止洗脱,测定每管酶活力和蛋白质含量,收集酶活力较高的几管,经过透析后冷冻干燥备用。
1.3.4 Superdex-200 凝胶过滤层析
层析柱用100 mmol/L pH 4.8的乙酸-乙酸钠缓冲液平衡处理后,取1.3.3节中冷冻干燥的β-木糖苷酶用100 mmol/L pH 4.8的乙酸-乙酸钠缓冲液溶解,每次上柱5 mL,用100 mmol/L pH 4.8乙酸-乙酸钠缓冲液进行洗脱,共收集60 管后停止洗脱,每管收集3 mL,流速设定为0.3 mL/min,测定每管酶活力和蛋白含量,收集酶活力较高的几管,通过透析后冷冻干燥得到酶的纯品,置于-20 ℃冰箱中保存备用。
1.3.5 β-木糖苷酶酶活力的测定
按照文献[9]测定方法略作修改:β-木糖苷酶催化对硝基苯基-β-D-木糖苷产生对硝基苯酚,在410 nm波长处有最大吸收峰。通过测定410 nm波长处吸光度来定量测定酶的活力。测定酶活力的反应体系为:0.1 mL的酶液和0.1 mL 10 mmol/L的对硝基苯基-β-D-木糖苷在40 ℃下反应30 min后加入3 mL质量分数为1% Tris溶液终止反应。一个酶单位(U)定义为:在该反应条件下,1 min内催化产生1 μmol对硝基苯基所需要的酶量。
1.3.6 蛋白质质量浓度的测定
采用紫外分光光度法 [10]与Bradford法 [11]对蛋白质质量浓度进行测定。
1.3.7 β-木糖苷酶分子质量的测定和纯度的鉴定
采用凝胶过滤法 [12]对全酶分子质量进行测定,用SDS-PAGE对1.3.4节中得到的酶的纯品进行纯度鉴定和亚基分子质量的测定 [13]。
1.3.8 韭菜β-木糖苷酶部分性质的研究
1.3.8.1 韭菜β-木糖苷酶最适温度和热稳定性
在pH 4.8,25~75 ℃(间隔为5 ℃)条件下测定反应体系中β-木糖苷酶酶活力(以最适温度下测得的酶活力为100%)。将适量的酶液分别放置在pH 4.8和不同温度(25~75 ℃,间隔为10 ℃)条件下,测定保温1、2、3、4、5 h时的酶活力,以原酶液保温0 min在40 ℃条件下测得的酶活力为100%,计算相对酶活力,研究β-木糖苷酶其最适温度以及不同温度下的稳定性。
1.3.8.2 韭菜β-木糖苷酶最适pH值和pH值稳定性
取一定量的酶液分别在40 ℃,pH 3.0~8.0(间隔为1)的缓冲液中保温30 min后测定该酶活力,以最适条件下(反应温度65 ℃)测得的酶活力为100%,计算相对酶活力,研究β-木糖苷酶最适pH值和pH值稳定性。
1.3.8.3 韭菜β-木糖苷酶的K m值测定
设置底物对硝基苯基-β-D-木糖苷浓度为2、3、4、6、10 mmol/L,在最适温度和最适pH值条件下用双倒数作图法(Lineweaver-Burk法) [14]求出β-木糖苷酶的K m值。计算公式如下。
式中:v为酶反应速率/(mmol/(mingL));v max为酶最大反应速率/(mmol/(mingL));[S]为底物浓度/(mol/L);K m为酶促反应速率为最大反应速率一半时的底物浓度/(mol/L)。当pH值、温度、离子强度不变时,K m是恒定的。
1.3.8.4 不同有机溶剂对韭菜β-木糖苷酶活性的影响
分别将甲醇、异丙醇、乙醇与一定量的酶液混合,使混合后有机溶剂的体积分数分别为10%、20%、30%、40%、50%,在40 ℃条件下保温30 min后,在40 ℃条件下分别测其酶活力。以酶液在40 ℃条件下测得酶活力为100%,加入不同有机溶剂后测得的酶活力与之相比得到相对酶活力。
1.3.8.5 不同化合物对韭菜β-木糖苷酶活性的影响
分别配制100 mmol/L含有乙二胺四乙酸(ehylenediaminetetraacetic acid,EDTA)、尿素、抗坏血酸、SDS、硫氰酸钾(KSCN)的母液,按一定的比例与一定量的酶液混合,使溶液中化合物浓度分别为10、20、30、40、50 mmol/L;在40 ℃条件下保温30 min后,在40 ℃条件下分别测酶活力。以酶液在40 ℃条件下测得酶活力为100%,加入不同化合物后测得的酶活力与之相比得到相对酶活力。
1.3.8.6 不同金属离子对韭菜β-木糖苷酶活性的影响
分别配制10 mmol/L含有金属离子Cd 2+、Co 2+、Ag +、Mg 2+、Ca 2+、Mn 2+、Zn 2+、Li +的母液,再按一定比例分别与适量的酶液混合,使溶液中化合物金属离子浓度分别为1、2、3、4、5 mmol/L,在40 ℃条件保温30 min后,在40 ℃条件下分别测酶活力。以酶液在40 ℃条件下测得酶活力为100%,加入不同金属离子后测得的酶活力与之相比得到相对酶活力。
2.1 韭菜β-木糖苷酶的分离纯化
由图1可知,经过硫酸铵分级沉淀再透析后得到的酶液经CM-Sepharose层析,酶活性最高的为28号管,酶活性峰主要集中在22~32号管,收集β-木糖苷酶酶活力较高的几管酶液,透析并经冷冻干燥浓缩后上Superdex-200层析柱,测定酶活性和蛋白质含量。由图2可知,酶活性最高管为30号管。具体分离纯化过程的结果见表1。
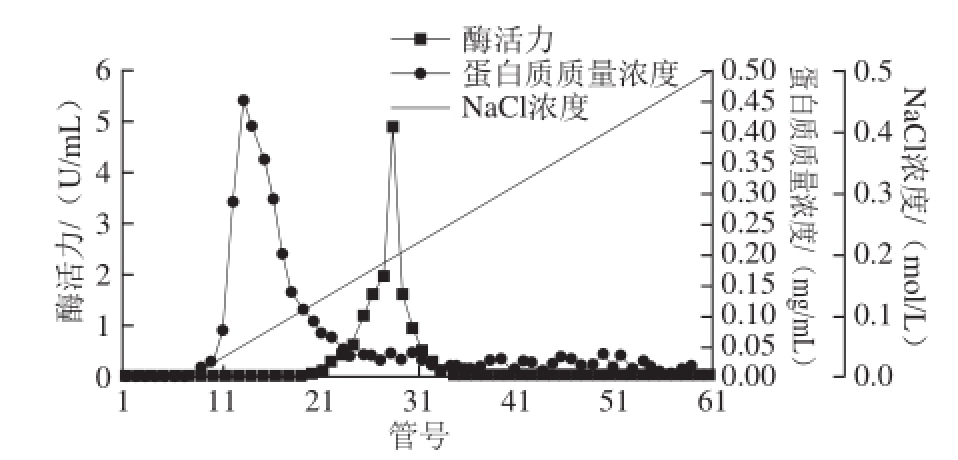
图1 韭菜β-木糖苷酶的CM-Sepharose离子交换柱层析
Fig.1 CM-Sepharose ion-exchange chromatography of β-D-xylosidase from leek
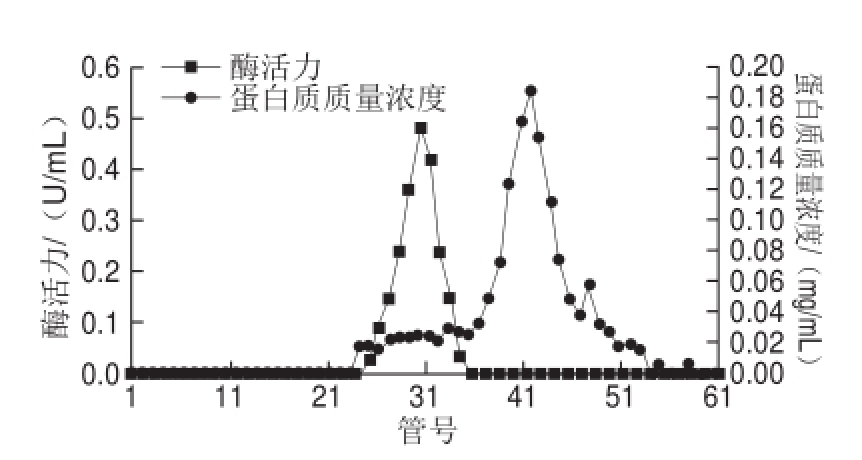
图2 韭菜β-木糖苷酶的Superdex-200凝胶过滤层析
Fig.2 Superdex-200 gel filtration chromatography of β-D-xylosidase from leek
表1 韭菜β-木糖苷酶的分离纯化结果
Table 1 Purification of β-D-xylosidase from leek
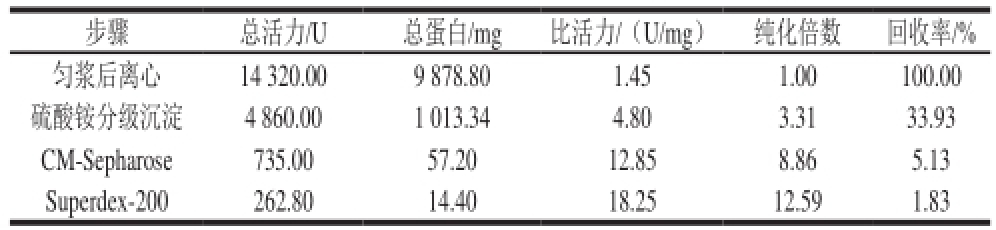
步骤 总活力/U 总蛋白/mg 比活力/(U/mg) 纯化倍数 回收率/%匀浆后离心 14 320.00 9 878.80 1.45 1.00 100.00硫酸铵分级沉淀 4 860.00 1 013.34 4.80 3.31 33.93 CM-Sepharose 735.00 57.20 12.85 8.86 5.13 Superdex-200 262.80 14.40 18.25 12.59 1.83
2.2 韭菜β-木糖苷酶纯度和分子质量
韭菜β-木糖苷酶纯化后,经SDS-PAGE显示单一条带(图3),说明该酶样品达到电泳纯。由图3可知,通过迁移率推算出该酶亚基的分子质量为61.51 kD;而通过凝胶过滤层析法测定的全酶分子质量约为123.02 kD,可以推断出韭菜木糖苷酶是由2 个相同的亚基组成。
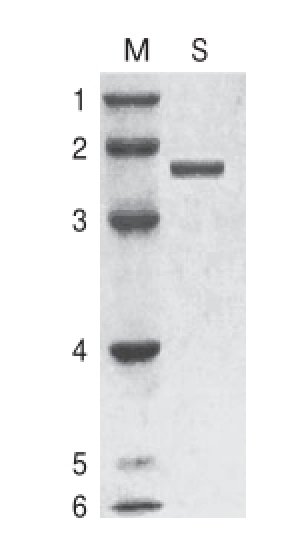
图3 韭菜β-木糖苷酶的SDS-PAGE图谱
Fig.3 SDS-PAGE of purified β-D-xylosidase from leek
M.分子质量标准品;1.兔磷酸化酶B 97.0 kD;2.牛血清白蛋白66.0 kD;3.鸡卵清蛋白45.0 kD;4.牛碳酸酐酶30.0 kD;5.胰蛋白酶抑制剂20.1 kD;6. α-牛乳清蛋白14.4 kD;S.韭菜β-木糖苷酶 61.51 kD。
2.3 韭菜β-木糖苷酶性质
2.3.1 韭菜β-木糖苷酶最适反应温度和热稳定性
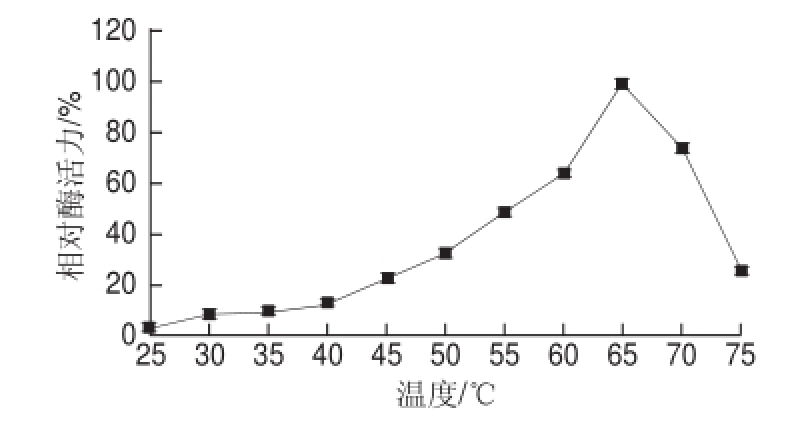
图4 不同温度对韭菜β-木糖苷酶活力的影响
Fig.4 Effect of temperature on the activity of β-D-xylosidase from leek
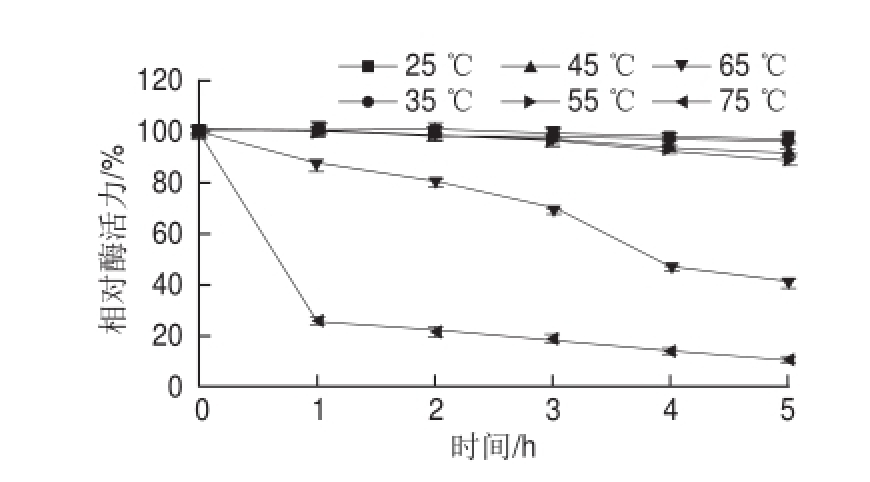
图5 韭菜β-木糖苷酶在不同温度条件下的稳定性
Fig.5 Thermal stability of β-D-xylosidase from leek
由图4可知,韭菜β-木糖苷酶的最适反应温度为65 ℃。由图5可知,在25~55 ℃范围内,韭菜β-木糖苷酶的稳定性较好;超过65 ℃时,随着温度的升高,酶活力明显下降;其中在75 ℃保温2 h后,酶活力几乎全部丧失。
2.3.2 韭菜β-木糖苷酶最适pH和pH值稳定性
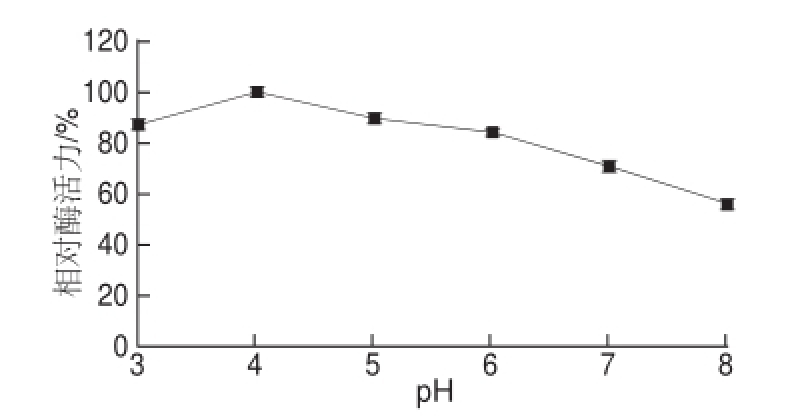
图6 pH值对韭菜β-木糖苷酶活力的影响
Fig.6 Effect of pH on the activity of β-D-xylosidase from leek
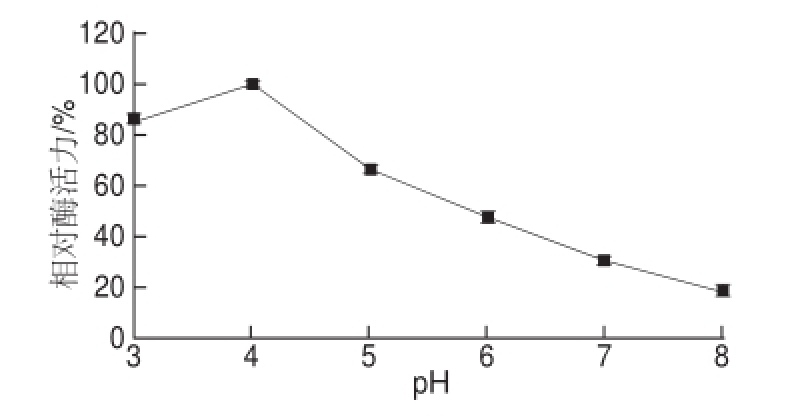
图7 韭菜β-木糖苷酶的pH值稳定性
Fig.7 pH Stability of β-D-xylosidase from leek
由图6可知,韭菜β-木糖苷酶的最适pH值为4.0。由图7可知,在pH 3.0~5.0时酶稳定性较好,酶活力变化趋势比较平缓;当pH>5.0时,酶蛋白分子结构受到破坏,酶活力开始下降。
2.3.3 韭菜β-木糖苷酶K m值
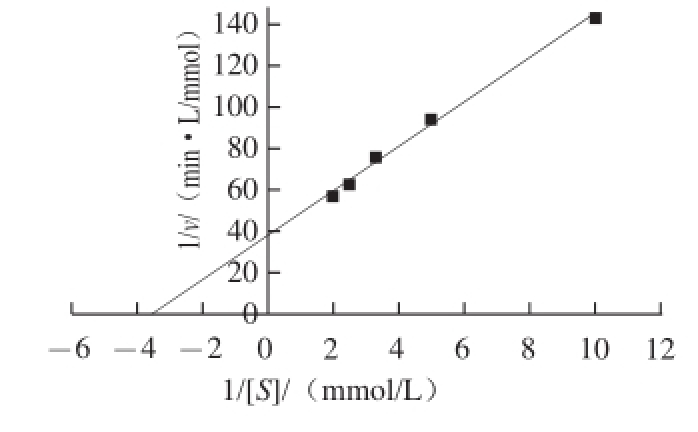
图8 双倒数法测韭菜β-木糖苷酶的米氏常数
Fig.8 K
mdetermination of β-D-xylosidase from leek by Lineweaver-Burk plot
由图8可知,韭菜β-木糖苷酶与对硝基苯基-β-D-木糖苷之间,反应速率与底物浓度的拟合方程为y=10.66x+ 37.71(R 2=0.994),K m的计算结果为0.28 mmol/L。
2.3.4 不同有机溶剂对韭菜β-木糖苷酶活性的影响
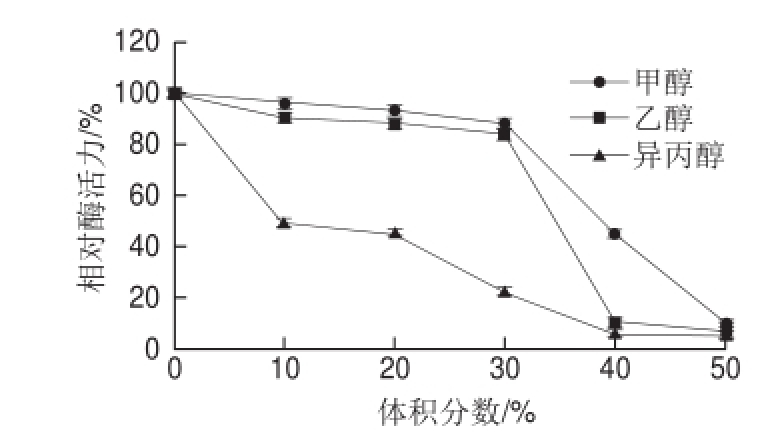
图9 不同有机溶剂对韭菜β-木糖苷酶活力的影响
Fig.9 Effect of organic solvents on the activity of β-D-xylosidase from leek
由图9可知,韭菜β-木糖苷酶在异丙醇、乙醇、甲醇3 种有机溶剂作用下,活性均受到了强烈的抑制,随着有机溶剂体积分数的增加,这种抑制作用增强。特别是异丙醇,当体积分数达到50%,该酶活力仅剩4%,3 种有机溶剂对该酶的抑制强弱依次为异丙醇、乙醇、甲醇。
2.3.5 不同化合物对韭菜β-木糖苷酶活性的影响
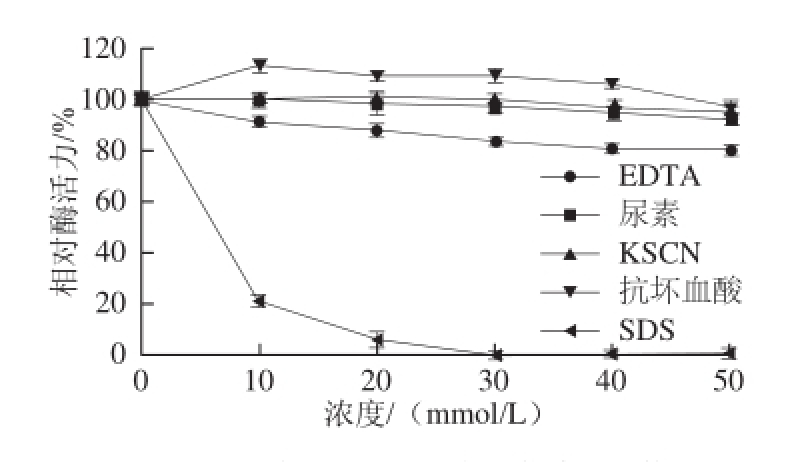
图10 不同化合物对韭菜β-木糖苷酶活力的影响
Fig.10 Effect of various compounds on the activity of β-D-xylosidase from leek
由图10可知,随着化合物浓度的增加,尿素、SDS、KSCN、EDTA对该酶活性都表现出了抑制作用,其中,SDS对该酶的抑制作用非常明显,尿素和KSCN对该酶活性影响不大,EDTA在10~50 mmol/L的浓度范围内对酶活性有明显的抑制作用。而抗坏血酸在10~40 mmol/L的浓度范围内对酶活性有促进作用。
2.3.6 不同金属离子对韭菜β-木糖苷酶活性的影响

图11 不同金属离子对β-木糖苷酶活力的影响
Fig.11 Effect of metal ions on the activity of β-D-xylosidase from leek
由图11可知,不同金属离子对韭菜木糖苷酶活性有不同的影响。一定浓度的Mn 2+和Co 2+对酶活性均有一定的激活作用;Ag +对该酶均有较强的抑制作用,当Ag +浓度达到50 mmol/L时,酶活性几乎完全丧失。其他金属离子对该酶活性基本没有影响。
本实验以韭菜为材料,通过匀浆、硫酸铵沉淀、CM-Sepharose、Superdex-200等步骤后,得到电泳纯的β-木糖苷酶。经过计算回收率(回收率/%=每次酶活力/第一次总活力×100)和纯化倍数(纯化倍数=每次比活力/第一次比活力)分别为1.83%和12.59,与小麦 [8](纯化倍数15和回收率0.2%)相比,纯化倍数略低,但回收率比其要高。纯化倍数低的原因可能是层析过后收集的管数过多,导致杂蛋白混入。
韭菜β-木糖苷酶最适温度为65 ℃,高于草菇的最适温度(55 ℃) [15],与海枣曲霉的最适温度(65 ℃) [16]相同,低于褐色高温单孢菌(82 ℃) [17]和海栖热袍菌(90 ℃) [18]的最适温度。而该酶的最适pH值为4,低于甘蔗(pH 4.85) [19]和L. shinshuensis(pH 7.0) [20]的最适pH值,高于里氏木霉(pH 3.5) [21]最适pH值,说明在不同种属之间的β-木糖苷酶的酶学性质上存在差异。文献中报道β-木糖苷酶的K m值范围在0.08~10 mmol/L之间 [22-23],而韭菜β-木糖苷酶的K m值为0.28 mmol/L,表明β-木糖苷酶与底物亲和力较高。
甲醇、乙醇、异丙醇都对韭菜β-木糖苷酶强烈的抑制作用,推测可能的原因是在有机溶剂的环境中,酶的构象发生了不同的改变,分子构型也有变化,从而导致酶活性降低。SDS和EDTA对韭菜β-木糖苷酶有抑制作用,推测原因是SDS是蛋白变性剂破坏了酶的结构,导致酶活性降低;而EDTA是金属螯合剂,破坏金属离子与活性中心的结合,导致酶活性降低 [24]。一定浓度的Mn 2+和Co 2+对酶活性有一定的激活作用,推测Mn 2+和Co 2+是韭菜β-木糖苷酶催化活性中心的金属离子,该金属离子可以促进底物与酶的结合能力,从而提高酶的活性 [25-26]。Ag +对该酶均有较强的抑制作用,推测可能是Ag +占据了底物与酶的结合位点,改变了酶的构象,从而抑制了酶的活性 [25]。
随着近几年对β-木糖苷酶研究的不断深入,该酶的作用机制逐渐清晰,本实验将韭菜作为β-木糖苷酶的一种植物性来源材料,其酶学性质与已有研究相比有一定差异,由此决定了其不同的实际用途,望以后对该酶的生产工艺作更深入的探索,以期为大规模工业化生产获得价格低廉、高纯度的β-木糖苷酶提供一个可行的参考。
参考文献:
[1] 范园园, 李秀婷, 滕超. 微生物产β-木糖苷酶的研究进展[J].食品研究与开发, 2013, 34(12): 116-121. DOI:10.3969/ j.issn.1005-6521.2013.12.033.
[2] 郑莉, 杨金玲, 朱平, 等. β-木糖苷酶的研究进展[J]. 浙江林业科技, 2005, 25(1): 59-64. DOI:10.3969/j.issn.1001-3776.2005.01.017.
[3] 毛连山, 尤纪雪, 宋向阳, 等. 内切木聚糖酶与木糖苷酶预处理对麦草浆漂白性能的影响[J]. 林产化学与工业, 2003, 23(2): 7-11. DOI:10.3321/j.issn:0253-2417.2003.02.002.
[4] TUNCER M, BALL A S. Co-operative actions and degradation analysis of purified xylan-degrading enzymes from Thermomonospora fusca BD25 on oat-spelt xylan[J]. Journal of Applied Microbiology, 2003, 94(6): 1030-1035. DOI:10.1046/j.1365-2672.2003.01943.x.
[5] PATEL R N. Tour de paclitaxel: biocatalysis for semisynthesis[J]. Annual Reviews in Microbiology, 1998, 52(1): 361-395. DOI:10.1146/ annurev.micro.52.1.361.
[6] 袁小平, 姚惠源. Bacillus subtilis木聚糖酶的纯化及其对小麦麸皮的作用[J]. 无锡轻工大学学报, 2005, 24(1): 19-23. DOI:10.3321/ j.issn:1673-1689.2005.01.005.
[7] 郑善荣. 木糖的性质及其在食品加工中的应用[J]. 食品科学, 1982, 3(2): 53-54.
[8] 汪发瓒, 唐进. 中国植物志: 百合科(第14卷) [M]. 北京: 科学出版社, 1980: 169-252.
[9] CLEEMPUT G, HESSING M, van OORT M, et al. Purification and characterization of a β-D-xylosidase and an endo-xylanase from wheat flour[J]. Plant Physiology, 1997, 113(2): 377-386. DOI:10.1021/ ac970470k.
[10] 刘奥梅, 朱怀荣. 生物化学实验教程[M]. 北京: 人民卫生出版社, 1997: 23-25.
[11] 余瑞元. 生物化学试验原理和方法[M]. 北京: 北京大学出版社, 1994: 171-176.
[12] 胡瑞斌, 李星, 王红杨, 等. 黄瓜过氧化物酶的分离纯化及酶学性质[J].食品科学, 2014, 35(11): 168-173. DOI:10.7506/spkx1002-6630-201411034.
[13] 孙芳, 任美凤, 胡瑞斌, 等. 韭菜酸性磷酸酶的分离纯化及酶学性质[J].食品科学, 2013, 34(17): 187-191. DOI:10.7506/spkx1002-6630-201317040.
[14] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 378-380.
[15] 吴华伟, 戴军, 邵蔚蓝. 草菇中木糖苷酶的分离纯化及其酶学性质[J]. 无锡轻工大学学报, 2004, 23(3): 30-35. DOI:10.3321/ j.issn:1673-1689.2004.03.008.
[16] 曾宇成, 张树政. 海枣曲霉β-木糖苷酶的提纯和性质[J]. 微生物学报, 1993, 33(6): 427-433.
[17] BACHMANN S L, MCCARTHY A J. Purification and characterization of a thermostable β-xylosidase from Thermomonospora fusca[J]. Journal of General Microbiology, 1989, 135(2): 293-299. DOI:10.1099/00221287-135-2-293.
[18] XUE Y, SHAO W. Expression and characterization of a thermostable β-xylosidase from the hyperthermophile, Thermotoga maritima[J]. Biotechnology Letters, 2004, 26(19): 1511-1515. DOI:10.1023/ B:BILE.0000044454.70768.81.
[19] CHINEN I, OOUCHI K, TAMAKI H, et al. Purification and properties of thermostable β-xylosidase from immature stalks of Saccharum officinɑrum L.(sugar cane)[J]. Journal of Biochemistry, 1982, 92(6): 1873-1881.
[20] 栾宏伟, 胡莹, 刘兴宝, 等. 一种来源于Leifsonia shinshuensis DICP 16菌体的β-D-木糖苷酶的分离纯化及其性质[J]. 生物工程学报, 2008, 24(5): 867-873. DOI:10.3321/j.issn:1000-3061.2008.05.024.
[21] 江小华, 朱均均, 余世袁, 等. 里氏木霉β-木糖苷酶的分离纯化, 酶学性质及水解机理研究[J]. 生物质化学工程, 2013, 47(1): 27-32. DOI:10.3969/j.issn.1673-5854.2013.01.004.
[22] HUDSON R C, SCHOFIELD L R, COOLBEAR T, et al. Purification and properties of an aryl β-xylosidase from a cellulolytic extreme thermophile expressed in Escherichia coli[J]. Biochemical Journal, 1991, 273(3): 645-650. DOI:10.1042/bj2730645.
[23] POUTANEN K, PULS J. Characteristics of Trichoderma reesei β-xylosidase and its use in the hydrolysis of solubilized xylans[J]. Applied Microbiology & Biotechnology, 1988, 28(4/5): 425-432. DOI:10.1007/BF00268208.
[24] ZHENG H. Isolation, purification, and characterization of a thermostable xylanase from a novel strain, Paenibacillus campinasensis G1-1[J]. Journal of Microbiology & Biotechnology, 2012, 22(7): 930-938. DOI:10.1007/s12010-014-1153-2.
[25] MCPHILLIPS K, WATERS D M, PARLET C, et al. Purification and characterisation of a β-1,4-xylanase from Remersonia thermophila CBS 540.69 and its application in bread making[J]. Applied Biochemistry & Biotechnology, 2014, 172(4): 1747-1762. DOI:10.1007/s12010-013-0640-1.
[26] MICHELIN M, SILVA T M, JORGE J A, et al. Purification and biochemical properties of multiple xylanases from Aspergillus ochraceus tolerant to Hg 2+ion and a wide range of pH[J]. Applied Biochemistry & Biotechnology, 2014, 174(1): 206-220. DOI:10.1007/ s12010-014-1051-7.
Isolation, Purification and Characterization of β-D-Xylosidase from Leek
WAN Ji, WANG Dan, FU Ting, LI Ruijia, LIAO Haijun, TANG Yunming
*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education, School of Life Science, Southwest University, Chongqing 400715, China)
Abstract:β-D-xylosidase of electrophoretic purity was obtained from leak after homogenization, buffer extraction, ammonium sulfate fractionation precipitation, CM-Sepharose ion-exchange and Superdex-200 gel filtration chromatography. Our results showed that the specific activity of β-D-xylosidase was 18.25 U/mg, purification fold was 12.59, and recovery rate was 1.83% after purification. The relative molecular weight of β-D-xylosidase was approximately 123.02 kD, in which the subunit molecular mass was 61.51 kD. Enzymatic properties of β-D-xylosidase showed that the optimal temperature and pH were 65 ℃ and 4.0, respectively. It was relatively stable in the range of 25–55 ℃ and pH 3.0–5.0, respectively. Furthermore, its K mwas 0.28 mmol/L under the optimum conditions. The activity of β-D-xylosidase could be inhibited by methanol, ethanol, isopropanol and sodium dodecyl sulfate and sodium salt (SDS) as well as Ag +, and activated by Mn 2+and Co 2+.
Key words:leek; β-D-xylosidase; isolation and purification; enzymatic properties
DOI:10.7506/spkx1002-6630-201607020
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2016)07-0104-06
引文格式:
万骥, 王丹, 傅婷, 等. 韭菜β-木糖苷酶的分离纯化与部分性质研究[J]. 食品科学, 2016, 37(7): 104-109. DOI:10.7506/ spkx1002-6630-201607020. http://www.spkx.net.cn
WAN Ji, WANG Dan, FU Ting, et al. Isolation, purification and characterization of β-D-xylosidase from leek[J]. Food Science, 2016, 37(7): 104-109. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607020. http://www.spkx.net.cn
收稿日期:2015-05-17
基金项目:中央高校基本科研业务费专项资金项目(XDJK2016C110)
作者简介:万骥(1990—),男,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:474667398@163.com
*通信作者:唐云明 (1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn