李笑梅,马慧玲
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
摘 要:采用对硝基苯基-β-D-葡萄糖苷法,与黑曲霉相比较考察素食者肠道菌LJ-G1、LJ-Q2产β-葡萄糖苷酶能力,再经单因素、响应面试验对菌种的产酶条件进行优化。结果表明:LJ-G1、LJ-Q2菌株均能产β-葡萄糖苷酶,且LJ-Q2产酶能力高于LJ-G1,与黑曲霉相比较,在发酵时间短于64 h时LJ-G1、LJ-Q2产酶能力高于黑曲霉;LJ-Q2菌种的最优产酶条件为:培养基pH 8.0、培养温度38 ℃、培养时间38 h。在最优条件下进行验证实验,酶活力达到1.70 IU/mL。加入大豆异黄酮原料进行发酵培养,得到游离大豆异黄酮转化率为39.4%。
关键词:素食者;肠道菌;β-葡萄糖苷酶;产酶条件
β-葡萄糖苷酶(β-glucosidase)又叫β-D-葡萄糖苷水解酶,可以将结合型的大豆异黄酮水解为糖基和游离型的大豆苷元 [1-2]。在人体内糖苷型的异黄酮不能直接被吸收,而是先被小肠的β-葡萄糖苷酶水解后脱去糖基进入血液中,才能发挥各种生理作用 [3]。肠道细菌在异黄酮的代谢中起到了关键的作用 [4],部分益生菌还可以将大豆苷元进一步代谢为雌马酚,与苷元相比它与雌激素受体的结合力更强 [5]。
现今产β-葡萄糖苷酶的菌种研究主要集中在酵母 [6]、曲霉、木霉以及细菌内 [7]。其中曲霉被普遍认为是产β-葡萄糖苷酶的优良菌种,尤以黑曲霉的效率最高 [5]。但是黑曲霉发酵到达产酶高峰期要96~144 h [8-9],工业化生产周期较长成本较大。近几年益生菌产β-葡萄糖苷酶发酵大豆异黄酮呈现研究热,有些益生菌 [10-11]不仅可以转化糖苷型大豆异黄酮,还有维持肠道、生殖系统、皮肤等正常菌群,抗感染、助降低胆固醇、抑制癌细胞和增强免疫功能等 [12]。LJ-G1、LJ-Q2两株菌是从素食者粪便中分离出来的具有代谢大豆异黄酮产雌马酚的能力 [13-14],大豆苷元是此代谢过程的中间产物之一 [1],所以推测两种菌株可能有产β-葡萄糖苷酶的能力,而且两种肠道菌的生长曲线表明 [15],指数生长期6~24 h、稳定期24~39 h活菌数达到最大值。据此研究探讨LJ-G1、LJ-Q2肠道菌产β-葡萄糖苷酶特性及产酶条件优化,旨在为丰富产β-葡萄糖苷酶菌种理论知识,也为后续开发以复合生物发酵法制备大豆苷元提供适宜的菌株资源和工艺技术参数,具有实际应用意义。
1.1 菌株与试剂
对照菌株:黑曲霉(Aspergillus niger)由哈尔滨商业大学食品工程学院微生物实验室提供;菌株LJ-G1、LJ-Q2从素食者粪便中分离获得。
对硝基苯酚、柠檬酸 天津市光复精细化工研究所;对硝基苯基-β-D-吡喃葡萄糖苷 上海金穗生物科技有限公司;所有试剂均为分析纯。
1.2 培养基
脑心浸出液培养基(brain heart influsion broth,BHI)青岛海博生物技术有限公司。
麸皮培养基:麸皮0.5%、(NH 4) 2SO 40.4%、K 2HPO 40.3%、MgSO 40.05%、CaCl 20.05%、FeSO 40.005%、ZnCl 20.000 14%、吐温-80 20 μL,pH 4.8。
1.3 仪器与设备
Agilent 1200LC高效液相色谱 美国安捷伦公司;722型光栅分光光度计 上海精密科学仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;超净操作台 上海净化设备有限公司;YQX-II型培养箱 上海新苗医疗机械有限公司。
1.4 方法
1.4.1 产β-葡萄糖苷酶菌株的初筛方法
采用显色反应 [16],判断是否产β-葡萄糖苷酶。用0.1%的刚果红对形成单菌落的平板染色处理10 min,再用1 mol/L的NaCl溶液脱色20 min,如果菌落周围产生透明圈说明该菌有产β-葡萄糖苷酶的能力。
1.4.2 3 种菌产β-葡萄糖苷酶酶活力比较
采用以对硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenylβ-D-glucopyranoside,pNPG)为底物测定酶活力 [17-19]。
1.4.2.1 对硝基苯酚标准曲线的绘制
用pH 5.0的磷酸氢二钠-柠檬酸缓冲溶液配制浓度为0、10、20、30、40、50、60 μmol/L的对硝基苯酚溶液,分别取2 mL上述稀释后的溶液至10 mL比色管中,于45 ℃水浴锅中水浴30 min后,加入4 mL 0.5 mol/L的碳酸钠溶液,混合均匀,于试管架中冷却至室温。在400 nm波长处测定吸光度(A 400 nm),绘制标准曲线。
1.4.2.2 培养基中酶活力的测定
将所试菌种黑曲霉接种于麸皮液体培养基中,28 ℃培养24~144 h;LJ-G1、LJ-Q2肠道菌分别接种于BHI液体培养基中,37 ℃厌氧培养24~144 h,每12 h测一次酶活力。各培养时段的培养基经3 000 r/min离心20 min,得3 种粗酶液,各吸取2 mL于比色管中,再分别加入10 mL pH 5.0的缓冲液,2 mL 50 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷溶液。其余实验过程同1.4.2.1节。参比溶液:以2 mL未发酵培养基代替发酵培养基。
酶活力定义:每分钟水解生成1 μmol/L对硝基苯酚所需要的酶量为一个酶活力单位。按公式(1)计算酶活力 [20-23]。
式中:X为发酵培养基中粗酶液酶活力/(IU/mL);c为根据实际样液的吸光度计算出的对硝基苯酚浓度/(μmol/L);N为试样溶液反应前的总稀释倍数;t为反应时间/min;V为酶反应液用量/mL。
1.4.3 产酶条件单因素试验
在筛选出产酶优势菌株的前提下,进行产酶单因素试验。固定因素水平设定为培养基pH 7.0、接种量5%、培养温度37 ℃、培养时间36 h,在此基础条件下,以酶活力为评价指标,选出适宜因素水平范围。
1.4.3.1 培养基初始pH值对菌种产酶酶活力的影响
在接种量5%、培养温度37 ℃、培养时间36 h条件下,分别考察培养基初始pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0对菌种产酶活力的影响。
1.4.3.2 培养时间对菌种产酶酶活力的影响
在培养基初始pH 7.0、接种量5%、培养温度37 ℃条件下,分别考察培养时间在24、36、48、60、72 h时对菌种产酶活力的影响。
1.4.3.3 培养温度对菌种产酶酶活力的影响
在培养基初始pH 7.0、接种量5%、培养时间36 h条件下,分别考察培养温度为33、35、37、39、41 ℃时对菌种产酶活力的影响。
1.4.3.4 接种量对菌种产酶酶活力的影响
在培养基初始pH 7.0、培养温度37 ℃、培养时间36 h条件下,分别考察1%、3%、5%、7%、9%接种量对菌种酶活力的影响。
1.4.4 响应曲面优化产酶条件
以单因素试验结果为依据,设计培养基初始pH值、培养温度、培养时间三因素做响应曲面试验。以培养基中的酶活力为指标,确定最佳产酶条件。
1.4.5 最优产酶条件下大豆苷元转化率的测定
采用高效液相色谱法测定,固定相为Agilent1200 LC C 18柱(250 mmh4.6 mm,5 μm),流动相为甲醇-水,0 min 20∶80(V/V,下同),40 min 60∶40,进行梯度洗脱,流速为1.2 mL/min,柱温为40 ℃,检测波长为259 nm。将配制成的0.048、0.096、0.144、0.192、0.24 mg/mL系列质量浓度大豆异黄酮混合标准溶液 [18]依次进样。利用峰面积绘制标准曲线。根据公式(2)计算大豆异黄酮含量。
式中:ρ为由各类型大豆异黄酮回归方程得出其质量浓度/(μg/mL);m为样品质量/g;V为定容体积/mL。
将菌液接种培养基中,再加入0.3 g大豆异黄酮粉,在最优条件下发酵培养,然后培养液经3 000 r/min离心30 min,吸取上清液进入高效液相色谱进行检测,与未接菌培养基进行比较,计算游离型大豆异黄酮转化率。
式中:m 1为原料中游离型异黄酮含量/mg;m 2为发酵后游离型异黄酮含量/mg。
2.1 产β-葡萄糖苷酶能力显色反应结果
LJ-G1杆菌、LJ-Q2球菌均产生透明圈,说明两种菌具有产β-葡萄糖苷酶的能力。
2.2 3 种菌产β-葡萄糖苷酶活力比较

图1 3 种菌产β-葡萄糖苷酶酶活力的比较
Fig.1 Comparison of β-glucosidase activities from three strains
由图1可知,3 种菌在培养36 h时均产酶,酶活力最高的是LJ-Q2,达到1.60 IU/mL。此时黑曲霉产酶能力最低,随着培养时间的增加,黑曲霉产酶能力逐渐增加,而LJ-Q2、LJ-G1产酶能力逐渐降低,当培养时间达到64 h时,3 种菌产酶能力相同,之后产酶能力从大到小顺序为黑曲霉>LJ-Q2>LJ-G1。故以下优化试验均用LJ-Q2菌种。
2.3 产酶条件单因素试验
2.3.1 培养基初始pH值对菌种产酶活力的影响
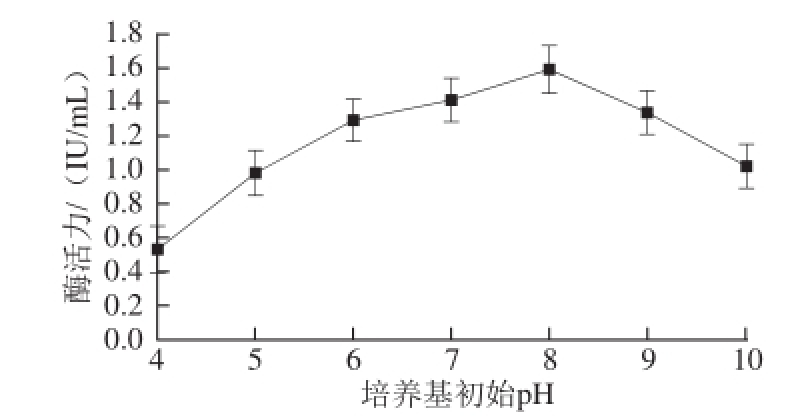
图2 培养基初始pH值对菌种产酶活力的影响
Fig.2 Effect of initial medium pH on β-glucosidase activity
如图2所示,当培养基初始pH值为4.0时菌株产酶能力较低,当pH值为8.0时产酶能力达到最高,之后酶活力开始下降,表明LJ-Q2在培养基初始pH值为7.0~9.0时产酶能力相对较强。
2.3.2 培养时间对菌种产酶活力的影响
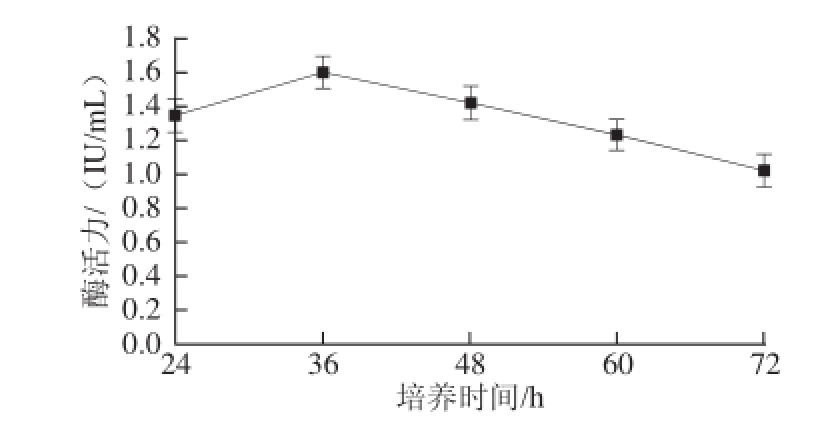
图3 培养时间对菌种产酶活力的影响
Fig.3 Effect of incubation time on β-glucosidase activity
如图3所示,菌株在培养时间达到36 h时产酶能力达到最高,之后酶活力随培养时间的延长而下降,表明该菌的最适培养时间在24~48 h。
2.3.3 培养温度对菌种产酶活力的影响

图4 培养温度对菌种产酶活力的影响
Fig.4 Effect of culture temperature on β-glucosidase activity
如图4所示,培养温度为33 ℃时,菌株产酶能力较低,当培养温度达到39 ℃时菌株产酶能力达到最高,此后随着温度升高酶活力下降,表明该菌最适培养温度为37~41 ℃。
2.3.4 接种量对菌种产酶活力的影响

图5 接种量对菌种产酶活力的影响
Fig.5 Effect of inoculum amount on β-glucosidase activity
如图5所示,接种量1%时,菌株产酶能力较低,随着接种量的增加,菌株产酶能力随之增大,当接种量达到5%时,菌株产酶能力达到最高,此后随着接种量升高酶活力变化不显著(P>0.05),表明该菌种最适接种量为5%。
2.4 响应面试验结果分析
表1 培养条件响应面试验方案设计及结果
Table 1 Response surface design and results for the optimization of culture conditions
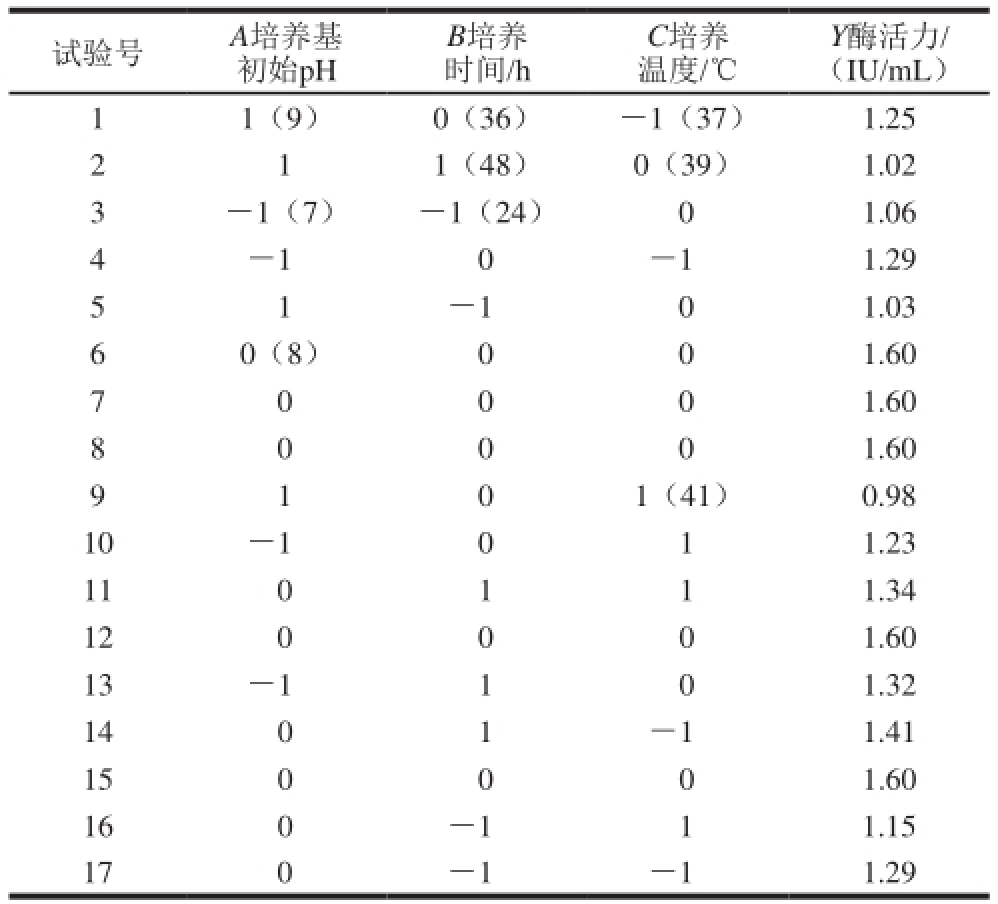
试验号 A培养基初始pH Y酶活力/(IU/mL)1 1(9) 0(36) -1(37) 1.25 2 1 1(48) 0(39) 1.02 3 -1(7) -1(24) 0 1.06 4 -1 0 -1 1.29 5 1-1 0 1.03 6 0(8) 0 0 1.60 7 0 0 0 1.60 8 0 0 0 1.60 B培养时间/h C培养温度/℃0 1(41) 0.98 10 -1 0 1 1.23 11 0 1 1 1.34 12 0 0 0 1.60 13 -1 1 0 1.32 14 0 1 -1 1.41 15 0 0 0 1.60 16 0 -1 1 1.15 17 0 -1 -1 1.29 9 1
培养条件响应面试验各因素和水平见表1,酶活力最高为1.60 IU/mL。产酶条件响应面回归方程及显著性分析见表2。利用Design-Expert软件对表2的响应曲面法试验设计结果的数据进行了多元回归拟合分析,得到回归方程:
Y=1.60-0.077A+0.070B-0.068C-0.068AB-0.053AC+0.018BC-0.30A 2-0.19B 2-0.11C 2
表2 响应面回归方程系数及显著性检验
Table 2 Significance test of all coefficients in the regression model

项 回归系数 自由度 标准误差 F值 P值模型 1.60 1 0.089 253.58 <0.000 1 A -0.077 1 1.08 137.29 <0.000 1 B 0.070 1 1.08 112.00 0.000 4 C -0.068 1 1.08 104.14 0.034 2 AB -0.068 1 1.87 52.07 0.000 2 AC -0.053 1 1.87 31.50 0.000 8 BC 0.018 1 1.87 3.50 0.103 6 A 2-0.30 1 1.47 1 091.75 <0.000 1 B 2-0.19 1 1.47 440.02 <0.000 1 C 2-0.11 1 1.47 148.89 <0.000 1失拟项 0.34 3 0.11 5.92 0.058 1纯误差 0.002 1 4 0.000 8总和 30.24
由表2可知,试验所选用的模型高度显著(P<0.000 1),模型的校正决定系数
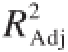 =0.951 1,说明该模型能解释95.11%响应值的变化,相关系数R=0.993 0,说明该模型拟合程度良好,试验误差小,该模型是合适的。从回归方程系数显著性检验可知,模型一次项A、B极显著(P<0.01),C显著(P<0.05);二次项AB、AC极显著(P<0.01),BC不显著(P>0.05),各因素对酶活力的影响程度排序为A>B>C。
=0.951 1,说明该模型能解释95.11%响应值的变化,相关系数R=0.993 0,说明该模型拟合程度良好,试验误差小,该模型是合适的。从回归方程系数显著性检验可知,模型一次项A、B极显著(P<0.01),C显著(P<0.05);二次项AB、AC极显著(P<0.01),BC不显著(P>0.05),各因素对酶活力的影响程度排序为A>B>C。

图6 培养基初始pH值、培养时间、培养温度间的交互作用对酶活力影响的响应面图
Fig.6 Response surface plots for the effect of time, initial medium pH and temperature on β-glucosidase activity
由图6a可知,当培养温度为39 ℃时,随培养时间的延长,酶活力逐渐增加,当培养时间在38 h左右时酶活力达到最大,之后又慢慢下降。随着培养基初始pH值的增加,酶活力增大,在培养基初始pH值为8左右时,酶活力为最大,之后又呈下降趋势。
由图6b可知,当培养时间为39 h时,随着培养基初始pH值的增大,酶活力逐渐增大,当培养基初始pH值在8左右时酶活力达到最大,之后又慢慢下降。随着培养温度的增加,酶活力增大,在培养温度为38 ℃左右时,酶活力为最大,之后又呈下降趋势。
由图6c可知,当培养基初始pH值为8时,随培养时间的延长,酶活力逐渐增大,当培养时间在38 h左右时酶活力达到最大,之后又慢慢下降。随着培养温度的增加,酶活力增大,在培养温度为38 ℃左右时,酶活力为最大,之后又呈下降趋势。
响应面产酶条件优化结果为:培养基初始pH 8.04、培养温度38.31 ℃、培养时间38.21 h。根据实际情况校正值为:培养基pH 8.0、培养温度38 ℃、培养时间38 h,在此条件下测得酶活力为1.7 IU/mL,比未优化前酶活力1.60 IU/mL提高了6.2%。
2.5 发酵培养游离型大豆异黄酮苷元转化率结果
表3 3 种游离型大豆异黄酮含量
Table 3 Contents of three soybean isoflavone aglycons before and after fermentation mg

组别 大豆素 大豆黄素 染料木素未发酵 2.7 0.50 1.6发酵 4.1 0.69 1.9
由表3可知,发酵后3 种游离型大豆异黄酮含量比发酵前高,共增加了1.89 mg,根据公式(3)计算游离型大豆异黄酮转化率为39.4%。
素食者粪便分离到的肠道菌LJ-G1和LJ-Q2有产β-葡萄糖苷酶的能力,在38 ℃培养36 h时、产酶能力比黑曲霉高。LJ-Q2菌株响应面试验产酶条件优化结果为:培养基初始pH 8.0、培养温度38 ℃、培养时间38 h。在此条件下酶活力达到1.70 IU/mL,比未优化前酶活力提高了6.2%。此条件应用于发酵大豆异黄酮其转化率为 39.4%。近几年对肠道菌产β-葡萄糖苷酶多有研究。Raimondi等 [24]研究了双歧杆菌属8 个菌种的22 个菌株转化大豆苷的能力,发现在发酵7 d内,除Bifidobacteria longum MB220和Bifidobacteria longum MB224外,其他菌株都能水解大豆苷,其中Bifidobacteria adolescentis MB116在生长稳定期的早期就有最高的酶活力,酶活力达0.92 U/mg。也有研究表明链球菌 [25]等细菌可转化结合型大豆异黄酮。LJ-Q2肠道菌与黑曲霉相比虽然产酶活力低,但是达到峰值的时间短于黑曲霉108 h,以进一步转化成雌马酚,因此,LJ-Q2肠道菌具有很好的应用前景。接下来的工作将探讨LJ-Q2肠道菌与其他产β-葡萄糖苷酶的肠道益生菌进行复合,以提高产β-葡萄糖苷酶的能力,应用于大豆苷元的制备,这对今后雌马酚的转化也有着重要的意义。
参考文献:
[1] 徐茂军. β-葡萄糖苷酶对豆奶及豆奶粉中大豆异黄酮糖苷化合物的转化作用研究[J]. 中国食品学报, 2005, 5(4): 28-33. DOI:10.3969/ j.issn.1009-7848.2005.04.006.
[2] PYO Y H, LEE T C, LEE Y C. Enrichment of bioactive isoflavones in soymilk fermented with β-glucosidase-producing lactic acid bacteria[J]. Food Research International, 2005, 38: 551-559. DOI:10.1016/j.foodres.2004.11.008.
[3] 孙逊, 姚文, 朱伟云. 肠道大豆异黄酮降解菌研究进展[J].世界华人消化杂志, 2006, 14(10): 236-241. DOI:10.3969/ j.issn.1009-3079.2006.10.008.
[4] TSUNCHIHASHI R, SAKAMOTO S, KODERA M, et al. Microbial metabolism of soy isoflavones by human intestinal bacterial strains[J]. Journal of Natural Medicines, 2008, 62: 456-460. DOI:10.1016/S0020-1693(01)00446-7.
[5] TSANGALIS D, WILCOX G, SHAH N P, et al. Urinary excretion of equol by postmenopausal women consuming soymilk fermented by probiotic bifidobacteria[J]. European Journal of Clinical Nutrition,2007, 61(3): 438-441. DOI:10.1038/sj.ejcn.1602530.
[6] 韩婷, 程钢. β-葡萄糖苷酶以及益生菌生物转化大豆异黄酮糖苷的研究进展[J]. 食品科学, 2010, 31(9): 333-337.
[7] MATEO J J, STEFANO R D. Description of the β-glucosidase activity of wine yeasts[J]. Food Microbiology, 1997, 14(6): 583-591. DOI:10.1006/fmic.1997.0122.
[8] 刘小杰. 黑曲霉ZJ1摇瓶发酵产β-葡萄糖苷酶的研究[J]. 中国食品添加剂, 2004(3): 27-31. DOI:10.3969/j.issn.1006-2513.2004.03.008.
[9] 鲁玮, 岳冬冬, 刘新育. 黑曲霉产β-葡萄糖苷酶的纯化及对中药糖苷类成分的转化[J]. 中国医药工业杂志, 2014, 45(3): 220-223.
[10] 杨守凤, 徐建雄. 基于复合益生菌和枯草芽孢杆菌发酵转化大豆异黄酮的比较研究[J]. 科学试验与研究, 2014(3): 1-4.
[11] 翟清燕, 赵龙玉, 赵凤春, 等. 高产大豆异黄酮糖苷转化酶乳酸菌的筛选及其发酵条件的优化[J]. 食品工业科技, 2014, 35(12): 162-166. DOI:10.13386/j.issn1002-0306.2014.12.026.
[12] 张勇. 世界益生菌产品研究和发展趋势[J]. 中国微生态学杂志, 2009, 21(2): 185-192.
[13] 李笑梅, 贾冰心. 素食者产雌马酚肠道菌的分离与鉴定[D]. 哈尔滨:哈尔滨商业大学, 2014: 50-59.
[14] 李笑梅, 贾姚. 两株素食者肠道菌产雌马酚特性的研究[D]. 哈尔滨:哈尔滨商业大学, 2015: 15-39.
[15] 李笑梅, 贾姚. 素食者产雌马酚肠道菌生长条件优化[J]. 食品科学, 2014, 35(23): 199-203. DOI:10.7506/spkx1002-6630-201423039.
[16] 邓媛. β-葡萄糖苷酶高产菌株的筛选及对大豆异黄酮糖苷转化的应用研究[D]. 西安: 西北大学, 2011: 17-32.
[17] GUNATA Z, DUGELAY I, VALLIER M J, et al. Multiple forms of glycosidases in an enzyme preparation from Aspergillus niger: partial characterization of a β-glucosidase[J]. Enzyme and Microbial Technology, 1997, 21: 39-44. DOI:10.1016/S0141-0229(96)00221-9.
[18] GRIMALDI A, BARTOWAKY E, JIRANEK V. A survey of glycosidase activities of commercial wine strains of Oencoccusoeni[J]. International Journal of Food Microbiology, 2005, 105: 233-244. DOI:10.1016/j.ijfoodmicro.2005.04.011.
[19] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of β-glucosidase activity in selected wild strains of Oencoccusoeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34: 292-296. DOI:10.1016/j.enzmictec.2003.11.013.
[20] 孙艳梅. β-葡萄糖苷酶水解大豆异黄酮糖苷的研究[D]. 哈尔滨: 东北农业大学, 2003: 21-30. DOI:10.7666/d.y506393.
[21] GB/T 23788ü2009保健食品中大豆异黄酮的测定方法 高效液相色谱法[S].
[22] MATEO J J, STEFANO R D. Description of the β-glucosidase activity of wine yeasts[J]. Food Microbiology, 1997, 14(6): 583-591. DOI:10.1006/fmic.1997.0122.
[23] INCECCO N, BARTOWSKY B, KASSARA S, et al. Release of glycosidically bound flavour compounds of chardonnay by Oencoccusoeni during malolactic fermentation[J]. Food Microbiology, 2004, 21: 257-265. DOI:10.1016/j.fm.2003.09.003.
[24] RAIMONDI S, RONCAGLIA L, LUCIA D M, et al. Bioconversion of soy isoflavones daidzin and daidzein by Bifidobɑcterium strains[J]. Applied Microbiology and Biotechnology, 2009, 81(5): 943-950. DOI:10.1007/s00253-008-1719-4.
[25] CHUN J, KIM J S, KIM J H. Enrichment of isoflavone aglycones in soymil by fermentation with single and mixed cultures of Streptococcus infantarius 12 and Weissella sp.4[J]. Food Chemistry, 2008, 109(2): 277-278. DOI:10.1016/j.foodchem.2007.12.024.
Comparison of Two β-Glucosidase-Producing Strains from the Intestinal Tract of Vegetarians and Optimizaiton of Fermentation Conditions for β-Glucosidase Production
LI Xiaomei, MA Huiling
(Key Laboratory of Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China)
Abstract:The β-glucosidase-producing capacity of strains LJ-G1 and LJ-Q2 isolated from the feces of vegetarians was measured using 4-nitrophenol-β-D-glucoside (pNPG) as substrate and compared with that of Aspergillus niger. The fermentation conditions for β-glucosidase production by the selected strain were optimized using combination of single factor method and response surface methodology. The results showed that both intestinal strains were able to produce β-glucosidase, and LJ-Q2 had higher β-glucosidase-producing capacity than LJ-G1. LJ-G1 and LJ-Q2 had higher β-glucosidase-producing capacity than Aspergillus niger in 64 h of fermentation. The optimal fermentation conditions for β-glucosidase production were determined as follows: culture medium pH, 8.0; temperature, 38 ℃; and time, 38 h. The experimental value of β-glucosidase activity produced under the optimized conditions was 1.70 IU/mL. The fermentation process could convert 39.4% of soybean isoflavones into aglycones.
Key words:vegetarians; intestinal bacteria; β-glucosidase; fermentation conditions for β-glucosidase production
DOI:10.7506/spkx1002-6630-201607023
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)07-0123-05
引文格式:
李笑梅, 马慧玲. 两株素食者肠道菌产β-葡萄糖苷酶考察及产酶条件优化[J]. 食品科学, 2016, 37(7): 123-127.
DOI:10.7506/spkx1002-6630-201607023. http://www.spkx.net.cn
LI Xiaomei, MA Huiling. Comparison of two β-glucosidase-producing strains from the intestinal tract of vegetarians and optimizaiton of fermentation conditions for β-glucosidase production[J]. Food Science, 2016, 37(7): 123-127. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607023. http://www.spkx.net.cn
收稿日期:2015-06-18
基金项目:黑龙江省科技厅应用技术项目(G013B203);黑龙江省自然科学基金项目(C201201);黑龙江省高校科技创新团队建设计划项目(2010td04)
作者简介:李笑梅(1960—),女,教授,本科,研究方向为食品科学。E-mail:lixm0451@163.com