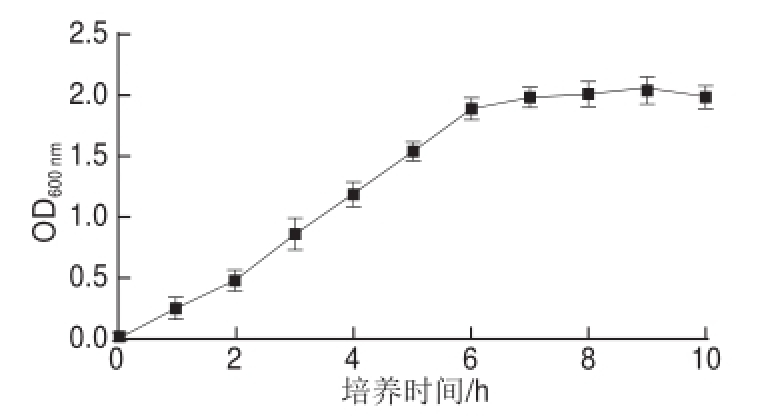
图1 工程菌生长曲线
Fig.1 Growth curve of the engineered strain
毕云枫,姜仁凤,何 舒,任大勇,徐琳琳,沈明浩 *
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:目的:用D-乳糖醇代替异丙基-β-D-巯基半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)作为诱导剂,诱导重组葡萄糖苷酶的表达。方法:首先通过单因素试验探讨D-乳糖醇浓度、诱导时间及诱导温度对重组葡萄糖苷酶表达的影响,从而确定最佳影响因素的水平值,然后在单因素试验的基础上采用三因素三水平的响应面法对重组葡萄糖苷酶表达进行优化分析,依据回归分析方法确定最佳诱导工艺条件。结果:最佳诱导工艺条件为D-乳糖醇的诱导终浓度1.0 mmol/L、诱导时间7.0 h、诱导温度34 ℃。结论:D-乳糖醇可以代替IPTG作为一种高效的lac及其衍生物的启动子基因工程重组蛋白的理想诱导剂。
关键词:α-葡萄糖苷酶;诱导;响应面;D-乳糖醇
异丙基-β-D-巯基半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG),是一种高效的lac及其衍生物的启动子诱导剂,是β-半乳糖苷酶的活性诱导物质。它可以直接进入大肠杆菌细胞内部,发挥诱导作用,使蛋白构象变化,导致阻遏蛋白与O序列解离、发生转录,从而发挥诱导作用。IPTG是一种非代谢性的诱导物,不会被菌体所消耗,只需要极少量的存在就能稳定地诱导乳糖启动子的转录 [1]。但其具有潜在的毒性,对菌体生长有一定的抑制作用,且价格较昂贵 [2-3]。而乳糖是一种二糖,没有毒性,具有天然诱导乳糖操纵子的作用,但乳糖本身作为一种碳源可以被菌体代谢利用,因此需要不断地向培养基中加入乳糖,因而对于菌体的生理及代谢也有一定程度的影响 [4]。另外,乳糖需要借助于乳糖透过酶(permase)的作用进入细胞,然后经过β-半乳糖苷酶的作用转化为异乳糖(allolactose)才能起到诱导剂的作用 [5]。同IPTG相比,乳糖作为诱导剂对于乳糖操纵子的诱导调控过程更为复杂 [6-7]。虽然乳糖诱导重组蛋白表达的应用研究有较多报道 [8-10],但很多都表明乳糖诱导效果不及IPTG。所以李攀峰等 [11]在2014年进一步研究了IPTG与乳糖联合诱导表达的优化,但诱导表达效果也不及单独使用IPTG诱导。目前国内外对重组菌诱导剂研究最多的也只有IPTG和乳糖 [12-15],而它们本身及在诱导过程中存在很多缺点,因此,寻找一种更适宜的替代物非常有必要。
由于D-乳糖醇(4-O-β-D-吡喃半乳糖基-D-葡糖醇)化学结构与IPTG相似,极易溶于水,微溶于乙醇,同时稳定性较强,在酸、碱、光照及高温条件下仍能保持稳定性,安全性较高,当前作为一种食品添加剂应用于食品工业;其次,价格便宜、来源广泛。所以本研究以D-乳糖醇为诱导剂来诱导重组α-葡萄糖苷酶的表达。响应面分析法由Box及其合作者于20世纪50年代提出并逐步完善,它以回归方程作为函数估算的工具,将多因子试验中因素与试验结果的关系用多项式拟合,将因子与实验结果的关系函数化 [16-18],因此,本研究将探讨各因子与响应面值之间、因子与因子之间的相互关系,并进行优化。本实验将利用α-葡萄糖苷酶转化进大肠杆菌中进行体外表达后的重组酶,研究通过D-乳糖醇作为诱导剂诱导α-葡萄糖苷酶在大肠杆菌中的高效表达,并利用响应面法对D-乳糖醇诱导条件进行优化。
1.1 菌种
按文献[19]的方法将新阿波罗栖热袍菌(Thermotoga neapolitana DSM 4359)α-葡萄糖苷酶基因(注册号为lcl2740)连接到pET-28a(+)质粒载体,转化进大肠杆菌BL21(DE3),-80 ℃冻存。此工程菌为卡那霉素抗性。
1.2 试剂与仪器
胰蛋白胨(tryptone)和酵母提取物(yeast extract)英国Oxoid公司;硫酸卡那霉素(Kan) 北京鼎国昌盛生物技术有限责任公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;海藻糖 美国Sigma公司;其他试剂均为国产分析纯。
JYP2-II超声波细胞粉碎机 宁波新芝生物科技股份有限公司;岛津1800紫外分光光度计 日本岛津公司。
1.3 LB培养基的制备
LB液体培养基的配制:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,用1 mmol/L的NaOH调节pH值至7.0,于121 ℃灭菌20 min后备用。LB固体培养基的制备:在液体培养基的基础上加入2 g/100 mL的琼脂,于121 ℃灭菌20 min后,倒入平板。
1.4 菌种的活化及扩培
取保存于-80 ℃的工程菌在LB固体培养基划线,37 ℃恒温箱过夜培养。然后取活化的工程菌,挑取单菌落于液体培养基中,200 r/min、37 ℃过夜振荡培养。
1.5 工程菌的生长曲线
用LB液体培养基培养工程菌,每隔1 h取样用分光光度法测定菌体生长的OD 600 nm值。以工程菌菌液培养的时间为横坐标,以各时间点所测得菌液平均OD 600 nm值为纵坐标,绘制工程菌的生长曲线。
1.6 D-乳糖醇诱导表达
1.6.1 工程菌最适诱导浓度的确定
在工程菌生长的菌液OD 600 nm值为0.4~0.6时,分别加入不同浓度的D-乳糖醇,使其终浓度分别达到0.4、0.6、0.8、1.0、1.2、1.4 mmol/L,然后在32 ℃振荡培养,诱导6 h。通过相对酶活力的测定,确定最适的诱导浓度。
1.6.2 最适诱导时间的确定
在工程菌生长的菌液OD 600 nm值达到0.4~0.6时,加入最适浓度的诱导物,在32 ℃分别诱导培养4、5、6、7、8 h。通过相对酶活力的测定,确定最适的诱导时间。
1.6.3 最适诱导温度的确定
在工程菌生长的菌液OD 600 nm值达到0.4~0.6时,加入最适诱导物,在最适的诱导时间下,分别在30、32、34、36、38 ℃诱导培养。通过相对酶活力的测定,确定最适的诱导温度。以上测定值都做3 个平行样。
1.6.4 α-葡萄糖苷酶的提取及活力测定
诱导后的菌液经7 000hg离心5 min,取离心后菌体沉淀3~4 次反复冻融后,用pH 5.0的醋酸-醋酸钠缓冲溶液溶解并超声波破碎,然后经12 000hg离心机离心取上清液,得粗酶液。酶活力测定的反应体系为:60 μL pH 5.0的醋酸-醋酸钠缓冲液、20 μL终浓度为5 mmol/L海藻糖为底物和20 μL粗酶液均匀混合,60 ℃水浴2 h。依据葡萄糖测定试剂盒测酶活力,计算相对酶活力。酶活力单位定义:在上述条件下,每分钟产生1 μmol葡萄糖所需要的酶量。相对酶活力是与最大酶活力的比值,并定义最大酶活力为100%。
1.7 响应面法试验设计
在单因素试验基础上,运用Design-Expert统计软件,以诱导剂D-乳糖醇浓度(A)、诱导时间(B)、诱导温度(C)为主要考察因素,相对酶活力为响应值(Y),进行三因素三水平的响应面试验分析。
1.8 D-乳糖醇与IPTG诱导表达 [20-21]
在工程菌生长的菌液OD 600 nm值达到0.4~0.6时,分别加入最适诱导浓度1.0 mmol/L的D-乳糖醇在34 ℃条件下诱导7 h,和0.8 mmol/L的IPTG在30 ℃诱导4 h,诱导重组α-葡萄糖苷酶的表达。
2.1 工程菌的生长曲线

图1 工程菌生长曲线
Fig.1 Growth curve of the engineered strain
由图1可知,工程菌在0~2 h为迟缓期,工程菌适应新环境,生长速率缓慢;3~6 h为对数生长时期,此时营养物质较充分,工程菌呈对数快速增长;7~9 h为稳定期,由于培养基中的营养物质不断地被消耗,工程菌新陈代谢产生的毒性物质的积累等因素的影响,工程菌生长速率逐渐下降,而死亡的细菌开始逐渐增加,增殖数与死亡数渐渐趋于平衡,细菌总数处于稳定状态;10 h后为衰亡期,营养物质减少,衰亡速率超过增长速率,细菌总数呈下降趋势。
2.2 单因素试验结果
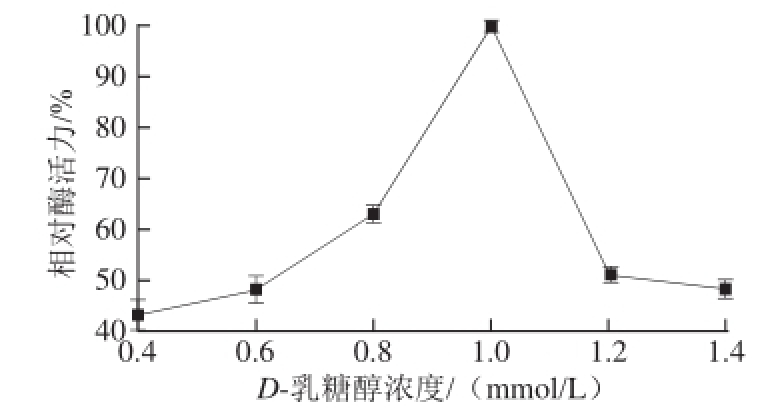
图2D-乳糖醇浓度对α-葡萄糖苷酶活力的影响
Fig.2 Effect of lactitol concentration on α-glucosidase activity
由图2可知,在D-乳糖醇在0.4~1.0 mmol/L浓度范围内,相对酶活力随浓度的增加而不断升高,1.0 mmol/L时相对酶活力最大,所以确定最佳诱导浓度为1.0 mmol/L。当浓度继续增大时,相对酶活力反而下降。说明工程菌对D-乳糖醇的诱导效应是十分敏感的,较低的浓度即能启动目的基因高效的表达,而高浓度反而抑制酶的表达。
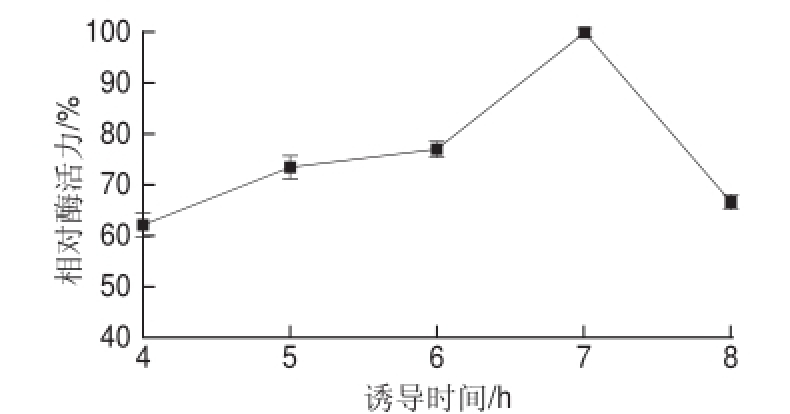
图3 诱导时间对α-葡萄糖苷酶活力的影响
Fig.3 Effect of induction time on α-glucosidase activity
由图3可知,诱导时间在4~7 h范围内,相对酶活力随时间的延长而不断增加,7 h时相对酶活力最大,当诱导时间继续增加时,相对酶活力却下降。由于诱导时间越长目的基因的表达量越多,就越容易形成包涵体 [22],从而导致相对酶活力下降。故选择7 h为最佳诱导时间。

图4 诱导温度对α-葡萄糖苷酶活力的影响
Fig.4 Effect of induction temperature on α-glucosidase activity
由图4可知,诱导温度在30~34 ℃范围内,相对酶活力随温度的增加而不断增加,34 ℃时相对酶活力最大,当温度继续增加时,相对酶活力急剧下降。诱导温度为34 ℃时目的基因表达量最高。这是由于温度较低时,菌体生长速率和反应速率较慢,从而增加外源蛋白的正确组装和折叠,更多地形成可溶性的、有活性的产物 [23]。
2.3 响应面试验结果分析
在单因素试验结果的基础上,采用Box-Behnken试验设计,根据三因素三水平方式分别进行17 组试验,其中12 个为析因试验,5 个为中心试验以估计误差。结果见表1。
表1 响应面试验设计与结果
Table 1 Experimental design and results for response surface analysis
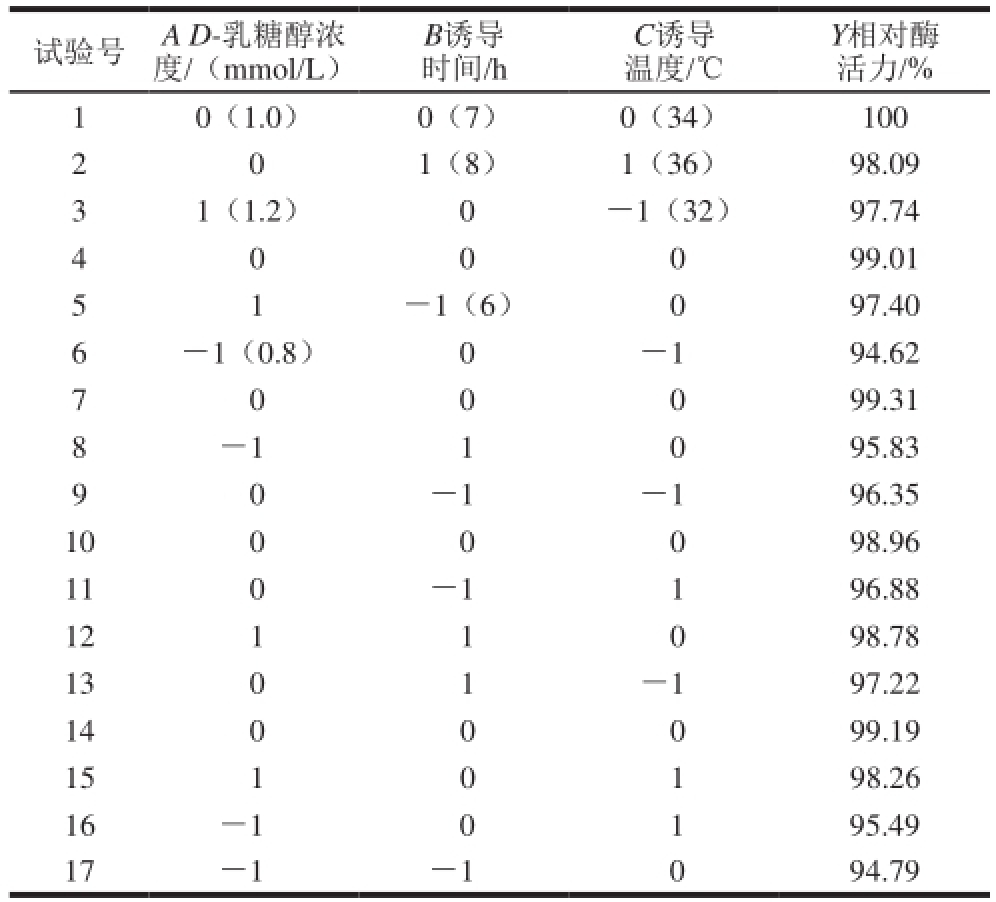
试验号 A D-乳糖醇浓度/(mmol/L)Y相对酶活力/% 1 0(1.0) 0(7) 0(34) 100 2 0 1(8) 1(36) 98.09 3 1(1.2) 0 -1(32) 97.74 4 0 0 0 99.01 B诱导时间/h C诱导温度/℃5 1 -1(6) 0 97.40 6 -1(0.8) 0 -1 94.62 7 0 0 0 99.31 8 -1 1 0 95.83 9 0-1 -1 96.35 10 0 0 0 98.96 11 0 -1 1 96.88 12 1 1 0 98.78 13 0 1 -1 97.22 14 0 0 0 99.19 15 1 0 1 98.26 16 -1 0 1 95.49 17 -1 -1 0 94.79
根据表1中Box-Behnken设计的试验结果,运用Design-Expert软件对表中结果进行二次回归分析,得到二次回归方程:Y=-263.488+107.333A+4.065B+16.063C+0.542AB-0.218AC+0.175BC-47.169A 2-1.024B 2-0.228C 2。
回归方程二次项A 2、B 2、C 2的系数均为负数,说明回归方程存在稳定点,即最大值点。回归方程的分析结果和回归方程方差分析结果分别见表2、3。
表2 回归模型分析结果
Table 2 Significance test of all coefficients in regression model
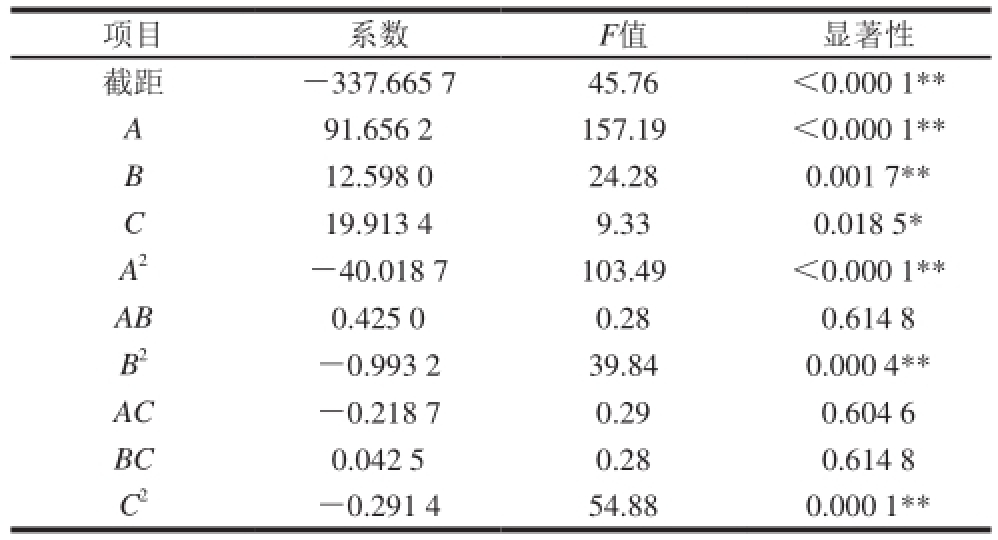
注: * *. P<0.01,表示差异极显著; *. P<0.05,表示差异显著。表3同。
项目 系数 F值 显著性截距 -337.665 7 45.76 <0.000 1 * *A 91.656 2 157.19 <0.000 1 * *B 12.598 0 24.28 0.001 7 * *C 19.913 4 9.33 0.018 5 *A 2-40.018 7 103.49 <0.000 1 * *AB 0.425 0 0.28 0.614 8 B 2-0.993 2 39.84 0.000 4 * *AC -0.218 7 0.29 0.604 6 BC 0.042 5 0.28 0.614 8 C 2-0.291 4 54.88 0.000 1 * *
表3 回归模型方差分析
Table 3 Analysis of variance of regression model
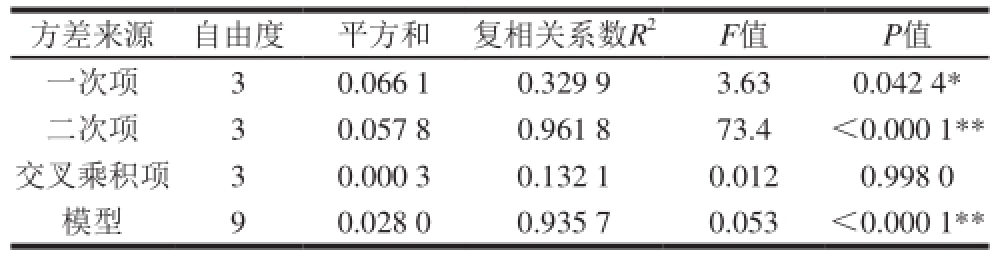
方差来源 自由度 平方和 复相关系数R 2F值 P值一次项 3 0.066 1 0.329 9 3.63 0.042 4 *二次项 3 0.057 8 0.961 8 73.4 <0.000 1 * *交叉乘积项 3 0.000 3 0.132 1 0.012 0.998 0模型 9 0.028 0 0.935 7 0.053 <0.000 1 * *
由表2、3可知,模型P<0.000 1,表明回归模型极显著。方程中除AB、AC、BC交互项不显著外,C为显著,其他各项对Y相对酶活力影响都是极显著。分析结果同时也表明试验因素对响应值不是简单的线性关系,二次项对响应值也有很大的影响 [24-26]。模型的复相关系数R 2=0.964 6,表明96.46%的实验数据可用该模型进行解释,说明方程拟合较好,可靠性较高。变异系数值越低,显示实验稳定性越好,本实验变异系数达到0.33%,较低,说明试验点数据的这种拟合方法合理、可靠。
2.4 响应面各因素间的交互作用
根据表2的回归模型分析可知,3 个因素对酶活力均具有显著影响。在保持1 个因素为最优条件下,其他2 个因素与响应值关系用三维坐标图表示,可以直观反映各因素对响应值的影响关系,见图5。
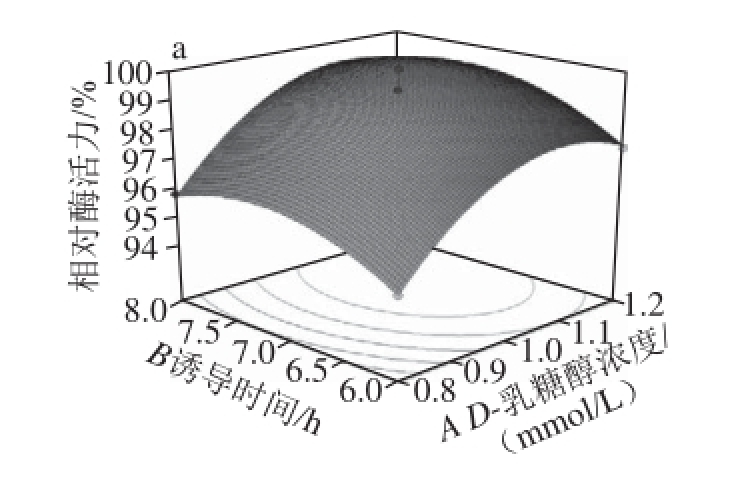

图5 各因素交互作用的响应面和等高线图
Fig.5 Contour and response surface plots for the interactive effect of three factors on α-glucosidase activity
图5 直观地给出了各个因素交互作用的响应面和等高线分析图,其中各图表示A、B、C中任意一个变量取零水平时,其余两个变量对酶活力的交互影响,从响应面的最高点和等高线可以看出,在所选的范围内存在极值,既是响应面的最高点,同时也是等值线最小椭圆的中心点 [27-29]。图5a表明,A、B的交互作用较强,实际值较大的A和B,反而使得响应值相对酶活力有减小的趋势,可能由于时间长导致目的基因蛋白形成较多的包涵体。当诱导剂D-乳糖醇浓度在0.8~1.2 mmol/L、诱导时间在6~8 h时,随着D-乳糖醇浓度和诱导时间的增加,相对酶活力不断增加,D-乳糖醇浓度高于1.0 mmol/L,时间高于7 h时相对酶活力下降。图5b表明,AC的交互作用在因素B实际值为7 h以上时较强,也表现出与图5a相同的现象。当D-乳糖醇浓度在0.8~1.2 mmol/L、诱导温度在32~36 ℃时,随着D-乳糖醇浓度和诱导温度的增加,相对酶活力不断增加,D-乳糖醇浓度高于1.0 mmol/L、诱导温度高于34 ℃时,相对酶活力开始下降。图5c表明,BC的交互作用不大,在因素B实际值为7 h以上因素C很大的范围内都能够得到较大的响应值,当诱导时间在6~8 h、诱导温度在32~36 ℃时,随着诱导时间和诱导温度的不断增加,相对酶活力不断增加,诱导时间高于7 h,诱导温度高于34 ℃时,相对酶活力开始下降。所以从响应面图和等高线分析图可以确定其最佳D-乳糖醇浓度为1.0 mmol/L、诱导时间为7 h、诱导温度为34 ℃。
2.5 D-乳糖醇与IPTG诱导表达效果比较
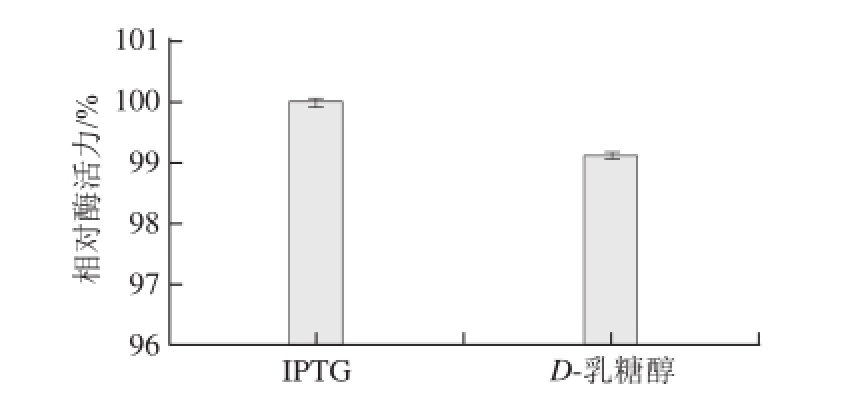
图6 IPTG与D-乳糖醇对α-葡萄糖苷酶活力的影响效果比较
Fig.6 Effect of IPTG versus D-lactitol on α-glucosidase activity
图6 为IPTG和D-乳糖醇在最优表达条件(D-乳糖醇诱导浓度为1.0 mmol/L、诱导时间为7 h、诱导温度为34 ℃)下的蛋白表达结果,在相同的酶液终体积下,D-乳糖醇为诱导剂所诱导的葡萄糖苷酶为IPTG最佳条件下诱导后的相对酶活力的99.13%,相差极其微小,经方差分析|t|=0.369 0<t 0.05(4)=2.776,说明用D-乳糖醇做诱导剂与IPTG做诱导剂无显著性差异,所以可以用D-乳糖醇替代IPTG做重组蛋白表达的诱导剂。
乳糖操纵子作为一种可诱导的负调控型操纵子,是目前研究的最为详尽的基因操纵子,已被广泛应用于大肠杆菌工程菌株的构建中。IPTG和乳糖是文献报道最多的诱导剂。其中IPTG诱导条件简单,在大肠杆菌中不被代谢和降解,效果持久稳定。但IPTG存在潜在的毒性且价格昂贵,因而只作为实验室少量蛋白表达时的诱导剂 [30];乳糖作为原核细胞的常用碳源,是乳糖操纵子控制细菌自身系列酶的天然底物,对乳糖操纵子具有天然的诱导作用,且价廉易得、无毒无害;但由于乳糖可以被细胞作为碳源代谢利用,诱导过程需要多次添加,操作麻烦,诱导效果不及IPTG,且诱导机制比IPTG更为复杂,诱导条件不易掌握,需要对菌体生长及诱导条件进行更为精细的研究及优化 [31]。
本实验通过响应面法优化了D-乳糖醇诱导重组α-葡萄糖苷酶的表达条件。得到重组α-葡萄糖苷酶的最佳诱导表达条件为:诱导剂D-乳糖醇浓度1.0 mmol/L、诱导时间7 h、诱导温度34 ℃。在最适条件下,通过比较D-乳糖醇与IPTG对重组蛋白的诱导表达,发现酶的诱导量几乎无差异。D-乳糖醇与IPTG的化学结构相似,且无毒无害,价廉易得,不被菌体所降解,诱导过程简便易行。所以D-乳糖醇完全可以代替IPTG作为lac及其衍生物的启动子诱导剂。对于各种利用原核表达系统进行重组蛋白的实验研究及大规模工业生产,均具有十分重要的现实意义和应用价值。
参考文献:
[1] MARBACH A, BETTENBROCK K. Lac operon induction in Escherichia coli: systematic comparison of IPTG and TMG induction and influence of the transacetylase LacA[J]. Journal of Biotechnology,2012, 157(1): 82-88. DOI:10.1016/j.jbiotec.2011.10.009.
[2] 陈亮, 任随周, 许枚英, 等. 乳糖替代IPTG诱导脱色酶TpmD基因在大肠杆菌中的高效表达[J]. 微生物学通报, 2009, 36(4): 551-556.
[3] WENG Y P, HSU F C, YANG W S, et al. Optimization of the overexpression of glutamate mutase S component under the control of T7 system by using lactose and IPTG as the inducers[J]. Enzyme and Microbial Technology, 2006, 38(3/4): 456-469. DOI:10.1016/ j.enzmictec.2005.07.002.
[4] 张毅, 屈贤明, 杨胜利. 乳糖作为诱导剂对重组目的蛋白表达的影响[J]. 生物工程学报, 2000, 16(4): 464-468. DOI:10.3321/ j.issn:1000-3061.2000.04.011.
[5] JOBE A, BOURGEOIS S. Lac repressor-opreator interaction: VI. The natural inducer of the lac operon[J]. Journal of Molecular Biology, 1972, 69(3): 397-404.
[6] 丁岚, 侯晓彦, 王小红, 等. 乳糖诱导葡萄球菌肠素A基因在大肠杆菌中的表达[J]. 食品与微生物技术学报, 2011, 30(2): 255-256.
[7] FERNÁNDEZ-CASTANÉ A, VINE C E, CAMINAL G, et al. Evidencing the role of lactose permease in IPTG uptake by Escherichia coli in fed-batch high cell density cultures[J]. Journal of Biotechnology, 2012, 157(3): 391-398. DOI:10.1016/j.jbiotec.2011.12.007.
[8] 李兆鹏, 张栩, 徐斌, 等. 重组大肠杆菌高密度发酵中乳糖诱导表达hBLyS[J]. 过程工程学报, 2005, 5(4): 446-449. DOI:10.3321/ j.issn:1009-606X.2005.04.020.
[9] 李春丽, 陈其新, 何国庆. 乳糖诱导植物甜蛋白des-pGlu1-Brazzein在大肠杆菌中的表达[J]. 生物工程学报, 2006, 22(6): 1021-1025. DOI:110.3321/j.issn:1000-3061.2006.06.026.
[10] 卫红飞, 万敏, 杨世杰, 等. 不同诱导剂对工程菌发酵及重组蛋白表达的影响[J]. 中国生物制品学杂志, 2005, 18(6): 518-525. DOI:10.3969/j.issn.1004-5503.2005.06.027.
[11] 李攀峰, 张洪斌, 胡雪芹. IPTG与乳糖联合诱导重组大肠杆菌右旋糖酐蔗糖酶表达[J]. 食品科学, 2014, 35(1): 185-188. DOI:10.7506/ spkx1002-6630-201401036.
[12] 任增亮, 堵国成, 陈坚, 等. 大肠杆菌高效表达重组蛋白策略[J].中国生物工程杂志, 2007, 27(9): 103-109. DOI:10.3969/ j.issn.1671-8135.2007.09.019.
[13] NGUYEN Q A, SCHUMANN W. Use of IPTG-inducible promoters for anchoring recombinant proteins on the Bacillus subtilis spore surface[J]. Protein Expression and Purification, 2014, 95(3): 67-76. DOI:10.1016/j.pep.2013.11.018.
[14] KILIKIAN B V, SUÁREZ I D, LIRIA C W, et al. Process strategies to improve heterologous protein production in Escherichia coli under lactose or IPTG induction[J]. Process Biochemistry, 2000, 35(9): 1019-1025. DOI:10.1016/S0032-9592(00)00137-0.
[15] 邓永康, 吴民泸, 刘盛邦, 等. 乳糖诱导重组尿酸酶基因在大肠杆菌中的表达[J]. 中国生物工程杂志, 2009, 29(7): 74-79.
[16] 王敏, 李市场, 刘红霞, 等. 响应面优化粘红酵母油脂提取工艺的研究[J]. 中国油脂, 2010, 35(4): 7-11.
[17] XYNOS N, PAPAEFSTATHIOU G, GIKAS E, et al. Design optimization study of the extraction of olive leaves performed with pressurized liquid extraction using response surface methodology[J]. Separation and Purification Technology, 2013, 122(3): 323-330. DOI:10.1016/j.seppur.2013.10.040.
[18] 赵强, 索有瑞, 李天才, 等. 响应面法优化苦荞皮中总黄酮超声波提取工艺[J]. 食品科学, 2014, 35(16): 64-70. DOI:10.7506/spkx1002-6630-201416012.
[19] 陈丽丽, 陈萍, 华欣春, 等. Thermotogɑ neɑpolitɑnɑ α-葡萄糖苷酶基因克隆及表达[J]. 食品与发酵科技, 2011, 47(6): 58-62. DOI:10.3969/j.issn.1674-506X.2011.06-014.
[20] 李春丽, 徐雪丽, 郑振宇, 等. 人β防御素3和植物des-pGLu1-brazzein融合蛋白表达菌的诱导条件优化及其活性分析[J]. 生物工程学报, 2008, 24(3): 485-490.
[21] 毕云枫, 刘薇薇, 李彦阳, 等. Thermotoga neapolitana葡萄糖苷酶基因的克隆、表达及其酶学性质[J]. 吉林大学学报, 2013, 39(6): 1148-1152.
[22] 麻晓庆, 王继红, 韩晓曦, 等. 基因重组蛋白L243诱导表达包涵体的变性、复性与纯化[J]. 吉林医药学院学报, 2007, 28(1): 1-3. DOI:10.3969/j.issn.1673-2995.2007.01.001.
[23] 叶姣, 陈长华, 夏杰, 等. 温度对重组大肠杆菌生长及外源蛋白表达的影响[J]. 华东理工大学学报, 2002, 28(2): 364-367. DOI:10.3969/ j.issn.1006-3080.2002.04.008.
[24] 胡成旭, 侯昕彤, 冯永宁, 等. 响应面法优化云芝多糖提取条件的研究[J]. 食品工业科技, 2007, 28(7): 124-130. DOI:10.3969/ j.issn.1002-0306.2007.07.037.
[25] 毕金峰. 响应面分析法优化马铃薯变温压差膨化干燥工艺研究[J]. 食品科学, 2007, 28(11): 236-240. DOI:10.3321/ j.issn:1002-6630.2007.11.052.
[26] 王晓阳, 唐琳, 赵垒. 响应面法优化刺槐花多酚的超声提取工艺[J].食品科学, 2011, 32(2): 66-70.
[27] 许晖, 孙兰萍, 张斌, 等. 响应面法优化花生壳黄酮提取工艺的研究[J].中国粮油学报, 2009, 24(1): 107-111.
[28] POLIN S, PAKAMON C. Optimisation of microencapsulation of holy basil essential oil in gelatin by response surface methodology[J]. Food Chemistry, 2014, 152(1): 313-320. DOI:10.1016/ j.foodchem.2013.10.159.
[29] 朱磊, 王振宇, 周芳. 响应面法优化微波辅助提取黑木耳多糖工艺研究[J]. 中国食品学报, 2009, 9(2): 53-60. DOI:10.3969/ j.issn.1009-7848.2009.02.010.
[30] 赵春丽, 范秀军, 赵冰, 等. IPTG诱导浓度对重组人肝再生增强因子基因表达的影响[J]. 东北农业大学学报, 2004, 35(4): 441-445. DOI:10.3969/j.issn.1005-9369.2004.04.012.
[31] 贾敏, 江波, 张晓鸣, 等. 乳糖诱导D-塔格糖3-差向异构酶基因在大肠杆菌中的表达[J]. 食品工业科技, 2012, 34(13): 143-152.
D-Lactitol as a Substitute for Isopropyl-β-D-Thiogalactoside to Induce Recombinant Protein Expression
BI Yunfeng, JIANG Renfeng, HE Shu, REN Dayong, XU Linlin, SHEN Minghao
*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:Objective: To induce the expression of recombinant glycosidase using D-lactitol instead of isopropyl-β-D-thiogalactoside (IPTG). Methods: Single-factor experiments were performed to discuss the effect of D-lactitol concentration, induction time and temperature on the expression of recombinant glucosidase and consequently select three appropriate levels for each of the three variables. Subsequently, the levels of these variables were optimized by regression analysis and response surface methodology. Results: The optimal induction conditions were determined to be induction at 34 ℃ for 7.0 h with 1.0 mmol/L lactitol. Conclusion: D-Lactitol can replace IPTG as an ideal inducer for the production of recombinant proteins in genetically engineered strains with the efficient promoter of lac and its derivatives.
Key words:α-glucosidase; induction; response surface methodology; D-lactitol
DOI:10.7506/spkx1002-6630-201607024
中图分类号:Q786
文献标志码:A
文章编号:1002-6630(2016)07-0128-06
引文格式:
毕云枫, 姜仁凤, 何舒, 等. D-乳糖醇代替异丙基-β-D-巯基半乳糖苷对重组蛋白诱导表达的影响[J]. 食品科学, 2016, 37(7): 128-133. DOI:10.7506/spkx1002-6630-201607024. http://www.spkx.net.cn
BI Yunfeng, JIANG Renfeng, HE Shu, et al. D-Lactitol as a substitute for isopropyl-β-D-thiogalactoside to induce recombinant protein expression[J]. Food Science, 2016, 37(7): 128-133. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607024. http://www.spkx.net.cn
收稿日期:2015-06-22
基金项目:吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2015]第207号)
作者简介:毕云枫(1976—),男,副教授,博士,研究方向为食品酶学。E-mail:yunfeng5609@sohu.com
*通信作者:沈明浩(1963—),男,教授,博士,研究方向为食品质量与安全评价。E-mail:shenmh2003@163.com