
图1S. enterica 单个克隆在LB培养基形态(A)和扫描电镜形态(×30 000)(B)
Fig.1 Morphology of S. enterica colonies on NA agar medium (A) and morphology of a single cell of S. enterica observed with SEM (×30 000) (B)
黄 科 1,2,李泊宁 1,罗 洁 1,2,庞 敏 1,刘奕清 1,2,邹 勇 1,2, *
(1.重庆文理学院林学与生命科学学院,重庆 402160;2.重庆文理学院特色植物研究所,重庆市特色种苗工程技术研究中心,重庆高校园林花卉工程研究中心,重庆 402160)
摘 要:本研究对重庆荣昌采后发病姜块进行病原菌分离鉴定,分离到一株新的生姜致病菌。通过细菌形态、生理生化、16S rDNA遗传分析鉴定为沙门氏菌(Salmonella enterica)。将沙门氏菌回接姜苗、姜块,发现姜苗叶片失绿,褶皱;姜块表面水渍并有分泌物;动态污染研究表明:沙门氏菌能在姜块中迅速繁殖,显著提高姜块超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)的活性。该研究表明,沙门氏菌能以生姜为寄主存活。
关键词:生姜;分离;沙门氏菌;抗氧化应答
生姜是一种重要的药食同源经济作物,可鲜食,也可作为调味。但生姜在营养繁殖时体内积累大量病原微生物(细菌和真菌)导致生姜在生产和贮藏过程中发生块茎腐烂、叶片枯萎,叶斑、干枯病症 [1]。研究认为生姜的主要病害包括:荧光假单胞杆菌(Pseudomonas fluorescens)引起的“姜温病” [2];欧文氏杆菌(Erwinia chrysanthemi)引发的生姜茎腐病 [3];肠杆菌(Enterobacter cloacae)引起的块茎腐烂 [4]。短小芽孢杆菌(Bacillus pumilus)也能引起生姜发病 [5];真菌腐霉菌属(Pythium myriotylum)引起生姜软腐病 [6];镰刀菌属(Fusarium oxysporum)可引起叶片变黄,幼芽腐化,长期感染,可致植株死亡 [7]。
沙门氏菌包含乍得沙门氏菌(S. bongor)和肠杆沙门氏菌(S. enterica),两者均能入侵宿主细胞,但只有S. enterica能引起致病 [8]。S. enterica以水果和蔬菜蔬为寄主感染人后,引发胃肠疾病 [9-11],如以番茄为寄主 [12];S. enterica也能侵染植物引起发病:S. enterica Typhimuriumjish寄生于莴苣叶柄周围,随着叶片的发育,感染加剧 [13],S. typhimuriumjish感染可引起水果和蔬菜软化腐烂 [14],S. enterica通过番茄种子传播,引发番茄在生长过程中发病 [15]。还未见S. enterica引起生姜发病的报道,本研究从重庆荣昌采后生姜中分离一株生姜致病菌,对其进行生理生化,16S rDNA遗传分析鉴定,并将致病菌回接生姜,观察致病菌在生姜中的增殖能力及感染症状。通过对生姜致病菌分离鉴定研究,以期为生姜病害及人类胃肠道疾病预防提供新的信息。
1.1 材料与试剂
生姜样品 重庆市荣昌县盘龙镇四川竹根姜栽培主产区。
酶联免疫吸附试剂盒 南京建成生物工程研究所;脱毒生姜营养袋苗 重庆市天沛农业科技有限公司馈赠。
1.2 培养基
营养肉汤琼脂(nutrient agar,NA)培养基:NaCl 5 g、蛋白胨10 g、牛肉膏3 g、琼脂15 g,加水1 000 mL,调节pH值至7.3;肉汤(nutrient broth,NB)培养基:NaCl 5 g、蛋白胨10 g、牛肉膏3 g,加水1 000 mL,调节pH值至7.3。
1.3 仪器与设备
S3400N扫描电子显微镜 日本Hitachi公司;酶标仪美国Bio-Rad公司;聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪 德国Eppendorf公司。
1.4 细菌的分离与纯化
发病样品用清水冲洗,去除表面污渍,然后用无菌水冲洗2 min,重复3 次,用0.6% NaClO浸泡3 min,用无菌水冲洗5 min,重复3 次。用无菌刀挑出生姜腐烂组织,无菌水中浸泡15 min。将浸泡液划线接种于NA培养基,25 ℃无菌培养48 h后观察菌落生长状况。挑取单个菌落,NA培养基上连续传代培养3 代,纯化菌株。将纯化后的菌株置于NB培养基25 ℃培养24 h,致病菌株用20%甘油于-80 ℃保存备用。
1.5 致病菌形态观察
致病菌形态鉴定参照Akin等 [16]方法,细菌经NB培养基25 ℃培养24 h。经12 000 r/min离心1 min收集菌体,样品用2.5%戊二醛(pH 7.4磷酸盐缓冲溶液(phosphate buffered solution,PBS))固定1 h,然后经30%、50%、70%、80%、90%、100%乙醇脱水、喷金,样品用S3400N扫描电子显微镜在15 kV观察。
1.6 细菌生理生化实验
菌株的生理生化特征通过以下实验来测定:革兰氏染色、鞭毛染色、荚膜染色、明胶实验、V.P.实验、甲基红实验、吲哚反应、三糖三醇实验、赖氨酸脱羧酶实验、尿素酶实验、三糖铁琼脂实验 [17]。其中,三糖三醇实验将乳糖、麦芽糖、纤维二糖,甘露醇、山梨醇、甜醇配制为质量浓度10 g/100 mL溶液灭菌后分别加入培养基中,三糖三醇最终质量浓度为1 g/100 mL,培养基配方为NH 4H 2PO 41 g、MgSO 4g7H 2O 0.2 g、KCl 0.2 g、酵母膏0.2 g、琼脂5 g,质量浓度0.04 g/100 mL溴甲酚紫乙醇溶液20 mL,蒸馏水1 000 mL,pH 7.2,将菌株穿刺接入培养基中37 ℃培养24 h,观察菌株生长情况,每个实验设3 个重复。
1.7 致病菌16S rDNA遗传分析
采用细菌基因组DNA小提试剂盒提取致病菌基因组DNA。用E. coli 16S rDNA保守序列,正向引物P1:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物P2:5′-ACGGCTACCTTGTTACGACTT-3′ [18],进行致病菌的16S rDNA扩增。PCR反应体系为10hBuffer 5 μL,2.5 mmol/L dNTP 3 μL,P1引物1 μL,P2引物1 μL,2.5 mmol/L MgCl 23.5 μL,Taq酶(5 U/μL)0.5 μL,总DNA 1 μL,加入ddH 2O 35 μL,总反应体积为50 μL。PCR扩增产物进行电泳检测、回收、克隆、测序鉴定。测序后16S rDNA在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI,http://blast. ncbi.nlm.nih.gov/Blast.cgi)中进行比对。使用MEGA 5.1软件中的邻接法(neighbor joining,NJ) [19],以E. coli为外群建立系统发育树。
1.8 S. enterica回接生姜姜块、姜苗
致病菌经NB培养基25 ℃培养12 h,测定OD 600 nm值约为1.0时,制备10 9CFU/mL的细胞悬液。将成熟健康生姜用清水洗净,用70%乙醇对块茎表面消毒5 min,用无菌水冲洗,晾干。用无菌刀片将块茎块切割为2.5 cmh1.5 cm的小块。在姜块上接种1 mL 10 9CFU/mL的细胞悬液,无菌水作对照,25 ℃培养箱中培养。脱毒生姜组培苗经穴盘移栽后 [20]转至10 cmh10 cm营养袋;穿刺接种0.5 mL 10 9CFU/mL的细胞悬液,无菌水作对照,温室培养。
1.9 生姜动态污染
将成熟健康生姜用清水洗净,用70%乙醇对块茎表面消毒5 min,之后无菌水冲洗,晾干。用无菌刀片将块茎切割为1.5 cmh1.5 cm的小块,在块茎上划5 mm深,3 mm宽伤口,在伤口上接种10 μL 10 9CFU/mL的细胞悬液,S. enterica在生姜上污染动态测定实验参照Liu Jia等 [21]的研究报道。细胞悬液接种在生姜2 h为起始点,每隔24 h从伤口上切取1 cm 2、1 cm深样品,每次切取20 块样品,样品经研磨,10 mL无菌水混合均匀后,200 µL涂布于NA培养基25 ℃,70%湿度培养2 d。测定每个伤口的菌落数,每个实验重复3 次,每次实验含20 个姜块。
1.10 宿主抗氧化酶活性测定
细菌经NB培养基,25 ℃培养12 h后,OD 600 nm值约1.0时,制备10 9CFU/mL的细胞悬液。将成熟健康生姜用清水洗净,用70%乙醇对块茎表面消毒5 min,之后无菌水冲洗,晾干。用无菌刀将块茎切割为2.5 cmh1.5 cm的小块。在姜块上接种1 mL 10 9CFU/mL的细胞悬液,每次接种60 块生姜,实验重复3 次。接种后于25.5 ℃、70%相对湿度连续培养6 d。每隔24 h取样品一次,每次取10 块生姜,-80 ℃保存。连续取样6 d。分别取2 g材料于预冷的研钵中,加入8 mL预冷的50 mmol/L、pH 7.8 PBS(先加2 mL,在冰浴下研磨成匀浆后,将匀浆转入10 mL离心管,再用6 mL冲洗),10 000 r/min离心15 min,取上清液定容至10 mL后于4 ℃保存。上清液用于过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)及过氧化物酶(peroxidase,POD)活性测定。采用双抗一步夹心法酶联免疫吸附试剂盒测定氧化酶活性。
2.1 S. enterica的形态及生理生化特性
分离的S. enterica经NA培养基25 ℃培养2 d后的形态如图1A所示,菌落为不规则圆形,表面光滑、凸起、白色。扫描电镜结果(图1B)表明,单个克隆直径约1.5 µm,长约13 µm。致病菌生理生化研究表明S. enterica为G -,含鞭毛,无荚膜,V.P.实验为阴性,不产生吲哚,甲基红实验为阳性,不能液化明胶,不分解尿素,不发酵乳糖,但能利用麦芽糖、纤维二糖、甘露醇、甜醇、山梨醇,三糖铁琼脂实验为阳性,赖氨酸脱羧酶反应为阳性结果如表1所示,生姜来源致病菌与已有S. enterica生理生化特性研究报道一致 [22]。

图1S. enterica 单个克隆在LB培养基形态(A)和扫描电镜形态(×30 000)(B)
Fig.1 Morphology of S. enterica colonies on NA agar medium (A) and morphology of a single cell of S. enterica observed with SEM (×30 000) (B)
表1S. enterica 的生理生化鉴定结果
Table 1 Physiological and biochemical characteristics of S. enterica
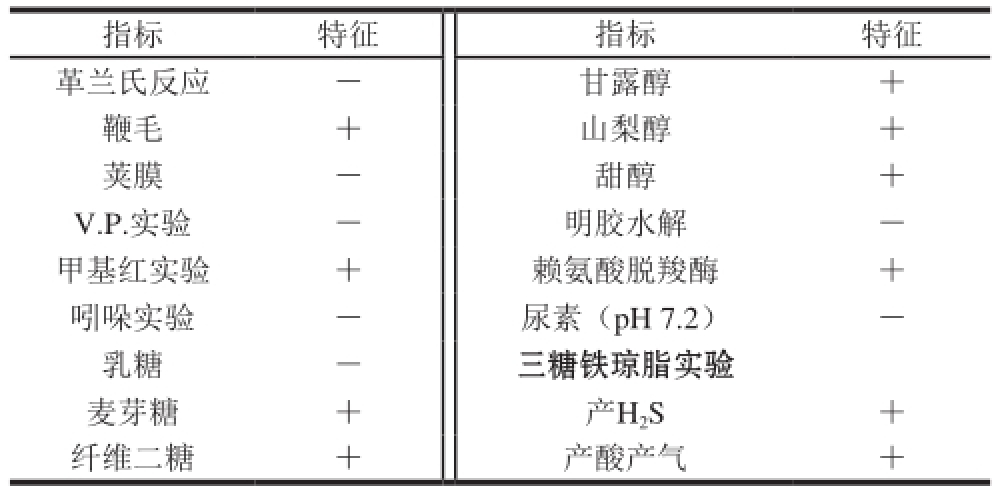
注:+.阳性反应;-.阴性反应。
指标 特征 指标 特征革兰氏反应 - 甘露醇 +鞭毛 + 山梨醇 +荚膜 - 甜醇 + V.P.实验 - 明胶水解 -甲基红实验 + 赖氨酸脱羧酶 +吲哚实验 - 尿素(pH 7.2) -乳糖 - 三糖铁琼脂实验麦芽糖 + 产H 2S +纤维二糖 + 产酸产气 +
2.2 S. enterica的16S rDNA遗传分析鉴定
以致病菌菌株的总DNA为模板,以16S通用引物进行PCR扩增,PCR产物经克隆、测序序列与GenBank中的核酸数据进行对比分析,结果表明致病菌序列与S. enterica属细菌相似度达到99%,在此基础上利用MEGA5.1的邻近相接法构建S. enterica的系统发育树,见图2。对于构建的系统发育树,采用Bootstrap方法500 个重复进行可靠性检验。它和S. enterica亚种具有较近的进化距离。
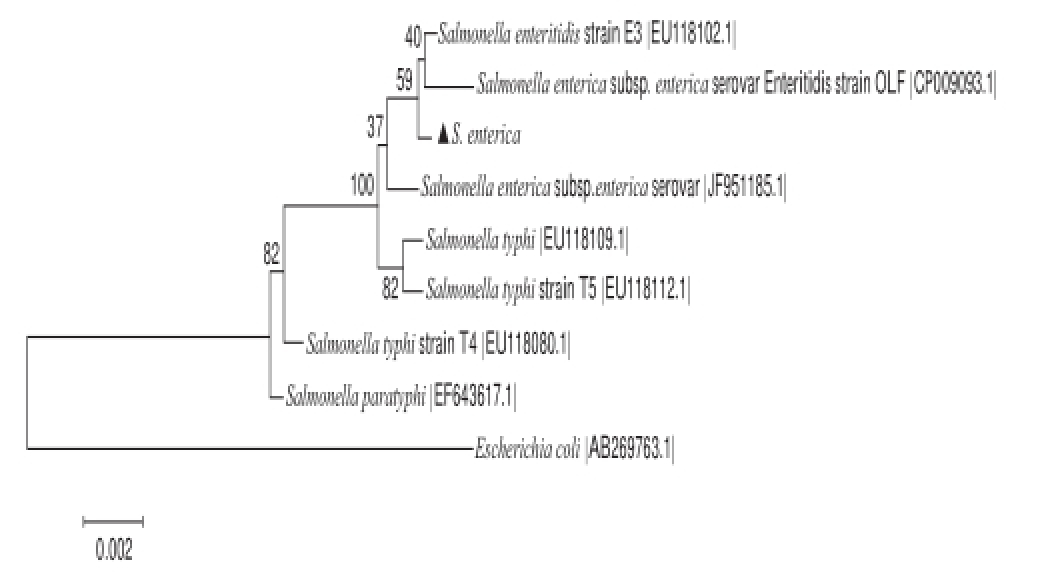
图2 菌株16S rDNA系统进化树分析
Fig.2 Phylogenetic relationships of S. enterica based on partial 16S rDNA sequences
2.3 S. enterica对生姜的回接及侵染动态
S. enterica回接姜块经25 ℃、70%湿度培养10 d以后,姜块表面水渍,并有分泌物渗出,而对照无上述现象(图3A)。S. enterica经穿刺回接生姜苗3 d后,约30%生姜幼苗叶片发黄,叶片褶皱(图3B)。S. enterica在回接生姜后,在25 ℃培养时增殖较快(图4),从接种后到第2天细菌增殖是接种后2 h的3 倍,第3天是第2天的3 倍,然后进入平台期。这一结果表明S. enterica能以生姜为寄主,并迅速繁殖。
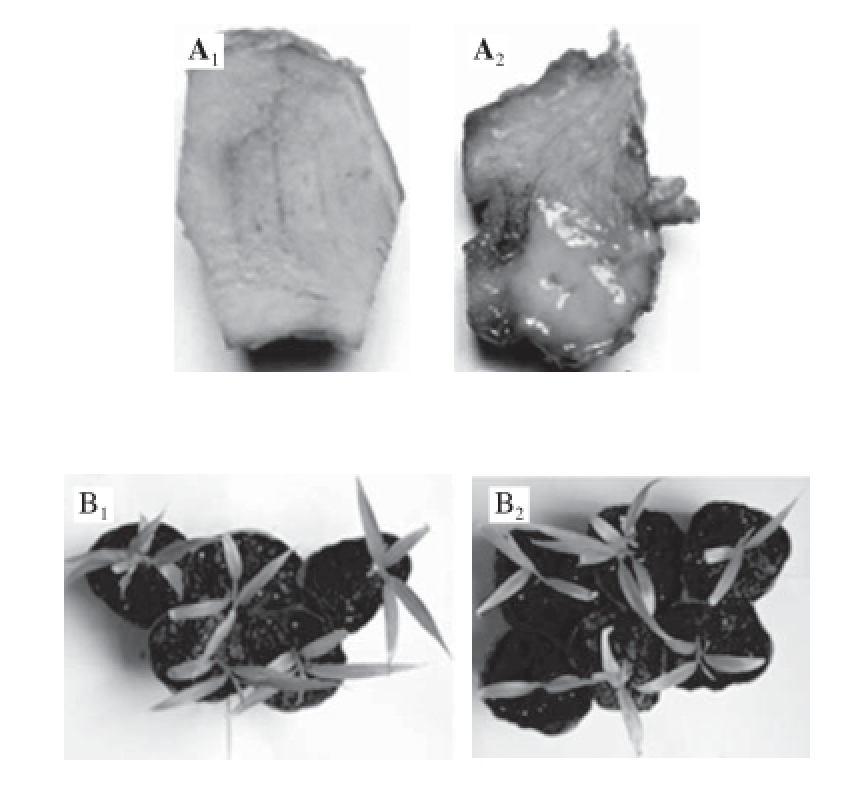
图3S. enterica回接生姜姜块(A)和幼苗(B)
Fig.3 S. enterica inoculated on ginger rhizome (A) and plant seedlings (B)
A图:1.对照组,为姜块用灭菌双蒸水接种10 d,2. S. enterica回接姜块;B图:1.对照组,为姜苗用灭菌水接种3 d,2. S. enterica回接姜苗。
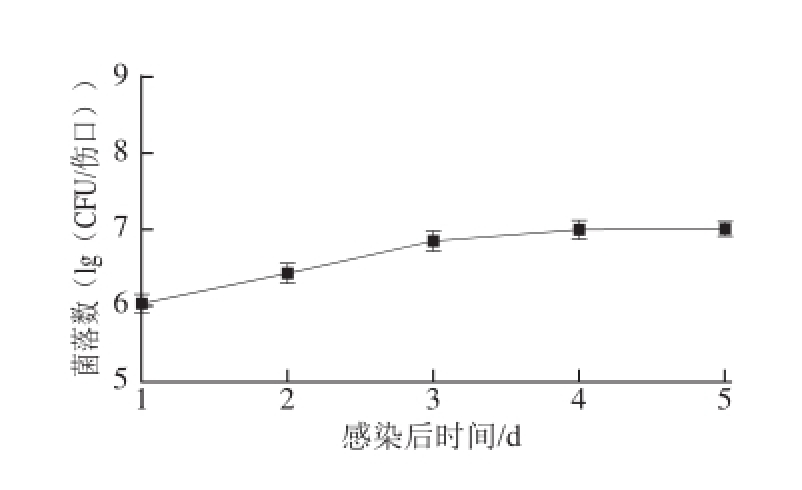
图4S. enterica对姜块的动态污染
Fig.4 Population dynamics of S. enterica in ginger rhizomes that were wounded, inoculated, and stored at 25 ℃
2.4 S. enterica侵染生姜后对其产生的抗氧化活性
抗氧化酶在激发宿主主动防御系统中起主要作用,由图5可知,S. enterica侵染宿主24 h后,宿主抗氧化酶SOD、POD、CAT活性均显著升高,SOD活性升高约3 倍,POD、CAT活性升高约1 倍,随着侵染时间的增加,SOD、POD活性呈上升趋势,而CAT活性经1、2、3 d平台期后再升高。
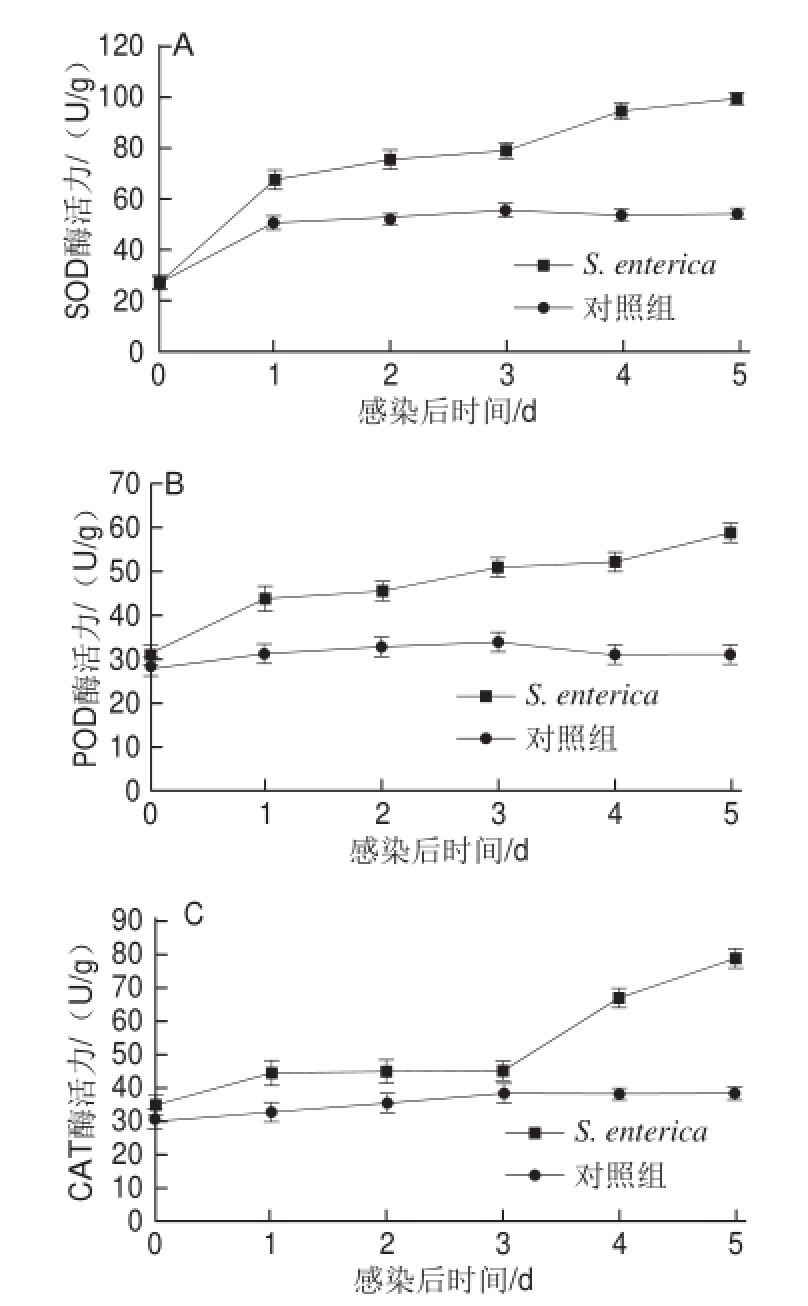
图5侵染茎块5 d中SOD(A)、POD(B)和CAT(C)酶活性
Fig.5 SOD (A), POD (B) and CAT (C) enzyme activities in ginger rhizomes wounded and inoculated with either S. enterica or sterile,distilled water S. enterica
本研究从发病姜块中分离出S. enterica。人类食物中毒主要是因食入受污染的食物或水,而S. enterica则是引起食物中毒的主要原因。许多研究表明,沙门氏菌可以感染许多植物,主要包括:卷心菜、莴苣、拟南芥、番茄、辣椒、苜蓿、大麦、土豆 [11]。但未见沙门氏菌侵染生姜的研究报道。本研究从发病生姜中分离S. enterica,沙门氏菌易在环境中存活,在水和食品中能存活几月,生姜栽培和生长发育中需大量水和肥,特别是在春季栽培时,亩施用大量农家肥,沙门氏菌可能是在田间施肥、施水时污染姜田,再加上适宜的温度、湿度加速了沙门氏菌的繁殖,并污染生姜;同时,本研究表明S. enterica回接生姜和姜苗后,姜苗3 d后出现黄叶、褶皱;姜块回接10 d后表面腐水渍,有分泌物。已有研究报道认为,假单胞菌、肠杆菌、欧文氏杆菌感染生姜块茎后均能引起发病生姜出现水渍、叶片萎黄变色、块腐烂等症状 [2-4]。生姜在生产和贮藏过程中易感染真菌、细菌而发病,特别是在西南地区长江流域高温高湿天气,特别是在大雨后,土壤湿度饱和,温度在25~30 ℃,这种微环境最易使生姜染病 [2,23]。而湿度是影响S. enterica繁殖侵染宿主的重要因素,湿度越大,S. montevideo [24]和S. enterica [25]的繁殖速率越快。本研究结果表明S. enterica在姜块繁殖速率较快,接种1 d后可繁殖3 倍。此外,致病菌侵染宿主通常引起宿主抗氧化酶活性升高,抗氧化酶在激发宿主主动防御系统中起主要作用 [26],S. enterica侵染生姜以后,宿主抗氧化酶活力明显升高。因此,综合以上结果,本研究从发病生姜中分离S. enterica,这一研究结果将为我国西南地区,特别是重庆地区高温、高湿的竹根姜产地对生姜病害防治提供了新的信息。此外,S. enterica能引发胃肠疾病,因此本研究也为人类疾病的预防提供了新的信息。
参考文献:
[1] PRABHAKARAN NAIR K P. The agronomy and economy of turmeric and ginger: the invaluable medicinal spice crops. Chapter 21: the diseases of ginger[M]. Boston, Massachusetts, United States: Elsevier, 2013: 409-426. DOI:10.1016/B978-0-12-394801-4.00028-4.
[2] TRUJILLO E E. Diseases of ginger (Zingiber officinɑle) in Hawaii[M]. Hawaii, United States: University of Hawaii, 1964: 1-14.
[3] STIRLING A. Erwinia chrysanthemi, the cause of soft rot in ginger (Zingiber officinɑle) in Australia[J]. Plant Pathology, 2002, 31(4): 419-420. DOI:10.1071/AP02046.
[4] JOLAD S D, LANTZ R C, CHEN G J, et al. Commercially processed dry ginger (Zingiber officinale): composition and effects on LPS-stimulated PGE production[J]. Phytochemistry, 2005, 66: 1614-1635. DOI:10.1016/j.phytochem.2005.05.007.
[5] PENG Q, YUAN Y, GAO M. Bacillus pumilus, a novel ginger rhizome rot pathogen in China[J]. Plant Disease, 2013, 97(10): 1308-1315. DOI:10.1094/PDIS-12-12-1178-RE.
[6] STIRLING G, TURAGANIVALU U, STIRLING A, et al. Rhizome rot of ginger (Zingiber officinɑle) caused by Pythium myriotylum in Fiji and Australia[J]. Australiasian Plant Pathology, 2009, 38(5): 453-460. DOI:10.1071/AP09023.
[7] NISHIJIMA K, ALVAREZ A, HEPPERLY P, et al. Association of Enterobacter cloacae with rhizome rot of edible ginger in Hawaii[J]. Plant Disease, 2004, 88(12): 1318-1327. DOI:10.1094/ PDIS.2004.88.12.1318.
[8] HENSEL M. Salmonella pathogenicity island 2[J]. Molecular Microbiology, 2000, 36(5): 1015-1023. DOI:10.1046/j.1365-2958.2000.01935.x.
[9] BERGER C N, SODHA S V, SHAW R K, et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens[J]. Environmental Microbiology, 2010, 12(9): 2385-2397. DOI:10.1111/ j.1462-2920.2010.02297.x.
[10] HEATON J, JONES K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review[J]. Journal of Applied Microbiology, 2008, 104(3): 613-626. DOI:10.1111/j.1365-2672.2007.03587.x.
[11] SCHIKORA A, GARCIA A V, HIRT H. Plants as alternative hosts for Salmonella[J]. Trends in Plant Science, 2012, 17(5): 245-249. DOI:10.1016/j.tplants.2012.03.007.
[12] CUMMINGS K, BARRETT E, MOHLE-BOETANI J C, et al. A multistate outbreak of Salmonella enterica serotype Baildon associated with domestic raw tomatoes[J]. Emerging Infectious Diseases, 2001, 7(6): 1046-1048. DOI:10.3201/eid0706.010625.
[13] KROUPITSKI Y, PINTO R, BELAUSOV E, et al. Distribution of Salmonella typhimurium in romaine lettuce leaves[J]. Food Microbiology, 2011, 28(5): 990-997. DOI:10.1016/j.fm.2011.01.007.
[14] WELLS J, BUTTERFIELD J. Salmonella contamination associated with bacterial soft rot of fresh fruits and vegetables in the marketplace[J]. Plant Disease, 1997, 81(8): 867-872. DOI:10.1094/ PDIS.1997.81.8.867.
[15] BARAK J D, LIANG A S. Role of soil, crop debris, and a plant pathogen in Salmonella enterica contamination of tomato plants[J]. Vaccine, 2008, 3(2): 665-671. DOI:10.1016/j.vaccine.2004.11.029.
[16] AKIN D E, BURDICK D, MICHAELS G E. Rumen bacterial interrelationships with plant tissue during degradation revealed by transmission electron microscopy[J]. Applied and Environmental Microbiology, 1974, 27(6): 1149-1156.
[17] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 8版. 北京: 科学出版社, 1984: 792-812.
[18] SONG J. Phylogenetic analysis of Streptomyces spp. isolated from potato scab lesions in Korea on the basis of 16S rRNA gene and 16S-23S rDNA internally transcribed spacer sequences[J]. International Journal of Systematic & Evolutionary Microbiology, 2004, 54(1): 203-209. DOI:10.1099/ijs.0.02624-0.
[19] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology & Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/ msr121.
[20] 刘奕清, 陈泽雄, 吴中军. 生姜脱毒种苗移栽基质筛选及肥水调控研究[J]. 北方园艺, 2010(2): 36-37.
[21] LIU J, WISNIEWSKI M, DROBY S, et al. Effect of heat shock treatment on stress tolerance and biocontrol efficacy of Metschnikowia fructicola[J]. FEMS Microbiology Ecology, 2011, 76(1): 145-155. DOI:10.1111/j.1574- 6941.2010.01037.x.
[22] 张河战. 沙门氏菌的分类、命名及中国沙门氏菌菌型分布[J].微生物学免疫学进展, 2002, 30(2): 74-76. DOI:10.3969/ j.issn.1005-5673.2002.02.018.
[23] STIRLING A M. The causes of poor establishment of ginger (Zingiber officinɑle) in Queensland, Australia[J]. Australasian Plant Pathology, 2004, 33(2): 203-210. DOI:10.1071/AP04003.
[24] ITURRIAGA M H, TAMPLIN M L, ESCARTIN E F. Colonization of tomatoes by Salmonella montevideo is affected by relative humidity and storage temperature[J]. Journal of Food Protection, 2007, 70(1): 30-34.
[25] KINSELLA K J, PRENDERGAST D M, McCANN M S, et al. The survival of Salmonella enterica serovar Typhimurium DT104 and total viable counts on beef surfaces at different relative humidities and temperatures[J]. Journal of Applied Microbiology, 2009, 106(1): 171-180. DOI:10.1111/j.1365-2672.2008.03989.x.
[26] SOTO M J, SANJUÁN J, OLIVARES J. Rhizobia and plantpathogenic bacteria: common infection weapons[J]. Microbiology, 2006, 152(6): 3167-3174. DOI:10.1099/mic.0.29112-0.
Salmonella enterica Causes Bacterial Disease in Ginger and Induces Host Antioxidant Response
HUANG Ke
1,2, LI Boning
1, LUO Jie
1,2, PANG Min
1, LIU Yiqing
1,2, ZOU Yong
1,2,
*
(1. College of Forestry and Life Sciences, Chongqing University of Arts and Sciences, Chongqing 402160, China; 2. Chongqing Engineering Research Center for Special Plant Seedlings, Garden Flower Engineering Research Center of Chongqing Colleges, Research Institute of Special Plant, Chongqing University of Arts and Sciences, Chongqing 402160, China)
Abstract:Ginger is an important economic crop with high medicinal and nutritional value. Diseases caused by pathogenic bacteria in ginger have negative impacts on its growth and storage postharvest quality, and often result in significant profit reduction. In the present study, a novel bacterial pathogen, Salmonella enterica, was isolated from postharvest rhizomes in Rongchang, Chongiqng city. The bacterium was identified by 16S rDNA sequence analysis, and morphological, physiological and biochemical tests. After being inoculated with S. enterica, ginger leaves were found to suffer from chlorosis and wrinkle and water and secretion appeared on the surface of rhizomes. Analysis of the population dynamics of S. enterica indicated that the bacterium colonized and grew well on ginger rhizomes. Biochemical analyses indicated that S. enterica activated antioxidant enzyme activities including superoxide dismutase, peroxidase and catalase in host tissues. These results reveal that S. enterica has the capacity to parasitize ginger.
Key words:ginger; isolate; Salmonella enterica; antioxidant response
DOI:10.7506/spkx1002-6630-201607028
中图分类号:Q93.331
文献标志码:A
文章编号:1002-6630(2016)07-0152-05
引文格式:
黄科, 李泊宁, 罗洁, 等. 生姜中Salmonella enterica的分离与宿主氧化应答[J]. 食品科学, 2016, 37(7): 152-156. DOI:10.7506/spkx1002-6630-201607028. http://www.spkx.net.cn
HUANG Ke, LI Boning, LUO Jie, et al. Salmonella enterica causes bacterial disease in ginger and induces host antioxidant response[J]. Food Science, 2016, 37(7): 152-156. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607028. http://www.spkx.net.cn
收稿日期:2015-06-08
基金项目:永川区自然科学基金项目(Ycstc2013nc8009);重庆文理学院引进人才项目(Z2011RCY02);国家星火计划项目(2013GA81102)
作者简介:黄科(1980—),男,讲师,博士,研究方向为病原微生物学。E-mail:shanbnm@126.com
*通信作者:邹勇(1982—),男,讲师,博士,研究方向为病原微生物学。E-mail:nevernever107@126.com