李 霞,姚 昭,张云龙,李红艳 *
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:目的:研究不同形态硒化合物(有机硒:L-硒甲基硒代半胱氨酸;无机硒:亚硒酸钠)单独使用及其与VE联合使用后对H 2O 2诱导人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)产生氧化应激损伤的保护作用。方法:采用体外细胞培养方法,将HUVECs随机分为7 组:对照组、H 2O 2组、L-硒甲基硒代半胱氨酸(L-Se-methylselenocysteine,L-SeMSC)组、亚硒酸钠(sodium selenite,SS)组、VE组、L-SeMSC+VE联用组、SS+VE联用组。经不同样品干预处理后,采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测 HUVECs存活率;检测各组细胞内脂质氧化终产物丙二醛(malondialdehyde,MDA)含量以及超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的变化。结果:各处理组HUVECs存活率之间没有显著差异;与H 2O 2组比较,0.1 mg/L亚硒酸钠、10 mg/L VE处理能使HUVECs内MDA生成量显著减少,SOD和GSH-Px活性显著升高,并且亚硒酸钠和VE联合使用在细胞水平上具有显著的协同作用,而L-SeMSC组与对照组无显著差异。结论:亚硒酸钠和VE均可保护由H 2O 2诱导引起的HUVECs氧化损伤,提高HUVECs抗氧化能力,并且亚硒酸钠和VE联用具有明显的协同抗氧化作用。
关键词:硒;VE;人脐血管内皮细胞;协同抗氧化活性
细胞受到氧化刺激时,细胞内成分如脂类、蛋白质和核酸都会受到程度各异的损伤,从而导致基因突变、细胞癌变和个体衰老等现象。此过程相应地会伴随着一些酶活性的变化以及一系列代谢产物的产生,这些指标可作为测试细胞损伤的标志物,进而用于表征样品的抗氧化能力 [1]。过氧化氢(H 2O 2)是一种重要的活性氧(reactive oxygen species,ROS),可导致包括血管内皮细胞在内的多种细胞发生一系列的生化反应。氧化应激引起的血管内皮细胞损伤是动脉粥样硬化形成的重要发病机制之一,在代偿范围内,ROS对血管内皮造成的损伤是可以恢复的,然而超过一定限度,将造成血管内皮细胞坏死和凋亡等不可逆的损伤 [2-3]。
L-硒甲基硒代半胱氨酸是一种新型硒强化剂,被认为是生物学效应最强的含硒化合物之一 [4-6]。亚硒酸钠作为目前最广泛的硒营养补充剂,可以预防许多营养性疾病发生 [7]。两种形态的硒化合物以提供硒元素的形式在体内作为多种抗氧化酶的活性中心,抗氧化酶催化氧化还原反应能够减轻ROS系统给机体带来的氧化损伤 [8]。VE是公认的脂溶性断链抗氧化剂,它可以影响谷胱甘肽氧化还原以及氧化剂和抗氧化剂之间的平衡 [9-10],而硒是谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的重要组成成分,可以间接增强GSH-Px的活性。因此,硒和VE在抗氧化应激方面密切相关。过去对硒元素和VE协同作用的研究主要集中陆生动物医学上 [11],而二者协同对人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)的影响及机理鲜见报道。本研究探讨不同形态硒和VE单独使用及联合使用对H 2O 2诱导HUVECs损伤后,细胞存活率和细胞中抗氧化酶——超氧化物歧化酶(superoxide dismutase,SOD)、GSH-Px活性以及脂质代谢产物丙二醛(malondialdehyde,MDA)含量的变化,探讨不同形态硒抗氧化功能的差异,进一步研究硒与VE在细胞内联合协同增效抗氧化作用。
1.1 材料与试剂
HUVECs来自于美国菌种保藏中心。
胎牛血清 美国Gibco公司;DMEM培养基 美国Invitrogen公司;SOD试剂盒、MDA试剂盒、GSH-Px试剂盒 南京建成生物工程研究所;30% H 2O 2西陇化工股份有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)粉剂(pH 7.2~7.4) 北京中杉金桥生物技术有限公司;谷氨酰胺、胰蛋白酶、青霉素、链霉素、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 北京Solarbio公司;L-硒甲基硒代半胱氨酸(L-Se-methylselenocysteine,L-SeMSC) 江西川奇制药有限公司;亚硒酸钠(sodium selenite,SS) 国药集团化学试剂有限公司;水溶性VE 广东天和诚科技公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、二甲基亚砜(dimethyl sulfoxide,DMSO)天津大茂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
生物安全柜 苏州净化设备工程公司;LDZX-50KBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;MK3型酶标仪 芬兰Thermo公司;CO 2恒温恒湿培养箱 长沙长锦科技公司;倒置生物相差显微镜 上海光学仪器进出口有限公司;HWS-150型恒温恒湿箱 精宏实验设备有限公司;Simplicity ®纯水仪 美国Millipore公司。
1.3 方法
1.3.1 HUVECs复苏与培养
从液氮中取出冻存的HUVECs,迅速于37 ℃水浴3 min,并不断摇晃使其解冻。1 000 r/min离心5 min后弃去上清液,加培养液吹打制备单细胞悬液,分装至多个培养瓶中。于37 ℃、5% CO 2培养箱中培养一段时间,待细胞增长至80%融合时,用0.25%胰蛋白酶消化后传代,取对数生长期的细胞进行下一步实验。
1.3.2 H 2O 2诱导HUVECs损伤模型的建立
取对数生长期的正常HUVECs接种于96 孔板中,37 ℃、5% CO 2培养箱中培养细胞,等细胞增长至80%融合时,空白对照组加入200 μL含体积分数10%胎牛血清的DMEM培养液;除空白对照组外,其他组分别加入H 2O 2终浓度为25、50、75、100、125、150 μmol/L的200 μL含体积分数10%胎牛血清的DMEM培养液,于37 ℃、5% CO 2条件下培养8 h,MTT法检测细胞存活率,确定建立损伤模型的H 2O 2最适浓度。
1.3.3 不同形态硒与VE单独和联用对HUVECs活力的影响
取对数生长期的HUVECs,按细胞密度为2h10 4个/mL接种于96 孔板中,每孔200 μL,37 ℃、5% CO 2条件下培养细胞24 h。将HUVECs随机分为6 组:对照组、L-SeMSC组(0.1 mg/L)、SS组(0.1 mg/L)、VE组(10 mg/L)、L-SeMSC(0.05 mg/L)+VE(5 mg/L)联用组、SS(0.05 mg/L)+VE(5 mg/L)联用组,除正常对照组外,其余组先用含有相应样品的DMEM培养液处理24 h,对照组则添加相同体积的PBS。24 h后弃去培养液,用含10%胎牛血清的细胞培养液继续培养6 h,以稳定细胞。最后,每孔细胞中加入200 μL含0.5 mg/mL MTT的培养液,置于细胞培养箱中37 ℃条件下避光孵育4 h。吸弃上清液,每孔加入150 μL DMSO,振荡使蓝紫色结晶充分溶解。每更换一次培养液后,用PBS冲洗两遍。再用酶标仪测定光密度(OD 490 nm)值。按照下式计算各组HUVECs的细胞存活率。
1.3.4 经H 2O 2处理后各组HUVECs的MDA生成量及SOD、GSH-Px活力测定
采用体外细胞培养方法,将HUVECs随机分为7 组:对照组、H 2O 2组(100 μmol/L)和L-SeMSC组、SS组、VE组、L-SeMSC+VE联用组、SS+VE联用组。H 2O 2组的HUVECs用含有H 2O 2(100 μmol/L)的DMEM培养液处理8 h,其余组(对照组除外)先用1.3.3节所述的含相应样品的DMEM培养液处理24 h,再将培养基换成含有100 μmol/L H 2O 2的DMEM培养液继续培养8 h。细胞经消化后4 ℃、1 500 r/min离心10 min。在收集管里加入600 μL裂解液,反复冻融两次,随后4 ℃、13 000 r/min离心15 min,取离心后的上清液,通过硫代巴比妥酸法测定MDA含量,通过黄嘌呤氧化酶法和二硫代二硝基苯甲酸法分别测定SOD和GSH-Px活力,测定步骤严格按照试剂盒说明书方法操作。
1.4 数据统计处理
实验数据均以
 表示,多组间差异显著性用SPSS 16.0统计软件进行单因素方差分析,P<0.05表示差异具有统计学意义。
表示,多组间差异显著性用SPSS 16.0统计软件进行单因素方差分析,P<0.05表示差异具有统计学意义。
2.1 H 2O 2诱导HUVECs氧化损伤模型的建立

图1 不同浓度H
2O
2处理HUVECs活力比较
Fig.1 Comparison of cell viability in HUVECs treated with different concentrations of H
2O
2
*. 与空白对照组相比,差异显著(P<0.05)。
如图1所示,以空白对照组(0 μmol/L)HUVECs的细胞存活率为100%,25、50、75、100、125、150 μmol/L的H 2O 2处理后,细胞存活率分别降至95.34%、82.67%、70.98%、49.12%、25.56%、10.92%,除25 μmol/L剂量组外,其他组与空白对照组相比均有显著差异(P<0.05),当H 2O 2浓度为100 μmol/L时,HUVECs的细胞存活率符合氧化损伤模型要求,故选100 μmol/L H 2O 2处理8 h作为建模条件。
2.2 各组样品对HUVECs活力的影响
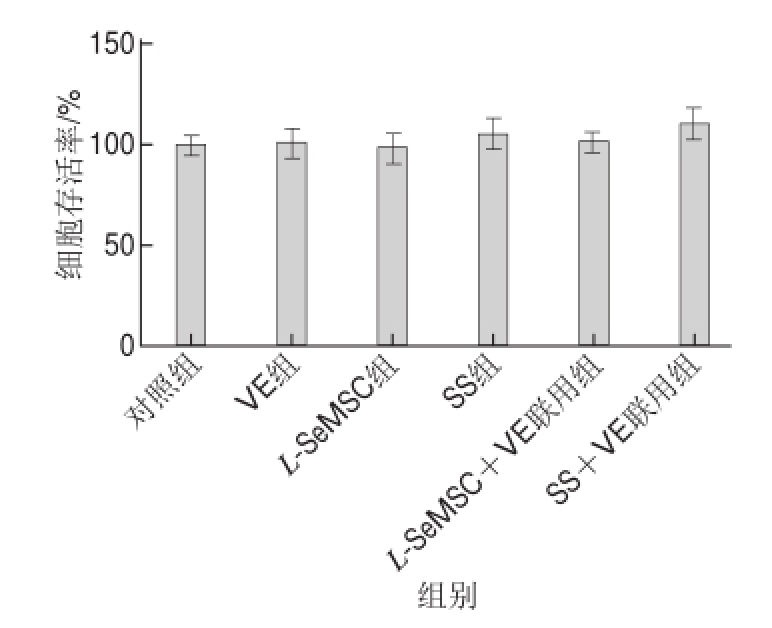
图2 各组细胞存活率比较
Fig.2 Cell viability in different groups
由图2可知,各处理组HUVECs存活率与对照组之间均无显著差异(P>0.05),故0.1 mg/L L-SeMSC、0.1 mg/L SS、10 mg/L VE、0.05 mg/L L-SeMSC+5 mg/L VE、0.05 mg/L SS+5 mg/L VE在本实验条件下均不会抑制HUVECs活力,即选取的各样品剂量可用于后续实验。
2.3 不同形态硒与VE联用对H 2O 2诱导HUVECs抗氧化能力的影响
2.3.1 各组HUVECs的MDA含量比较
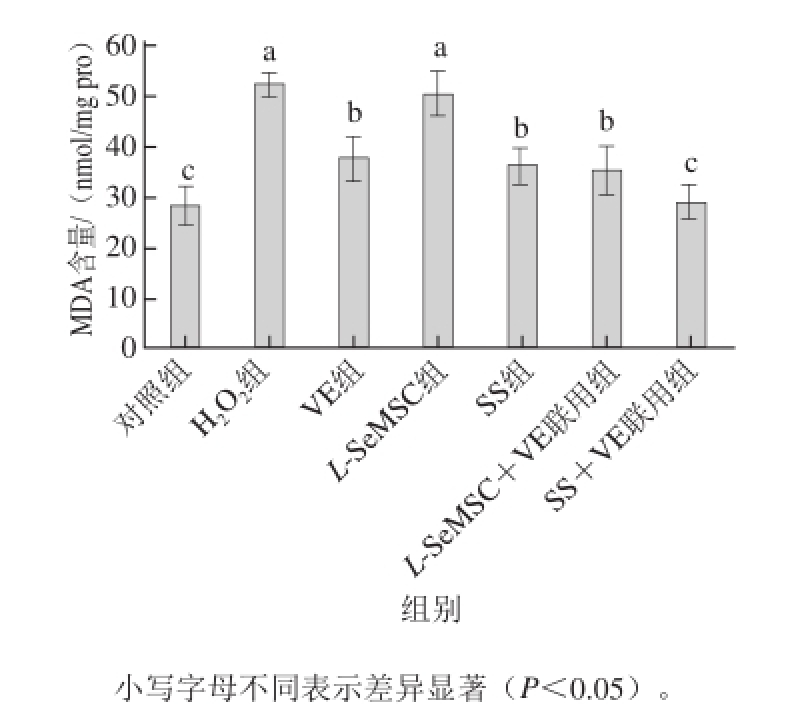
图3 各组细胞MDA含量比较
Fig.3 MDA contents in HUVECs from different groups
如图3所示,H 2O 2组的HUVECs经过H 2O 2处理之后,细胞中MDA含量((52.43f2.32) nmol/mg pro)与对照组((28.31f3.71) nmol/mg pro)相比显著升高(P<0.05),MDA是ROS降解多不饱和脂肪酸的代谢产物,是最常见的脂质过氧化指标之一,其含量高低间接反映了细胞氧化损伤的程度。在经VE、SS处理过后,HUVECs内MDA含量与H 2O 2组相比显著下降,分别为(37.91f4.01)、(36.16f3.87) nmol/mg pro(P<0.05)。SS+VE联用组的MDA含量((29.17f 3.44) nmol/mg pro)与H 2O 2组相比下降更为明显(P<0.05),同时与VE组、SS组相比也具有显著差异(P<0.05)。然而L-SeMSC组HUVECs内MDA含量与H 2O 2组相比却不具有统计学意义(P>0.05),L-SeMSC+VE组的MDA含量((35.32f4.92) nmol/mg pro)与VE组相比无显著差异(P>0.05)。
2.3.2 各组HUVECs的SOD与GSH-Px活力比较
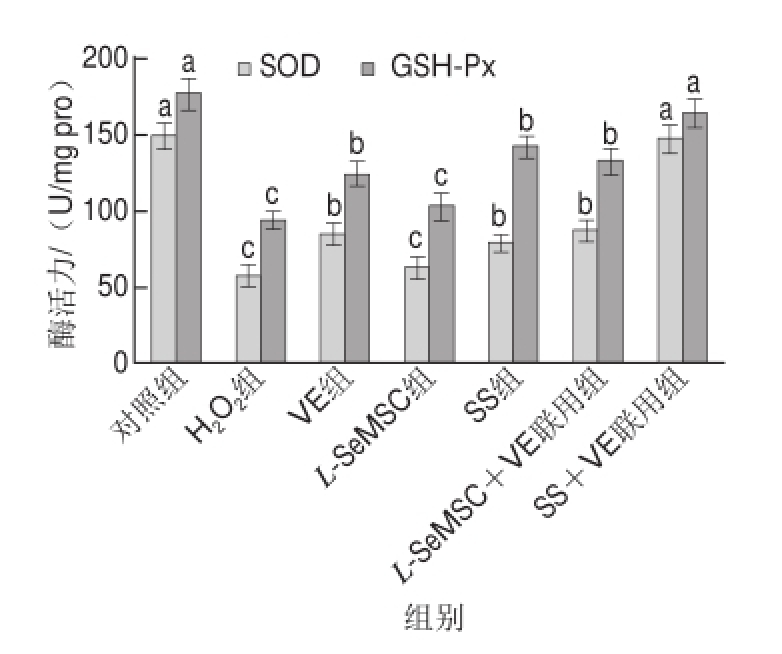
图4 各组细胞SOD和GSH-Px活力比较
Fig.4 Activity of antioxidant enzymes in HUVECs from different groups
小写字母不同表示同一指标相比差异显著(P<0.05)。
SOD是细胞内主要的抗氧化酶之一,如图4所示,经H 2O 2处理后,H 2O 2组HUVECs内SOD活力((57.42f6.81) U/mg pro)与对照组((148.56f8.74) U/mg pro)相比急剧下降(P<0.05)。L-SeMSC组HUVECs的SOD活力((62.23f6.97) U/mg pro)与H 2O 2组相比无显著差异(P>0.05),VE组、SS组、L-SeMSC+VE组HUVECs内SOD活力分别为(84.3f7.32)、(78.37f5.24)、(86.63f6.43) U/mg pro,与H 2O 2组相比显著升高(P<0.05),而SS+VE组HUVECs的SOD活力高达(146.36f9.32) U/mg pro,显著高于H 2O 2组(P<0.05)且与对照组相比无显著差异(P>0.05),并且显著高于VE组、SS组,而L-SeMSC+VE组HUVECs的SOD活力与VE组相比无显著差异(P>0.05)。
GSH-Px是细胞内以硒元素为活性中心的重要的抗氧化酶,如图4所示,H 2O 2组中HUVECs的GSH-Px活力((93.71f6.21) U/mg pro)与对照组((176.49f9.63) U/mg pro)相比显著下降(P<0.05)。VE组((123.83f8.32) U/mg pro)和SS组((141.72f5.87) U/mg pro)HUVECs的GSH-Px活力与H 2O 2组相比均显著降低(P<0.05)。值得注意的是,L-SeMSC组HUVECs的GSH-Px活力((103.36f8.55) U/mg pro)与H 2O 2组相比无显著差异(P>0.05),且L-SeMSC+VE组HUVECs的GSH-Px活力((132.62f7.31) U/mg pro)与VE组相比差异也不存在统计学意义(P>0.05)。但是SS+VE组HUVECs的GSH-Px活力((163.54f8.96) U/mg pro)却远远高于H 2O 2组(P<0.05),并与SS组相比也更高(P<0.05)。
3.1 H 2O 2对HUVECs的氧化损伤
血管内皮细胞的损伤以及功能异常是动脉粥样硬化发生的早期症状,许多因素都能导致血管内皮细胞的损伤,如调节因子、炎症因子、活性氧、脂肪氧化酶的紊乱等 [12],其中ROS产生的氧化损伤是导致动脉粥样硬化发生的重要因素,ROS的产生和积累对血管内皮细胞功能的改变以及凋亡起到重要作用。本实验中所用的H 2O 2作为一种强氧化剂,它可以促进自由基的生成,如果机体中H 2O 2不能及时被抗氧化酶消除,即可透过细胞膜,在膜外与Cu 2+或Fe 3+反应,生成活性更强的羟自由基(·OH),后者可使血管内皮细胞的细胞膜发生过氧化损伤,引起细胞脂质过氧化反应,并持续发展为链式反应,几乎可以和任何细胞成分发生反应,对细胞产生明显的损伤作用 [13]。
在本研究中采用100 μmol/L的H 2O 2诱导人脐静脉血管内皮细胞氧化模型,经H 2O 2处理之后,H 2O 2组HUVECs内MDA含量与对照组相比显著升高,SOD和GSH-Px活性则急剧下降,这表明在100 μmol/L的H 2O 2诱导下,细胞内产生大量氧自由基,自由基侵害细胞后,与细胞内的多不饱和脂肪酸发生脂质过氧化反应,产生MDA等代谢产物,大量的MDA使得细胞膜磷脂结构发生不可逆变化,进而导致细胞膜的通透性增加,与此同时,细胞外分泌乳酸脱氢酶含量增多,细胞活力下降,引起细胞损伤 [14]。此外,细胞内过量的自由基可能会抑制抗氧化酶活性,造成细胞内SOD和GSH-Px活力与对照组相比也显著下降,使得自由基的清除能力大大减弱,使得细胞氧化损伤程度进一步加重 [15]。
3.2 VE、SS对H 2O 2诱导HUVECs氧化损伤的保护作用
在VE作用下,细胞内由H 2O 2诱导产生的过量氧自由基能够及时被清除,阻止ROS对细胞膜的进一步的氧化损伤 [16]。而在加入Na 2SeO 3后,为细胞提供了大量的硒元素,首先硒自身能阻止脂类过氧化物与游离基相结合,其次,硒还能够参与体内抗氧化酶如GSH-Px、硫氧化还原蛋白、硒蛋白R的形成,通过抗氧化酶催化氧化还原反应,能够减轻ROS系统带来的氧化损伤 [17-18],此外,补充硒还能使细胞内谷胱甘肽(glutathione,GSH)含量升高,而GSH又能使VE再生 [19]。因此,在Na 2SeO 3和VE联合使用后,两者在细胞内能发挥协同抗氧化作用,效果优于单独使用Na 2SeO 3和VE。
3.3 SS、L-SeMSC对H 2O 2诱导HUVECs氧化损伤的影响
Liu Jiaguo [20]和Wang Yang [21]等分别发现可以通过补充一定量的L-SeMSC和SS来提高抗氧化酶的活力,进而减缓大鼠和小鼠氧化应激的现象,Zeng Huawei等 [22]研究发现在Caco-2细胞中L-SeMSC的吸收显著高于SS,除此之外,Ip等 [23]研究发现甲基硒酸(CH 3SeO 2H)在抑制小鼠乳腺增生上皮细胞代谢堆积物和促进癌细胞凋亡等方面的效果显著高于相同硒浓度的L-SeMSC,甲基硒酸是一种功能类似于L-SeMSC在β-裂解酶作用下脱去氨基酸的物质,因此,L-SeMSC被认为在β-裂解酶存在的情况下,可以有与甲基硒酸相同的作用。而在本研究中,添加L-SeMSC对HUVECs内MDA含量和SOD、GSH-Px活力与H 2O 2组相比均无明显差异。这可能是因为L-SeMSC发挥其抗氧化作用必须在β-裂解酶的作用下转化为CH 3SeH,CH 3SeH进而进入无机硒代谢池,转化为H 2Se,作为合成各种含硒蛋白的前体,以硒代半胱氨酸的形式嵌入各种蛋白 [24],例如含硒的GSH-Px。但是β-裂解酶仅存在于肠道、肝脏、肾脏和乳腺细胞中,血管内皮细胞由于缺乏β-裂解酶,不能裂解L-SeMSC,因此在人脐静脉血管内皮细胞中发挥不了其抗氧化作用。而亚硒酸钠可通过硒化氢的甲基化转化为甲基硒,参与代谢活动,不需要β-裂解酶的参与 [25]。因此,在本研究中L-SeMSC对细胞的保护作用要弱于其他形态的硒。
综上所述,本实验结果表明亚硒酸钠、VE均可减弱因H 2O 2引起的细胞过度脂质过氧化,减少细胞内MDA生成量,增强细胞内SOD、GSH-Px活力,并且亚硒酸钠和VE联合使用时,可起到抗氧化协同效应。而由于人脐静脉血管内皮细胞内缺乏β-裂解酶,不能分解L-SeMSC,故L-SeMSC在人脐静脉血管内皮细胞中无明显的抗氧化活性。
参考文献:
[1] AW T Y. Molecular and cellular responses to oxidative stress and changes in oxidation-reduction imbalance in the intestine[J]. American Journal of Clinical Nutrition, 1999, 70(4): 557-565.
[2] CHEN H, YOSHIPKA H, KIM G S, et al. Oxidative stress in ischemic brain damage: mechanisms of cell death and potential molecular targets for neuroprotection[J]. Antioxid Redox Signal, 2011, 14(8):1505-1517. DOI:10.1089/ars.2010.3576.
[3] 白玉婷, 周白丽. 氧化应激与心血管疾病关系的研究进展[J]. 医学综述, 2012, 18(2): 192-194. DOI:10.3969/ j.issn.1006-2084.2012.02.012.
[4] SINGH A, JAIN A, SARMA B K, et al. Natural antioxidants and their role in cancer prevention[M]// SHANKAR S, SRIVASTAVA R K. Nutrition, diet and cancer. Netherlands: Springer, 2012: 563-583. DOI:10.1007/978-94-007-2923-0_23.
[5] CAO S, DURRANI F A, TOTH K, et al. Se-methylselenocysteine offers selective protection against toxicity and potentiates the antitumour activity of anticancer drugs in preclinical animal models[J]. British Journal of Cancer, 2014, 110(7): 1733-1743. DOI:10.1038/ bjc.2014.85.
[6] FRANKEL P H, PARKER R S, MADSEN F C, et al. Baseline selenium and prostate cancer risk: comments and open questions[J]. Journal of the National Cancer Institute, 2014, 106(3): dju005. DOI:10.1093/jnci/dju005.
[7] 石新兰, 凌允礼, 侯健存. 亚硒酸钠及抗氧化剂抑制小鼠肺泡Arthus血管炎发生的机制[J]. 中国医学科学院学报, 1999, 21(4): 256-261.
[8] SUZUKI K T, KURASAKI K, SUZUKI N. Selenocysteine beta-lyase and methylselenol demethylase in the metabolism of Se-methylated selenocompounds into selenide[J]. Biochimica et Biophysica Acta,2007, 1770(7): 1053-1061. DOI:10.1016/j.bbagen.2007.03.007.
[9] TAPPEL A L. Vitamin E as the biological lipid antioxidant[J]. Vitamins & Hormones, 1962, 20: 493-510. DOI:10.1016/S0083-6729(08)60732-3.
[10] HERRARA E, BARBAS C. Vitamin E: action, metabolism and perspectives[J]. Journal of Physiology and Biochemistry, 2001, 57(1):43-56. DOI:10.1007/BF03179812.
[11] 张琴. 微量元素硒抗氧化研究发展态势文献计量分析[J]. 安徽农业科学, 2012, 40(26): 131643-13166. DOI:10.13989/ j.cnki.0517-6611.2012.26.064.
[12] WANG L, HAO Q, WANG Y D, et al. Protective effects of dehydroepiandrosterone on atherosclerosis in ovariectomized rabbits via alleviating inflammatory injury in endothelial cells[J]. Atherosclerosis, 2011, 214(1): 47-57. DOI:10.1016/ j.atherosclerosis.2010.07.043.
[13] WITZTUM J L, STEINBERG D. Role of oxidized low density lipoprotein in atherogenesis[J]. Journal of Clinical Investigation, 1991,88(6): 1785-1792. DOI:10.1172/JCI115499.
[14] RAI B K S J R. Salivary lipid peroxidation product malonaldehyde in various dental diseases[J]. World Journal of Medical Sciences, 2006,1(2): 100-101.
[15] WICKENS A P. Ageing and the free radical theory[J]. Respiration Physiology, 2001, 128(3): 379-391. DOI:10.1016/S0034-5687(01)00313-9.
[16] FAURE P, ROSSINI E, LAFOND J L, et al. Vitamin E improves the free radical defense system potential and insulin sensitivity of rats fed high fructose diets[J]. Journal of Nutrition, 1997, 127(1): 103-107.
[17] XIA Y, HILL K E, LI P, et al. Optimization of selenoprotein P and other plasma selenium biomarkers for the assessment of the selenium nutritional requirement: a placebo-controlled, double-blind study of selenomethionine supplementation in selenium-deficient Chinese subjects[J]. American Journal of Clinical Nutrition, 2010, 92(3): 525-531. DOI:10.3945/ ajcn.2010.29642.
[18] 许友卿, 谢亮亮, 丁兆坤. 维生素E和硒在机体的协同作用[J]. 饲料工业, 2012, 33(4): 30-33.
[19] ROJAS C, CADENAS S, LÓPEZ-TORRES M O N, et al. Increase in heart glutathione redox ratio and total antioxidant capacity and decrease in lipid peroxidation after vitamin E dietary supplementation in guinea pigs[J]. Free Radical Biology and Medicine, 1996, 21(7):907-915. DOI:10.1016/S0891-5849(96)00223-7.
[20] LIU J, ZHAO H, LIU Y, et al. Effect of two selenium sources on hepatocarcinogenesis and several angiogenic cytokines in diethylnitrosamine-induced hepatocarcinoma rats[J]. Journal of Trace Elements in Medicine and Biology, 2012, 26(4): 255-261. DOI:10.1016/j.jtemb.2012.02.001.
[21] WANG Y, WU Y, LUO K, et al. The protective effects of selenium on cadmium-induced oxidative stress and apoptosis via mitochondria pathway in mice kidney[J]. Food and Chemical Toxicology, 2013, 58:61-67. DOI:10.1016/j.fct.2013.04.013.
[22] ZENG H, JACKSON M I, CHENG W, et al. Chemical form of selenium affects its uptake, transport, and glutathione peroxidase activity in the human intestinal Caco-2 cell model[J]. Biological Trace Element Research, 2011, 143(2): 1209-1218. DOI:10.1007/s12011-010-8935-3.
[23] IP C, THOMPSON H J, ZHU Z, et al. In vitro and in vivo studies of methylseleninic acid: evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention[J]. Cancer Research,2000, 60(11): 2882-2886.
[24] SUZUKI K T, TSUJI Y, OHTA Y, et al. Preferential organ distribution of methylselenol source Se-methylselenocysteine relative to methylseleninic acid[J]. Toxicology and Applied Pharmacology,2008, 227(1): 76-83. DOI:10.1016/j.taap.2007.10.001.
[25] KLEIN E A. Selenium: epidemiology and basic science[J]. Journal of Urology, 2004, 171(Suppl 2): 50-53. DOI:10.1097/01. ju.0000107837.66277.e9.
Protective Effect of Individual and Combined Selenium and VE on H 2O 2-Induced Oxidative Damage in HUVECs
LI Xia, YAO Zhao, ZHANG Yunlong, LI Hongyan
*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:Objective: To study the protective effect of individual and combined selenium and VE on human umbilical vein endothelial cell (HUVECs) with H 2O 2-induced oxidative damage. Methods: HUVECs cultured in vitro were divided into normal control group, model control group and five treatment groups including L-Se-methylselenoeysteine (L-SeMSC)group, sodium selenite (SS) group, VE group, L-SeMSC + VE group, and SS + VE group. The HUVECs were injured by H 2O 2after they were incubated for 24 h. The effects of all these treatments on cell viability were assayed by MTT. The activity of antioxidant enzymes (SOD and GSH-Px) and the content of MDA were determined. Results: Compared with the model group, treatment with 0.1 mg/L SS, or 10 mg/L VE could increase the viability of HUVECs, reduce the content of MDA, and increase the activity of antioxidant enzymes (SOD and GSH-Px). The combination of SS and VE exerted a synergistic antioxidant effect at the cellular level, but L-SeMSC did not exhibit a significant difference when compared with the control group. Conclusion: both SS and VE possess protective effect on H 2O 2-induced damage in HUVECs, and can enhance cell antioxidant activity in a synergistic manner.
Key words:selenium; VE; human umbilical vein endothelial cells (HUVECs); synergistic antioxidant activity
DOI:10.7506/spkx1002-6630-201607035
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)07-0192-05
引文格式:
李霞, 姚昭, 张云龙, 等. 不同形态硒与VE联用对H 2O 2诱导人脐静脉血管内皮细胞氧化应激损伤的保护作用[J]. 食品科学, 2016, 37(7): 192-196. DOI:10.7506/spkx1002-6630-201607035. http://www.spkx.net.cn
LI Xia, YAO Zhao, ZHANG Yunlong, et al. Protective effect of individual and combined selenium and VE on H 2O 2-induced oxidative damage in HUVECs[J]. Food Science, 2016, 37(7): 192-196. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201607035. http://www.spkx.net.cn
收稿日期:2015-06-30
基金项目:江西省博士后科研项目(2013KY04);江西省科技厅国际合作项目(20122BDH80003)
作者简介:李霞(1991—),女,硕士研究生,研究方向为食品科学。E-mail:931152524@qq.com
*通信作者:李红艳(1986—),女,副教授,博士,研究方向为天然产物与健康。E-mail:lihongyan@ncu.edu.cn