王 敏 1,帅天罡 1,秦清娟 1,钟 耕 1,2, *
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400716)
摘 要:目的:研究以半干法酶解制备的魔芋葡甘低聚糖(konjac oligosaccharides,KOS)对大鼠肠道环境的影响。方法:将KOS掺入到饲料中饲喂Sprague-Dawley(SD)大鼠,30 d后测定大鼠盲肠内容物各项指标和盲肠、小肠的理化指标。结果:KOS可以明显增加大鼠粪便含水率及盲肠壁表面积、小肠的拉伸性能、盲肠内容物中双歧杆菌和乳酸菌的数量;降低盲肠内容物pH值及含水率、游离氨及挥发性醛类和含氮类物质含量;抑制大肠杆菌和梭状芽孢杆菌的生长,增加短链脂肪酸的产生量。结论:KOS可以调节大鼠肠道菌群组成,改善肠道环境,促进肠道健康,是一种优良的益生元。
关键词:魔芋葡甘低聚糖;肠道环境;盲肠内容物;益生元
魔芋葡甘聚糖(konjac glucomannan,KGM)又被称为魔芋多糖,是从魔芋块茎中提取的储备性多糖 [1-2]。它是由D-甘露糖和D-葡萄糖按物质的量比1.6∶1或1.69∶1通过β-1,4糖苷键聚合成的 [3]。KGM具有良好的吸水性、成膜性、增稠性、可塑性、乳化性、结构性、保水性和赋形性等多种性质 [4-5],其独特的流变和凝胶性能使其在功能性食品领域被广泛应用 [6-7]。同时它还具有提高机体免疫力、清洁胃肠道、减肥、降血脂、防止糖尿病、抗衰老等多种生理功效 [8]。但目前KGM的应用也存在较大问题,如KGM相对分子质量较高,黏度大,难以工业化生产,因此选取一种优良工艺,获取利于应用的产品成为了人们关注的焦点。
魔芋葡甘低聚糖(konjac oligosaccharide,KOS)味微甜,有魔芋特有的香味,且口感纯正。有研究者通过实验得出KOS对致病菌如金黄色葡萄球菌和鼠伤寒沙门氏菌有明显抑制作用 [9],并能抑制淀粉老化、清除自由基、对益生菌如乳酸菌有促进和增殖作用 [10-11]。目前,KOS的制备方法主要集中在物理法 [12-13]、化学法 [14-15]和生物酶法 [16-17]。本实验拟采取半干酶法制备KOS,即以β-甘露聚糖酶处理KGM,通过微波加热灭酶制备KOS。该方法具有反应条件温和、污染小、能耗低、得率高、提纯方法简单等特点 [18],并且避免了KGM相对分子质量大、黏度高、溶解度小等缺陷。
有研究表明,在体外发酵实验中KOS表现出良好的肠道益生性能,明显增加肠道益生菌数量和短链脂肪酸含量 [18],而其在动物体内能否表现出这种功能尚且不知。因此,本实验以Sprague-Dawley(SD)大鼠为受试体,研究KOS对其肠道环境的影响,为KOS作为益生元及其进一步开发利用提供实验依据。
1.1 动物、材料与试剂
清洁级SD大鼠80 只,体质量(180f10)g,大鼠及饲料均购自重庆腾鑫比尔实验动物销售有限公司,许可证号:SCXK(渝)2012-0003;动物房温度22~25 ℃,每天12 h明暗轮换(7:00ü19:00),实验动物环境设施合格证:普通级环境。
KOS粉末为自制 [19-20],外观呈粉状,白色,无臭无味,易溶于水,不溶于乙醇、乙醚等有机溶剂;经液相色谱和飞行质谱联用分析,可推导出该低聚糖是一种吡喃型葡甘露低聚糖。该低聚糖中相对分子质量最小的为甘露二糖,最大的为甘露十糖,表明该KOS粉末为葡甘二糖~葡甘十糖及少量单糖的混合物 [21]。
乙酸、丙酸、丁酸、正戊酸、异戊酸(色谱纯)阿拉丁试剂(上海)有限公司;RR820A荧光定量聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒、SYBR Premix Ex Taq TM、9763 DNA提取试剂盒日本TaKaRa公司。
1.2 仪器与设备
HH-4数字恒温水浴锅 金坛市富华仪器有限公司;JTI0001电子天平 上海精天电子仪器有限公司;DHG-9070A电热鼓风干燥箱 上海奇欣科学仪器有限公司;DSC4000差示扫描量热仪 美国Perkin Elmer公司;DHR-1流变仪 美国TA公司;MVAG803202微型快速黏度仪 德国Brabender GmbH公司;CT-3质构仪美国Brookfield公司。
1.3 方法
1.3.1 动物分组及处理
健康SD大鼠80 只,随机分为4 组,每组20 只,雌雄各半。两只同性别的大鼠放于一笼,自由进食进水,普通饲料预养1 周,观察实验动物对环境的适应情况。将含低(0.625 g/(kg·d))、中(1.250 g/(kg·d))、高(2.500 g/(kg·d))3 个不同剂量KOS粉碎样品的饲料分别给予3 组大鼠,另设给予不含样品的同种饲料的空白对照组。连续喂养30 d,自由进水,待实验结束后断头处死大鼠,解剖测定相关指标。
1.3.2 大鼠粪便含水率测定
实验开始后,每周的后3 d收集空白对照组和KOS不同剂量组大鼠粪便,称量各组大鼠新鲜粪便质量。然后将大鼠粪便放入60 ℃鼓风干燥箱中干燥12 h,按照公式(1)计算粪便含水率 [22]。
1.3.3 盲肠物理指标测定
1.3.3.1 盲肠内容物质量测定
取出盲肠,称量盲肠总质量,计为m 1;刮出盲肠内容物,用无菌生理盐水清洗肠壁,称取盲肠壁净质量,计为m 2;按照公式(2)计算盲肠内容物质量。
1.3.3.2 盲肠壁表面积测定
参照刘庆庆等 [23]的方法:将清洗干净的盲肠壁完全展开固定到A4纸上,勾出其轮廓,待纸完全干燥后将盲肠壁轮廓复印到打印纸上,然后将纸上的盲肠壁轮廓图剪切下来,称量其质量,计为m 3;另外准确称取25 cm 2打印纸质量,计为m 4,按照公式(3)计算盲肠壁表面积。
1.3.3.3 盲肠内容物pH值测定
取新鲜盲肠内容物于去离子水处理过的离心管中,加入10 倍质量的去离子水(V/m),放于漩涡振荡器上混合均匀,静置,用精密pH计测定上清液的pH值。
1.3.3.4 盲肠内容物含水率测定
取0.3 g左右盲肠内容物,放于恒质量的称量皿中,放于60 ℃鼓风干燥箱中干燥12 h,计算烘干前后盲肠内容物质量的差值 [22],按公式(4)计算盲肠内容物含水率。
1.3.4 盲肠内容物游离氨含量测定
标准曲线的绘制:称取1.004 5 g无水NH 4Cl溶于800 mL蒸馏水中,用稀释的盐酸调节pH值至2.0,再用蒸馏水定容至1 L,即质量浓度320 mg/L的贮备液。用贮备液配制成320、160、80、40、20、10、0 mg/L的标准溶液,制作标准曲线 [24]。
取0.5 g盲肠内容物加入10 倍质量的蒸馏水(V/m),漩涡振荡器混合均匀,4 000 r/min离心后取上清液40 μL,依次加入2.5 mL含有0.001 mol/L亚硝基铁氰化钠的0.500 mol/L苯酚溶液、2 mL含有0.625 mol/L氢氧化钠的0.030 mol/L次氯酸钠溶液。将上述混合液混匀,60 ℃保温5 min,于625 nm波长处测定吸光度(A 625 nm)。
1.3.5 盲肠内容物短链脂肪酸含量的测定
准确称取各组大鼠盲肠内容物0.5 g,溶于5 mL蒸馏水中,将其放到漩涡振荡仪上使盲肠内容物呈均匀悬浮液,静置10 min,4 000 r/min离心10 min。移取2 mL上清液于5 mL离心管中,加入2 mL无水乙醚,混匀,密封,于4 ℃冰箱中静置30 min,使乙醚和发酵液分层。移取上层乙醚溶液,过0.45 μm滤膜,用于有机酸的测定。
参照贾益群等 [25]的方法测定大鼠盲肠内容物中的短链脂肪酸含量:用气相色谱法测定发酵液中乙酸、丙酸、丁酸、戊酸及总酸含量。其中总酸含量为以上各种酸含量的总和。取乙酸、丙酸、正丁酸、异丁酸、正戊酸及异戊酸制备标准品贮备液,再按6 个稀释梯度的标准液制作标准曲线。
气相色谱条件:进样量1 µL;进样口温度220 ℃;柱流量0.95 mL/min,柱温90 ℃、平衡时间0.5 min,以5 ℃/min的速率升温至150 ℃,保留时间7 min;检测器温度230 ℃;氢气流量40 mL/min,空气流量400 mL/min,尾吹流量40 mL/min。
1.3.6 盲肠内容物微生物数量测定
1.3.6.1 细菌基因组DNA提取
分别取各组大鼠盲肠内容物0.3 g,用5 mL无菌磷酸盐缓冲溶液稀释,3 000 r/min低速离心5 min,取上清,12 000 r/min离心3 min,弃上清液。按照DNA提取试剂盒说明书进行细菌基因组总DNA提取,提取的DNA经微量紫外分光光度计测得A 260 nm/A 280 nm为1.8~2.0,说明DNA纯度较高,可以作为荧光定量PCR的DNA模板。
1.3.6.2 荧光定量PCR
盲肠内容物中微生物数量的测定采用SYBR GreenⅠ染料法,在定量PCR仪上进行。反应体系:SYBR GreenⅠ染料10 µL、上下游引物1 µL、DNA模板4 µL,最后以双蒸水补足20 µL;反应程序:95 ℃ 1 min,95 ℃ 5 s,56 ℃ 30 s,72 ℃ 1 min,40 个循环。循环结束后进行熔解,熔解程序:95 ℃ 5 s,65 ℃ 15 s,95 ℃ 0.1 ℃/s降温至65 ℃。用定量PCR得出的Ct值,采用2 -ΔΔCt法 [26]计算大肠杆菌、双歧杆菌、拟杆菌、梭状杆菌、乳酸菌的相对数量,相关引物见表1。其中-ΔΔCt=(Ct 目标菌-Ct 总细菌) 实验组-(Ct 目标菌-Ct 总细菌) 对照组。不同细菌DNA引物见表1。
表1 细菌DNA引物对照表
Table 1 Bacterial DNA primers used in fluorescence quantitative PCR

正向:GATTCTGGCTCAGGATGAACGC 22 61.9反向:CTGATAGGACGCGACCCAT 19 59.7大肠杆菌(Escherichia coli)正向:CTGATGTGAAAGCCCTCG 18 57.3反向:GAGCCTCAGCGTCAGTTG 18 59.6双歧杆菌(Bifidobɑcterium)细菌 序列(5′→3′) 长度/bp解链温度/℃总细菌 正向:CGGTACCTGACTAAGAAGC 19 57.6反向:AGTTTTATTCTTGCGAACG 19 51.1乳酸菌(Lactobacillus)正向:AGCAGCCGCGGTAAT 15 53.6反向:CTAAGCATTTCACCGCTA 18 52.7梭状芽孢杆菌(Bacterium fusiformis)正向:CATGCCGCGTGTATGAAGAA 20 57.8反向:CGGGTAACGTCAATGAGCAAA 21 58.0拟杆菌(Bacteroidetes)正向:AAATGACGGTACCTGACTAA 20 53.7反向:CTTTGAGTTTCATTCTTGCGAA 22 54.5
1.3.7 盲肠内容物挥发性成分含量测定
盲肠内容物中挥发性成分含量采用气相色谱-质谱联用仪测定 [27-28]:在20 mL样品瓶中加入0.5 g盲肠内容物,加入5 mL无菌缓冲溶液,在漩涡振荡器上振荡均匀,于60 ℃条件下顶空萃取30 min,250 ℃解吸5 min。
气相色谱-质谱条件:毛细管柱DB-5MS(30 mh0.25 µm,膜厚0.25 µm);柱升温程序:起始温度40 ℃,保持1 min,以20 ℃/min升至140 ℃,再以3 ℃/min升至155 ℃,保持1 min,然后以2 ℃/min升至190 ℃,保持1 min,最后以25 ℃/min升至250 ℃,保持5 min;汽化室温度:250 ℃;载气(He)流速:1.0 mL/min;进样方式:不分流进样。
1.3.8 小肠物理性质测定
小肠长度测定:将整段小肠(从胃根部算起,下至盲肠根部)剪下,自然拉直,用米尺测量小肠长度。
小肠系数测定:用分析天平测定小肠净质量,按照公式(5)计算大鼠小肠系数。
小肠拉伸性能采用质构仪测定:取下小肠中段10 cm,用于测定拉伸性。质构仪参数设定如下:探头TA3/100,夹具TA-RT-KIT,触发点负载0.02 N,测试速率0.5 mm/s,100%形变。
1.4 数据处理
实验结果以
 表示,使用Excel、SPSS软件进行数据处理和统计分析。
表示,使用Excel、SPSS软件进行数据处理和统计分析。
2.1 大鼠粪便含水率变化
实验过程中,各组大鼠粪便形状、大小均一,无黏连或稀便现象。其中KOS低、中剂量组大鼠粪便较其他各组表面更显光滑。如图1所示,各组大鼠在实验第1~4周内粪便含水率变化不大。比较各组可以发现,KOS各剂量组大鼠粪便含水率均高于空白对照组,其中雌性大鼠的KOS低、中剂量组和雄性大鼠的KOS中剂量组(第2~4周)粪便含水率均显著高于空白对照组(P<0.05)。以上结果说明饲喂KOS可增加大鼠粪便含水率。
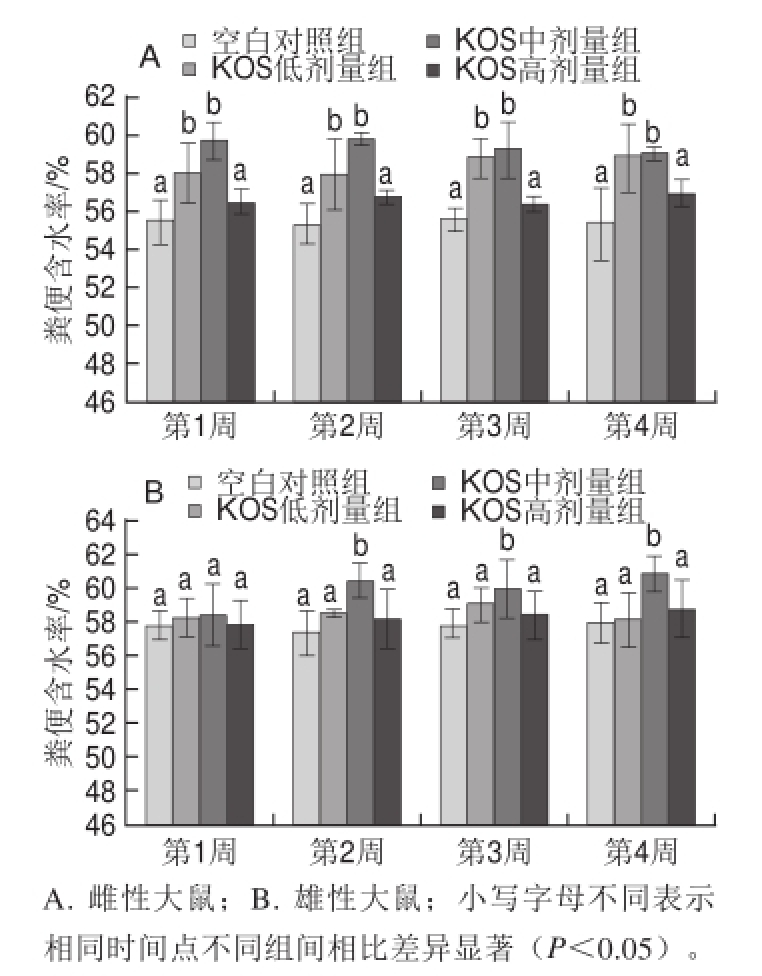
图1 KOS对大鼠粪便含水率的影响
Fig.1 Effect of KOS on fecal moisture content from rats
2.2 大鼠盲肠物理指标变化
表2 KOS对大鼠盲肠内容物质量、盲肠壁净质量和盲肠表面积的影响(
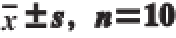 )
)
Table 2 Effect of KOS on cecal content weight, cecal wall weight and cecal wall area in rats (
 )
)
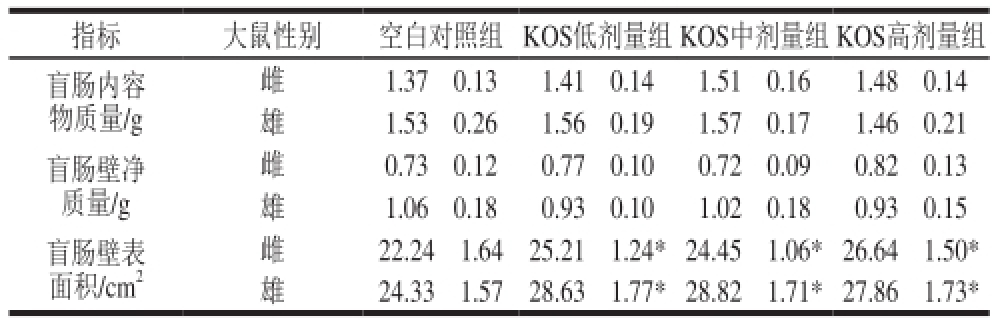
注: *.与空白对照组(相同性别)相比差异显著(P<0.05)。表6同。
指标 大鼠性别 空白对照组 KOS低剂量组KOS中剂量组KOS高剂量组盲肠内容物质量/g雌 1.37f0.13 1.41f0.14 1.51f0.16 1.48f0.14雄 1.53f0.26 1.56f0.19 1.57f0.17 1.46f0.21盲肠壁净质量/g雌 22.24f1.64 25.21f1.24 *24.45f1.06 *26.64f1.50 *雄 24.33f1.57 28.63f1.77 *28.82f1.71 *27.86f1.73 *雌 0.73f0.12 0.77f0.10 0.72f0.09 0.82f0.13雄 1.06f0.18 0.93f0.10 1.02f0.18 0.93f0.15盲肠壁表面积/cm 2
由表2可知,各组大鼠盲肠内容物质量和盲肠壁净质量均无显著差异(P>0.05),而KOS各剂量组大鼠的盲肠壁表面积均显著大于空白对照组(P<0.05)。这可能是由于KOS对小鼠肠道产生了刺激作用,增大了盲肠壁表面积,加强了大鼠盲肠对营养物质的吸收所致。
2.3 大鼠盲肠内容物pH值变化
肠道pH值是肠道健康的一个重要指标。如图2所示,KOS各剂量组大鼠盲肠内容物pH值较空白对照组均有所降低,且随着KOS剂量的增加,大鼠盲肠内容物pH值呈现先降低后升高的趋势,其中KOS中剂量组大鼠盲肠内容物pH值最低。KOS各剂量组大鼠盲肠内容物pH值均下降的现象与KOS体外发酵实验结果趋势一致 [18],即KOS可以降低盲肠内容物pH值。

图2 KOS对大鼠盲肠内容物pH值的影响
Fig.2 Effect of KOS on pH of cecal contents in rats
A. 雌性大鼠;B. 雄性大鼠;小写字母不同表示差异显著(P<0.05)。图3、4同。
2.4 大鼠盲肠内容物含水率变化
如图3所示,比较发现,雌、雄两个性别大鼠的盲肠内容物含水率均在45%以上,KOS各剂量组大鼠盲肠内容物含水率明显低于空白对照组,且随着KOS剂量的增加,大鼠盲肠内容物含水率先降低后稍有增加,在雌、雄两个性别大鼠中都有此规律。

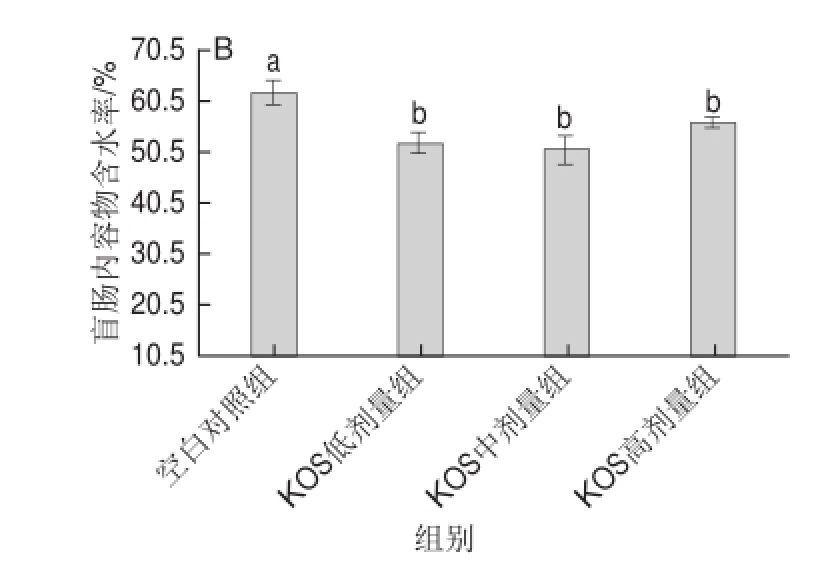
图3 KOS对大鼠盲肠内容物含水率的影响
Fig.3 Effect of KOS on the moisture content of cecal contents in rats
2.5 大鼠盲肠内容物游离氨含量变化
游离氨是造成肠道内容物气味、对肠道健康不利的主要物质。如图4所示,KOS各剂量组大鼠盲肠内容物中游离氨含量显著低于空白对照组(P<0.05),但KOS高剂量组大鼠盲肠内容物中游离氨含量却有升高的趋势,原因目前尚不明确,还有待进一步研究。由此可以看出KOS可以显著降低盲肠中游离氨含量,这正好与盲肠内容物pH值变化趋势吻合。

图4 KOS对大鼠盲肠内容物游离氨含量影响
Fig.4 Effect of KOS on the free ammonia content of cecal contents in rats
2.6 大鼠盲肠内容物中微生物数量变化
如表3所示,KOS各剂量组大鼠盲肠内容物中乳酸菌和双歧杆菌数量均显著高于空白组(P<0.05),且随着KOS剂量的增加,乳酸菌和双歧杆菌数量均呈现出先增加后降低的趋势。而梭状芽孢杆菌和大肠杆菌数量均显著降低(P<0.05),且与乳酸菌和双歧杆菌呈现相反的趋势;而KOS各剂量组大鼠盲肠内容物中拟杆菌数量与空白对照组均无显著差异(P>0.05)。KOS对大鼠肠道乳酸菌、双歧杆菌和梭状芽孢杆菌的作用与体外发酵结果一致 [18],而对大肠杆菌的影响不同,这可能是因为体外发酵条件难以控制,从而造成的实验误差较大所致。
表3 KOS对盲肠内容物微生物相对数量的影响(x±s,n=10)
Table 3 Effect of KOS on bacterial counts in cecal contents in rats (x± s,n= 10)
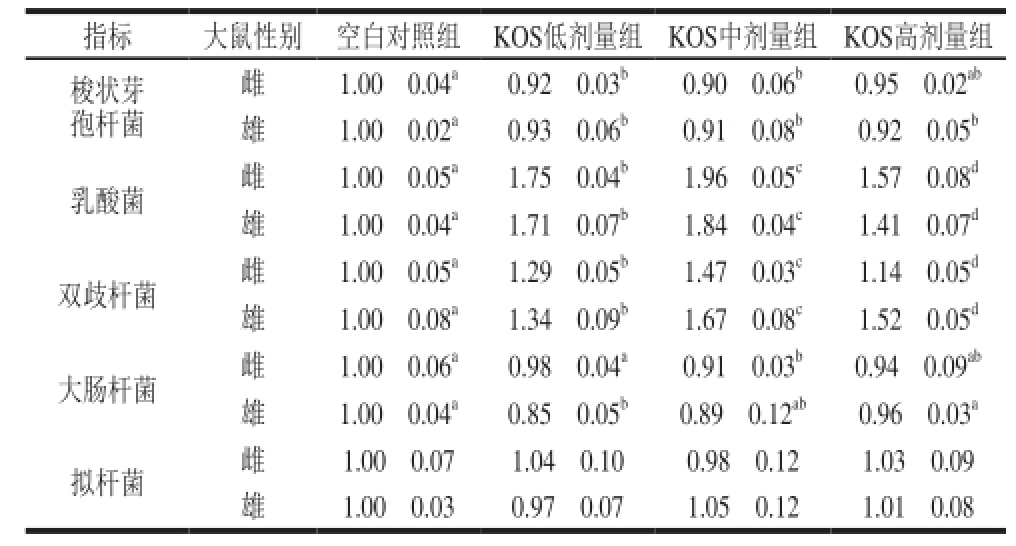
注:同行小写字母不同表示差异显著(P<0.05)。表 4同。
雌 1.00f0.04 a0.92f0.03 b0.90f0.06 b0.95f0.02 ab雄 1.00f0.02 a0.93f0.06 b0.91f0.08 b0.92f0.05 b乳酸菌 雌 1.00f0.05 a1.75f0.04 b1.96f0.05 c1.57f0.08 d雄 1.00f0.04 a1.71f0.07 b1.84f0.04 c1.41f0.07 d双歧杆菌 雌 1.00f0.05 a1.29f0.05 b1.47f0.03 c1.14f0.05 d雄 1.00f0.08 a1.34f0.09 b1.67f0.08 c1.52f0.05 d大肠杆菌 雌 1.00f0.06 a0.98f0.04 a0.91f0.03 b0.94f0.09 ab雄 1.00f0.04 a0.85f0.05 b0.89f0.12 ab0.96f0.03 a拟杆菌 雌 1.00f0.07 1.04f0.10 0.98f0.12 1.03f0.09雄 1.00f0.03 0.97f0.07 1.05f0.12 1.01f0.08指标 大鼠性别 空白对照组 KOS低剂量组 KOS中剂量组 KOS高剂量组梭状芽孢杆菌
2.7 KOS对大鼠盲肠内容物短链脂肪酸含量的影响
表4 KOS对大鼠盲肠内容物中短链脂肪酸含量的影响(x±s,n=10)
Table 4 Effect of KOS on cecal SCFAs in rats (x± s,n = 10) mmol/g
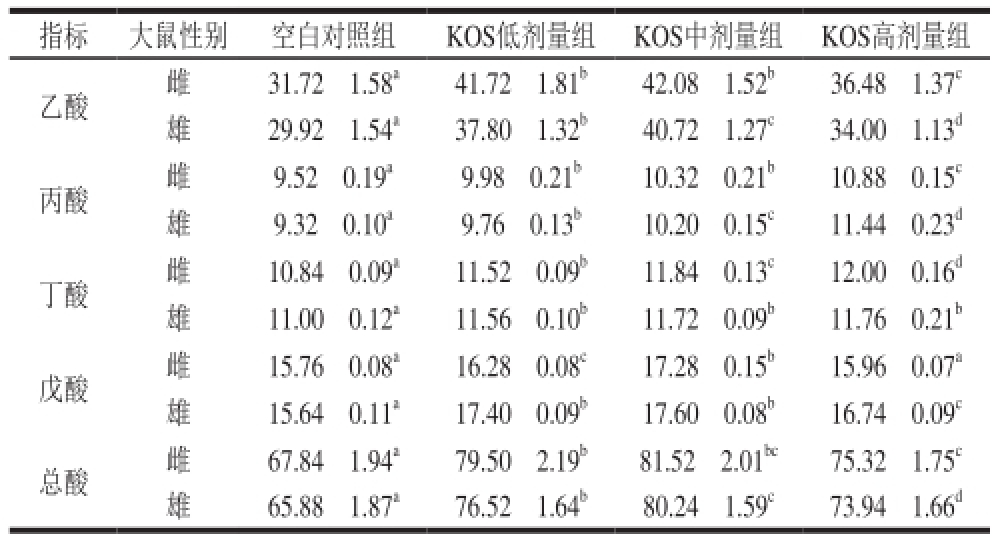
指标 大鼠性别 空白对照组 KOS低剂量组 KOS中剂量组 KOS高剂量组乙酸 雌 31.72f1.58 a41.72f1.81 b42.08f1.52 b36.48f1.37 c雄 29.92f1.54 a37.80f1.32 b40.72f1.27 c34.00f1.13 d丙酸 雌 9.52f0.19 a9.98f0.21 b10.32f0.21 b10.88f0.15 c雄 9.32f0.10 a9.76f0.13 b10.20f0.15 c11.44f0.23 d丁酸 雌 10.84f0.09 a11.52f0.09 b11.84f0.13 c12.00f0.16 d雄 11.00f0.12 a11.56f0.10 b11.72f0.09 b11.76f0.21 b戊酸 雌 15.76f0.08 a16.28f0.08 c17.28f0.15 b15.96f0.07 a雄 15.64f0.11 a17.40f0.09 b17.60f0.08 b16.74f0.09 c总酸 雌 67.84f1.94 a79.50f2.19 b81.52f2.01 bc75.32f1.75 c雄 65.88f1.87 a76.52f1.64 b80.24f1.59 c73.94f1.66 d
如表4所示,在饲料中添加KOS后,雌、雄大鼠盲肠中乙酸和戊酸含量均显著升高(P<0.05),且随着KOS剂量的增加呈现先升高后降低的趋势,这与肠道益生菌数量的变化趋势相同;同时也使大鼠盲肠中丙酸和丁酸含量显著增加(P<0.05),且变化趋势与KOS添加量成正相关。KOS各剂量组大鼠盲肠中总酸含量显著高于空白对照组(P<0.05),且与乙酸含量具有相同的变化趋势,KOS中剂量组总酸含量最高,这与体外发酵实验结果趋势一致 [18]。
2.8 大鼠盲肠内容物挥发性物质种类和含量变化
如表5所示,共检测出醛类、酮类、醇类和吲哚类总计15 种挥发性物质,还有部分烷烃类。其中变化最明显的是吲哚类物质,与空白对照组相比,摄入KOS的大鼠盲肠内容物中吲哚的相对含量明显降低。另外,有较大变化的挥发性物质还有月桂醇、豆蔻醇、肉豆蔻醛和香叶基丙酮等。这种现象同样与体外发酵实验挥发性物质测定结果相符 [18],由此可以推断KOS可以减少大鼠盲肠中刺激性物质的产生。
表5 KOS对大鼠盲肠内容物挥发性物质含量的影响(x±s,n=10)
Table 5 Effect of KOS on the volatile substance contents of cecal contents in rats (x± s,n= 10) %

注:—.未检出。
序号 名称 分子式雌性大鼠 雄性大鼠空白对照组KOS低剂量组1 癸醛 C 10H 20O 0.47 0.45 0.32 0.27 0.59 ü 0.22 0.32 2 甲基壬基甲酮 C 11H 22O 1.23 ü ü ü 0.92 ü 0.25 ü 3 吲哚 C 8H 7N 5.40 0.80 1.40 1.20 5.10 1.30 1.70 1.80 4 香叶基丙酮 C 13H 22O 0.81 1.84 0.87 0.86 0.57 1.59 1.20 0.94 5 2,4-二叔丁基苯酚 C 14H 220.94 ü ü 0.57 1.11 0.55 0.65 0.68 6 2-十二烷酮 C 12H 24O 1.16 0.4 0.77 0.77 0.86 ü ü ü 7 十六醛 C 16H 32O 6.08 7.35 ü ü 11.24 10.31 6.39 ü 8 月桂醇 C 12H 26O 4.69 3.89 1.48 0.60 7.39 3.45 3.88 2.45 9 豆蔻醇 C 14H 30O 0.83 1.79 2.09 2.36 ü 1.03 1.18 1.89 10 3-十六烯 C 16H 322.68 2.1 2.55 3.59 4.22 2.36 1.75 2.10 11 十七烷酮 C 17H 34O ü 0.70 ü 2.36 2.26 1.35 0.60 ü 12 1-十七烷醇 CH 3(CH 2) 16OH 49.2 28.29 31.46 42.2 48.1 34.61 32.40 35.31 13 肉豆蔻醛 C 14H 28O ü 4.64 3.65 2.52 ü 4.12 3.94 3.81 14 十八醛 C 18H 36O 0.44 0.35 0.74 0.47 0.17 0.69 0.62 1.10 15 十八醇 C 18H 38O ü ü 2.46 3.42 0.46 ü ü 0.85 16 烷烃类 6.25 10.75 3.61 6.21 3.53 15.19 8.96 12.93 KOS高剂量组KOS中剂量组KOS低剂量组空白对照组KOS高剂量组KOS中剂量组
肠道中的游离氨、挥发性物质中的吲哚等有害物质主要是由肠道中有害菌的生长代谢产生。KOS抑制了大鼠肠道中有害菌的生长,从而减少了盲肠内容物中游离氨和吲哚的含量。
2.9 大鼠小肠物理性质变化
表6 KOS对大鼠小肠物理性质的影响(x±s,n=10)
Table 6 Effect of KOS on small intestinal parameters in rats (x± s,n= 10)
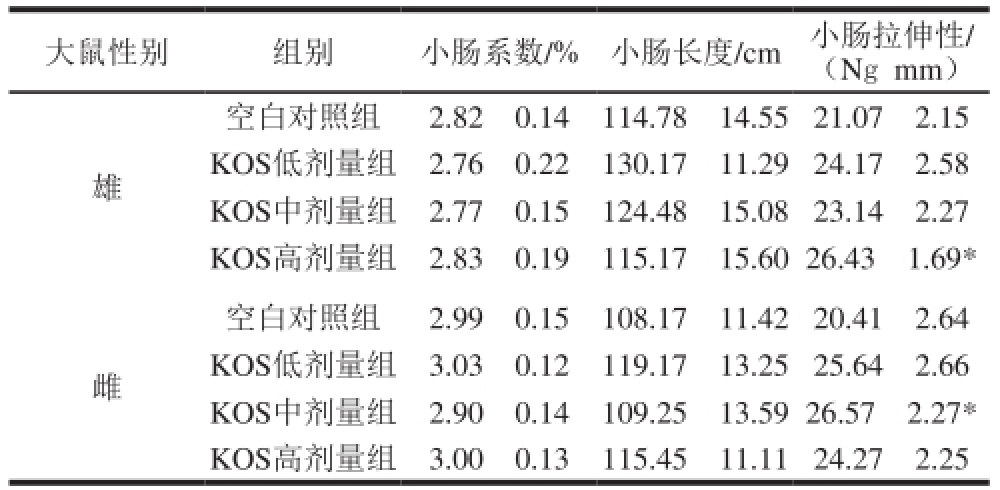
大鼠性别 组别 小肠系数/% 小肠长度/cm 小肠拉伸性/(Ngmm)雄空白对照组 2.82f0.14 114.78f14.5521.07f2.15 KOS低剂量组 2.76f0.22 130.17f11.2924.17f2.58 KOS中剂量组 2.77f0.15 124.48f15.0823.14f2.27 KOS高剂量组 2.83f0.19 115.17f15.6026.43f1.69 *雌空白对照组 2.99f0.15 108.17f11.4220.41f2.64 KOS低剂量组 3.03f0.12 119.17f13.2525.64f2.66 KOS中剂量组 2.90f0.14 109.25f13.5926.57f2.27 *KOS高剂量组 3.00f0.13 115.45f11.1124.27f2.25
如表6所示,KOS各剂量组大鼠的小肠系数和小肠长度变化不明显,而小肠拉伸性均高于空白对照组,其中雄性KOS高剂量组和雌性KOS中剂量组与空白对照组相比存在显著差异(P<0.05),但是不存在明显的剂量-效应关系。上述结果表明KOS可以增加小肠的拉伸性能。目前,小肠黏膜下基质(small intestinal submucosa,SIS)作为一种新型的生物衍生支架材料正在得到更多关注。SIS在心血管、泌尿系统、胃肠类等管状组织的治疗的恢复中有良好作用。但SIS作为一种组织工程化血管生物材料,必须具有适当的力学特性如弹性,才能保证其植入宿主体内后提供暂时的机械支撑力。因此增强小肠的拉伸性能可为新材料的应用提供有利条件 [29-30],而本实验结果表明KOS具有增加大鼠小肠拉伸性能的良好作用。
本实验通过测定大鼠粪便含水率,盲肠壁净质量、表面积,盲肠内容物质量、pH值、游离氨含量、短链脂肪酸含量、微生物数量、挥发性物质种类和含量等项目检测KOS对大鼠肠道健康的影响,结果表明KOS可以明显增加大鼠粪便含水率,降低盲肠内容物pH值和含水率;增加大鼠盲肠壁表面积,加强小肠的拉伸性能;增加大鼠盲肠内容物中双歧杆菌和乳酸菌的数量、短链脂肪酸的产生量,抑制大肠杆菌和梭状芽孢杆菌的生长;降低大鼠盲肠内容物中游离氨及挥发性含氮类物质含量。
此外,从大鼠盲肠内容物pH值、短链脂肪酸含量、微生物数量和挥发性物质含量等指标的变化趋势可以看出,KOS体内实验和体外发酵实验结果趋势基本相同。由此可以推断,KOS可以调节大鼠肠道菌群组成,改善肠道环境,促进肠道健康,是一种优良的益生元。
参考文献:
[1] LI Bin, XIE Bijun, KENNEDY J F. RETRACTED: Studies on the molecular chain morphology of konjac glucomannan[J]. Carbohydrate Polymers, 2006, 64(4): 510-515. DOI:10.1016/j.carbpol.2005.11.001.
[2] 唐贵丹, 杜小兵, 张兴国, 等. 酸性乙醇法纯化魔芋葡甘聚糖的研究[J].食品科学, 2008, 29(12): 308-311.
[3] KATO K, WATANABE T, MATSUDA K. Studies on the chemical structure of konjac mannan: part II. Isolation and characterization of oligosaccharides from the enzymatic hydrolyzate of the mannan[J]. Agricultural and Biological Chemistry, 1970, 34(4): 532-539. DOI:10. 1080/00021369.1970.10859645.
[4] ZHANG Yingqing, XIE Bijun, GAN Xin. Advance in the applications of konjac glucomannan and its derivatives[J]. Carbohydrate Polymers,2005, 60(1): 27-31. DOI:10.1016/j.carbpol.2004.11.003.
[5] ALONSO-SANDE M, TEIJEIRO-OSORIO D, REMUÑÁNLÓPEZ C, et al. Glucomannan, a promising polysaccharide for biopharmaceutical purposes[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2009, 72(2): 453-462. DOI:10.1016/ j.ejpb.2008.02.005.
[6] LIU Jinjin, ZHU Kunkun, YE Ting. Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J]. Food Research International, 2013, 51(2): 437-443. DOI:10.1016/ j.foodres.2013.01.002.
[7] 夏朝红, 高山俊. 魔芋葡甘聚糖的物理化学性能及生理学应用[J].武汉大学学报(医学版), 2011, 32(5): 700-704.
[8] 金灵红, 朱伟云. 魔芋葡甘聚糖功能及其应用研究进展[J]. 畜牧与兽医, 2014, 46(2): 97-99.
[9] AL-GHAZZEWI F H, TESTER R F, ALVANI K. The synbiotic effects of konjac glucomannan hydrolysates (GMH) and lactobacilli on the growth of Staphylococcus aureus and Salmonella typhimurium[J]. Nutrition & Food Science, 2012, 42(2): 97-101.
[10] AL-GHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2012, 92(11): 2394-2396. DOI:10.1002/jsfa.5678.
[11] 张琳. 魔芋低聚糖的制备及其性质研究[D]. 长春: 吉林大学, 2013:15-17.
[12] 丁金龙, 孙远明, 杨幼慧, 等. 魔芋葡甘聚糖机械力化学降解研究[J]. 现代食品科技, 2008, 24(7): 621-623. DOI:10.3969/ j.issn.1673-9078.2008.07.001.
[13] 黄永春, 谢清若, 何仁, 等. 微波辅助H 2O 2降解魔芋葡甘聚糖的研究[J].食品科学, 2005, 26(8): 197-200.
[14] 罗清楠, 谭玉荣, 刘宏, 等. 响应曲面法优化酸法魔芋葡甘露聚糖水解工艺[J]. 食品科学, 2012, 33(6): 119-122.
[15] 娄广庆, 林向阳, 彭树美, 等. 臭氧降解魔芋葡甘露聚糖的效果研究[J].食品科学, 2009, 30(20): 203-206.
[16] 张迎庆, 干信, 谢笔钧. 纤维素酶制备魔芋葡甘低聚糖[J]. 吉首大学学报(自然科学版), 2003, 21(3): 42-44. DOI:10.3969/ j.issn.1007-2985.2003.03.011.
[17] 李剑芳, 邬敏辰, 夏文水, 等. 黑曲霉酸性β-甘露聚糖酶及制备魔芋低聚糖研究[D]. 无锡: 江南大学, 2007: 23-26.
[18] 秦清娟, 徐小青, 张媛, 等. 魔芋葡甘低聚糖毒理学及肠道益生性评价[J]. 食品科学, 2014, 35(21): 244-248. DOI:10.7506/spkx1002-6630-201421048.
[19] YASUHIRO K, AKIKO Y, KIRIKO H, et al. Convenient synthesis of a sialylglycopeptide-thioester having an intact and homogeneous complex-type disialyl-oligosaccharide[J]. Carbohydrate Research,2006, 341(10): 1333-1340. DOI:10.1016/j.carres.2006.04.037.
[20] 秦清娟, 张媛, 刘倍毓, 等. 半干法酶解制备魔芋葡甘低聚糖工艺及其抗氧化性能研究[J]. 食品工业科技, 2013, 34(24): 186-191.
[21] 汪建明, 赵征, 王勇志. 低聚糖的分离与鉴定[J]. 食品研究与开发,2000, 21(3): 3-5. DOI:10.3969/j.issn.1005-6521.2000.03.001.
[22] 吴怡. 大黄敷脐对慢传输型便秘小鼠影响的实验研究[D]. 杭州: 浙江中医药大学, 2014.
[23] 刘庆庆, 任文瑾, 吕娇, 等. 花椒精灌胃剂量对去势大鼠肠道健康的影响[J]. 食品科学, 2013, 34(17): 241-245. DOI:10.7506/spkx1002-6630-201317051.
[24] 周笑犁. 大豆寡糖对肠道微生态与免疫功能的调控作用及机制研究[D]. 南昌: 南昌大学, 2013: 5-6.
[25] 贾益群, 叶福媛, 王双, 等. 生物样品中短链脂肪酸的快速提取与分析方法[J]. 实验室研究与探索, 2012, 31(7): 262-264.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 -ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262. DOI:10.1006/meth.2001.1262.
[27] 孟凌玉. 虾头酶解产物微生物混合发酵工艺及其风味成分的变化[D].湛江: 广东海洋大学, 2013: 32-34.
[28] 徐永霞, 刘滢, 姜程程, 等. 固相微萃取及其在水产品风味分析中的应用[J]. 食品与发酵工业, 2013, 39(8): 176-181.
[29] 冷晔, 丁祖泉, 龚璐璐. 小肠黏膜下基质弹性模量的测定[J].中国修复重建外科杂志, 2006, 20(3): 292-294. DOI:10.3321/ j.issn:1002-1892.2006.03.026.
[30] 杨凯, 张育敏, 张乃丽, 等. 小肠黏膜下层在组织修复重建中的应用研究进展[J]. 中国修复重建外科杂志, 2013, 27(9): 1138-1143.
Effect of Konjac Oligosaccharides on Rat Intestinal Environment
WANG Min
1, SHUAI Tiangang
1, QIN Qingjuan
1, ZHONG Geng
1,2,
*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Engineering Research Center of Regional Food, Chongqing 400716, China)
Abstract:Objective: To evaluate the effect of konjac oligosaccharides (KOS), prepared by semi-drying enzymatic hydrolysis, on the rat intestinal environment. Methods: The cecal contents, cecal parameters and small intestinal parameters of Sprague-Dawley rats were measured to evaluate the safety of KOS after 30 days of dietary incorporation with KOS. Results: KOS could significantly increase the moisture content of rat feces and the surface area of the cecum wall, the tensile strength of the small intestine, the total amounts of beneficial bacteria such as Bifidobɑcterium spp., Lactobacillus and reduce pH and moisture, volatile aldehydes and nitrogenous substances contents of the cecal contents. In addition, KOS inhibited the growth of Escherichia coli and Bacterium fusiformis and increased the total amount of short-chain fatty acids (SCFAs). Conclusion: KOS can adjust the intestinal microflora, improve the intestinal environment and promote intestinal health as an excellent prebiotic.
Key words:konjac oligosaccharides (KOS); intestinal environment; cecal contents; prebiotic
DOI:10.7506/spkx1002-6630-201607036
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)07-0197-07
引文格式:
王敏, 帅天罡, 秦清娟, 等. 魔芋葡甘低聚糖对大鼠肠道环境的影响[J]. 食品科学, 2016, 37(7): 197-203. DOI:10.7506/ spkx1002-6630-201607036. http://www.spkx.net.cn
WANG Min, SHUAI Tiangang, QIN Qingjuan, et al. Effect of konjac oligosaccharides on rat intestinal environment[J]. Food Science, 2016, 37(7): 197-203. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607036. http://www.spkx.net.cn
收稿日期:2015-05-13
基金项目:重庆市“121”科技支撑示范工程项目(cstc2014zktjccxyyBX0032);重庆市前沿与应用基础研究计划一般项目(cstc2014jcyjA80040)
作者简介:王敏(1991—),女,硕士研究生,研究方向为食品科学。E-mail:414008142@qq.com
*通信作者:钟耕(1964—),男,教授,博士,研究方向为粮食、油脂、植物蛋白。E-mail:zhongdg@126.com