宫 强,阮梦蝶,马丽苹,牛明福,任国艳,侯 颖,秦翠丽,孙晓菲,李 阳
(河南科技大学食品与生物工程学院,河南省食品原料工程技术研究中心,河南 洛阳 471023)
摘 要:为探讨菊粉对小鼠的免疫调节作用,本实验以200、400、600 mg/kg的剂量对雌性BALB/c小鼠进行灌胃,每天1 次,连续15 d。通过对小鼠免疫功能的测定评价不同剂量菊粉的免疫调节作用。结果显示,各剂量的菊粉灌胃组小鼠各项免疫指标均高于对照组。其中,中、高剂量组小鼠的免疫器官指数、腹腔巨噬细胞吞噬能力、血清溶血素水平、脾淋巴细胞增殖水平和γ干扰素(interferon-γ,IFN-γ)分泌水平显著(P<0.05)或极显著(P<0.01)高于对照组。以上研究结果表明,菊粉对小鼠具有较好的免疫增强作用。
关键词:菊粉;小鼠;免疫调节
多糖又称为多聚糖,是由10 个以上单糖残基以糖苷键相连而形成的聚合糖高分子碳水化合物,包括微生物多糖、植物多糖和动物多糖等,是生物细胞的重要组成部分,在维持细胞的正常结构、控制细胞分裂分化、调节细胞生长衰老以及能量储存等方面具有重要的生物学功能 [1]。目前生物多糖的应用已涉及人类生活的各个领域,如微生物多糖作为增稠剂、乳化剂、食品添加剂等被广泛应用于石油、化工、食品等多种工业领域。此外,有些生物多糖也已作为免疫增强剂应用于医药领域 [2]。自20世纪30年代Shear发现生物多糖具有抗肿瘤活性之后,人们对多糖免疫调节活性的研究日益深入 [3]。尤其是近30 a来,随着分子生物学技术的迅猛发展,人们对多糖的生物学功能有了全新的认识,从而极大地促进了糖生物学的发展。现有的研究表明多种生物多糖具有广谱的免疫调节作用,如提高巨噬细胞的吞噬能力、促进T、B淋巴细胞的增殖、激活补体系统等 [4]。
菊粉是存在于菊芋、菊苣等多种菊科植物中的一种天然多糖,其主要成分是一类结构相似的果聚糖,与低聚糖结构上的根本区别在于聚合度上的差异,因而可将低聚果糖认为是菊粉的一种 [5],而低聚果糖则具有促进双歧杆菌增殖、诱导肠黏膜淋巴系统的免疫活性、激活体液和细胞免疫应答等多种功能 [6]。魏轶男 [7]的研究表明,菊粉添加于肉仔鸡饲料中可有效提高其免疫器官指数并具有一定的抗氧化能力。Gourbeyre等 [8]将低聚半乳糖/菊粉益生元添加于饮食中喂养小鼠,结果可增强实验动物的免疫功能及肠道屏障功能。上述研究是将菊粉作为饲料或食品添加剂来探讨菊粉对动物机体免疫功能的促进作用,而单独服用菊粉是否也具有此作用?本实验对此进行一定的研究,以期为菊粉保健食品的开发提供一定的依据。
1.1 动物、细胞及试剂
雌性BALB/c小鼠购自河南科技大学实验动物中心;鸡红细胞和绵羊红细胞(sheep red blood cell,SRBC)购自郑州百基生物工程有限公司。豚鼠补体由河南科技大学食品与生物工程学院、河南省食品原料工程技术研究中心制备:分别采取5 只豚鼠新鲜血液,分离血清,充分混合均匀后,取5 mL血清加入1 mL压积SRBC,置于4 ℃冰箱内吸附30 min后离心取上清液,置于-20 ℃以下保存备用。
菊粉、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、刀豆蛋白A(concanavalin A,ConA)及γ干扰素(interferon-γ,IFN-γ)检测试剂盒美国Sigma公司。
1.2 方法
1.2.1 小鼠分组及饲喂
体质量为18~20 g的雌性BALB/c小鼠共100 只,随机平均分为4 组,分别为对照组、低剂量组、中剂量组和高剂量组。菊粉按照实验所需剂量配制成相应浓度,参照文献[9]的剂量给药,低、中和高剂量组小鼠分别按照菊粉200、400、600 mg/kg(以体质量计)的剂量进行灌胃,每日1 次,连续15 d,期间对照组小鼠正常状态下饲喂。
1.2.2 小鼠免疫器官指数的测定
灌胃15 d后,每组随机取5 只小鼠,称取其体质量,随后脱颈处死小鼠,无菌条件下摘取胸腺和脾脏,去除脂肪后称质量,计算各组小鼠的胸腺和脾脏指数,计算公式如下。
1.2.3 小鼠腹腔巨噬细胞吞噬能力的测定
采用小鼠腹腔巨噬细胞吞噬鸡红细胞的方法进行测定 [10]。末次灌胃2 h后,每组随机取5 只小鼠,向小鼠腹腔注射0.5 mL体积分数为10%的鸡红细胞悬液,6 h后脱颈,处死小鼠。再向小鼠腹腔注射2 mL生理盐水,轻揉腹部边缘5 min,以无菌注射器吸取腹腔液,滴于洁净的载玻片上,于37 ℃湿盒内放置30 min。随后以生理盐水漂洗,自然干燥后以丙酮-甲醇(体积比1∶1)固定,以体积分数为4%的Giemsa-磷酸缓冲液染色3 min,无菌水漂洗后自然干燥,油镜下观察,计算小鼠腹腔巨噬细胞的吞噬百分比和吞噬指数,计算公式如下 [11-12]。

1.2.4 血清溶血素的检测
采用半数溶血值法测定各组小鼠的血清溶血素含量。各组小鼠在灌胃15 d后,各取5 只给予腹腔注射0.2 mL 2%的SRBC悬液。正常饲喂5 d后眼眶采血,分离血清,以无菌生理盐水稀释200 倍。取干净试管,向其中依次加入稀释后的血清1 mL,10%的SRBC 0.5 mL和补体(稀释10 倍的生理盐水)1 mL,混合均匀,同时设立无血清的空白对照管,于37 ℃水浴中放置30 min后以冰水浴终止反应。离心取上清1 mL与3 mL都氏试剂混合均匀,同时取10%的SRBC悬液0.25 mL加都氏试剂至4 mL充分混匀作为半数溶血管。放置10 min后,以对照管为空白,测定各样品管在540 nm波长处的光密度(OD)值,以半数溶血值(half value of hemolysin,HC 50)表示各组小鼠血清溶血素的含量,计算公式如下。
1.2.5 脾淋巴细胞增殖实验
末次灌胃2 d后,每组取小鼠5 只脱颈处死,无菌采取脾脏制备脾细胞悬液,调整细胞浓度为1h10 7个/mL。96 孔细胞培养板每孔加入脾细胞悬液50 μL,同时设阴性对照。实验孔和阴性对照孔各设3 个重复,实验孔每孔加入50 μL 10 μg/mL的ConA,阴性对照孔每孔加入50 μL RPIM1640培养液,置于37 ℃,体积分数为5%的CO 2培养箱培养48 h后,每孔加入5 mg/mL MTT 10 μL,继续培3 h。然后每孔加100 μL十二烷基硫酸钠-盐酸盐(sodium dodecyl sulfate- hydrochloric acid,SDS-HCl),继续作用2 h终止反应,测定570 nm波长处光密度值,计算刺激值(stimulation index,SI),计算公式如下。
1.2.6 IFN-γ分泌实验
末次灌胃2 d后,每组取5 只小鼠处死,无菌条件下迅速取出脾脏制备脾淋巴细胞悬液,细胞计数后调整细胞浓度为1h10 7个/mL。按上述同样方法制备ConA活化的脾淋巴细胞,于37 ℃ 体积分数为5% CO 2培养箱中培养48 h后,吸取培养上清液,离心收集后于-20 ℃保存。按照IFN-γ检测试剂盒制作标准曲线,对免疫小鼠脾细胞分泌的IFN-γ进行检测。
2.1 菊粉对免疫器官指数的影响
对各组小鼠灌胃结束后摘取胸腺和脾脏,测定其免疫器官指数。由表1可知,以菊粉灌胃15 d后,低、中、高剂量组小鼠的胸腺指数和脾脏指数均较对照组有所升高,其中,中剂量组与高剂量组小鼠的免疫器官指数与对照组相比差异极显著(P<0.01),表明菊粉可显著促进小鼠免疫器官的发育。
表1 菊粉对小鼠免疫器官指数的影响
Table 1 Effect of inulin on immune organ indices of mice
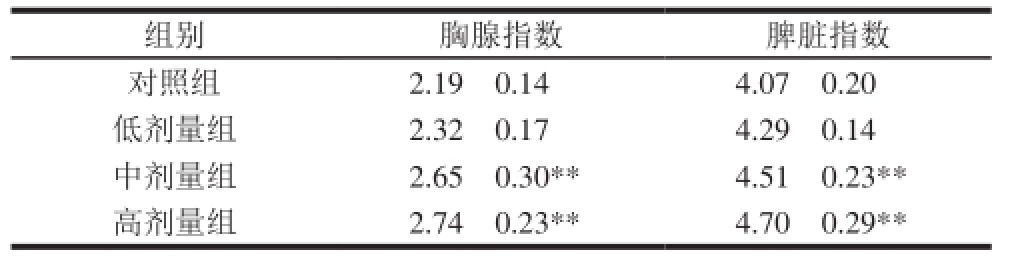
注: * *.与对照组相比差异极显著(P<0.01)。下同。
组别 胸腺指数 脾脏指数对照组 2.19f0.14 4.07f0.20低剂量组 2.32f0.17 4.29f0.14中剂量组 2.65f0.30 * *4.51f0.23 * *高剂量组 2.74f0.23 * *4.70f0.29 * *
2.2 菊粉对小鼠巨噬细胞吞噬能力的影响
以吞噬鸡红细胞法测定各组小鼠巨噬细胞吞噬能力。由表2可知,菊粉具有增强小鼠巨噬细胞吞噬红细胞的能力,且随灌胃剂量的增加而增强。其中,中、高剂量组小鼠腹腔巨噬细胞对鸡红细胞的吞噬率与对照组相比差异显著(P<0.05),其吞噬指数与对照相比差异极显著(P<0.01)。
表2 菊粉对小鼠腹腔巨噬细胞吞噬能力的影响
Table 2 Effect of inulin on phagocytic capacity of peritoneal macrophages in mice

注: *.与对照组相比差异显著(P<0.05)。下同。
?
2.3 小鼠血清溶血素检测结果
以半数溶血值法测定不同剂量菊粉灌胃后小鼠血清溶血素的生成情况。由表3可知,低剂量组小鼠半数溶血值高于对照组,但两者在统计学上无明显差异;中、高剂量组与对照组相比,其差异分别为显著(P<0.05)和极显著(P<0.01),表明随菊粉剂量的升高,其抗体生成能力有所增强。
表3 小鼠血清溶血素测定结果
Table 3 Contents of serum hemolysin in mice
组别 对照组 低剂量组 中剂量组 高剂量组半数溶血值(HC 50) 43.74f7.01 51.82f6.85 56.59f8.05 *63.48f7.35 * *
2.4 淋巴细胞增殖实验结果
末次灌胃2 d后,制备各组小鼠的脾淋巴细胞悬液,MTT法检测其增殖情况。由图1可知,菊粉灌胃组小鼠的脾淋巴细胞增殖水平均高于对照组,且随剂量的增加而升高,中剂量组与对照组相比其SI值差异显著(P<0.05),而高剂量组则与对照组表现出极显著的差异(P<0.01)。
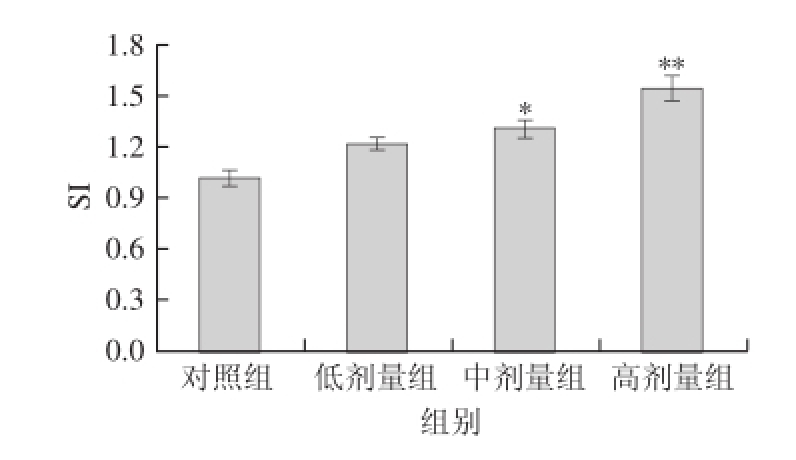
图1 小鼠淋巴细胞增殖情况
Fig.1 Proliferation of lymphocytes from mice administered with inulin
*. 与对照组相比差异显著(P<0.05)。 * *. 与对照组相比差异极显著(P<0.01)。下同。
2.5 IFN-γ分泌水平
末次灌胃2 d后,同样制备脾淋巴细胞悬液,以ConA进行诱生,收集上清,检测上清中IFN-γ的含量。由图2可知,经ConA诱生后,低剂量组小鼠脾淋巴细胞分泌的IFN-γ水平略高于对照组,两者无统计学差异,中、高剂量组分泌的IFN-γ水平则明显高于对照组(P<0.01)。

图2 小鼠脾淋巴细胞IFN-γ分泌水平
Fig.2 Levels of IFN-γ secreted by splenic lymphocytes in mice
近年来,随着人们对各种生物多糖保健功能的深入了解,对其在免疫调节方面的探索已成为免疫学领域研究的热点之一。国内外研究表明多种生物多糖均具有一定的免疫调节作用 [13-19],菊粉即是其中之一。已有的研究表明,将菊粉作为饲料添加剂可促进畜禽的生长并可提高其血清免疫球蛋白的含量 [20-22]。另外,菊粉也可作为疫苗佐剂以增强疫苗的免疫效果,如Saade等 [23]实验表明菊粉作为疫苗佐剂可增强乙肝疫苗诱导机体产生的体液和细胞免疫应答水平。Honda-Okubo等 [24]研究了菊粉对H1N1流感病毒灭活疫苗的佐剂效应,结果表明菊粉可提高流感疫苗的免疫效果。此外,菊粉作为疫苗佐剂在日本乙型脑炎疫苗、HIV疫苗、H5N1流感病毒疫苗等中的研究都有相关报道 [25-27]。
胸腺和脾脏是动物机体主要的免疫器官,胸腺是T淋巴细胞分化成熟的场所,脾脏则是机体最大的免疫器官。因此,胸腺和脾脏指数可在一定程度上反映机体对抗原的免疫应答水平,本实验结果显示菊粉的摄入可提高小鼠的脾脏和胸腺指数,表明其具有增强小鼠免疫功能的作用。
巨噬细胞可通过吞噬作用杀灭和清除病原体及异物,在机体对抗原的非特异性免疫应答中发挥着重要作用,本研究通过巨噬细胞吞噬实验证实菊粉可有效增强小鼠巨噬细胞的吞噬能力,表明菊粉对小鼠非特异性免疫反应具有一定的促进作用。
机体的特异性免疫反应包括体液免疫应答和细胞免疫应答,血清溶血素实验是测定体液免疫应答水平的方法之一,本实验对各组小鼠灌胃后的血清溶血素水平进行了检测,结果表明,随剂量的升高,菊粉灌胃组小鼠的血清溶血素水平明显高于对照组,说明菊粉具有增强小鼠抗体应答的能力。在细胞免疫反应中,淋巴细胞增殖实验是检测细胞免疫功能指标的常用方法 [28-29],常通过淋巴细胞对ConA刺激后的转化程度来衡量T淋巴细胞的应答功能。同时,T细胞分泌的多种细胞因子如IFN-γ、IL-2等在细胞免疫应答中也具有重要作用,本实验对各组小鼠脾淋巴细胞的增殖水平及其分泌的IFN-γ水平进行了检测。检测结果与血清溶血素实验一致,菊粉灌服组小鼠的脾淋巴细胞增殖水平及其分泌的IFN-γ水平均明显高于对照组,表明菊粉同样具有增强小鼠细胞免疫应答的能力。
参考文献:
[1] 王剑. 海藻多糖抗肿瘤作用机制的研究进展[J]. 实用医学杂志, 2012, 29(7): 655-656. DOI:10.3969/j.issn.1671-4008.2012.07.057.
[2] 孙波, 陈静, 刘江, 等. 黄芪多糖在动物饲料添加剂与免疫增强剂中的应用[J]. 动物医学进展, 2014, 35(7): 111-114. DOI:10.3969/ j.issn.1007-5038.2014.07.025.
[3] 刘姚, 欧阳克蕙, 葛霞, 等. 植物多糖生物活性研究进展[J]. 江苏农业科学, 2013, 41(1): 1-4. DOI:10.3969/j.issn.1002-1302.2013.01.001.
[4] 王增敏. 多糖对畜禽免疫的调控作用及机制[J]. 中国畜牧兽医,2010, 37(10): 221-223.
[5] 上官明军, 王芳, 张红岗, 等. 菊粉对蛋雏鸡生长性能、免疫器官指数和血清免疫球蛋白的影响[J]. 动物营养学报, 2009, 21(1): 118-122. DOI:10.3969/j.issn.1006-267x.2009.01.020.
[6] 陈亚非, 罗琦珊, 葛亚中. 低聚果糖调节机体免疫功能作用的研究进展[J]. 现代食品科技, 2005, 21(4): 83-86.
[7] 魏轶男. 菊粉对肉仔鸡生长性能、免疫功能及抗氧化性能的影响[D].杨凌: 西北农林科技大学, 2013: 24-29.
[8] GOURBEYRE P, DESBUARDS N, GREMY G, et al. Exposure to a galactooligosaccharides/inulin prebiotic mix at different developmental time points differentially modulates immune responses in mice[J]. Journal of Agricultural and Food Chemistry, 2012, 60(48): 11942-11951. DOI:10.1021/jf3036403.
[9] 洪德志, 张作法, 蒋学, 等. 桑枝多糖对正常小鼠免疫功能的影响[J]. 蚕业科学, 2011, 37(3): 481-485. DOI:10.3969/ j.issn.0257-4799.2011.03.016.
[10] 朱宇旌, 李艳, 于治娇, 等. 酸模叶蓼类黄酮对小鼠生长、免疫和抗氧化性能的影响[J]. 现代畜牧兽医, 2015(2): 1-7. DOI:10.3969/ j.issn.1672-9692.2015.02.001.
[11] 张迅捷, 陈绍军, 陈冠敏. 樟芝多糖对小鼠免疫功能影响的研究[J].福建师范大学学报(自然科学版), 2011, 27(5): 79-84.
[12] 费建明, 赵丽华, 占鹏飞, 等. 桑枝皮多糖对小鼠的免疫调节试验[J]. 蚕业科学, 2009, 35(4): 907-912. DOI:10.3969/ j.issn.0257-4799.2009.04.037.
[13] 王国秀, 蔺威呜, 赵瑞芳, 等. 6种多糖对小鼠免疫细胞活性作用的比较研究[J]. 卫生研究, 2008, 37(5): 577-580. DOI:10.3969/ j.issn.1000-8020.2008.05.016.
[14] 向维, 陈松华, 李朝品. 彩虹明樱蛤多糖对小鼠的免疫调节作用[J].中国生化药物杂志, 2011, 32(5): 393-395.
[15] 刘刚, 刘育辰, 邱德, 等. 苗药双肾草多糖含量测定及其免疫调节作用研究[J]. 安徽农业科学, 2012, 40(25): 12459-12461. DOI:10.3969/ j.issn.0517-6611.2012.25.045.
[16] 杨鸿, 邓桦, 卢月媚, 等. 玉屏风复合多糖对免疫低下小鼠血清IL-2和IFN-γ含量的影响[J]. 安徽农业科学, 2014, 42(12): 3571-3572. DOI:10.3969/j.issn.0517-6611.2014.12.038.
[17] SUN W J, MENG K, QI C H, et al. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohydrate Polymers, 2015, 126: 91-96. DOI:10.1016/ j.carbpol.2015.03.034.
[18] SHI C L, PAN Z M, CAO M J, et al. Suppression of Th2 immune responses by the sulfated polysaccharide from Porphyra haitanensis in tropomyosin-sensitized mice[J]. International Immunopharmacology,2015, 24(2): 211-218. DOI:10.1016/j.intimp.2014.11.019.
[19] LEE J S, KWON D S, LEE K R, et al. Mechanism of macrophage activation induced by polysaccharide from Cordyceps militaris culture broth[J]. Carbohydrate Polymers, 2015, 120: 29-37. DOI:10.1016/ j.carbpol.2014.11.059.
[20] 王中华, 周德忠. 菊粉对断奶仔猪生长性能和免疫功能的作用研究[J]. 饲料工业, 2011, 32(24): 36-38. DOI:10.3969/j.issn.1001-991X.2011.24.011.
[21] 王中华, 周德忠. 菊粉对肉仔鸡生产性能和免疫功能的影响[J].饲料研究, 2012(2): 55-57. DOI:10.3969/j.issn.1002-2813.2012.02.019.
[22] 李海英, 张俐华, 翟卫爽, 等. 菊粉替代饲用抗生素对白羽肉鸡生产性能和免疫器官指数的影响[J]. 新疆农业科学, 2014, 51(3): 558-563. DOI:10.6048/j.issn.1001-4330.2014.03.025.
[23] SAADE F, HONDA-OKUBO Y, TREC S, et al. A novel hepatitis B vaccine containing Advax™, a polysaccharide adjuvant derived from delta inulin, induces robust humoral and cellular immunity with minimal reactogenicity in preclinical testing[J]. Vaccine, 2013, 31(15):1999-2007. DOI:10.1016/j.vaccine.2012.12.077.
[24] HONDA-OKUBO Y, SAADE F, PETROVSKY N. Advax, a polysaccharide adjuvant derived from delta inulin, provides improved influenza vaccine protection through broad-based enhancement of adaptive immune responses[J]. Vaccine, 2012, 30(36): 5373-5381. DOI:10.1016/j.vaccine.2012.06.021.
[25] CRISTILLO A D, FERRARI M G, HUDACIK L, et al. Induction of mucosal and systemic antibody and T-cell responses following primeboost immunization with novel adjuvanted human immunodeficiency virus-1-vaccine formulations[J]. Journal of General Virology, 2011,92(1): 128-140. DOI:10.1099/vir.0.023242-0.
[26] LAYTON R C, PETROVSKY N, GIGLIOTTI A P, et al. Delta inulin polysaccharide adjuvant enhances the ability of split-virion H5N1 vaccine to protect against lethal challenge in ferrets[J]. Vaccine, 2011,29(37): 6242-6251. DOI:10.1016/j.vaccine.2011.06.078.
[27] LOBIGS M, PAVY M, HALL R A, et al. An inactivated Vero cellgrown Japanese encephalitis vaccine formulated with Advax, a novel inulin-based adjuvant, induces protective neutralizing antibody against homologous and heterologous flɑviviruses[J]. Journal of General Virology, 2010, 91(6): 1407-1417. DOI:10.1099/vir.0.019190-0.
[28] WALSH C J, BUTAWAN M, YORDY J, et al. Sublethal red tide toxin exposure in free-ranging manatees (Trichechus manatus) affects the immune system through reduced lymphocyte proliferation responses, inflammation, and oxidative stress[J]. Aquatic Toxicology, 2015, 161: 73-84. DOI:10.1016/j.aquatox.2015.01.019.
[29] CHINTHAKINDI P K, SANGWAN P L, FAROOQ S, et al. Diminutive effect on T and B-cell proliferation of non-cytotoxic α-santonin derived 1,2,3-triazoles: areport[J]. European Journal of Medicinal Chemistry, 2013, 60: 365-375. DOI:10.1016/ j.ejmech.2012.12.018.
Effect of Inulin on Modulating Immune Function in Mice
GONG Qiang, RUAN Mengdie, MA Liping, NIU Mingfu, REN Guoyan, HOU Ying, QIN Cuili, SUN Xiaofei, LI Yang
(Henan Engineering Research Center of Food Material, College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Abstract:To explore the effect of inulin on immune modulation in mice, 100 BALB/c female mice were allocated to control group, low-dose inulin group, mid-dose inulin group and high-dose inulin group, respectively. Then, the mice in three inulin groups were orally administered with inulin at doses of 200, 400 and 600 mg/(kg·d) body weight, respectively. After 15 days of consecutive administration, immune function indexes in these mice were detected. The results showed that inulin at both mid and high doses could significantly enhance immune organ indexes, phagocytotic capacity of peritoneal macrophages, the level of serum hemolysin, lymphocyte proliferation (SI value) and the level of interferon-γ (IFN-γ) (P < 0.05) or (P < 0.01),indicating that inulin improves immune function in mice to some degree.
Key words:inulin; mice; immune modulation
DOI:10.7506/spkx1002-6630-201607037
中图分类号:O629.12
文献标志码:A
文章编号:1002-6630(2016)07-0204-04
引文格式:
宫强, 阮梦蝶, 马丽苹, 等. 菊粉对小鼠的免疫调节作用[J]. 食品科学, 2016, 37(7): 204-207. DOI:10.7506/spkx1002-6630-201607037. http://www.spkx.net.cn
GONG Qiang, RUAN Mengdie, MA Liping, et al. Effect of inulin on modulating immune function in mice[J]. Food Science,2016, 37(7): 204-207. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607037. http://www.spkx.net.cn
收稿日期:2015-06-01
作者简介:宫强(1979—),男,副教授,博士,研究方向为分子生物学与免疫学。E-mail:gongqiang79@126.com