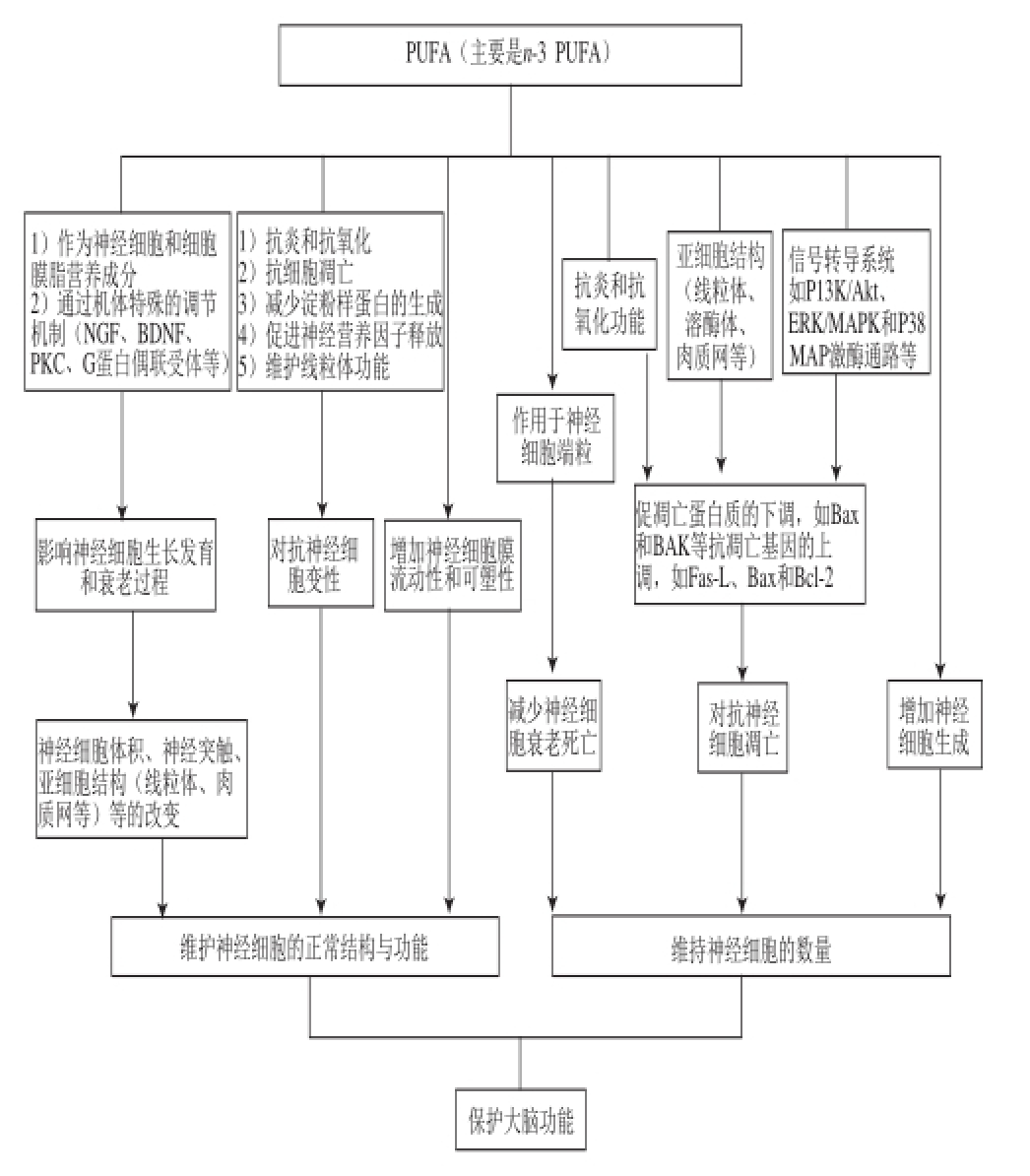
图1 PUFAs保护大脑功能的细胞生物学机制示意图
Fig.1 Schematic diagram of the mechanism of action of PUFAs in protecting brain function
Fas-L. Fas配体(Fas ligand);Bax. Bcl-2相关X蛋白(Bcl-2-associated X protein)。
刘志国,王华林,王丽梅,刘烈炬 *
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
摘 要:本文从细胞生物学的角度综述多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)改善大脑功能的作用机理,包括PUFAs促进神经细胞生成(neurogenesis)、维持神经细胞形态和功能、促进神经突生长、防止神经细胞变性(neurodegeneration)、抑制神经细胞凋亡(apoptosis),以及调节神经细胞膜流动性和可塑性(plasticity)、端粒(telomere)活性等作用机制,为PUFAs的营养干预研究应用,特别是应用于保护大脑正常功能,防止生理性衰老和疾病性脑功能障碍(如阿尔兹海默氏症和帕金森症)所致的脑功能障碍提供参考。
关键词:多不饱和脂肪酸;神经变性;神经细胞;神经发生;大脑功能
神经细胞(也称神经元)是脑组织的主要功能细胞,其正常的生长分化及功能健全是维持大脑功能的基础。多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是一类在脑组织中含量丰富的脂肪酸,对维护神经细胞的正常结构和功能发挥着至关重要的作用 [1-4],尤其n-3 PUFAs具有促进神经细胞增殖、维持神经细胞正常形态及促进神经突触生长、防止神经细胞变性与凋亡等功能作用,对促进胎儿和婴幼儿大脑的正常生长发育,防止老年期大脑功能的衰退具有重要作用 [5-6]。本课题组前期探讨了PUFAs对不同龄人群学习记忆功能的影响和对大脑功能的保护作用。同时,近年来国内外也大量开展PUFAs增强大脑学习记忆等大脑功能的细胞学机制研究,取得了一些重要的进展,包括PUFAs对大脑神经细胞的形态和亚细胞结构影响,对神经细胞生成和神经细胞变性及细胞凋亡的影响,以及对神经细胞膜流动性、可塑性、端粒活性的调节作用等方面 [3-5]。因此,细胞学机制研究已成为PUFAs增强大脑功能研究的重要内容,并为进一步阐明PUFAs的营养干预机制,拓宽其应用领域提供了理论依据和重要参考。
神经细胞生成(或神经发生)是神经干细胞增殖、分裂成为定向祖细胞,并逐渐定向迁移、分化成为功能神经细胞,构成神经系统的过程。脑组织中,通过神经细胞生成作用,可增加大脑神经元的数量,维护大脑的正常功能,而神经细胞的生成与神经干细胞(neural stem cell,NSC)的增殖、分化及迁移过程密不可分。神经干细胞首先从成年小鼠侧脑室膜下区分离获得,随后陆续在中枢神经系统的多个部位(包括:大脑海马区、大脑皮层和纹状体等)分离获得。例如,与大脑空间记忆功能有关的海马神经细胞,是由位于海马颗粒细胞层和齿状回门之间颗粒下层的海马神经干细胞经历增殖、分化,迁移至海马CA1和CA3区形成 [7]。尽管观察到大脑的神经生成能力可以持续到老年阶段,但中年以后其生成能力急剧下降 [8]。大量体内和体外实验均表明PUFAs可促进神经细胞的生成,并能显著延缓神经细胞生成能力的衰退。例如,动物胚胎神经发育期补充n-3 PUFAs可促进神经细胞的生成,增加神经干细胞的增殖、分化成熟,但是n-6 PUFAs无此作用 [9-12]。Fat1转基因小鼠(可将n-6 PUFAs转化为n-3 PUFAs的转基因鼠),由于二十二碳六烯酸(docosahexaenoic acid,DHA)合成的大量增加,增加了神经细胞生成的能力,并伴随实验动物学习记忆能力的增强 [13]。而且也发现,即使是老年实验动物,DHA仍具有促进神经干细胞分化的功能 [14],可通过促进神经干细胞的增殖和成熟,对老年大脑功能发挥保护作用。尽管在动物实验中观察到n-3和n-6 PUFAs在保护大脑功能方面的显著差异,但体外细胞培养实验显示:n-3 PUFAs中的DHA或n-6 PUFAs中的花生四烯酸(arachidonic acid,AA)都可以促进神经干细胞的增殖 [11,15]。这种体内外作用的差异提示体内微环境也是影响神经细胞生成的重要因素。而且也有实验观察到n-3 PUFAs缺乏的大鼠,脑源性神经营养因子(brain-drived neurotrophic factor,BDNF)合成减少,神经细胞生成受到抑制的现象 [16]。到目前为止,PUFAs影响神经细胞生成的机制并不十分清楚,综合来看,其机制主要涉及:1)神经干细胞的磷脂脂肪酸组成及其影响的细胞膜功能和膜蛋白定位是重要影响因素 [17];2)n-3 PUFAs及其活性衍生物通过相应的信号转导系统、膜相关途径、核受体途径等影响神经细胞的功能 [18]。
PUFAs可以影响神经细胞的形态,如增加细胞体积、促进突触的生长等 [19]。神经细胞体积的增加,常伴随着神经原纤维合成的增加以及神经元功能的改变,还通常伴随着神经末梢和突触结数量的增加 [19-20]。神经元核周质的体积与神经末梢密度,与大脑学习记忆功能之间表现为明显的正相关的关系 [21]。n-3 PUFAs作为神经细胞膜的重要组成部分,可对细胞膜形成某种外凸压力,促进神经细胞树突棘形成,有助于神经突起的生长和神经突触的生成 [22]。神经元形态变化,包括体积大小、神经末梢分布以及突触数量的改变是影响大脑神经回路的关键因素,与大脑功能密切相关。如海马神经回路与大脑的学习记忆功能有着密切的联系 [23]。研究显示,n-3 PUFAs中DHA的缺乏可导致海马CA1区神经元的萎缩,补充ɑ-亚麻酸(ɑ-linolenic acid,ALA)和DHA后,海马CA1和CA3神经元的体积增加 [24]。其机制涉及蛋白激酶C(protein kinase C,PKC)的活化和海马突触小泡蛋白的表达增加 [25-26]。
由于神经突起和神经细胞体积的变化往往联系在一起,因此,当神经突生长时,总是首先表现为细胞体积和膜表面积的增加 [27]。反过来也是这样,当海马和下丘脑神经元体积减小的同时,可以观察到神经元树突分支的明显减少 [24]。研究表明DHA具有促进海马组织和大脑皮质神经元神经突生长的作用 [28]。在胚胎发育期,n-3 PUFAs的缺乏可导致神经细胞突起的发育不良(突起少而短),而补充DHA可使细胞的突起的长度增加、数量增多,并伴随着突触蛋白含量的增加 [29];但n-6 PUFAs的AA在体内没有促进神经突生长的作用 [30]。然而在体外培养细胞中观察到,不管是n-6 PUFAs的亚油酸(linoleic acid,LA)、AA,还是n-3 PUFAs的ALA和DHA等,都可以促进神经突生长,只是饱和脂肪酸和单不饱和脂肪酸则无此作用 [31-32]。这同样提示,PUFAs对神经突起和神经细胞体积的影响与体内微环境及代谢机制密切相关。有研究显示DHA可能通过其代谢物N-二十二碳六烯乙醇胺(N-docosahexaenoylethanolamide,DEA)发挥作用,并通过G-蛋白受体促进神经干细胞分化和神经突起生长 [33-34]。另外,PUFAs可能作用于神经生长因子(nerve growth factor,NGF) [35],从而促进神经细胞生长发育 [24,36]。大脑n-3 PUFAs的缺乏,可导致海马组织NGF含量显著的下降。在NGF的刺激下,通过磷脂酶A2(phospholipase A2,PLA2)的作用,可导致AA和DHA从细胞膜的释放。被释放的AA和DHA可与突触融合蛋白3结合,在可溶性N-乙酰基马来酰亚胺敏感因子结合蛋白受体(soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor,SNAREs)的协助下,导致膜磷脂双层结构的融合,促进神经突的生长。
虽然单独补充DHA可增加神经元树突棘和突触的数量 [37]。但实验观察到DHA与尿苷、胆碱联合干预具有明显的协同效应,可显著增加DHA对神经细胞生长分化的作用 [38]。由于尿苷、胆碱和PUFAs是合成磷脂的主要成分。因此,三者的合并使用可进一步促进大脑磷脂,以及多种突触蛋白的合成。实验显示:在沙鼠的饲料中进行尿苷、胆碱和DHA的联合干预,可使突触小泡突触蛋白-1(synapsin-1)含量增加41%,突触后蛋白质psd-95增加38%,突触的神经纤维蛋白-M(neurofibrillar protein-M,NF-M)和神经纤维蛋白-70(neurofibrillar protein-70,NF-70)分别增加48%和102% [38]。上述结果表明:尿苷、胆碱、AA和DHA的联合干预是增加PUFAs功能的有效途径。尿苷的食物来源常见的有:番茄和西兰花。富含胆碱的食物包括:鸡蛋、鳕鱼、小麦胚芽、花椰菜、菠菜、藜麦等。母乳含有丰富的尿苷、胆碱、AA和DHA等成分 [39],是婴儿智力发育最好的食物来源。
神经变性(neurodegeneration)和坏死(necrosis)是造成神经细胞数量减少的重要原因之一。PUFAs可通过抗神经变性的作用,防止神经细胞数量减少,维护正常的大脑学习记忆功能。影响神经变性的因素众多,主要包括常见的环境因素和机体自身的生理、病理性因素。前者包括化学(如酒精和环境污染)、物理(机械损伤、电离辐射和噪音等)、生物(病毒和细菌感染等)等因素;后者主要有衰老、精神因素(紧张和抑郁等)和神经变性疾病或称神经退行性疾病等。在防范有害的环境因素基础上,营养干预延缓生理或病理性神经变性损伤对维护大脑功能尤为重要。大量研究表明 [2-3,40-43]:PUFAs,特别是长链(long chain,LC)-PUFAs,在防止神经细胞变性的过程中,发挥着重要的作用。
3.1 PUFAs防止衰老导致的神经细胞变性
在生理特征上,衰老表现为感官、运动和认知功能的下降,是导致神经变性重要生理因素 [44]。随着机体的衰老,血浆中n-3 PUFAs的含量逐渐下降,n-3 PUFAs含量的下降反过来又进一步促进机体的衰老 [41]。研究发现大脑中的总脂质的含量,特别是DHA的含量,与大脑的功能和神经变性密切相关。在生命的开始20 a里,大脑脂质的含量呈逐渐增加的趋势,随后保持基本的稳定,老年后脂质的含量快速下降 [45]。衰老造成大脑功能损伤有两个常见的原因:一是神经细胞的丧失(包括神经细胞的凋亡和坏死);二是神经细胞结构和功能的变化,即神经变性。研究表明 [46-47],在大脑衰老过程中实际死亡神经细胞的数量并不多,造成大脑功能衰退的主要原因是由于年龄增长导致的神经细胞结构和功能的改变,表现为神经递质释放的减少和传递功能的下降等。而脑内氧化物的增加,细胞解毒功能的下降是导致神经变性的重要原因 [48]。PUFAs则可以保护和防止这一过程,通过增加机体抗氧化能力,阻止活性氧(reactive oxygen species,ROS)的增加,促进树突重塑,防止大脑兴奋性中毒所致的大脑功能紊乱 [45],从而对抗神经变性,增加大脑学习记忆的能力 [49-50]。进一步研究发现 [51-52]:食物中的二十碳五烯酸(eicosapentaenoic acid,EPA)和DHA可以缓解衰老过程中大脑中PUFAs含量的下降,提高年龄相关的谷氨酸受体中的N-甲基-D-天冬氨酸受体2B(N-methyl-D-aspartate receptor 2B,NR2B)亚单位和α-氨基-3-羧基-5-甲基异唑-4-丙酸(alpha-amino-3-hydoxy-5-methyl-4-isoxazolepropionate,AMPA)受体的谷氨酸受体2(glutamate receptor 2,GluR2)亚单位的表达,并增加大脑的学习记忆功能。这些受体在神经变性的过程中起着重要的作用,除直接参与突触的传递功能外,GluR2还在促进树突增长和维持树突棘稳定中扮演着重要的角色 [53]。
3.2 PUFAs改善细胞膜的功能,防止神经变性
突触的可塑性被广泛认为是大脑功能最重要的细胞结构基础 [45]。许多研究探讨了与年龄相关的突触可塑性变化和大脑认知功能障碍之间的相关性,研究发现影响记忆形成的主要因素可能是突触可塑性的变化,而影响记忆丧失(遗忘)的主要因素是突触功能衰退 [54-55]。年龄的增长可导致记忆形成的阈值增加,记忆丧失的阈值减小 [56]。AA和DHA是神经细胞质膜(包括细胞膜、线粒体膜、蘘泡膜等)的重要组成部分,在突触部位其含量可达摩尔水平 [18]。AA和DHA在神经细胞质膜水平的改变可直接影响到细胞膜的特性(包括膜的流动性、曲率和脂质筏的形成等),进一步影响镶嵌在脂质双层中蛋白质的功能(包括受体、通道和酶类等),因此PUFAs在维持突触可塑性中发挥了关键的作用。食物中的PUFAs,有利于缓解由衰老导致的大脑AA和DHA水平的下降,对抗由衰老导致的神经细胞结构和功能的变化,增强大脑学习记忆的功能 [57]。
膜的流动性受多方面因素的影响。饮食习惯可以直接影响神经元膜脂肪酸组成。实验证明通过补充PUFAs可以改善膜流动性,进而影响突触的可塑性,神经传递和突触生成,增强学习记忆的能力 [55,57]。膜流动性也受到年龄和神经变性疾病的影响,如阿尔茨海默病(Alzheimer’s disease,AD)和帕金森病(Parknson’s disease,PD)。影响膜流动性的其他原因包括:胆固醇和活性氧含量的增加 [58]。活性氧可导致膜蛋白和脂质化学交联,减少细胞膜的不饱和性。这除了可降低膜流动性外,还可导致膜中酶、离子通道和受体的抑制 [59]。增加PUFAs的摄入量可以部分对抗ROS的作用,但大剂量的使用仍然值得注意 [58]。n-3 PUFAs结合入神经膜,可降低细胞膜胆固醇的含量、改善神经细胞膜的特性,例如流动性、渗透性和黏度等,同时改善神经传递、突触可塑性、学习记忆及其他复杂的认知过程 [2,6,40]。
PUFAs影响膜流动性的机制之一,是通过抑制脂质筏(膜质双层含中由特殊的脂质和蛋白质组成的微区,该区域结构致密,属抗去垢剂的膜组分 [60],富含胆固醇、鞘磷脂、糖脂,是蛋白质停泊的平台,与膜的信号转导、蛋白质的分选有关系密切)的形成和跨膜受体蛋白的定位和表达来完成的。脂质双层的磷脂中DHA的含量增加,导致脂质双层更加松散,更多的流动性和可压缩性以及更强的渗透性。此外DHA还具有排斥胆固醇的作用。DHA取代膜内的饱和脂肪酸后,造成该区域内胆固醇的浓度降低,从而干扰脂筏的形成 [61]。实验证明膳食中补充ALA并不能改变膜磷脂分布,然而补充DHA可以明显提高细胞膜磷脂的水平 [62]。虽然DHA可迅速结合入脂质双层结构中的磷脂,但在各类磷脂之间分布是不均匀的。DHA优先结合入sn-2位置磷脂酰乙醇胺(phosphatidylethanolamine,PE)以及少量的磷脂酰胆碱(phosphatidyl choline,PC)或磷脂酰丝氨酸(phosphatidylserine,PS) [63-65]。在大脑,DHA结合在磷脂酰丝氨酸磷脂中可促进信号转导分子蛋白激酶B(protein kinase B,PKB)(也称AKT)向细胞核的易位,调节凋亡基因的转录 [66]。另外,PUFAs还可调节细胞膜的硬度,导致巨噬细胞黏度增加和对凋亡细胞的吞噬作用的下降 [62,67]。
3.3 PUFAs调节端粒的长度,延缓大脑功能衰退
神经细胞的衰老死亡可导致神经元的数量减少,影响大脑的功能。关于细胞的衰老目前有多种学说,最重要是内置时钟说、氧化应激说和端粒学说 [45]。端粒学说提出细胞的衰老源于端粒缩短。端粒是真核细胞染色体两臂末端由5′TTAGGG-3′重复序列构成的结构,具有保护染色体末端,维持染色体结构的稳定和完整、避免其发生融合、降解、重组等功能。端粒的长度与衰老、认知能力(包括学习记忆能力)、以及老年性疾病的发生(如痴呆和神经退行性疾病)有着密切的关系 [68-69],并受多种因素的影响,如:炎性反应和氧化应激反应等 [70-72]。体育锻炼、他汀类药物(用于治疗高胆固醇血症)、补充n-3 PUFAs等可增加端粒的长度,延缓衰老,其机制可能与端粒酶的活性变化有关 [73]。
端粒的长度受到饮食中脂肪酸组成的影响。最近一项研究将实验分为饱和脂肪酸组、低脂高糖组和地中海饮食组(富含单不饱和脂肪酸)三组,通过随机交叉分析发现地中海饮食组细胞内活性氧的水平、细胞凋亡数和端粒的缩短都明显低于脂肪酸组和低脂高糖组 [71]。PUFAs对端粒的长度也有影响,且发现n-6和n-3 PUFAs对端粒的作用是不同的。n-3 PUFAs可延缓端粒缩短,而n-6 PUFAs可能会加速端粒的缩短,因此在实验中应区分n-3和n-6脂肪酸的作用 [74]。最近采用前瞻性队列研究对冠状动脉疾病的患者追踪调查后发现,血液中n-3 PUFAs的含量与端粒缩短的速率成负相关的关系 [75]。O’Callaghan等 [68]在对轻度认知障碍(mild cognitive impairment,MCI)老年人补充n-3 PUFAs时发现,虽然干预与治疗组端粒长度没有显著的变化,但血液中的红细胞DHA的水平与端粒缩短密切相关,即红细胞DHA含量增加端粒缩短的速率降低,提示n-3 PUFAs可能延缓端粒的缩短,且n-3脂肪酸对端粒的影响与n-6/n-3的比例有关。Kiecolt-glaser等 [72]研究采用随机对照实验探讨了n-3 PUFAs的干预,与白细胞端粒长度、促炎细胞因子和氧化应激的关系,发现n-3 PUFAs可降低血液中促炎细胞因子的浓度和氧化应激的水平,降低n-6/n-3 PUFAs的比值可导致端粒长度增加,提示饮食中n-6/n-3 PUFAs比值对延缓大脑功能衰退的重要作用,表明n-3 PUFAs与n-6 PUFAs对炎性应激和氧化应激存在作用差异,从而对端粒长度的影响不一致。虽然PUFAs对端粒的作用以及与大脑功能的关系目前仍缺乏足够的资料,但为PUFAs的功能作用与机理研究提供了新的方向 [76]。
3.4 PUFAs干预疾病所致的神经变性
神经变性疾病是影响神经变性的重要的病理因素。神经变性疾病是一组原因不明的,以神经细胞变性为主要的病理特征的中枢神经系统疾病,典型的如AD和PD [41]。
AD是以进行性痴呆为主要临床表现的大脑变性疾病,俗称老年痴呆症。研究发现AD的发病与脑内β淀粉样蛋白(Aβ)异常沉淀有关。Aβ的前体是前β淀粉样蛋白,由于三级结构中的β折叠,形成了不可溶的特性。研究发现Aβ对周围的突触和神经元具有毒性作用,可导致神经细胞变性死亡 [77]。随着神经元的变性死亡,导致脑内相应的神经递质水平下降,其中最重要的是乙酰胆碱。由于AD患者中脑内的乙酰胆碱的水平下降得最早和最为明显,因此产生了AD的胆碱能学说:即AD患者乙酰胆碱的缺乏是导致认知功能障碍的主要因素。增加脑内乙酰胆碱的水平是目前AD药物治疗的重要手段。例如,采用胆碱酯酶抑制剂,通过抑制乙酰胆碱的酶解,增加胆碱能神经元的传递功能。但这些拟胆碱类药物,虽然能缓解患者认知能力的下降,但并不能延缓AD的病程的发展。
研究表明 [78-80],AD的发病与机体能量代谢失衡有关,且氧化应激和线粒体功能障碍在AD的发病机制中扮演着重要的角色,是药物治疗AD新的潜在的靶标。线粒体功能障碍是导致β样淀粉样变的重要病因 [81-84]。DHA可抑制前淀粉样蛋白转化为Aβ,并阻止Aβ的累积 [85-86]。DHA可对抗Aβ引起的神经毒性反应,对大脑产生保护作用 [87]。在人胚肾-淀粉酶前体蛋白(human embryonic kidney-amyloid precursor protein,HEK-APP)细胞,DHA可显著提高膜流动性、增加可溶性淀粉酶前体蛋白α(soluble amyloid precursor protein α,sAPPα)的分泌。后者具有对线粒体的保护作用以及抗凋亡的功能 [88]。动物实验表明 [86,89-90]:富含DHA的饮食可以减少老年痴呆症小鼠模型中Aβ的含量。对老年3hTg-AD小鼠(大脑中含有大量Aβ的模型鼠)补充DHA,可导致膜磷脂内DHA水平增加、AA含量降低以及心磷脂水平增加;并明显改善大脑的认知能力和内嗅皮层神经元的功能障碍 [91-92]。大量研究显示 [85],减少n-3 PUFAs的摄入量或鱼类食品的消费,可增加与年龄相关的认知能力的下降或患呆痴症的风险。
PD又称为振颤麻痹症,是一种与年龄相关的慢性和进行性的神经变性疾病。主要的临床特征是运动障碍,伴随着大脑认知能力的下降和精神症状,病理特征为大脑黑质致密部(substantia nigra pars compacta,SNPC)多巴胺能神经元的广泛的变性死亡 [93]。在尸检报告中,大脑SNPC匀浆DHA水平明显下降 [94]。尸检结果还表明PD患者额叶皮层脂质筏的分离体中DHA和AA的含量大幅下降 [95]。氧化应激是PD重要的发病机制。在PD脑内发现,脂质过氧化物水平,黑质和纹状体中8-OHdG(8-羟脱氧鸟苷,DNA氧化损伤的标志物)的含量以及亚硝酰基和蛋白质碳酰基水平均明显的增加。进一步可导致线粒体功能障碍,诱导细胞变性和凋亡,最终导致多巴胺能神经元的死亡。
摄入DHA胶囊可选择性地增加小鼠额叶皮层DHA的水平,阻断由1-甲基-4-苯基吡啶离子(1-methyl-4-phenyl-pyridinium,MPP+)导致黑质细胞数量的下降以及核受体相关因子1(nuclear receptor-related factor 1,Nurr1)mRNA和多巴胺转运体mRNA水平的下降 [96]。Nurr1是多巴胺能神经元重要转录因子 [97]。饮食中的DHA可对抗由MPP+导致的纹状体多巴胺及其代谢物二羟基苯乙酸(dihydroxyphenylacetic acid)含量的下降 [96]。在MPP+诱导的PD模型中,DHA治疗可缓解PD部分神经症状 [98-99]。采用MPP+PD模型,实验探讨了LC-PUFAs对左旋多巴(levodopa,LD)诱导运动障碍的影响,DHA可对抗LD诱导运动障碍或延迟运动障碍的发展 [100]。在1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)-丙磺舒(probenecid)PD小鼠的模型中,饮食补充乙基-EPA后,可预防运动功能减退和记忆力的改善,但不能阻止黑质纹状体多巴胺的下降 [101]。在小鼠和大鼠PD模型中,脑室注射6-羟多巴胺(6-hydroxydopamine,6-OHDA)可引起纹状体病变,包括多巴胺的水平下降 [102-103]。口服DHA可对抗6-OHDA的作用,部分恢复多巴胺能神经传递功能 [103]。老鼠腹腔内注射乙基-DNA,也可对抗6-OHDA导致小鼠纹状体多巴胺的水平下降 [102]。大量文献均表明高n-3 LC-PUFAs的饮食对预防或缓解PD具有显著作用 [96,98,100,104]。
PUFAs对细胞凋亡的影响是目前营养生物学研究的重要领域 [22,88,105-106]。PUFAs的抗凋亡功能与n-3 PUFAs的抗炎、抗氧化有关,并对大脑具有保护作用,包括婴幼儿大脑的发育、老年大脑的衰老以及神经变性疾病等 [22,106]。n-3 PUFAs可通过抗凋亡的作用,保持一定神经元的数量,维持神经系统的正常功能。
PUFAs的抗凋亡功能目前已有许多文献的报道。最新研究表明孕妇和产妇饮食中的DHA有助于预防由产前精神压力导致新生儿记忆功能的障碍,氧化标记物含量的增加,线粒体代谢功能紊乱以及海马细胞的凋亡 [107]。同时,产前n-3 PUFAs的干预可对抗高氧血症诱导大鼠大脑细胞的凋亡 [108]。怀孕期间食用富含DHA的食物,可以通过抑制氧化应激和细胞的凋亡,减少新生儿大脑的损伤 [109]。新生儿的高血胆红素血症所致的血清未结合胆红素(unconjugated bilirubin,UCB)水平升高,可对中枢神经系统造成各种副作用。DHA的干预可对抗UCB导致的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶以及谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性下降;以及UCB诱导的星形细胞的凋亡,表明DHA可通过抑制细胞的凋亡和增加抗氧化酶的活性,对大脑细胞产生保护作用 [110]。在大脑的生长发育期间,充足的n-3 PUFAs也可以通过抑制感光细胞凋亡和视网膜的变性,对视网膜产生保护作用 [111-113]。氧化损伤和线粒体功能失调是导致神经细胞凋亡的重要因素,DHA可激活细胞内多种调节机制、抑制氧化应激反应、维护线粒体的功能、提高抗凋亡蛋白-B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的含量,保护神经细胞免受到伤害 [111-112]。
PUFAs的抗凋亡作用是一个复杂的过程,多种信号转导系统参与了PUFAs的抗凋亡过程,如细胞内Ca 2+信号系统、磷脂酰肌醇(-3)激酶/蛋白激酶B(phosphatidylinositol (-3) kinase/protein kinase B,PI3K/Akt)途径、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPKs)途径和P38蛋白激酶(mitogen-activated protein kinases p38,P38MAPKs)途径等。机理涉及docosanoid类脂质信号分子的作用、线粒体在抗凋亡过程中的作用以及表观遗传学效应等。
综上所述,近年来开展的PUFAs对神经细胞保护作用研究取得了很多成果,并注意到不同类型PUFAs对神经细胞结构与功能影响存在差异。其中n-3 PUFAs展现了较为全面的有益作用和独特的细胞学机制,归纳起来包括:通过促进神经细胞增殖分化、增加神经细胞的数量;通过抗氧化、抗凋亡及阻止端粒缩短等机制防止生理或病理条件下的神经细胞变性;以及通过影响神经细胞的膜可塑性和突触功能,维护神经细胞的正常结构与功能,实现对大脑的保护作用(图1)。这些机制研究为PUFAs尤其是其中的n-3 PUFAs保护大脑功能的营养干预奠定了重要的细胞生物学基础。

图1 PUFAs保护大脑功能的细胞生物学机制示意图
Fig.1 Schematic diagram of the mechanism of action of PUFAs in protecting brain function
Fas-L. Fas配体(Fas ligand);Bax. Bcl-2相关X蛋白(Bcl-2-associated X protein)。
近年来,有关PUFAs对大脑功能的保护作用研究已取得了丰硕成果,发现PUFAs不仅可以通过抗炎、抗氧化、维护心脑血管功能等全身性功能,改善大脑的微环境而发挥对大脑的保护作用;而且揭示了其直接作用于神经细胞,促进神经细胞生长和突触的形成,以及通过调节细胞膜流动性和可塑性,保护神经细胞正常功能。展望未来,研究将不断深入到细胞与分子水平,从细胞生物学与分子生物学角度揭示其对神经细胞作用的分子机制。特别是关于PUFAs及其活性代谢物调节细胞信号转导系统、膜相关途径、核受体途径,促进神经细胞生成、突触生长,阻止细胞变性和凋亡的细胞内途径与作用机制,从而发挥其延缓大脑功能衰退与神经变性类疾病发展的有益作用,为PUFAs的营养功能及其对大脑功能的保护作用研究奠定基础。
参考文献:
[1] DENIS I, POTIER B, VANCASSEL S, et al. Omega-3 fatty acids and brain resistance to ageing and stress: body of evidence and possible mechanisms[J]. Ageing Research Reviews, 2013, 12(2): 579-594. DOI:10.1016/j.arr.2013.01.007.
[2] LUCHTMAN D W, SONG C. Cognitive enhancement by omega-3 fatty acids from child-hood to old age: findings from animal and clinical studies[J]. Neuropharmacology, 2013, 64: 550-565. DOI:10.1016/j.neuropharm.2012.07.019.
[3] JANSSEN C I, KILIAAN A J. Long-chain polyunsaturated fatty acids (LCPUFA) from genesis to senescence: the influence of LCPUFA on neural development, aging, and neurodegeneration[J]. Progress in Lipid Research, 2014, 53: 1-17. DOI:10.1016/j.plipres.2013.10.002.
[4] SWANSON D, BLOCK R, MOUSA S A. Omega-3 fatty acids EPA and DHA: health benefits throughout life[J]. Advance Nutrition, 2012,3(1): 1-7. DOI:10.3945/an.111.000893.
[5] HENNEBELLE M, CHAMPEIL-POTOKAR G, LAVIALLE M, et al. Omega-3 polyunsaturated fatty acids and chronic stress-induced modulations of glutamatergic neurotransmission in the hippocampus[J]. Nutrition Reviews, 2014, 72(2): 99-112. DOI:10.1111/nure.12088.
[6] ROGERS L K, VALENTINE C J, KEIM S A. DHA supplementation: current implications in pregnancy and childhood[J]. Pharmacological Research, 2013, 70(1): 13-19. DOI:10.1016/j.phrs.2012.12.003.
[7] TROUCHE S, BONTEMPI B, ROULLET P, et al. Recruitment of adult-generated neurons into functional hippocampal networks contributes to updating and strengthening of spatial memory[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5919-5924. DOI:10.1073/ pnas.0811054106.
[8] LEUNER B, YEVGENIA K, CHARLES G G, et al. Diminished adult neurogenesis in the marmoset brain precedes old age[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(43): 17169-17173. DOI:10.1073/pnas.0708228104.
[9] COTII B P, O’KUSKY J R, INNIS S M. Maternal dietary (n-3) fatty acid deficiency alters neurogenesis in the embryonic rat brain[J]. Journal of Nutrition, 2006, 136(6): 1570-1575. DOI:10.1111/j.1471-4159.2005.03513.x.
[10] YAVIN E, HIMOVICHI E, EILAM R. Delayed cell migration in the developing rat brain following maternal omega-3 alpha linolenic acid dietary deficiency[J]. Neuroscience, 2009, 162(4): 1011-1022. DOI:10.1016/j.neuroscience.2009.05.012.
[11] KAWAKITA E, HASHIMOTO M, SHIDO O. Docosahexaenoic acid promotes neurogenesis in vitro and in vivo[J]. Neuroscience, 2006, 139(3): 991-997. DOI:10.1016/j.neuroscience.2006.01.021.
[12] DYALL S C, MICHAEL G J, MICHAEL-TITUS A T. Omega-3 fatty acids reverse age-related decreases in nuclear receptors and increase neurogenesis in old rats[J]. Journal of Neuroscience Research, 2010, 88(10): 2091-2102. DOI:10.1002/jnr.22390.
[13] HE C W, QU X Y, CUI L B, et al. Improved spatial learning performance of fat-1 mice is associated with enhanced neurogenesis and neuritogenesis by docosahexaenoic acid[J]. Proceedings of theNational Academy of Sciences of the United States of America, 2009, 106(27): 11370-111375. DOI:10.1073/pnas.0904835106.
[14] ROBSON L G, DYALL S, SIDLOFF D, et al. Omega-3 polyunsaturated fatty acids increase the neurite outgrowth of rat sensory neurones throughout development and in aged animals[J]. Neurobiol Aging, 2010, 31(4): 678-687. DOI:10.1016/ j.neurobiolaging.2008.05.027.
[15] KAN I, MELAMED E, OFFEN D, et al. Docosahexaenoic acid and arachidonic acid are fundamental supplements for the induction of neuronal differentiation[J]. Journal of Lipid Research, 2007, 48(3): 513-517. DOI:10.1194/jlr.C600022-JLR200.
[16] RAO J S, HYUN J L, STALEY I. Dietary n-3 PUFA deprivation alters expression of enzymes of the arachidonic and docosahexaenoic acid cascades in rat frontal cortex[J]. Molecular Psychiatry, 2007, 12(2): 151-157. DOI:10.1038/sj.mp.4001887.
[17] LANGELIER B, LINARD A, BORDAT C, et al. Long chainpolyunsaturated fatty acids modulate membrane phospholipid composition and protein localization in lipid rafts of neural stem cell cultures[J]. Journal of Cellular Biochemistry, 2010, 110(6): 1356-1364. DOI:10.1002/jcb.22652.
[18] PIOMELLI D, ASTARITA G, RAPAKA R. A neuroscientist’s guide to lipidomics[J]. Nature Reviews Neuroscience, 2007, 8(10): 743-754. DOI:10.1002/jcb.22652.
[19] HAJJAR T, GOH Y M, RAJION M A, et al. Alterations in neuronal morphology and synaptophysin expression in the rat brain as a result of changes in dietary n-6: n-3 fatty acid ratios[J]. Lipids in Health and Disease, 2013, 12: 113. DOI:10.1186/1476-511X-12-113.
[20] PURVES D, SNIDER W D, VOYYODIC J T. Trophic regulation of nerve cell morphology and innervation in the autonomic nervous system[J]. Nature, 1988, 336: 123-128. DOI:10.1038/336123a0.
[21] GUSTILO M C, MARKOWSKA A L, BRECKLER S J, et al. Evidence that nerve growth factor influences recent memory through structural changes in septohippocampal cholinergic neurons[J]. Journal of Comparative Neurology, 1999, 405(4): 491-507. DOI:10.1002/ (SICI)1096-9861(19990322)405:4<491::AID-CNE4>3.0.CO;2-N.
[22] SU H M. Mechanisms of n-3 fatty acid-mediated development and maintenance of learning memory performance[J]. Journal of Nutrition Biochemistry, 2010, 21(5): 364-373. DOI:10.1016/ j.jnutbio.2009.11.003.
[23] SMITH T D, ADAMS M M, GALLAGHER M, et al. Circuit-specific alterations in hippocampal synaptophysin immunoreactivity predict spatial learning impairment in aged rats[J]. Journal Neuroscience, 2000, 20(17): 6587-6593.
[24] AHMAD A, MORIGUCHI T, SALEM N. Decrease in neuron size in docosahexaenoic acid-deficient brain[J]. Pediatric Neurology, 2002, 26(3): 210-218. DOI:10.1016/S0887-8994(01)00383-6.
[25] VENNA V R, DEPLANQUE D, ALLET C, et al. PUFA induce antidepressant-like effects in parallel to structural and molecular changes in the hippocampus[J]. Psychoneuroendocrinology, 2009, 34(2): 199-211. DOI:10.1016/j.psyneuen.2008.08.025.
[26] HAMA H, HARA C, MIYAWAKI A. PKC signaling mediates global enhancement of excitatory synaptogenesis in neurons triggered by local contact with astrocytes[J]. Neuron, 2004, 41(3): 405-415. DOI:10.1016/S0896-6273(04)00007-8.
[27] FUTERMAN A H, Banker G A. The economics of neurite outgrowth-the addition of new membrane to growing axons[J]. Trends in Neuroscience, 1996, 19(4): 144-149. DOI:10.1016/S0166-2236(96)80025-7.
[28] CAO D H, XU J F, XUE R H, et al. Protective effect of chronic ethyl docosahexaenoate administration on brain injury in ischemic gerbils[J]. Pharmacology, Biochemistry and Behavior, 2004, 79(4): 651-659. DOI:10.1016/j.pbb.2004.09.016.
[29] CAO D H, KEVALA K, KIM J, et al. Docosahexaenoic acid promotes hippocampal neuronal development and synaptic function[J]. Journal of Neurochemistry, 2009, 111(2): 510-521. DOI:10.1111/j.1471-4159.2009.06335.x.
[30] CANSEV M, WURTMAN R J. Chronic administration of docosahexaenoic acid or eicosapentaenoic acid, but not arachidonic acid, alone or in combination with uridine, increases brain phosphatide and synaptic protein levels in gerbils[J]. Neuroscience, 2007, 148(2): 421-431. DOI:10.1016/j.neuroscience.2007.06.016.
[31] DARIOS F, DAVLETOV B. Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3[J]. Nature, 2006, 440(7085): 813-817. DOI:10.1038/nature04598.
[32] HAAG M. Essential fatty acids and the brain[J]. The Canadian Journal of Psychiatry, 2003, 48(3): 195-203.
[33] MA D, ZHANG M, LARSEN C P, et al. DHA promotes the neuronal differentiation of rat neural stem cells transfected with GPR40 gene[J]. Brain Research, 2010, 1330: 1-8. DOI:10.1016/j.brainres.2010.03.002. [34] IKEMOTO A, ATSUMI N, FURUKAWA S, et al. Dietary n-3 fatty acid deficiency decreases nerve growth factor content in rat hippocampus[J]. Neuroscience Letter, 2000, 285(2): 99-102. DOI:10.1016/S0304-3940(00)01035-1.
[35] YAMASHIMA T. A putative link of PUFA, GPR40 and adult-born hippocampal neurons for memory[J]. Progress in Neurobiology, 2008, 84(2): 105-115. DOI:10.1016/j.pneurobio.2007.11.002.
[36] KIM H Y, MOON H S, CAO D H, et al. N-Docosahexaenoylethanolamide promotes development of hippocampal neurons[J]. Biochemical Journal, 2011, 435(2): 327-336. DOI:10.1042/BJ20102118.
[37] SALAMOTO T, CANSEV M, WURTMAN R J. Oral supplementation with docosahexaenoic acid and uridine-5’-monophosphate increases dendritic spine density in adult gerbil hippocampus[J]. Brain Research, 2007, 1182: 50-59. DOI:10.1016/j.brainres.2007.08.089.
[38] WURTMAN R J, ULUS I H, CANSEV M, et al. Synaptic proteins and phospholipids are increased in gerbil brain by administering uridine plus docosahexaenoic acid orally[J]. Brain Research, 2006, 1088(1): 83-92. DOI:10.1016/j.brainres.2006.03.019.
[39] THORELL L, SJOBERG L B, HEMELL O. Nucleotides in human milk: sources and metabolism by the newborn infant[J]. Pediatric Research, 1996, 40(6): 845-852. DOI:10.1203/00006450-199612000-00012.
[40] PARLETTA N, MILTE C M, MEYER B J. Nutritional modulation of cognitive function and mental health[J]. Journal of Nutrition Biochemisty, 2013, 24(5): 725-743. DOI:10.1016/ j.jnutbio.2013.01.002.
[41] ECKERT G P, LIPKA U, MULLER W E. Omega-3 fatty acids in neurodegenerative diseases: focus on mitochondria[J]. Prostaglandins Leukot Essent Fatty Acids, 2013, 88(1): 105-114. DOI:10.1016/ j.plefa.2012.05.006.
[42] BORRE Y E, PANAGAKI T, KOELINK P J, et al. Neuroprotective and cognitive enhancing effects of a multi-targeted food intervention in an animal model of neurodegeneration and depression[J]. Neuropharmacology, 2014, 79: 738-749. DOI:10.1016/ j.neuropharm.2013.11.009.
[43] TORRES M, PRICE S L, FIOL-DEROQUE M A, et al. Membrane lipid modifications and therapeutic effects mediated by hydroxydocosahexaenoic acid on Alzheimer’s disease[J]. Biochimica Et Biophysica Acta, 2014, 1838(6): 1680-1692. DOI:10.1016/ j.bbamem.2013.12.016.
[44] MATTSON M P, MAGNUS T. Ageing and neuronal vulnerability[J]. Nature Reviews Neuroscience, 2006, 7(4): 278-294. DOI:10.1038/ nrn1886.
[45] LEDESMA M D, MARTIN M G, DOTTI C G. Lipid changes in the aged brain: effect on synaptic function and neuronal survival[J]. Progress in Lipid Research, 2012, 51(1): 23-35. DOI:10.1016/ j.plipres.2011.11.004.
[46] MORRISON J H, HOF P R. Life and death of neurons in the aging brain[J]. Science, 1997, 278: 412-419. DOI:10.1126/ science.278.5337.412.
[47] APRIKYAN G V, GEKCHYAN K G. Release of neurotransmitter amino acids from rat brain synaptosomes and its regulation in aging[J]. Gerontology, 1988, 34(1/2): 35-40. DOI:10.1159/000212928.
[48] MCEEEN B S. Physiology and neurobiology of stress and adaptation: central role of the brain[J]. Physiological Reviews, 2007, 87(3): 873-904. DOI:10.1152/physrev.00041.2006.
[49] LEE L K, SHAHAR S, RAJAB N F, et al. The role of long chain omega-3 polyunsaturated fatty acids in reducing lipid peroxidation among elderly patients with mild cognitive impairment: a case-control study[J]. Journal of Nutrition Biochemistry, 2013, 24(5): 803-808. DOI:10.1016/j.jnutbio.2012.04.014.
[50] GIORDANO E, VISIOLI F. Long-chain omega 3 fatty acids: molecular bases of potential antioxidant actions[J]. Prostaglandins Leukot Essential Fatty Acids, 2014, 90(1): 1-4. DOI:10.1016/ j.plefa.2013.11.002.
[51] FOSTER T C, KUMAR A. Calcium dysregulation in the aging brain[J]. Neuroscientist, 2002, 8(4): 297-301. DOI:10.1177/107385840200800404.
[52] DYALL S C, MICHAEL G J, WHEIPTON R, et al. Dietary enrichment with omega-3 polyunsaturated fatty acids reverses age-related decreases in the GluR2 and NR2B glutamate receptor subunits in rat forebrain[J]. Neurobiol Aging, 2007, 28(3): 424-439. DOI:10.1016/j.neurobiolaging.2006.01.002.
[53] PASSAFARO M, NAKAGAWA T, SALA C, et al. Induction of dendritic spines by an extracellular domain of AMPA receptor subunit GluR2[J]. Nature, 2003, 424: 677-681. DOI:10.1038/nature01781.
[54] BARNES C A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat[J]. Journal of Comparative and Physiological, 1979, 93(1): 74-104. DOI:10.1037/ h0077579.
[55] ROSENZWEIG E S, BARNES C A. Impact of aging on hippocampal function: plasticity, network dynamics, and cognition[J]. Progress in Neurobiology, 2003, 69(3): 143-179. DOI:10.1016/S0301-0082(02)00126-0.
[56] BARNES C A, MCNAUGHTON B L. Physiological compensation for loss of afferent synapses in rat hippocampal granule cells during senescence[J]. The Journal of Physiology, 1980, 309: 473-485. DOI:10.1113/jphysiol.1980.sp013521.
[57] MCGAHON B M, MARTIN D S D, HORROBIN D F, et al. Agerelated changes in synaptic function: analysis of the effect of dietary supplementation with omega-3 fatty acids[J]. Neuroscience, 1999, 94(1): 305-314. DOI:10.1016/S0306-4522(99)00219-5.
[58] YEHUDA S, RABINOVITZ S, CARASSO R, et al. The role of polyunsaturated fatty acids in restoring the aging neuronal membrane[J]. Neurobiol Aging, 2002, 23(5): 843-853. DOI:10.1016/ S0197-4580(02)00074-X.
[59] FRISARDI V, PANZA F, SERIPA D, et al. Glycerophospholipids and glycerophospholipid-derived lipid mediators: a complex meshwork in Alzheimer’s disease pathology[J]. Progress in Lipid Research, 2011, 50(4): 313-330. DOI:10.1016/j.plipres.2011.06.001.
[60] SIMONS K, IKONEN E. Functional rafts in cell membranes[J]. Nature, 1997, 387: 569-572. DOI:10.1038/42408.
[61] HUBER T, RAJAMOORTHI K, KURZE V F, et al. Structure of docosahexaenoic acid-containing phospholipid bilayers as studied by (2)H NMR and molecular dynamics simulations[J]. Journal of the American Chemical Society, 2002, 124(2): 298-309. DOI:10.1021/ ja011383j.
[62] KEW S, BANERJEE T, MINIHANE A M, et al. Relation between the fatty acid composition of peripheral blood mononuclear cells and measures of immune cell function in healthy, free-living subjects aged 25-72 y[J]. The American Journal of Clinical Nutrition, 2003, 77(5): 1278-1286.
[63] WASSALL S R, STILLWELL W. Polyunsaturated fatty acidcholesterol interactions: domain formation in membranes[J]. Biochim Biochimica Et Biophysica Acta, 2009, 1788(1): 24-32. DOI:10.1016/ j.bbamem.2008.10.011.
[64] VANKUIJK F J, BUCK P. Fatty acid composition of the human macula and peripheral retina[J]. Investigative Ophthalmology & Visual Science, 1992, 33(13): 3493-3496.
[65] KISHIMOTO Y, AGRANOFF B W, RADIN N S, et al. Comparison of the fatty acids of lipids of subcellular brain fractions[J]. Journal of Neurochemistry, 1969, 16(3): 397-404. DOI:10.1111/j.1471-4159.1969.tb10380.x.
[66] AKBAR M, CALDERON F, WEN Z, et al. Docosahexaenoic acid: a positive modulator of Akt signaling in neuronal survival[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 10858-10863. DOI:10.1073/ pnas.0502903102.
[67] CALDER P C, BOND J A, HARVEY D J, et al. Uptake and incorporation of saturated and unsaturated fatty acids into macrophage lipids and their effect upon macrophage adhesion and phagocytosis[J]. Biochemical Journal, 1990, 269(3): 807-814. DOI:10.1042/bj2690807.
[68] O’CALLAGHAN N, PARLETTA N, MILTE C M, et al. Telomere shortening in elderly individuals with mild cognitive impairment may be attenuated with omega-3 fatty acid supplementation: a randomized controlled pilot study[J]. Nutrition, 2014, 30(4): 489-491. DOI:10.1016/j.nut.2013.09.013.
[69] MARTIN-RUIZ C, DICKINSON H O, KEYS B, et al. Telomere length predicts poststroke mortality, dementia, and cognitive decline[J]. Annals of Neurology, 2006, 60(2): 174-180. DOI:10.1002/ ana.20869.
[70] VANADAL M, ALATA W, TREMBLAY C, et al. Reduction in DHA transport to the brain of mice expressing human APOE4 compared to APOE2[J]. Journal of Neurochemistry, 2014, 129(3): 516-526. DOI:10.1111/jnc.12640.
[71] MARIN C, DELQADO-LISTA J, RAMIREZ R, et al. Mediterranean diet reduces senescence-associated stress in endothelial cells[J]. Age, 2012, 34(6): 1309-1316. DOI:10.1007/s11357-011-9305-6.
[72] KIECOLT-GLASER J K, EPEL E S, BELURY M A, et al. Omega-3 fatty acids, oxidative stress, and leukocyte telomere length: a randomized controlled trial[J]. Brain Behavior and Immunity, 2013, 28: 16-24. DOI:10.1016/j.bbi.2012.09.004.
[73] GLEIHMANN U, GLEICHMANN U S, GLEICHMANN S. From cardiovascular prevention to anti-aging medicine: influence on telomere and cell aging[J]. Deutsche Medizinische Wochenschrift, 2011, 136(38): 1913-1916. DOI:10.1055/s-0031-1286363.
[74] KANG J X. Differential effects of omega-6 and omega-3 fatty acids on telomere length[J]. The American Journal of Clinical Nutrition, 2010, 92(5): 1276-1277. DOI:10.3945/ajcn.110.000463.
[75] FARZANEH-FAR R, LIIN J, EPEL E S, et al. Association of marine omega-3 fatty acid levels with telomeric aging in patients with coronary heart disease[J]. The Japan Automobile Manufacturers Association, 2010, 303(3): 250-257. DOI:10.1001/jama.2009.2008.
[76] LAYE S. What do you eat dietary omega 3 can help to slow the aging process[J]. Brain, Behavior, and Immunity, 2013, 28: 14-15. DOI:10.1016/j.bbi.2012.11.002.
[77] VALLA J, BERMDT J D, GONZALEZ-LIMA F. Energy hypometabolism in posterior cingulate cortex of Alzheimer’s patients: superficial laminar cytochrome oxidase associated with disease duration[J]. The Journal of Neuroscience, 2001, 21(13): 4923-4930.
[78] SCHIOTH H B, CRAFT S, BROOK S J, et al. Brain insulin signaling and Alzheimer’s disease: current evidence and future directions[J]. Molecular Neurobiology, 2012, 46(1): 4-10. DOI:10.1007/s12035-011-8229-6.
[79] MATTSON M P, GLEICHMANN M, CHENG A. Mitochondria in neuroplasticity and neurological disorders[J]. Neuron, 2008, 60(5): 748-766. DOI:10.1016/j.neuron.2008.10.010.
[80] ECKERT G P, RENNER K, ECKERT S H, et al. Mitochondrial dysfunction-a pharmacological target in Alzheimer’s disease[J]. Molecular Neurobiology, 2012, 46(1): 136-150. DOI:10.1007/s12035-012-8271-z.
[81] DU H, GUO L, YAN S Q, et al. Early deficits in synaptic mitochondria in an Alzheimer’s disease mouse model[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(43): 18670-18675. DOI:10.1073/pnas.1006586107.
[82] BORGER E. Mitochondrial beta-amyloid in Alzheimer’s disease[J]. Biochemical Society Transactions, 2011, 39(4): 868-873. DOI:10.1042/BST0390868.
[83] PAVLOV P F, WIEHAGER B, SAKAI J, et al. Mitochondrial gammasecretase participates in the metabolism of mitochondria-associated amyloid precursor protein[J]. The FASEB Journal, 2011, 25(1): 78-88. DOI:10.1096/fj.10-157230.
[84] LEUNER K, SCHUTT T, KURZ C, et al. Mitochondrion-derived reactive oxygen species lead to enhanced amyloid beta formation[J]. Antioxidants and Redox Signaling, 2012, 16(12): 1421-1433. DOI:10.1089/ars.2011.4173.
[85] COLE G M, MA Q L, FRAUTSCHY S A. Omega-3 fatty acids and dementia[J]. Prostaglandins Leukot Essent Fatty Acids, 2009, 81(2/3): 213-221. DOI:10.1016/j.plefa.2009.05.015.
[86] GREEN K N, MARTINEZ-CORIA H, KHASHWJI H, et al. Dietary docosahexaenoic acid and docosapentaenoic acid ameliorate amyloidbeta and tau pathology via a mechanism involving presenilin 1 levels[J]. The Journal of Neuroscience, 2007, 27(16): 4385-4495. DOI:10.1523/JNEUROSCI.0055-07.2007.
[87] GRIMM M O, CHENBECKER J, GROSQEN S, et al. Docosahexaenoic acid reduces amyloid beta production via multiple pleiotropic mechanisms[J]. Journal of Biological Chemistry, 2011, 286(16): 14028-14039. DOI:10.1074/jbc.M110.182329.
[88] ECKERT G P, CHANG S, ECKMANN J, et al. Liposomeincorporated DHA increases neuronal survival by enhancing nonamyloidogenic APP processing[J]. Biochimica Et Biophysica Acta, 2011, 1808(1): 236-243. DOI:10.1016/j.bbamem.2010.10.014.
[89] PEREZ S E, BERG B M, MOORE K A, et al. DHA diet reduces AD pathology in young APPswe/PS1 Delta E9 transgenic mice: possible gender effects[J]. Journal of Neuroscience Research, 2010, 88(5): 1026-1040. DOI:10.1002/jnr.22266.
[90] OSTER T, PILLOT T. Docosahexaenoic acid and synaptic protection in Alzheimer’s disease mice[J]. Biochimica Et Biophysica Acta, 2010, 1801(8): 791-798. DOI:10.1016/j.bbalip.2010.02.011.
[91] ARSENAULT D, JULIEN C, TREMBLAY C, et al. DHA improves cognition and prevents dysfunction of entorhinal cortex neurons in 3xTg-AD mice[J]. PLoS One, 2011, 6(2): 17397. DOI:10.1371/ journal.pone.0017397.
[92] STANLEY W C, KHAIRALLAH R J, DABKOWSKI E R. Update on lipids and mitochondrial function: impact of dietary n-3 polyunsaturated fatty acids[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2012, 15(2): 122-126. DOI:10.1097/ MCO.0b013e32834fdaf7.
[93] KONES R. Parkinson’s disease: mitochondrial molecular pathology, inflammation, statins, and therapeutic neuroprotective nutrition[J]. Nutrition in Clinical Practice, 2010, 25(4): 371-389. DOI:10.1177/0884533610373932.
[94] DALFO E, PORTERO-OTIN M, AYALA V, et al. Evidence of oxidative stress in the neocortex in incidental Lewy body disease[J]. The Journal of Neuropathology & Experimental Neurology, 2005, 64(9): 816-830. DOI:10.1097/01.jnen.0000179050.54522.5a.
[95] FABELO N, MARTIN V, SANTPERE G, et al. Severe alterations in lipid composition of frontal cortex lipid rafts from Parkinson’s disease and incidental Parkinson’s disease[J]. Molecular Medicine, 2011, 17(9/10): 1107-1118. DOI:10.2119/molmed.2011.00119.
[96] BOUSQUET M, SAINT-PIERRE M, JULIEN C, et al. Beneficial effects of dietary omega-3 polyunsaturated fatty acid on toxin-induced neuronal degeneration in an animal model of Parkinson’s disease[J]. The Faseb Journal, 2008, 22(4): 1213-1225. DOI:10.1096/fj.07-9677com.
[97] HERMANSON E, PERLMANN T, OLSON L E, et al. Nurr1 regulates dopamine synthesis and storage in MN9D dopamine cells[J]. Experimental Cell Research, 2003, 288(2): 324-334. DOI:10.1016/ S0014-4827(03)00216-7.
[98] OZSOY O, SEVAL-CELIK Y, HACIOGLU G, et al. The influence and the mechanism of docosahexaenoic acid on a mouse model of Parkinson’s disease[J]. Neurochemistry International, 2011, 59(5): 664-670. DOI:10.1016/j.neuint.2011.06.012.
[99] TANRIOVER G, SEVAL-CELIK Y, OZSOY O, et al. The effects of docosahexaenoic acid on glial derived neurotrophic factor and neurturin in bilateral rat model of Parkinson’s disease[J]. Folia Histochemica et Cytobiologica, 2010, 48(3): 434-441. DOI:10.2478/ v10042-010-0047-6.
[100] SAMADI P, GREQOIRE L, ROUILLARD C, et al. Docosahexaenoic acid reduces levodopa-induced dyskinesias in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine monkeys[J]. Annals of Neurology, 2006, 59(2): 282-288. DOI:10.1002/ana.20738.
[101] LUCHTMAN D W, MENG Q, SONG C. Ethyl-eicosapentaenoate(E-EPA) attenuates motor impairments and inflammation in the MPTP-probenecid mouse model of Parkinson’s disease[J]. Behavioural Brain Research, 2012, 226(2): 386-396. DOI:10.1016/j.bbr.2011.09.033.
[102] KABUTO H, AMAKAWA M, MANKURA M, et al. Docosahexaenoic acid ethyl ester enhances 6-hydroxydopamineinduced neuronal damage by induction of lipid peroxidation in mouse striatum[J]. Neurochemical Research, 2009, 34(7): 1299-1303. DOI:10.1007/s11064-008-9909-0.
[103] CANSEV M, ULUS I H, WANG L, et al. Restorative effects of uridine plus docosahexaenoic acid in a rat model of Parkinson’s disease[J].Neuroscience Research, 2008, 62(3): 206-209. DOI:10.1016/ j.neures.2008.07.005.
[104] BOUSQUET M, GUE K, EMOND V, et al. Transgenic conversion of omega-6 into omega-3 fatty acids in a mouse model of Parkinson’s disease[J]. Journal of Lipid Research, 2011, 52(2): 263-271. DOI:10.1194/jlr.M011692.
[105] LUKIW W J, BAZAN N G. Inflammatory, apoptotic, and survival gene signaling in Alzheimer’s disease: a review on the bioactivity of neuroprotectin D1 and apoptosis[J]. Molecular Neurobiology, 2010, 42(1): 10-16. DOI:10.1007/s12035-010-8126-4.
[106] MAYURASAKORM K, WILLIAMS J J, TEN V S, et al. Docosahexaenoic acid: brain accretion and roles in neuroprotection after brain hypoxia and ischemia[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2011, 14(2): 158-167. DOI:10.1097/ MCO.0b013e328342cba5.
[107] FENG Z H, ZOU, X, JIA H Q, et al. Maternal docosahexaenoic acid feeding protects against impairment of learning and memory and oxidative stress in prenatally stressed rats: possible role of neuronal mitochondria metabolism[J]. Antioxidants & Redox Signaling, 2012, 16(3): 275-289. DOI:10.1089/ars.2010.3750.
[108] TUZUN F, KUMRAL A, OZBAL S, et al. Maternal prenatal omega-3 fatty acid supplementation attenuates hyperoxia-induced apoptosis in the developing rat brain[J]. International Journal of Developmental Neuroscience, 2012, 30(4): 315-523. DOI:10.1016/ j.ijdevneu.2012.01.007.
[109] SUGANUMA H, ARAI Y, KITAMURA Y, et al. Maternal docosahexaenoic acid-enriched diet prevents neonatal brain injury[J]. Neuropathology, 2010, 30(6): 597-605. DOI:10.1111/j.1440-1789.2010.01114.x.
[110] BECERIR C, KILICI I, SAHIN O, et al. The protective effect of docosahexaenoic acid on the bilirubin neurotoxicity[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2013, 28(4): 801-807. DOI:10.3109/14756366.2012.684053.
[111] ROTSEIN N P, AVELDANO M, FRANCISCO B J, et al. Apoptosis of retinal photoreceptors during development in vitro: protective effect of docosahexaenoic acid[J]. Journal of Neurochemistry, 1997, 69(2): 504-513. DOI:10.1046/j.1471-4159.1997.69020504.x.
[112] ROTSEIN N P, POLITI L E, GERMAN O L, et al. Protective effect of docosahexaenoic acid on oxidative stress-induced apoptosis of retina photoreceptors[J]. Investigative Ophthalmology & Visual Science, 2003, 44(5): 2252-2259. DOI:10.1167/iovs.02-0901.
[113] YOSHIZAWA K, SASAKI T, KURO M, et al. Arachidonic acid supplementation during gestational, lactational and post-weaning periods prevents retinal degeneration induced in a rodent model[J]. The British Journal of Nutrition, 2013, 109(8): 1424-1432. DOI:10.1017/ S0007114512003327.
Advances in Research on Neuron-Protective Role of Polyunsaturated Fatty Acids
LIU Zhiguo, WANG Hualin, WANG Limei, LIU Lieju
*
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:The protective effects of polyunsaturated fatty acids (PUFAs) on brain function and the nervous system have attracted a lot of attention. Numerous studies have illustrated the anti-inflammation, anti-oxidative and cardiovascular protective effects of PUFAs, as well as the protective effects on brain function, particularly nerve cells. In this article, we review the mechanisms of brain-protective effects of PUFAs in following fields: how PUFAs promote neurogenesis,maintain nerve cell morphology and function, improve neurite growth; prevent neurodegeneration, depress nerve cell apoptosis and regulate membrane fluidity, plasticity and telomere activity in neurons. This review provides a prospective insight on nutritional studies of PUFAs against aging and/or diseases (such as Alzheimer’s disease and Parkinson’s disease) inducing brain disorders.
Key words:polyunsaturated fatty acid; neurodegeneration; nerve cells; neurogenesis; brain function
DOI:10.7506/spkx1002-6630-201607043
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)07-0239-10
引文格式:
刘志国, 王华林, 王丽梅, 等. 多不饱和脂肪酸对神经细胞保护作用的研究进展[J]. 食品科学, 2016, 37(7): 239-248. DOI:10.7506/spkx1002-6630-201607043. http://www.spkx.net.cn
LIU Zhiguo, WANG Hualin, WANG Limei, et al. Advances in research on neuron-protective role of polyunsaturated fatty acids[J]. Food Science, 2016, 37(7): 239-248. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607043. http://www.spkx.net.cn
收稿日期:2015-03-26
基金项目:国家自然科学基金面上项目(31271855);国家自然科学基金青年科学基金项目(31000772);湖北省自然科学基金项目(2014CFB887);湖北省教育厅科技计划项目(D20141705)
作者简介:刘志国(1963—),男,教授,博士,研究方向为营养与食品安全。E-mail:zhiguo_l@126.com
*通信作者:刘烈炬(1952—),男,教授,硕士,研究方向为营养生物学。E-mail:liulieju@qq.com