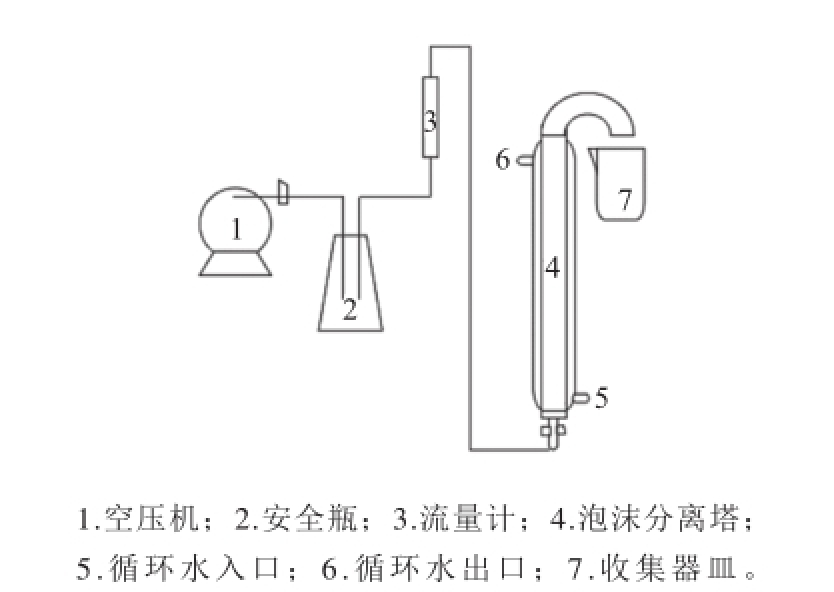
图1 泡沫分离装置图
Fig.1 Experimental apparatus for foam separation
高中超,张 炜*,陈元涛,刘海彬,刘 龙,雷 蕾
(青海师范大学化学系,青海 西宁 810008)
摘 要:在酶解黄姜的基础上,对黄姜薯蓣皂苷进行超声醇提,进而建立泡沫分离黄姜薯蓣皂苷的新方法。通过单因素试验及响应面试验设计,探讨稀释倍数、温度、装液量对泡沫法分离黄姜中薯蓣皂苷回收率及富集比的影响。结果得出,泡沫分离最佳条件为稀释倍数84、温度20 ℃、装液量436 mL,此条件下薯蓣皂苷的回收率为91.08%,富集比为7.53。研究表明,泡沫分离法是一种有效、简便、易于工业化生产和环境友好的黄姜薯蓣皂苷的分离富集方法。
关键词:黄姜;薯蓣皂苷;泡沫分离法;响应面分析法
高中超, 张炜, 陈元涛, 等. 响应面试验优化泡沫分离黄姜中薯蓣皂苷工艺[J]. 食品科学, 2016, 37(8): 26-31.
GAO Zhongchao, ZHANG Wei, CHEN Yuantao, et al. Optimization of foam separation of dioscin from Dioscorea zingiberensis C. H. Wright by response surface methodology[J]. Food Science, 2016, 37(8): 26-31. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608005. http://www.spkx.net.cn
黄姜(Dioscorea zingiberensis C. H. Wright)学名盾叶薯蓣,又名火头根、枕头根 [1-2],是我国特有的薯蓣科薯蓣属多年生草质缠绕性藤本植物,主要分布在河南、湖南、湖北、陕西、甘肃、四川 [3-5]。其根茎中的多种薯蓣皂苷水解后得到的薯蓣皂苷元是合成避孕药、甾体激素类药物的重要原料,有“激素之母”、“药用黄金”的美称,含量约1.0%~5.0% [6-9],是目前世界上最好的激素类来源的天然药物,进而为从植物中大量获取天然甾体激素原料开辟了新途径 [10-11]。
薯蓣皂苷元是薯蓣属植物中薯蓣皂苷的配基,主要以薯蓣皂苷的形式与纤维素结合存在于细胞壁中,即在C3位通过皂苷键与糖链相连,进而与植物细胞壁紧密连接 [12-13]。工业上主要采用盐(硫)酸破坏薯蓣植物细胞结构和组成,断开薯蓣皂苷元与糖(纤维素)连接的苷键,使薯蓣皂苷元游离出来,利用它不溶于水而溶于有机溶剂的性质,用丙酮或石油醚等把它提取出来 [14-15]。此法虽工艺简单,但存在水解不完全、能耗高、收率低、淀粉和纤维素等成分不能被综合利用、后续提取的溶剂量较大和严重污染环境等问题。另外黄姜皂素生产企业主要集中在鄂西北和陕南地区 [16-17],这些区域既是黄姜主产区,又与我国南水北调中线工程的水源地重叠 [18],成为中线工程的重要污染源,黄姜皂素行业污染屡屡成为国家环保挂牌督办的案件。所以研究开发黄姜薯蓣皂苷元的清洁生产工艺已成为皂素产业面临的亟待解决的问题。
近年来许多研究机构和企业纷纷致力于开发黄姜薯蓣皂苷元的清洁生产工艺,目前主要提出了两种解决方案:一是用反应专一性好、条件温和的酶水解代替酸水解;二是减少进入酸水解环节的非皂苷物料。但是现行的研究结果表明,选用特定的糖苷酶进行水解,存在选择性差、水解不完全等缺点,但至今尚未发现活性较高、选择性较好的糖苷酶菌种 [19],因此在目前酸水解核心工艺无法被替代的情况下,第2种方案即从黄姜中把薯蓣皂苷提取出来后,经浓缩、水解得到薯蓣皂苷元,才是行之有效的解决办法。
泡沫分离是一种基于溶液中溶质组分间表面活性的差异进行分离的新型技术,由于泡沫分离法具有设备简单、操作方便、运行成本低、环境友好和适于大规模工业化生产等优点 [20-22],已被成功地用于金属离子、表面活性剂、蛋白质、皂苷及中药有效成分的分离富集。众所周知,溶液中含有表面活性物质是泡沫分离的必要条件之一,薯蓣皂苷具有亲水性的糖基和疏水性的皂苷元,是一种优良的天然非离子型表面活性成分,具有良好的起泡性。因此黄姜粗提液具备了泡沫分离的必要条件。采用泡沫分离法提取黄姜中的薯蓣皂苷,可一步完成上述第2种方案的提取和浓缩薯蓣皂苷工序,避免了非皂苷物料进入下一步的酸水解环节,从而大幅减少酸和有机溶剂的使用量,同时也降低了废水排放量,可实现黄姜薯蓣皂苷元高效、简便和环境友好的分离提取。迄今为止,泡沫分离法提取黄姜中薯蓣皂苷的研究鲜见报道。
本研究选用黄姜薯蓣皂苷作为分离对象,考察了稀释倍数、温度、空气流速和装液量对薯蓣皂苷泡沫分离过程的影响,并通过响应面优化工艺条件,为开发和探索黄姜薯蓣皂苷元的清洁生产工艺提供理论依据。
1.1 材料与试剂
新鲜黄姜,经青海省食品药品检定所姜世贤研究员鉴定,产地湖北恩施神农架;薯蓣皂苷标准品(含量≥98%,色谱纯) 上海雅吉生物科技有限公司;高氯酸(分析纯) 天津市化学试剂一厂;无水乙醇(分析纯) 国药集团化学试剂有限公司;其他试剂均为分析纯;实验用水为去离子水。
1.2 仪器与设备
TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;RV10BS25旋转蒸发仪、RCT加热磁力搅拌器 艾卡(广州)仪器设备有限公司;BSA224SCW分析天平 赛多利斯科学仪器(北京)有限公司;101A-1E电热鼓风干燥箱 上海五久自动化设备有限公司;HK-2A超级恒温水浴 南京大学物理应用物理研究所;恒温泡沫分离柱(内径35 mm、外径40 mm、柱高1 050 mm(加弯头150 mm),分布器微孔孔径为30 μm;外有夹套,通循环水,控制温度) 自制(图1);LZB型转子流量计 上海帆扬机电有限公司;FB45/7空气压缩机 上海捷豹压缩机制造有限公司。

图1 泡沫分离装置图
Fig.1 Experimental apparatus for foam separation
1.3 方法
1.3.1 薯蓣皂苷标准曲线的绘制 [23]
精确称量薯蓣皂苷标准品8.8 mg,加甲醇定容至25 mL,摇匀得标品溶液。分别准确量取薯蓣皂苷标品溶液0.01、0.04、0.08、0.12、0.16、0.20 mL于6 支10 mL具塞试管中,置入烘箱,于65 ℃挥发尽溶剂;每支试管加入5 mL高氯酸,塞紧旋塞于70 ℃水浴显色反应15 min,取出,放入冰水中冷却5 min;以高氯酸作为参比,紫外-可见分光光度计测得薯蓣皂苷在406.5 nm波长处有最大吸收;以标量量和吸光度的关系作线性回归,结果表明,薯蓣皂苷量品量在3.52×10 -3~70.4×10 -3mg范围内与吸光度呈线性关系,得标准曲线方程为:y=0.003 03x-0.000 88,R 2=0.999 1。
1.3.2 量品溶液的制备
新鲜黄姜烘干后粉碎,过80 目筛;准确称取10.0 g黄姜干粉,加入0.2 g纤维素酶、30 mL去离子水,50 ℃水浴条件下,电磁搅拌酶解2 h;倾入120 mL无水乙醇,超声浸提1 h,减压过滤,重复1次(80%乙醇溶液50 mL);合并两次滤液得约200 mL。
1.3.3 单因素试验
选取稀释倍数、温度、空气流速、装液量4 个因素进行单因素考察。采用分光光度法测定其薯蓣皂苷含量,以富集比、回收率为指标评价泡沫分离效果,计算见式(1)、(2)。
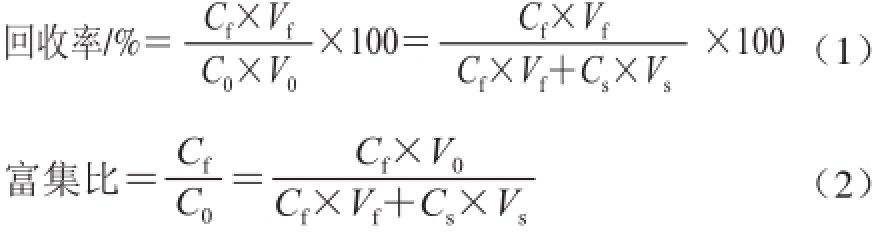
式中:C 0、C f、C s分别为初始液、泡沫层和残留液中薯蓣皂苷质量浓度/(mg/mL);V 0、V s、V f分别为原液、残留液和泡沫层的体积/mL。
1.3.4 响应面试验设计
根据Box-Behnken原理设计试验,在单因素试验的基础上采用三因素三水平的响应面分析方法进一步试验。选择稀释倍数、装液量、温度3 个因素为自变量,以薯蓣皂苷回收率和富集比为响应值,确定这3 个自变量对黄姜薯蓣皂苷回收率和富集比的影响,以及最佳工艺条件组合。试验因素与水平设计见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Three factors and their coded levels used in Box-Behnken design
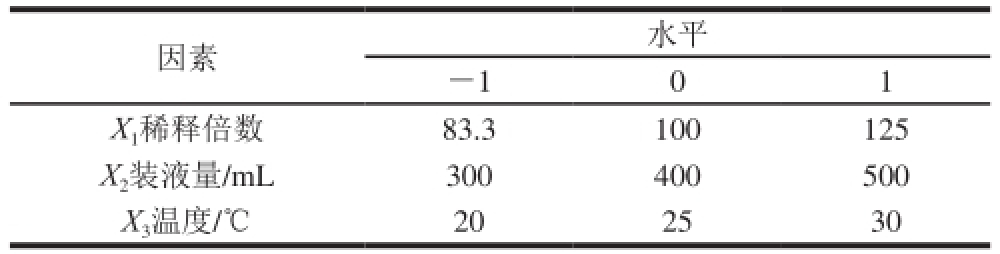
因素水平-101 X 1稀释倍数83.3100125 X 2装液量/mL300400500 X 3温度/℃202530
2.1 单因素试验结果
2.1.1 稀释倍数对薯蓣皂苷泡沫分离的影响
在同台设备上,25 ℃进行间歇式操作,空气流速60 mL/min、装液量400 mL,考察稀释倍数对分离效果的影响。
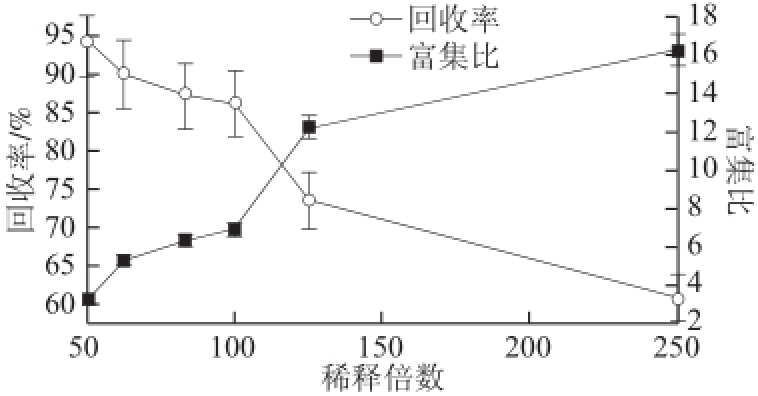
图2 稀释倍数对薯蓣皂苷泡沫分离的影响
Fig.2 Effect of dilution factor on foam separation
由图2可知,薯蓣皂苷富集比随料液质量浓度的增大而降低,回收率随料液质量浓度的增大反而升高。随着料液质量浓度的增大,溶液中所含的表面活性物质的质量浓度也增大,使泡沫的稳定性增加,泡沫所夹带的液体量增多,因此薯蓣皂苷富集比下降而回收率升高。综合可知,当稀释倍数在100 倍左右时,泡沫分离效果较好。
2.1.2 温度对薯蓣皂苷泡沫分离的影响
同台设备上,进行间歇式操作,空气流速60 mL/min,进料液中薯蓣皂苷质量浓度一定,装液量400 mL,考察温度对分离效果的影响。
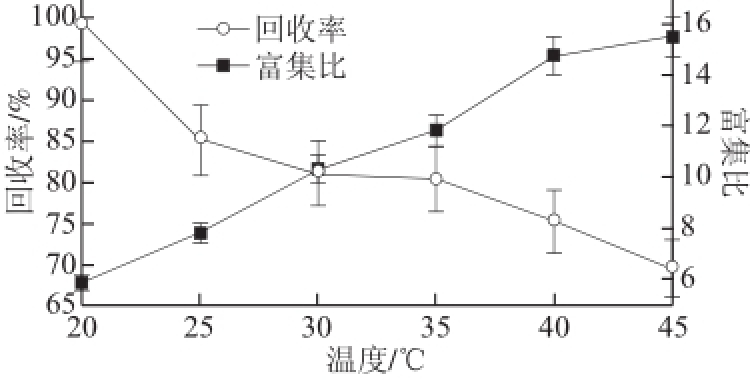
图3 温度对薯蓣皂苷泡沫分离的影响
Fig.3 Effect of initial temperature on foam separation
由图3可见,随着温度升高,薯蓣皂苷回收率随之降低,富集比却随之增大。实验过程中,温度的升高会降低泡沫液膜的表面黏度,减小了扩散阻力,吸附阻力降低,吸附量增大,但表面黏度是泡沫稳定性的主要影响因素,当黏度减小时,泡沫液膜易变薄,泡沫不稳定,容易破裂,破碎的泡沫更容易鼓出;过高或过低的温度都不利于泡沫稳定的存在,因此只有温度适宜才能得到好的泡沫分离效果 [24]。综合回收率与富集比之间关系,当原料液温度为25 ℃左右时,分离效果较好。
2.1.3 空气流速对薯蓣皂苷泡沫分离的影响
同台设备上,25 ℃进行间歇式操作,装液量为400 mL,进料液中薯蓣皂苷质量浓度一定,考察空气流速对分离效果的影响。
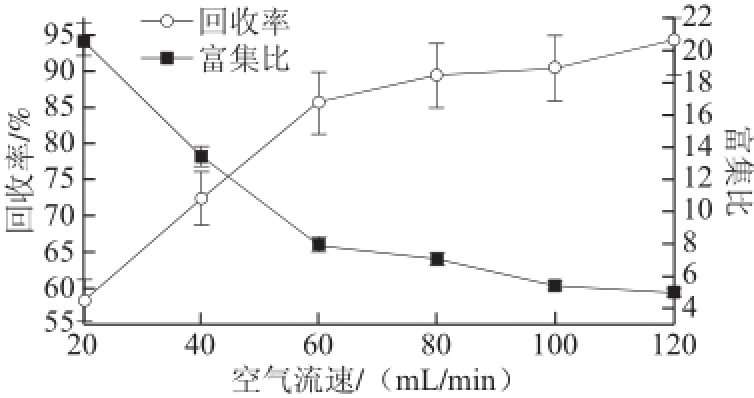
图4 空气流速对薯蓣皂苷泡沫分离的影响Fig.4 Effect of airflow rate on foam separation
由图4可见,随着空气流速的增大,薯蓣皂苷富集比降低,回收率却随之增大。较低的空气流速条件下,由于泡沫到达塔顶的时间较长,延长了排水时间,使进入泡沫间隙的主体溶液减少,泡沫中夹带的液体量也减少,从而导致浓缩倍数高和收率低;在较高的空气流速条件下,泡沫中夹带液体的量增加,使吸附于泡沫中的薯蓣皂苷被有效地“稀释”,从而致使浓缩倍数低;同时,由于进入泡沫间隙液体中的夹带液增多,导致皂苷的收率较高 [25]。综合以上指标可得,当空气流速在60 mL/min左右时,有较好的分离效果。
2.1.4 装液量对薯蓣皂苷泡沫分离的影响
同台设备上,25 ℃条件下进行间歇式操作,空气流速60 mL/min,进料液中薯蓣皂苷质量浓度一定,考察装液量对分离效果的影响。
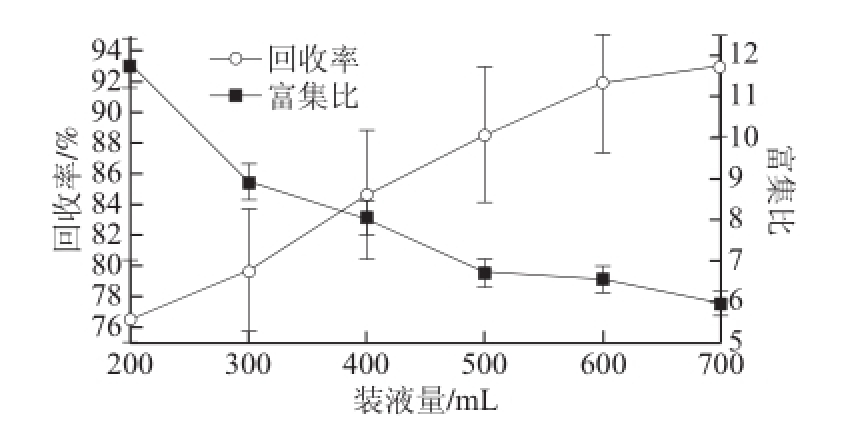
图5 装液量对薯蓣皂苷泡沫分离的影响
Fig.5 Effect of loading volume on foam separation
由图5可知,回收率随着装液量的增加呈现上升趋势,富集比随着装液量的增加呈下降趋势。这是因为随着装液量的增大,鼓泡区变大,相应的泡沫分离区就小了,泡沫中更多的夹带液在回流前被鼓出,因此回收率增大。另外,由于进料量的增加,液体回流时间减少,使得更多的泡沫夹带液被收集,则富集比呈现下降的趋势。综合以上2 个指标可见,当装液量在400 mL左右时,泡沫分离效果较好。
2.2 响应面试验结果
2.2.1 响应面试验设计及结果
黄姜中甾体皂苷含量高,溶液起泡性好,较高气速导致皂苷难与溶液本体分离(皂苷带出液体过多),故本试验空气流速偏低,但在较低空气流速条件下试验周期较长,且气速影响与装液量影响一致;因此选取稀释倍数、温度、装液量3 个因素进行响应面试验。响应面试验设计及结果见表2。
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
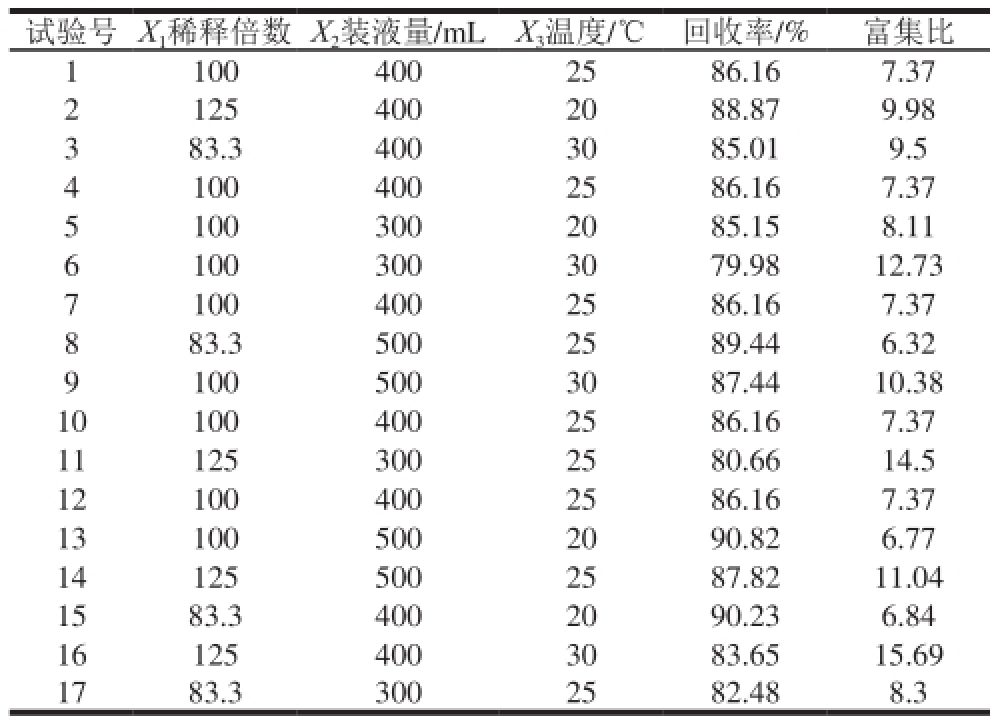
试验号X 1稀释倍数X 2装液量/mLX 3温度/℃回收率/%富集比11004002586.167.37 21254002088.879.98 383.34003085.019.5 41004002586.167.37 51003002085.158.11 61003003079.9812.73 71004002586.167.37 883.35002589.446.32 91005003087.4410.38 101004002586.167.37 111253002580.6614.5 121004002586.167.37 131005002090.826.77 141255002587.8211.04 1583.34002090.236.84 161254003083.6515.69 1783.33002582.488.3
2.2.2 回归模型的建立与检验
对表2试验数据用多元回归量合后,得到薯蓣皂苷回收率(R)及富集比(E)与稀释倍数、温度和装液量的回归方程:
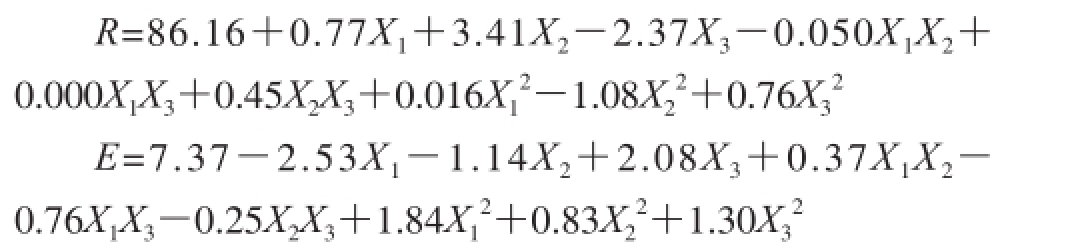
对两回归方程进行方差分析,结果见表3、4。
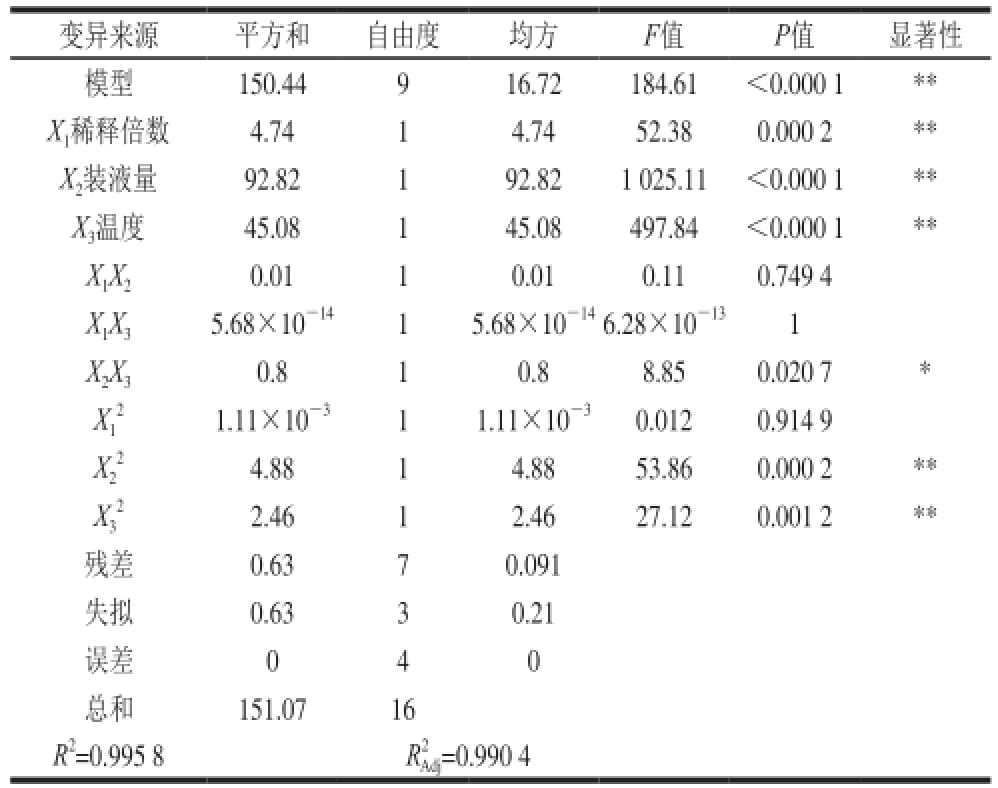
表3 回收率的线性回归方差分析
Table 3 Analysis of variance (ANOVA) of the linear regression equation of dioscin recovery
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
变异来源平方和自由度均方F值P值显著性模型150.44916.72184.61<0.000 1** X 1稀释倍数4.7414.7452.380.000 2** X 2装液量92.82192.821 025.11<0.000 1** X 3温度45.08145.08497.84<0.000 1** X 1X 20.0110.010.110.749 4 X 1X 35.68×10 -1415.68×10 -146.28×10 -131 X 2X 30.810.88.850.020 7* X 11.11×10 -311.11×10 -30.0120.914 9 X2 2 2.4612.4627.120.001 2**残差0.6370.091失量0.6330.21误差040总和151.0716 4.8814.8853.860.000 2** X3 22 R 2=0.995 8R 2 Adj=0.990 4
由表3可知,该模型达到极显著水平(P<0.01),模型的调整确定系数R
2=0.995 8,该模型能解释99.58%响应值的变化,校正决定系数
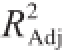 =0.990 4,可知该回归方程量合度和可信度均很高,因而该模型量合程度比较好,试验误差小,故可用于设计范围内的预测。对表3回归模型系数的显著性分析可见,一次项中,X
1、X
2、X
3极显著;平方项中X
2
2、X
3
2极显著,说明装液量和温度与薯蓣皂苷回收率之间存在明显的二次关系;交互项中X
2X
3显著,说明X
2X
3之间存在显著的交互作用。
=0.990 4,可知该回归方程量合度和可信度均很高,因而该模型量合程度比较好,试验误差小,故可用于设计范围内的预测。对表3回归模型系数的显著性分析可见,一次项中,X
1、X
2、X
3极显著;平方项中X
2
2、X
3
2极显著,说明装液量和温度与薯蓣皂苷回收率之间存在明显的二次关系;交互项中X
2X
3显著,说明X
2X
3之间存在显著的交互作用。
由表4可知,该模型达到极显著水平(P<0.01),模型的调整确定系数R
2=0.994 5,该模型能解释99.45%响应值的变化,校正决定系数
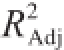 =0.987 3,可知该回归方程量合度和可信度均很高,因而该模型量合程度比较好,试验误差小,故可用于设计范围内的预测。对表4回归模型系数的显著性分析可见,一次项中,X
1、X
2、X
3极显著;平方项中
=0.987 3,可知该回归方程量合度和可信度均很高,因而该模型量合程度比较好,试验误差小,故可用于设计范围内的预测。对表4回归模型系数的显著性分析可见,一次项中,X
1、X
2、X
3极显著;平方项中
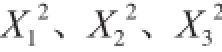 极显著,说明各因素与薯蓣皂苷富集比之间存在明显的二次关系;交互项中X
1X
3极显著,说明X
1X
3之间存在极显著的交互作用。
极显著,说明各因素与薯蓣皂苷富集比之间存在明显的二次关系;交互项中X
1X
3极显著,说明X
1X
3之间存在极显著的交互作用。
表4 富集比的线性回归方差分析
Table 4 Analysis of variance (ANOVA) of linear regression equation of enrichment ratio
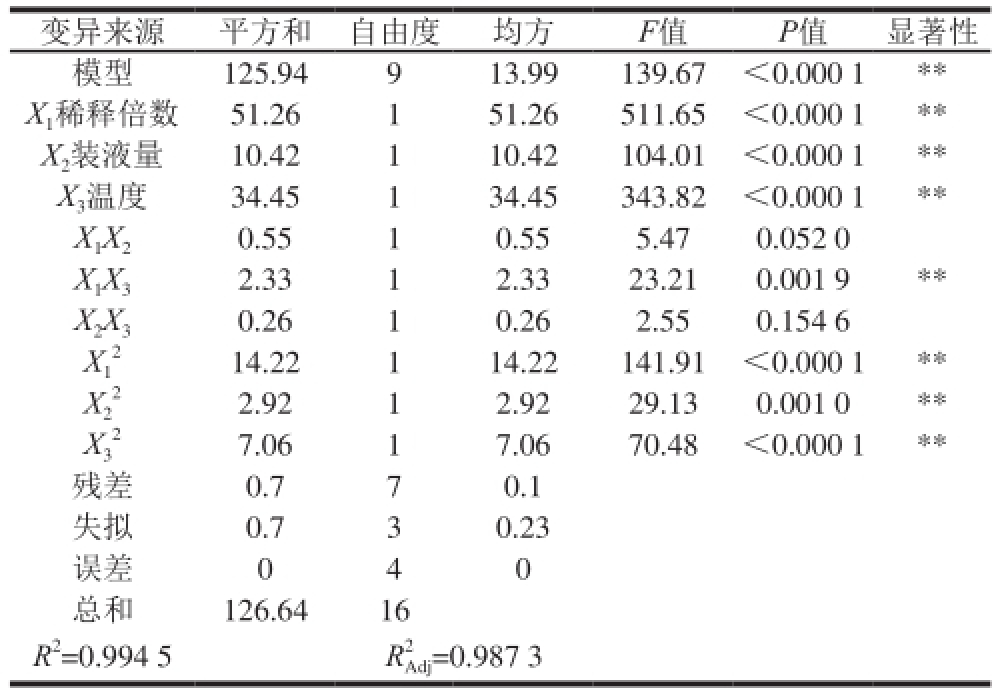
变异来源平方和自由度均方F值P值显著性模型125.94913.99139.67<0.000 1** X 1稀释倍数51.26151.26511.65<0.000 1** X 2装液量10.42110.42104.01<0.000 1** X 3温度34.45134.45343.82<0.000 1** X 1X 20.5510.555.470.052 0 X 1X 32.3312.3323.210.001 9** X 2X 30.2610.262.550.154 6 X1 2 14.22114.22141.91<0.000 1** X2 7.0617.0670.48<0.000 1**残差0.770.1失量0.730.23误差040总和126.6416 2.9212.9229.130.001 0** X3 22 R 2=0.994 5R 2 Adj=0.987 3
2.2.3 响应面图分析及最佳条件优化
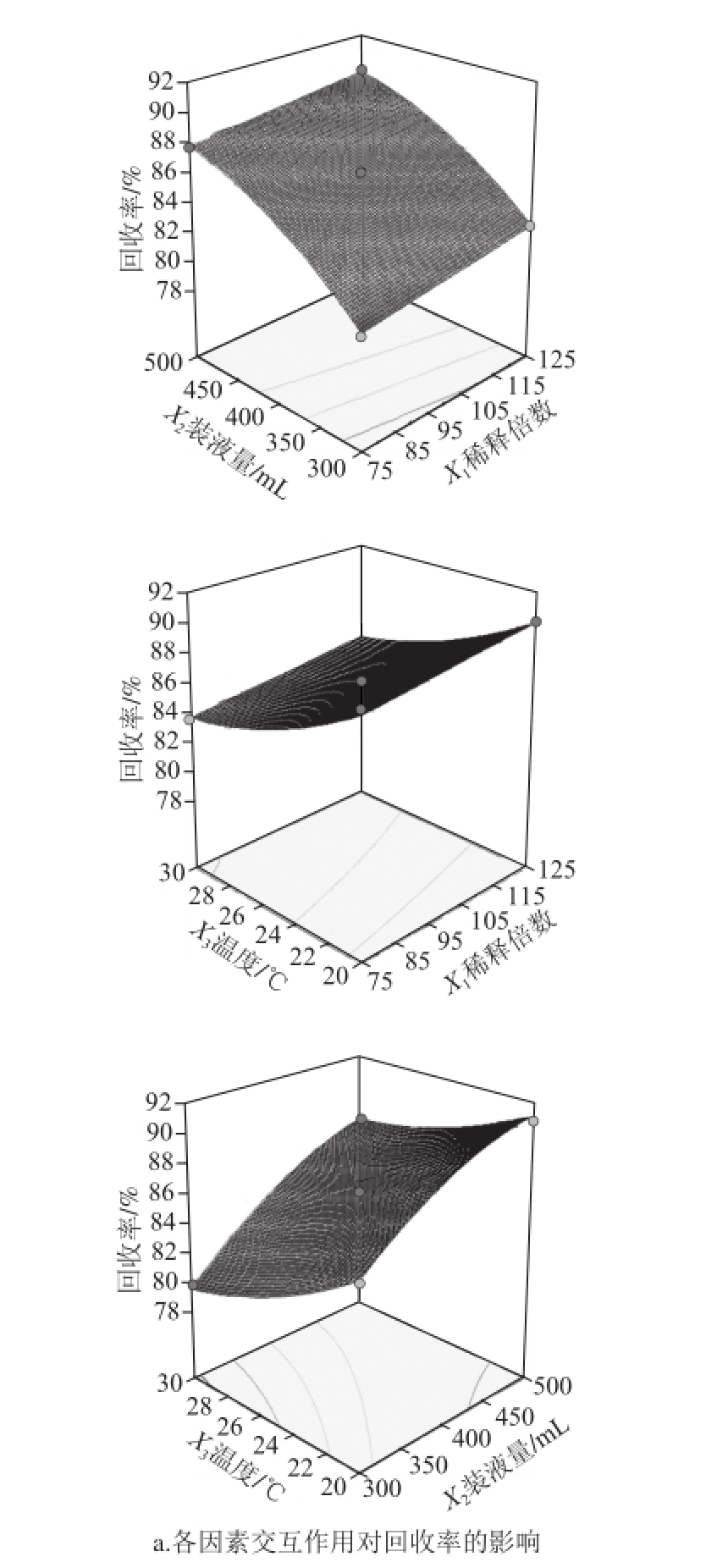
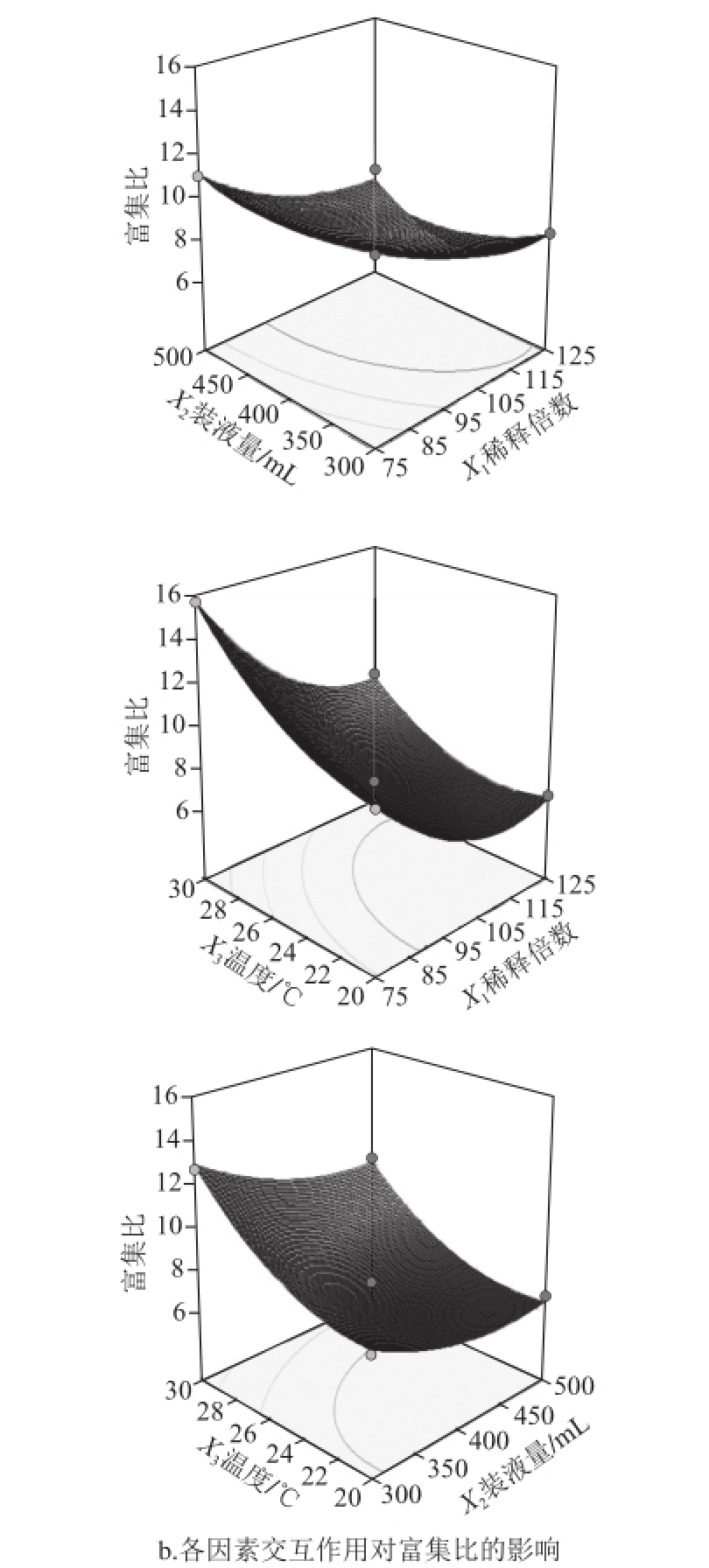
图6 各因素交互作用对回收率及富集比影响的响应面
Fig.6 Response surface graphs for the interactive effects of operating parameters on foam separation
如图6所示,薯蓣皂苷回收率随着装液量与温度的变化会产生较大变化,装液量越大,温度越低,薯蓣皂苷回收率越高。同理,由稀释倍数与温度交互响应面可知,稀释倍数越小,温度越低,薯蓣皂苷富集比越高。根据确立的响应面模型,通过Design-Expert 8.0.6.1软件得出泡沫分离黄姜中薯蓣皂苷最优分离条件(确立最大回收率的前提下,优选较大富集比):稀释倍数83.89、温度20.01℃、装液量436.18 mL,预测薯蓣皂苷的最优回收率为90.89%,富集比为7.67。为验证此试验确立的最佳工艺条件,结合实际需求,控制稀释倍数84、温度20 ℃、装液量436 mL,在上述条件下,平行实验3 次,得到薯蓣皂苷回收率为91.08%,富集比为7.53,说明该试验优化的工艺条件可靠。
建立了黄姜薯蓣皂苷回收率(R)、富集比(E)与稀释倍数、装液量以及温度的回归方程:R=86.16+ 0.77X 1+3.41X 2-2.37X 3-0.050X 1X 2+0.000X 1X 3+ 0.45X 2X 3+0.016X 1 2-1.08X 2 2+0.76X 3 2;E=7.37-2.53X 1-1.14X 2+2.08X 3+0.37X 1X 2-0.76X 1X 3-0.25X 2X 3+ 1.84X 1 2+0.83X 2 2+1.30X 3 2。方差分析表明量合较好、可信度均很高,可用于设计范围内的预测。
通过单因素试验及响应面统计分析,结合实际操作,得出分离薯蓣皂苷的最佳工艺条件是稀释倍数84、温度20 ℃、装液量436 mL/min,在此条件下进行提取,薯蓣皂苷的回收率为91.08%,富集比为7.53。实验结果表明,泡沫分离法是一种有效、简便和环境友好的黄姜薯蓣皂苷的分离富集方法,可为黄姜薯蓣皂苷的工业化生产提供一定的理论依据。
参考文献:
[1] 杨如同, 佟海英. 盾叶薯蓣鲜根茎中甾体皂苷成分研究[J]. 中药材,2010, 33(1): 62-64. DOI:10.13863/j.issn1001-4454.2010.01.023.
[2] 康阿龙, 孙文基, 朱朝德, 等. 盾叶薯蓣引种栽培调查报告[J]. 中药材, 2002, 25(7): 465-466. DOI:10.3321/j.issn:1001-4454.2002.07.003.
[3] 徐德平, 胡长鹰, 魏蕾, 等. 盾叶薯蓣中水溶性甾体皂苷成分[J]. 药学学报, 2007, 42(11): 1162-1165. DOI:10.3321/ j.issn:0513-4870.2007.11.010.
[4] 徐德平, 胡长鹰, 王琳, 等. 盾叶薯蓣中新甾体皂苷的研究[J]. 药学学报, 2009, 40(1): 56-59.
[5] 程娟, 胡长鹰, 庞自洁, 等. 盾叶薯蓣中甾体皂苷的分离与结构鉴定[J]. 中草药, 2008, 39(2): 165-167. DOI:10.3321/ j.issn:0253-2670.2008.02.002.
[6] QIU Linli, NIU Hai, HUANG Wen. Ultrasonic and fermented pretreatment technology for diosgenin production from Diosorea zingiberensis C. H. Wright[J]. Chemical Engineering Research snd Design, 2011, 89(2): 239-247. DOI:10.1016/j.cherd.2010.04.023.
[7] WEN Huang, ZHAO Huazhang, NI Jinren, et al. The best utilization of D. zingiberensis C. H. Wright by an eco-friendly process[J]. Bioresource Technology, 2008, 99(15): 7407-7411. DOI:10.1016/ j.biortech.2008.01.015.
[8] 李辉, 倪晋仁. 薯蓣皂甙元的研究进展[J]. 精细化工, 2010, 27(1): 60-65.
[9] 张艳, 吴永江, 王龙虎, 等. 黄姜有效成分薯蓣皂素结晶工艺研究[J]. 中国现代应用药学, 2015(3): 301-304. DOI:10.13748/j.cnki.issn1007-7693.2015.03.011.
[10] 杨如同, 唐世蓉, 潘福生, 等. 药源植物盾叶薯蓣甾体皂苷及皂苷元的研究进展[J]. 中国野生植物资源, 2007, 26(4): 1-5. DOI:10.3969/ j.issn.1006-9690.2007.04.001.
[11] 康阿龙, 孙文基, 汤迎爽, 等. 盾叶薯蓣资源、成分及组培学研究进展[J]. 中草药, 2003, 34(8): 附17-19. DOI:10.3321/ j.issn:0253-2670.2003.08.053.
[12] 李会, 张佳佳, 梁静怡, 等. 基于酶法辅提和微波酸解的黄姜薯蓣皂苷元清洁生产工艺[J]. 食品科学, 2012, 33(20): 94-98.
[13] PIRES V S, TAKETA A T C, GRACE G, et al. Saponins and sapogenins from Brachiaria decumbens Stapf[J]. Journal of the Brazilian Chemical Society, 2002, 13(2): 135-139.
[14] 宋发军. 甾体药物源植物薯蓣属植物中薯蓣皂苷元的研究及生产状况[J]. 中成药, 2003, 25(3): 232-234. DOI:10.3969/ j.issn.1001-1528.2003.03.021.
[15] 昝丽霞, 孙文基, 张湛睿. 黄姜的生态分布及化学成分研究进展[J]. 西北药学杂志, 2005(20): 138-139. DOI:10.3969/ j.issn.1004-2407.2005.03.029.
[16] 李江浩, 葛台明. 黄姜皂素提取工艺研究进展[J]. 山东农业大学学报(自然科学版), 2014(3): 476-480. DOI:10.3969/ j.issn.1000-2324.2014.03.030.
[17] 徐永涛. 黄姜皂素产业最佳清洁生产评估及其生产废水处理探究[D].武汉: 华中科技大学, 2013.
[18] 徐升运, 赵文娟, 陈卫锋. 应用生物酶法提取黄姜皂素的清洁工艺研究[J]. 环境科学与技术, 2011, 34(2): 162-164. DOI:10.3969/ j.issn.1003-6504.2011.02.036.
[19] 薛念涛, 张国臣, 陈坚, 等. 层次分析-灰色关联分析法评价黄姜皂素生产工艺[J]. 环境科学研究, 2014, 27(1): 99-105. DOI:10.13198/ j.issn.1001-6929.2014.01.15.
[20] 吴兆亮. 泡沫分离技术及在食品组分分离中的应用[J]. 食品研究与开发, 2009, 30(5): 附录. DOI:10.3969/j.issn.1005-6521.2009.05.058.
[21] 兰洁, 李锐, 韩丽, 等. 泡沫分离法分离重楼中重楼皂苷的工艺研究[J]. 中草药, 2008, 39(1): 44-47. DOI:10.3321/ j.issn:0253-2670.2008.01.016.
[22] 谭相伟, 吴兆亮, 贾永生, 等. 泡沫分离技术在蛋白质多元体系分离中的应用[J]. 化工进展, 2005, 24(5): 510-513. DOI:10.3321/ j.issn:1000-6613.2005.05.012.
[23] 王光忠, 刘伟伟, 葛如斌, 等. 分光光度法测定盾叶薯蓣总皂苷的含量[J]. 湖北中医药大学学报, 2008, 10(2): 44-45. DOI:10.3969/ j.issn.1008-987X.2008.02.024.
[24 林清霞, 郑德勇. 泡沫分离法分离纯化无患子皂苷的研究[J]. 生物质化学工程, 2013, 47(3): 34-38. DOI:10.3969/ j.issn.1673-5854.2013.03.007.
[25] 修志龙, 张代佳, 贾凌云, 等. 泡沫分离法分离人参皂苷[J]. 过程工程学报, 2001, 1(3): 289-292. DOI:10.3321/j.issn:1009-606X.2001.03.013.
Optimization of Foam Separation of Dioscin from Dioscorea zingiberensis C. H. Wright by Response Surface Methodology
GAO Zhongchao, ZHANG Wei*, CHEN Yuantao, LIU Haibin, LIU Long, LEI Lei
(Department of Chemistry, Qinghai Normal University, Xining 810008, China)
Abstract:A novel method for recovering dioscin produced from the rhizomes of Dioscorea zingiberensis C. H. Wright by enzymatic hydrolysis and ultrasonic extraction with aqueous ethanol as the solvent was established by foam separation in this study. The effect of dilution factor, temperature and filling volume in the separation column on the recovery and enrichment ratio of dioscin was addressed using combination of one-factor-at-a-time method and response surface methodology. A dilution factor of 84, an operating temperature of 20 ℃ and filling 436 mL of sample into the separation column provided optimal conditions for separation of dioscin. Under these conditions, the maximum enrichment ratio and recovery of dioscin of 7.53 and 91.08% respectively were obtained. The procedure presented in this study is an effective, simple and environmentally compatible method thathas a great potential to be industrialized to separate dioscin from Dioscorea zingiberensis C.H. Wright using foam separation.
Key words:Dioscorea zingiberensis C. H. Wright; dioscin; foam separation; response surface methodology
DOI:10.7506/spkx1002-6630-201608005
中图分类号:O629.9
文献标志码:A
文章编号:1002-6630(2016)08-0026-06
DOI:10.7506/spkx1002-6630-201608005. http://www.spkx.net.cn
收稿日期:2015-08-10
基金项目:科技部科技人员服务企业项目(2009GJG20039)
作者简介:高中超(1988—),男,硕士研究生,研究方向为天然产物分离与提取。E-mail:39635128@qq.com
*通信作者:张炜(1972—),女,教授,硕士,研究方向为天然产物分离与提取。E-mail:zhangwei@qhnu.edu.cn
引文格式: