表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels used in Box-Behnken design
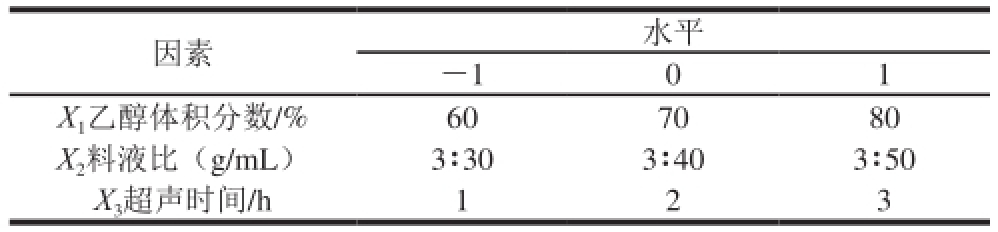
因素水平-101 X 1乙醇体积分数/%607080 X 2料液比(g/mL)3∶303∶403∶50 X 3超声时间/h123
周 茜,韩 雪,韩晓梅,闫晨静,白冰瑶,王唯霖,赵 文*
(河北农业大学食品科技学院,河北 保定 071000)
摘 要:采用响应面法优化超声提取乌梅熊果酸的最佳条件。在单因素试验基础上,选择乙醇体积分数、料液比和超声时间为影响因素,以乌梅熊果酸提取量为响应值进行响应面分析;并研究了乌梅熊果酸对大肠杆菌的抑制作用。结果表明,乌梅熊果酸提取最佳工艺条件为乙醇体积分数71%、料液比3∶44(g/mL)、超声时间2.5 h,在此条件下提取量为(12.61±0.13)mg/g。乌梅熊果酸对大肠杆菌最低抑菌浓度为0.25 mg/mL;高剂量组(0.5 mg/mL)处理后与对照组相比,细胞壁和细胞膜通透性增加,培养液蛋白质含量、核酸大分子物质含量、Ca 2+浓度和总漏出率分别增加了28、1.5、7 倍和0.8 倍;扫描电镜观察菌体有明显变形或破碎现象,表明乌梅熊果酸对大肠杆菌生长具有抑制作用。
关键词:乌梅;熊果酸;响应面分析法;大肠杆菌;抑菌作用
周茜, 韩雪, 韩晓梅, 等. 响应面试验优化乌梅熊果酸提取工艺及其对大肠杆菌的抑制作用[J]. 食品科学, 2016, 37(8): 67-73. DOI:10.7506/spkx1002-6630-201608012. http://www.spkx.net.cn
ZHOU Qian, HAN Xue, HAN Xiaomei, et al. Optimization of ursolic acid extraction from Fructus Mume and evaluation of its antibacterial activity against Escherichia coli[J]. Food Science, 2016, 37(8): 67-73. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201608012. http://www.spkx.net.cn
乌梅,又称酸梅、合汉梅,是梅果主要加工产品之一。梅是我国的一种特种资源,目前世界上仅在韩国、日本、新西兰等少数国家人工栽培,其他国家和地区相对罕见。乌梅使用历史悠久,具有敛肺涩肠、生津止渴、驱虫止痢等功效,《神农本草经》中列为中品,是我国重要的药食同源物品 [1]。研究 [2]表明,乌梅中含有多种活性物质,包括有机酸、萜类、黄酮、酯类等,其中熊果酸是乌梅发挥药理作用的有效成分之一。熊果酸具有抗炎症、降血糖及免疫增强效果等多种生物学活性 [3-5]。Zhang Tingting等 [6]研究表明熊果酸可以通过抑制Toll量受体介导的炎症途径及改善机体氧化应激作用,对实验性早期脑损伤起到保护作用。日本等国家已经将其作为天然抗氧化剂应用于食品中,具有广阔的应用前景和重要的开发利用价值 [7]。
目前乌梅熊果酸的相关研究较少。王娟 [8]采用乙醇提取乌梅熊果酸并进行响应面法优化,熊果酸提取量为6.57 mg/g。纪晓花 [9]对乌梅熊果酸抑菌效果进行初步研究,结果表明其对大肠杆菌、金黄色葡萄球菌等4 种致病菌具有显著抑菌作用。但是乌梅熊果酸提取量较低,制约了其生物活性的深入研究。因此本研究采用超声辅助提取乌梅熊果酸并进行响应面试验优化,获得最佳提取条件,提高乌梅熊果酸提取量;并从细胞膜和细胞壁通透性、蛋白质含量、细胞内容物及菌体形态等方面研究乌梅熊果酸对大肠杆菌的抑菌作用,以期为熊果酸及乌梅资源的综合利用提供可靠的理论依据。
1.1 材料与试剂
乌梅购于河北省保定万宝堂药房,60 ℃恒温烘箱中烘干,多功能高速粉碎机粉碎,60 目过筛备用。
熊果酸对照品 中国食品药品检定研究院;香草醛、无水乙醇、高氯酸、冰乙酸(均为分析纯) 天津市百纳化工有限公司;营养琼脂、酵母浸粉、琼脂粉北京奥博星生物技术有限责任公司;牛肉浸膏、蛋白胨北京双旋微生物培养基制品厂;实验用水为蒸馏水。
大肠杆菌(Escherichia coli)保存于河北农业大学微生物实验室。
1.2 仪器与设备
BL-100型高速多功能粉碎机 浙江省永康市松青五金工具厂;TU-1910紫外-可见分光光度计 北京普析通用仪器有限公司;电子天平 常州称重设备系统有限公司;SB-5200DTDN超声波清洗机 宁波新芝生物科技股份有限公司;SPX-150S-Ⅱ型生化培养箱 上海新苗医疗器械制造有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;DDS-307A (DDB-600)型电导仪 上海精密科学仪器公司。
1.3 方法
1.3.1 乌梅熊果酸含量的测定 [10-11]
1.3.1.1 熊果酸标准溶液的配制
精密称取干燥至质量恒定的熊果酸标准品20.00 mg,置于50 mL容量瓶中,无水乙醇定容,获得质量浓度为400 µg/mL的标准溶液。准确吸取2.5 mL标准品溶液,定容至10 mL,即得质量浓度为100 µg/mL的熊果酸对照品,待用。
1.3.1.2 标准曲线绘制
准确吸取熊果酸标准品0.10、0.20、0.40、0.60、0.80、1.0 mL,分别置于试管中,85 ℃水浴锅中挥干溶剂,加入5%香草醛-冰乙酸溶液0.3 mL,摇匀;加入高氯酸1.0 mL,摇匀;60 ℃水浴温育15 min,后置于冰水冷却至室温;加入冰乙酸5.0 mL,摇匀后放置15 min显色,以空白试剂为参比,测定546 nm波长处吸光度。以熊果酸标准品含量(µg/mL)为横坐标,吸光度为纵坐标,绘制熊果酸标准曲线并得到回归方程为:y=0.006 4x-0.013 2,相关系数R 2=0.999 5。
1.3.1.3 乌梅量品中熊果酸含量测定
准确吸取0.3 mL乌梅量品提取液,参照1.3.1.2节方法,测定456 nm波长处的吸光度。根据回归方程计算乌梅熊果酸质量。乌梅熊果酸提取量以单位乌梅质量(g)含有的熊果酸质量(mg)计算。
1.3.2 乌梅熊果酸取工艺流程
乌梅(干燥)→粉碎→不同条件下超声辅助浸提→离心→过滤→定容→测定吸光度→浓缩干燥→提取量计算
1.3.3 乌梅熊果酸提取单因素试验
1.3.3.1 乙醇体积分数对提取效果的影响
准确称取乌梅量品3.0 g共4 份,固定料液比3∶30(g/mL)、超声时间2 h、超声温度50 ℃,考察乙醇体积分数为50%、60%、70%、80%、90%条件下乌梅熊果酸提取量。
1.3.3.2 料液比对提取效果的影响
准确称取乌梅量品3.0 g共4 份,乙醇体积分数用1.3.3.1节中选定的条件,固定超声时间2 h、超声温度50 ℃,考察料液比为3∶20、3∶30、3∶40、3∶50、3∶60(g/mL)条件下乌梅熊果酸提取量。
1.3.3.3 超声时间对提取效果的影响
准确称取乌梅量品3.0 g共4 份,乙醇体积分数用1.3.3.1节中选定的条件,料液比用1.3.3.2节中选定的比例,固定超声温度50 ℃,考察超声时间为0.5、1、2、3、4 h条件下乌梅熊果酸提取量。
1.3.3.4 超声温度对提取效果的影响
准确称取乌梅量品3.0 g共4 份,乙醇体积分数用1.3.3.1节中选定的条件,料液比用1.3.3.2节中选定的比例,超声时间用1.3.3.3节中选定的时间,考察超声温度为30、40、50、60、70 ℃条件下乌梅熊果酸提取量。
1.3.4 乌梅熊果酸提取响应面试验优化 [12-13]
在单因素试验结果基础上,选取乙醇体积分数(X 1)、料液比(X 2)、超声时间(X 3)为自变量,以乌梅熊果酸提取量为响应值,根据响应面Box-Behnken试验设计原理,对乌梅熊果酸提取的影响因素进行深入研究和条件优化,并做出响应面图,对响应面受多个变量影响的因素进行建模分析。试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels used in Box-Behnken design

因素水平-101 X 1乙醇体积分数/%607080 X 2料液比(g/mL)3∶303∶403∶50 X 3超声时间/h123
1.3.5 乌梅熊果酸对大肠杆菌的抑制作用
依照响应面分析确定的最优条件提取乌梅熊果酸。提取液5 000 r/min离心10 min,取上清液,经大孔凝胶树脂纯化后,回收洗脱液冷冻干燥即得乌梅熊果酸粉末。配制相应质量浓度溶液进行大肠杆菌抑制作用研究。
1.3.5.1 最低抑菌浓度(minimum inhibitory concentration,MIC)的测定
采用琼脂平板稀释法测定乌梅熊果酸的MIC值 [14]。将乌梅熊果酸倍比稀释,使其在培养基中终质量浓度为2.0、1.0、0.5、0.25、0.125、0.062 5 mg/mL,分别取1 mL加入培养皿中,倒入15 mL培养基,充分混匀。待冷却凝固后,均匀涂布100 μL 10 4CFU/mL的对数生长期大肠杆菌菌悬液,37 ℃恒温培养24 h,观察菌落生长情况。以无菌落生长的最低乌梅熊果酸稀释含量为MIC。
1.3.5.2 乌梅熊果酸对大肠杆菌细胞膜通透性的影响
将培养至对数期的大肠杆菌,分别加入乌梅熊果酸使其终质量浓度为MIC和2MIC,37 ℃、150 r/min继续培养。分别于0、2、4、6、8 h时取量,3 500 r/min离心10 min,取上清液,用电导仪测定其电导率 [15]。以不含乌梅熊果酸的菌悬液为对照,重复3 次,取平均值。
1.3.5.3 乌梅熊果酸对大肠杆菌细胞壁通透性的影响
分别于0、2、4、6、8 h时取1.3.5.2节中实验组与对照组菌悬液,3 500 r/min离心10 min,取上清液,用试剂盒测定碱性磷酸酶(alkaline phosphatase,AKP)的活性 [16],重复3 次,取平均值。
1.3.5.4 乌梅熊果酸对大肠杆菌培养液蛋白质含量的影响
分别于0、2、4、6、8 h时取1.3.5.2节中实验组与对照组菌悬液,采用Bradford [17]方法测定菌液中蛋白质含量,重复3次,取平均值。
1.3.5.5 乌梅熊果酸对大肠杆菌细胞内容物含量的影响
分别取1.3.5.2节中实验组与对照组培养8 h菌悬液10 mL于离心管中,分别测定核酸大分子物质含量、Ca 2+浓度及总漏出率 [18]。核酸大分子物质含量测定:4 000 r/min离心5 min,取上清液,测定260 nm波长条件下的吸光度;Ca 2+浓度测定:依照钙试剂盒说明书测定上清液中Ca 2+浓度;总漏出率测定:测定上清液600 nm波长条件下的吸光度。重复3 次,取平均值。
1.3.5.6 扫描电镜观察
分别取1.3.5.2节实验组与对照组菌悬液各5 mL,8 000 r/min 离心5 min收集菌体,2.5%戊二醛溶液固定4 h,磷酸缓冲液洗涤,依次使用体积分数50%、70%、90%和100%乙醇溶液对菌体进行脱水处理30 min。将脱水菌体涂片于盖玻片上,自然风干,放入高真空蒸发器中,喷金镀膜,扫描电镜观察细菌表面形态 [19-20]。
2.1 单因素试验结果
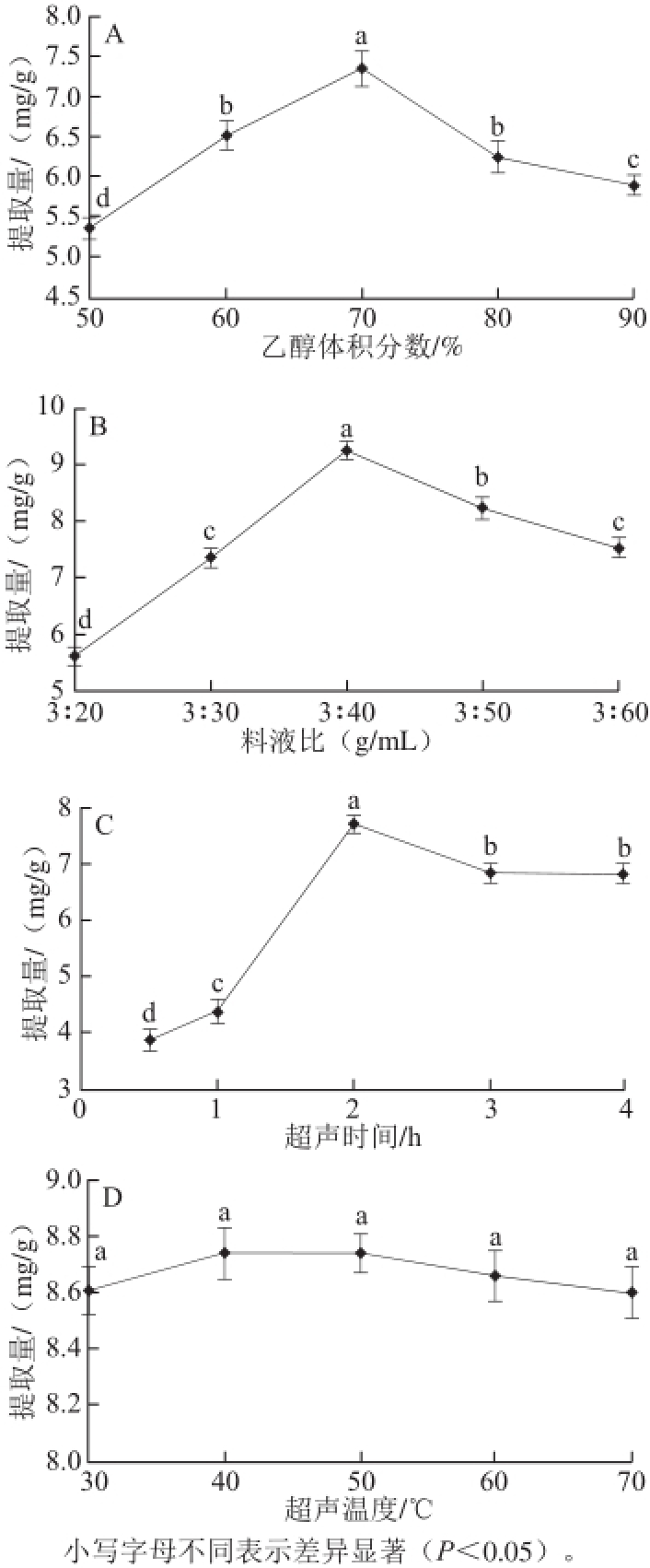
图1 乙醇体积分数(A)、料液比(B)、超声时间(C)和超声温度(D)对乌梅熊果酸提取量的影响
Fig.1 Effects of ethanol concentration, solid-to-solvent ratio, sonication time and temperature on the extraction yield of ursolic acid
图1A结果显示,乙醇体积分数在50%~70%范围内,乌梅熊果酸提取量呈现上升趋势,且乙醇体积分数达到70%时提取量最高;但当乙醇体积分数大于70%时,提取量下降,提取溶剂的极性降低,可能会导致熊果酸溶解度下降,而其他脂溶性杂质溶出量增加,影响乌梅熊果酸提取量,因此选择70%的乙醇溶液作为提取溶剂。图1B显示,料液比在3∶20~3∶40的范围内,乌梅熊果酸提取量显著增加,且料液比为3∶40时最高;但当溶剂用量继续增加时,乌梅熊果酸提取量下降;当提取溶剂过少时,固液两相浓度梯度小,使熊果酸有效物质不能完全溶出;而溶剂过多会造成溶剂浪费并对后续分离纯化步骤不利,因此选择3∶40为最适提取料液比。图1C结果显示,在2 h内,提取量随超声时间延长而增高,2 h时达到最大;但继续延长超声时间,提取量开始下降并且趋于平稳,故选定2 h为最佳提取时间。图1D结果显示,提取量随超声温度升高而平缓增加,但没有显著性差异,故超声温度对乌梅熊果酸提取的影响较小。
2.2 响应面试验与结果
2.2.1 回归模型的建立及方差分析
在单因素试验结果基础上,选择乙醇体积分数(X 1)、料液比(X 2)、超声时间(X 3)为自变量,进行三因素三水平的响应面试验设计,试验设计与结果见表2。
表2 乌梅熊果酸提取响应面试验方案及结果
Table 2 Response surface design and results for the optimization of ursolic acid extraction
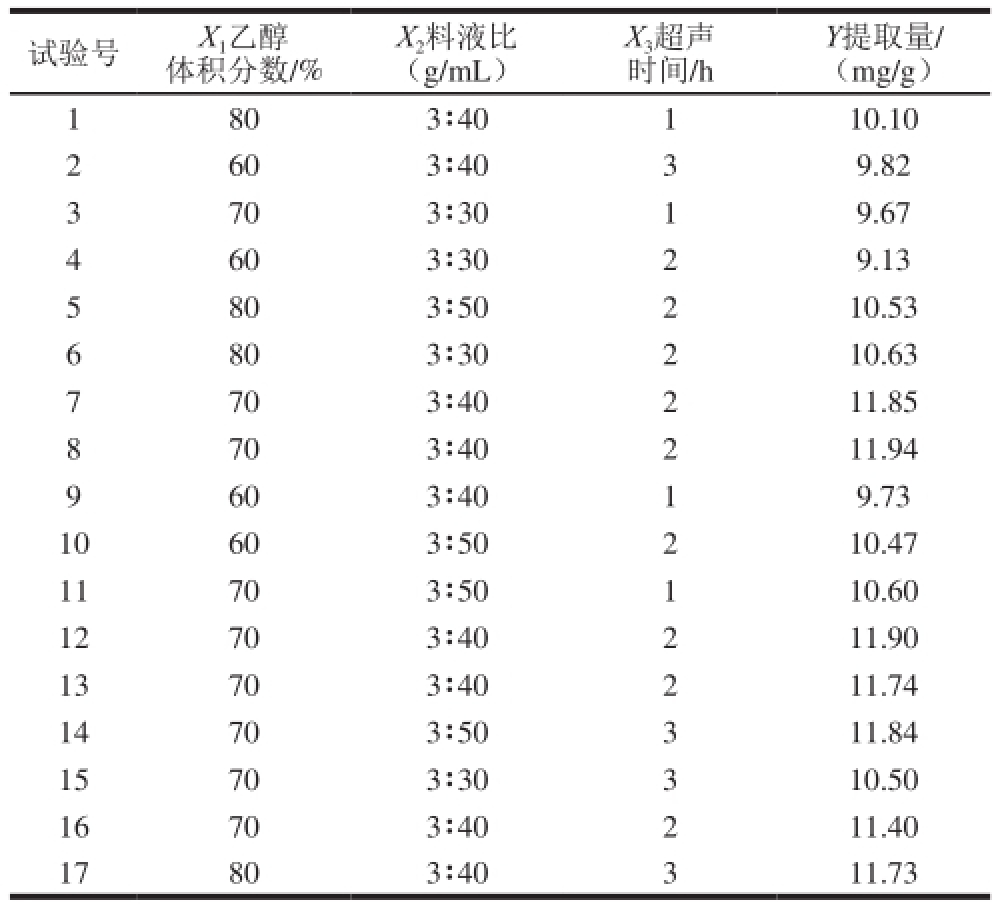
试验号X 1乙醇体积分数/% X 2料液比(g/mL)X 3超声时间/h Y提取量/(mg/g)1 803∶40110.10 2 603∶4039.82 3 703∶3019.67 4 603∶3029.13 5 803∶50210.53 6 803∶30210.63 7 703∶40211.85 8 703∶40211.94 9 603∶4019.73 10603∶50210.47 11703∶50110.60 12703∶40211.90 13703∶40211.74 14703∶50311.84 15703∶30310.50 16703∶40211.40 17803∶40311.73
利用Design-Expert 7.0软件对表2数据进行多元回归量合分析,获得以乌梅熊果酸提取量为响应值的回归方程:Y=11.77+0.36X 1+0.44X 2+0.35X 3-0.36X 1X 2+ 0.14X 1X 3+0.10X 2X 3-1.07X 1 2-0.51X 2 2-0.60X 3 2。
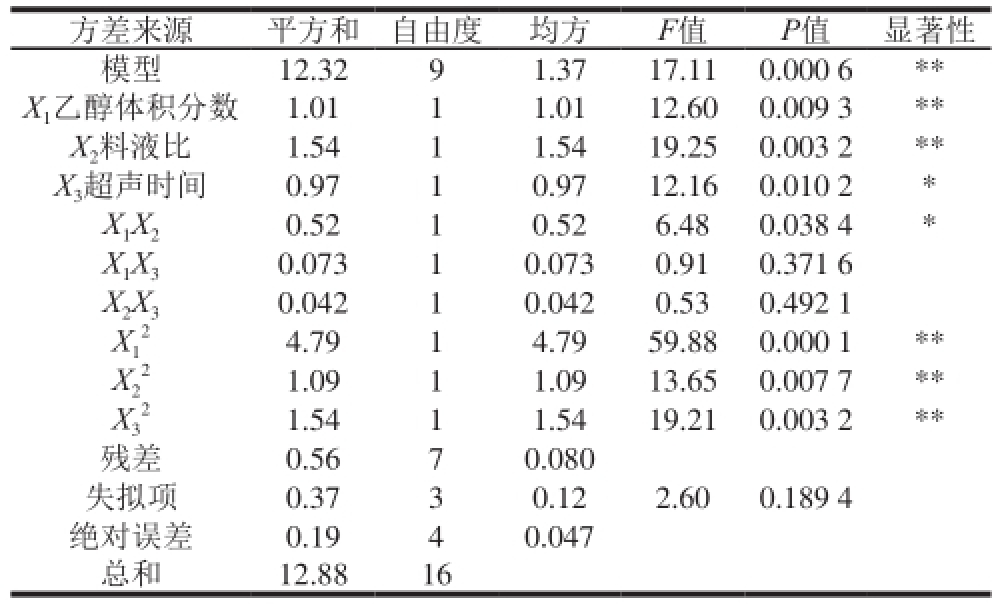
由表3可知,模型P=0.000 6<0.01(极显著),失量项P=0.189 4>0.05(不显著),说明此模型与试验有较好的量合性,试验误差较小。相关系数R=0.956 9和调整系数
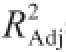 =0.900 6也表明模型量合程度较好,总变异系数为2.63%,说明重现性较好,该模型可用于优化乌梅熊果酸提取工艺条件。从各个因素显著性水平差异可知,对乌梅熊果酸提取量影响大小为:料液比>乙醇体积分数>超声时间。乙醇体积分数、料液比一次项和乙醇体积分数、料液比、超声时间的二次项对乌梅熊果酸提取量的影响达到了极显著水平(P<0.01);超声时间一次项影响显著(P<0.05);交互项X
1X
2对乌梅熊果酸提取量具有显著影响(P<0.05);而其他因素交互作用不显著。
=0.900 6也表明模型量合程度较好,总变异系数为2.63%,说明重现性较好,该模型可用于优化乌梅熊果酸提取工艺条件。从各个因素显著性水平差异可知,对乌梅熊果酸提取量影响大小为:料液比>乙醇体积分数>超声时间。乙醇体积分数、料液比一次项和乙醇体积分数、料液比、超声时间的二次项对乌梅熊果酸提取量的影响达到了极显著水平(P<0.01);超声时间一次项影响显著(P<0.05);交互项X
1X
2对乌梅熊果酸提取量具有显著影响(P<0.05);而其他因素交互作用不显著。
表3 乌梅熊果酸提取优化回归模型方差分析
Table 3 Analysis of variance of regression model
注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。
方差来源平方和自由度均方F值P值显著性模型12.3291.3717.110.000 6** X 1乙醇体积分数1.0111.0112.600.009 3** X 2料液比1.5411.5419.250.003 2** X 3超声时间0.9710.9712.160.010 2* X 1X 20.5210.526.480.038 4* X 1X 30.07310.0730.910.371 6 X 2X 30.04210.0420.530.492 1 X 14.7914.7959.880.000 1** X2 2 1.0911.0913.650.007 7** X3 2 1.5411.5419.210.003 2**残差0.5670.080失量项0.3730.122.600.189 4绝对误差0.1940.047总和12.8816 2
2.2.2 响应面分析
根据回归方程得出不同因素的响应面和等高线,结果见图2。

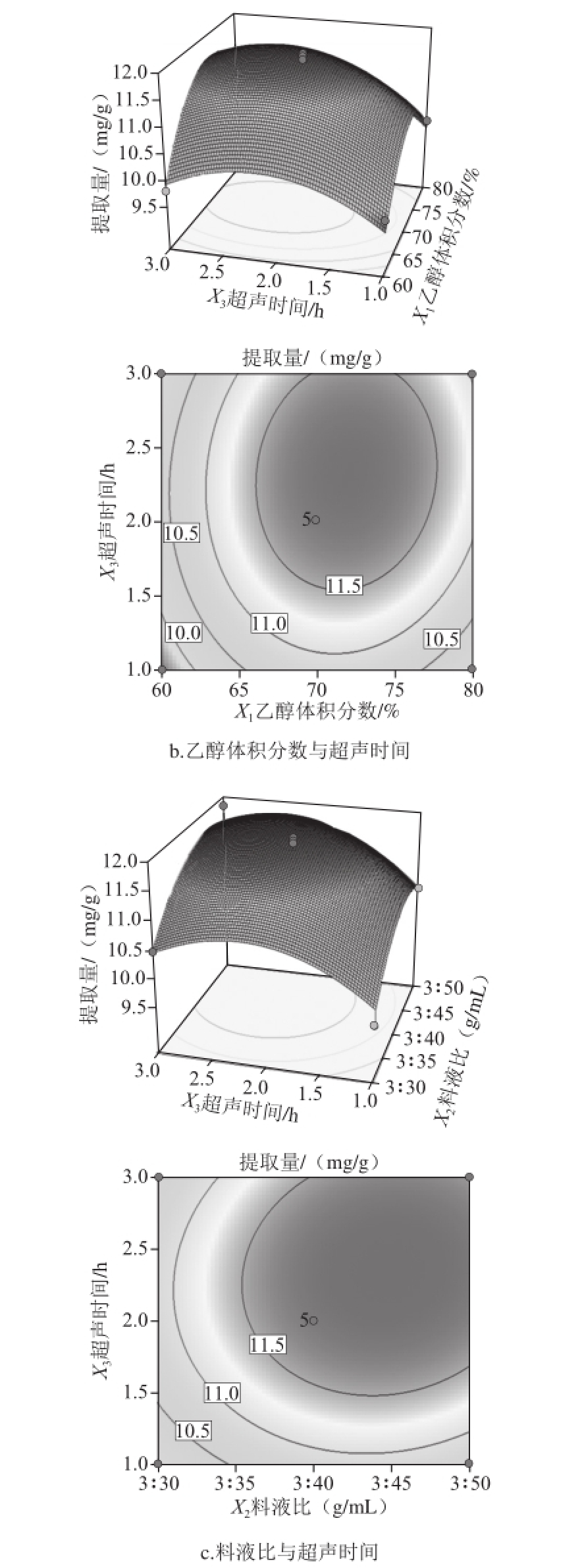
图2 各因素交互作用对提取量影响的响应面
Fig.2 RSM analysis for interactive effects of ethanol concentration,solid-to-solvent ratio and sonication time on extraction efficiency
从图2a可知,曲面比较陡峭,说明乙醇体积分数、料液比对提取量影响都显著;同时等高线是椭圆形,说明交互作用也非常显著;当乙醇体积分数比较低时,提取量随料液比变化不明显;当乙醇体积分数在70%~72%之间时,提取量随着溶剂用量增加而显著提高,且能达到最大值。由图2b可知,虽然乙醇体积分数和超声时间单因素对提取量影响显著,但两者交互作用不显著(P=0.371 6),响应面图曲面相对陡峭,等高线图接近圆形;从等高线图中还可看出,保持乙醇体积分数不变,超声时间太长不利于乌梅熊果酸提取;当超声时间大于2.5 h时,提取量开始降低。由图2c可知,料液比和超声时间交互作用(P=0.492 1)不显著;当料液比在3∶44之后时,提取量降低;同时,乙醇体积分数和料液比的交互作用与料液比和超声时间的交互作用相比,前者等高线更接近于椭圆形,其对提取量作用比后者显著。
2.2.3 验证实验结果
根据回归方程预测乌梅熊果酸超声提取最优工艺条件为乙醇体积分数71%、料液比3∶44、超声时间2.5 h,该优化条件下乌梅熊果酸提取量预测12.58 mg/g。为证明试验结果与实际情况是否相符,以上述优化条件做3 次平行,得到乌梅熊果酸提取量为(12.61±0.13)mg/g,与预测值无显著性差异,说明此响应面法得到的回归模型具有一定的可靠性。与王娟 [8]研究结果相比,乌梅熊果酸提取量增加1 倍,具有较好应用前景。
2.3 乌梅熊果酸的抑菌作用
2.3.1 乌梅熊果酸对大肠杆菌的MIC
表4 乌梅熊果酸对大肠杆菌的MIC测定结果
Table 4 MIC of ursolic acid against E. coli

注:+.有菌生长;-.无菌生长。
供试菌株乌梅熊果酸质量浓度/(mg/mL)2.01.00.50.250.1250.062 50(对照组)大肠杆菌菌落----+++
由表4可知,乌梅熊果酸对大肠杆菌的抑制效果明显,MIC值为0.25 mg/mL。
2.3.2 乌梅熊果酸对大肠杆菌细胞膜通透性的影响

图3 乌梅熊果酸对大肠杆菌细胞膜通透性的影响
Fig.3 Effects of ursolic acid on the cell membrane permeability of E. coli
当外界环境不利于微生物生长时,菌体细胞内K +、Na +等电解质大量外漏,导致培养液电导率改变,从而反映细胞膜渗透性情况,同时电解质离子的外漏导致细胞内多种代谢途径受阻,严重影响细菌的正常生长 [21-22]。由图3可知,不同质量浓度乌梅熊果酸处理的大肠杆菌培养液电导率明显高于对照组。随着作用时间的延长,乌梅熊果酸处理的培养液电导率都呈现持续升高现象,且高质量浓度乌梅熊果酸处理组的电导率变化显著。这说明乌梅熊果酸处理后大肠杆菌菌体细胞质发生渗漏,电解质渗出量不断增大,细胞内环境稳定性被破坏,从而破坏菌体细胞,达到抑菌效果。
2.3.3 乌梅熊果酸对大肠杆菌细胞壁通透性的影响
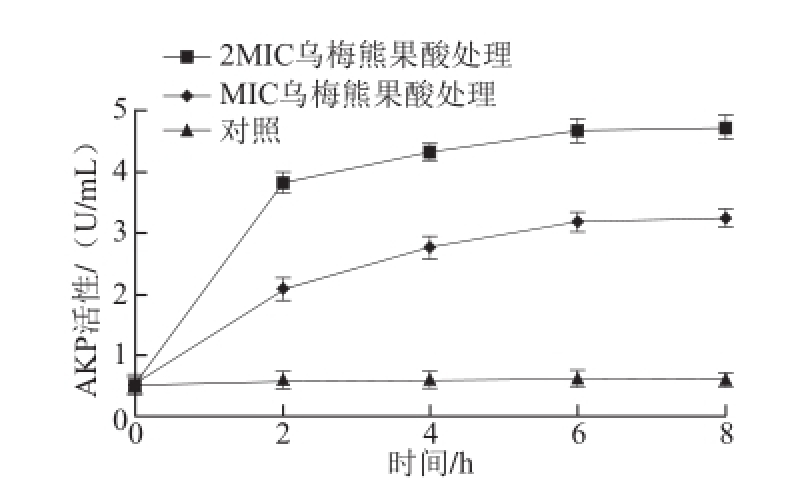
图4 乌梅熊果酸对大肠杆菌细胞壁通透性的影响
Fig.4 Effects of ursolic acid on the cell wall permeability of E. coli
AKP是存在于细胞壁与细胞膜之间的一种酶,正常情况下胞外液中检测不到其活性。当细胞壁受到破坏后,透性增加,AKP会泄漏到胞液中,所以通过检测细胞外AKP活性的变化可以反映细胞壁的通透性 [23-25]。由图4可知,随着作用时间延长,不同质量浓度处理组的大肠杆菌培养液中AKP活性持续上升,当达到6 h时,活性达到最高值,随后趋于平稳状态,且活性高于对照组。说明乌梅熊果酸处理对大肠杆菌细胞壁有很强的破坏作用。
2.3.4 乌梅熊果酸对大肠杆菌培养液蛋白质含量的影响
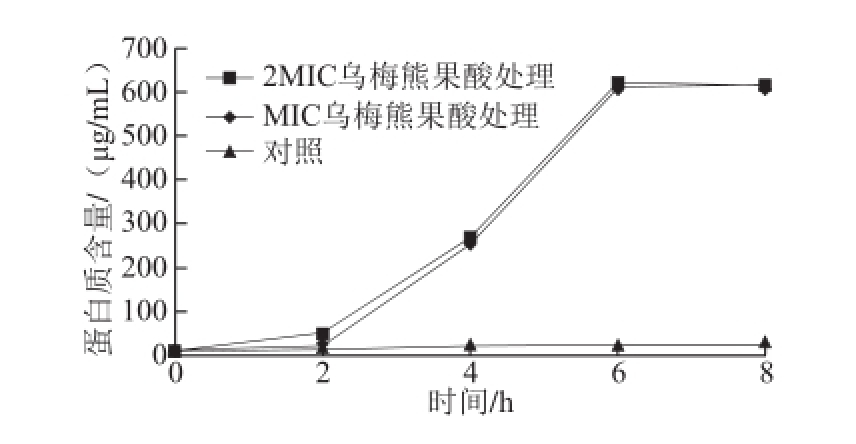
图5 乌梅熊果酸对大肠杆菌蛋白质含量的影响
Fig.5 Effects of ursolic acid on the protein content of E. coli
由图5可知,不同质量浓度乌梅熊果酸对大肠杆菌培养液蛋白质含量具有显著影响,当作用时间超过2 h时,蛋白质含量快速增加,6 h时达到最高,但随着作用时间继续延长,变化不大。当作用时间为6 h时,MIC、2MIC乌梅熊果酸处理及对照组的蛋白质含量分别为610.49、620.38、21.4 µg/mL,乌梅熊果酸显著改变大肠杆菌细胞的膜透性,使细胞内的蛋白质渗漏到胞外培养液中。但MIC和2MIC乌梅熊果酸处理的差异不显著。
2.3.5 乌梅熊果酸对大肠杆菌细胞内容物含量的影响
表5 乌梅熊果酸对大肠杆菌细胞内容物含量的影响
Table 5 Effects of ursolic acid on the intracellular constituents of E. coli

注:同行字母不同表示差异显著(P<0.05)。
指标乌梅熊果酸质量浓度0(对照)MIC2MIC核酸大分子物质含量(A 260 nm)0.16±0.08 b0.42±0.12 a0.40±0.16 aCa 2+浓度/(mmol/L)0.14±0.08 c0.60±0.11 b1.12±0.18 a总漏出率(A 600 nm)0.32±0.11 b0.52±0.14 a0.59±0.17 a
如表5所示,大肠杆菌经乌梅熊果酸处理8 h后,不同处理组的核酸大分子物质含量、Ca 2+浓度和总漏出率与对照组相比,均具有差异显著性。不同质量浓度乌梅熊果酸处理的核酸大分子物质含量和总漏出率没有显著差异。高质量浓度乌梅熊果酸处理的Ca 2+浓度显著高于低质量浓度处理。
2.3.6 扫描电镜观察结果

图6 大肠杆菌的扫描电镜图
Fig.6 Scanning electron micrograph of E. coli
图6 显示,不同处理组大肠杆菌菌体都发生明显变化。MIC乌梅熊果酸处理的大肠杆菌菌体边缘模糊,菌体间界限不明显,发生聚集现象;且菌体细胞表面粗糙,有凹陷和皱缩痕迹。2MIC乌梅熊果酸处理的大肠杆菌呈不规则状态,菌体出现破碎,并伴随有碎片产生。对照组大肠杆菌,菌体边缘整齐、形状规则,未发现明显变化。说明乌梅熊果酸能够有效抑制大肠杆菌的生长。
通过单因素试验和响应面优化分析,影响乌梅熊果酸提取量大小的因素顺序为料液比、乙醇体积分数和超声时间,其中料液比与乙醇体积分数因素之间的交互作用显著。通过响应面得到乌梅熊果酸提取最佳工艺条件为:乙醇体积分数71%、料液比3∶44(g/mL)、超声时间2.5 h。在该优化条件下,乌梅熊果酸提取量为(12.61±0.13)mg/g。
乌梅熊果酸对大肠杆菌的MIC值为0.25 mg/mL,随着乌梅熊果酸质量浓度增大,其抑菌效果也逐渐增强。经过0.5 mg/mL乌梅熊果酸处理后,大肠杆菌细胞壁、细胞膜通透性明显增加,培养液中蛋白质含量、核酸大分子物质、Ca 2+浓度和总漏出率分别增加了28、1.5、7 倍和0.8 倍,扫描电镜观察菌体有明显变形或破碎现象。乌梅熊果酸主要是通过破坏菌体细胞壁和细胞膜的完整性,引起细胞内容物的外漏,从而发挥对大肠杆菌的抑制作用。
参考文献:
[1] 范成杰, 刘友平, 陈鸿平, 等. 乌梅药材中齐墩果酸和熊果酸的高效液相色谱含量测定[J]. 时珍国医国药, 2008, 19(8): 1843-1844. DOI:10.3969/j.issn.1008-0805.2008.08.020.
[2] 阮毅铭. 乌梅的化学成份及药理作用概述[J]. 中国医药导刊, 2008,10(5): 793-794. DOI:10.3969/j.issn.1009-0959.2008.05.109.
[3] 孟艳秋, 陈瑜, 王趱, 等. 熊果酸的研究进展[J]. 中国新药杂志, 2007,16(1): 25-28. DOI:10.3321/j.issn:1003-3734.2007.01.007.
[4] TAPONDJOU L A, LONTSI D, SONDENGAM B L, et al. In vivo anti-nociceptive and anti-inflammatory effect of the two triterpenes,ursolic acid and 23-hydroxyursolic acid, from Cussonia bancoensis[J]. Archives of Pharmacal Research, 2003, 26(2): 143-146.
[5] 王婷, 宋怀燕. 熊果酸药理作用研究进展[J]. 中华医学研究杂志,2005, 9(5): 1-8.
[6] ZHANG Tingting, SU Jingyuan, GUO Bingyu, et al. Ursolic acid alleviates early brain injury after experimental subarachnoid hemorrhage by suppressing TLR4-mediated inflammatory pathway[J]. International Immunopharmacology, 2014, 23(2): 585-591. DOI:10.1016/j.intimp.2014.10.009.
[7] 孙益民, 焦容容, 孙若琼, 等. 用神经网络技术确定枇杷叶中熊果酸提取时间[J]. 食品与发酵工艺, 2010, 36(7): 6-12. DOI:10.13995/ j.cnki.11-1802/ts.2010.07.012.
[8] 王娟. 响应面优化乌梅熊果酸提取工艺研究[J]. 食品工业, 2014,35(1): 101-104.
[9] 纪晓花. 乌梅熊果酸抑菌活性和抗氧化性研究[J]. 食品工业, 2013,34(9): 142-144.
[10] 郑艳, 苏丹. 女贞子中熊果酸的提取工艺研究[J]. 陕西科技大学学报, 2008, 26(4): 84-88.
[11] 罗容珍, 杜怀明, 张利, 等. 微波-超声波协同作用提取熊果酸的工艺研究[J]. 安徽农业科学, 2011, 39(4): 2322-2323; 2327. DOI:10.13989/j.cnki.0517-6611.2011.04.041.
[12] 孙海涛, 王成. 响应面法优化酸浆宿萼色素的提取工艺[J]. 现代食品科技,2013, 29(3): 579-582. DOI:10.13982/j.mfst.1673-9078.2013.03.031.
[13] 贾静波, 赵猛. 响应面法优化女贞子色素提取工艺研究[J]. 宁夏农林科技, 2014, 55(1): 67-69.
[14] HE Feng, YANG Ying, YANG Guang, et al. Studies on antibacterial activity and antibacterial mechanism of a novel polysaccharide from Streptomyces virginia H03[J]. Food Control, 2010, 21: 1257-1262. DOI:10.1016/j.foodcont.2010.02.013.
[15] KONG Ming, CHEN Xiguang, LIU Chengsheng, et al. Antibacterial mechanism of chitosan microspheres in a solid dispersing system against E. coli[J]. Colloids and Surfaces B: Biointerfaces, 2008, 65: 197-202. DOI:10.1016/j.colsurfb.2008.04.003.
[16] 孙京新, 王文娟. 茶多酚对假单胞菌抑菌机理研究[J]. 肉类研究,2009, 23(10): 48-51. DOI:10.3969/j.issn.1001-8123.2009.10.015.
[17] BRADFORD M M. Determination of proteins from sediment samples[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[18] DIAO Wenrui, HU Qingping, ZHANG Hong, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J]. Food Control, 2014, 35: 109-116. DOI:10.1016/j.foodcont.2013.06.056.
[19] 曾哲灵, 赵存洋, 罗春燕, 等. 单癸月桂酸甘油酯的抑菌作用及机理研究[J]. 食品科学, 2013, 34(3): 70-74.
[20] DU Wen, SUN Chunlong, LIANG Zongqi, et al. Antibacterial activity of hypocrellin A against Staphylococcus aureus[J]. World Journal of Microbiology and Biotechnology, 2012, 28: 3151-3157. DOI:10.1007/ s11274-012-1125-z.
[21] 刘唤明, 孙力军, 王雅玲, 等. 纳豆菌脂肽对金黄色葡萄球菌抑菌机理的研究[J]. 食品工业科技, 2012, 33(11): 109-112. DOI:10.13386/ j.issn1002-0306.2012.11.044.
[22] 张黎明, 李瑞超, 郝利民, 等. 响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究[J]. 现代食品科技, 2014, 30(4): 233-239. DOI:10.13982/j.mfst.1673-9078.2014.04.019.
[23] COX S D, MANN C M, MARKHAM J L, et al. Determining the antimicrobial action of tea tree oil[J]. Molecules, 2001, 6: 87-91. DOI:10.3390/60100087.
[24] HARA S, YAMAKAWAM M. Moricin, a novel type of antibacterial peptide isolated from the silkworm, Bombyx mori[J]. Journal of Biological Chemistry, 1995, 270(50): 29923-29927.
[25] 师伟. 中药有效成分抑菌机制研究[J]. 科技信息, 2011(5): 37-38. DOI:10.3969/j.issn.1001-9960.2011.05.022.
Optimization of Ursolic Acid Extraction from Fructus Mume and Evaluation of Its Antibacterial Activity against Escherichia coli
ZHOU Qian, HAN Xue, HAN Xiaomei, YAN Chenjing, BAI Bingyao, WANG Weilin, ZHAO Wen
*
(College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China)
Abstract:The conditions for ultrasound-assisted extraction of ursolic acid from Fructus Mume were optimized by response surface methodology (RSM). Based on the results of single-factor tests, three factors including ethanol concentration, solidto-liquid ratio and extraction time were identified as main variables that affect extraction efficiency. Optimization of the three factors was performed using extraction efficiency of ursolic acid as the response. Besides, the antibacterial effect of ursolic acid on Escherichia coli was studied. The optimum extraction conditions were determined as follows: ethanol concentration, 71%; solid-to-liquid ratio, 3:44 (g/mL); and extraction time, 2.5 h. Under these conditions, the yield of ursolic acid was (12.61 ± 0.13) mg/g. The antibacterial test showed that the minimal inhibition concentration of ursolic acid against E. coli was 0.25 mg/mL. After treatment with 0.5 mg/mL ursolic acid, the cell wall and membrane permeability of E. coli was increased and the contents of protein, nucleic acid materials, Ca 2+and total leakage were enhanced by 29, 2.5, 8 and 1.8 folds compared to control, respectively. The scanning electron microscopic observation of E. coli showed that the cells were obviously destroyed or broken, indicating that ursolic acid has inhibitory effect on the growth of E. coli. The study can lay the theoretical basis for the application of ursolic acid and Fructus Mume in the future.
Key words:Fructus Mume; ursolic acid; response surface methodology; Escherichia coli; antibacterial effect
DOI:10.7506/spkx1002-6630-201608012
中图分类号:R284.5
文献标志码:A
文章编号:1002-6630(2016)08-0067-07
收稿日期:2015-07-01
基金项目:河北省科技计划项目(13226602D)
作者简介:周茜(1986—),女,讲师,博士,研究方向为天然活性物质研究与食品安全。E-mail:zhouqianyz513@126.com
*通信作者:赵文(1962—),女,教授,硕士,研究方向为营养分析与食品安全。E-mail:13582820221@163.com
引文格式: