张媛媛,王瑞鑫,李秋薇,李书国 *
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
摘 要:以改性壳聚糖包埋固定羧基化多壁碳纳米管和莱克多巴胺抗体,构建免疫传感器用于莱克多巴胺的检测。以K
3[Fe(CN)
6]为探针,利用循环伏安法表征传感器构建过程和差分脉冲伏安法探究莱克多巴胺抗体/抗原间免疫反应对电流的影响。结果表明,在优化条件下,免疫响应电流与溶液中莱克多巴胺质量浓度的立方根在0.05~4.05 ng/mL范围内呈线性关系,其线性方程为
![]() 最低检测限为0.08 ng/mL(R
SN=3);所构建的免疫传感器的特异性、稳定性和重复性良好。该法对猪肉、羊肉等量品进行检测,其检测结果与国标方法高效液相色谱法一致,检测快捷方便,可用于食品中莱克多巴胺的快速检测。
最低检测限为0.08 ng/mL(R
SN=3);所构建的免疫传感器的特异性、稳定性和重复性良好。该法对猪肉、羊肉等量品进行检测,其检测结果与国标方法高效液相色谱法一致,检测快捷方便,可用于食品中莱克多巴胺的快速检测。
关键词:莱克多巴胺;免疫传感器;多壁碳纳米管;快速检测;食品安全
张媛媛, 王瑞鑫, 李秋薇, 等. 基于多壁碳纳米管免疫传感器法快速测定食品中的莱克多巴胺[J]. 食品科学, 2016, 37(8): 170-175. DOI:10.7506/spkx1002-6630-201608030. http://www.spkx.net.cn
ZHANG Yuanyuan, WANG Ruixin, LI Qiuwei, et al. An immunosensor for rapid determination of ractopamine in foods based on multi-walled carbon nanotubes[J]. Food Science, 2016, 37(8): 170-175. (in Chinese with English abstract)
莱克多巴胺(ractopamine,RAC)属于人工合成的一种β-肾上腺受体激动剂 [1-3]。RAC可有效提高动物的瘦肉相对百分比和蛋白质含量,常作为克伦特罗的违规替代品于畜牧养殖业(主要用于养牛和养猪),属于较为常见的“瘦肉精”之一。残留在动物内脏和肌肉组织中的RAC,可经过食物链进入人类体内,进而危害人类的健康。食用后症状表现为心动失常、心律不稳定、恶心和晕眩等 [4-6]。RAC的残留问题引起研究者和消费者的热切关注,尽管不同国家和地区对于其在动物饲料中使用问题,观点不尽相同,美国和加拿大等地区允许使用,但严格规定残留限量,如美国规定猪肉中RAC的最大残留为50 μg/kg,而欧盟和我国明确禁止在畜禽养殖业中使用RAC [7-10]。因此,建立一种检测时间短、精确度优良的RAC分析方法对于确保食品安全,维护消费者生命安全和身体健康有着重要意义。
目前,检测RAC的方法主要有色谱分析法 [11-14]、免疫分析法 [15-17]、快速检测卡法 [18-22]、电化学分析法 [23-25]等,这些方法各有各自的检测优势和劣势。随着目标性抗体不断地研发,免疫分析法得到迅速发展,其中尤以电化学免疫分析法发展迅速,因其特异性好、检测灵敏度高以及检测速度快、量品处理简单等优势,成为食品安全快速检测的主要发展方向之一。
本实验以RAC为研究对象,以羧基化多壁碳纳米管/壳聚糖(carboxylic multiwalled carbon nanotubes/ chitosan,MWNTs-COOH/CS)构建复合膜,用于莱克多巴胺抗体(ractopamine antibody,RAC-anti)的固定。该免疫传感器利用碳纳米管对于生物分子中电子传递的良好促进性,以及CS成膜以后的生物兼容性及其表面丰富氨基对于生物分子的良好固定,使得该免疫传感器在增加RAC-anti固载量的同时,能较好地固定在玻碳电极(glassy carbon electrode,GCE)表面。根据质量浓度不同的RAC标准溶液与RAC-anti结合后,MWNTs-COOH/ CS/RAC-anti/GCE界面的电流变化联系,探究其数学模型,建立一种快速测定食品中瘦肉精的方法。
1.1 材料与试剂
猪肉、牛肉、羊肉、鸡肉 石家庄市购。
MWNTs-COOH(外径:40~60 μm,长度:2~5 μm) 北京德科岛金科技有限公司;CS(脱乙酰度≥90.0%) 北京索莱宝科技有限公司;RAC-anti深圳芬德生物技术有限公司;RAC标准品 德国Dr Ehrenstorfer公司;牛血清白蛋白 上海翊圣科技有限公司;N,N-二甲基甲酰胺(分析纯) 天津市达森化工产品销售有限公司;冰乙酸(分析纯) 天津市富宇精细化工有限公司;铁氰化钾、甲醇(均为分析纯) 天津市永大化学试剂有限公司;正己烷(分析纯) 天津市津东天正精细化学试剂厂;高纯度氮气 石家庄市西三教气体公司。
1.2 仪器与设备
LK98BⅡ型微机电化学分析系统 天津兰力科化学电子高技术有限公司;三电极系统(3 mm玻碳圆盘电极为工作电极、铂丝电极为对电极、Ag/AgCl电极为参比电极)、电解杯 上海CHI仪器公司;FA2204型电子分析天平 上海菁海仪器有限公司;LC-10A型高效液相色谱(high performance liquid chromatography,HPLC)仪日本岛津公司; KQ2200型超声波清洗仪 昆山市超声仪器有限公司;TGL-10B型高速台式离心机 上海安亭科学仪器厂;S-4800-Ⅰ型场发射扫描电镜(scanning electron microxcope,SEM) 日本Hitachi公司。
1.3 方法
1.3.1 MWNTs-COOH/CS复合膜的制备
准确称取0.01 g MWNTs-COOH,加入到10 mL N,N-二甲基甲酰胺溶液中,超声5 min,得到分散均匀的MWNTs-COOH悬浊液。准确称取1.0 g CS,溶于100 mL 1%冰乙酸溶液,制得1% CS透明溶液,置于4 ℃条件下储存。取5 mL MWNTs-COOH的N,N-二甲基甲酰胺溶液加入到1% CS的冰乙酸溶液中,超声30 min,使MWNTs-COOH均匀地分散到CS溶液中,制得MWNTs-COOH/CS悬浊液,置于4 ℃条件下保存、备用。
1.3.2 电化学免疫传感器的制备
将GCE(直径为3 mm)用粒径大小为0.05 μm的氧化铝粉末轻轻打磨抛光,直至电极表面成光滑镜面,再依次于硝酸(体积分数为50%)、无水乙醇和去离子水中各超声2 min。超声完毕以后,将玻碳电极表面用氮气吹干后待用。将电极置于0.1 mol/L的稀硫酸溶液中,设置循环伏安法的扫描速率为50 mV/s,电压范围为-1.0~1.0 V,对电极进行扫描直至循环伏安图稳定后取出,用去离子水冲洗电极表面,再次用氮气干燥后备用。
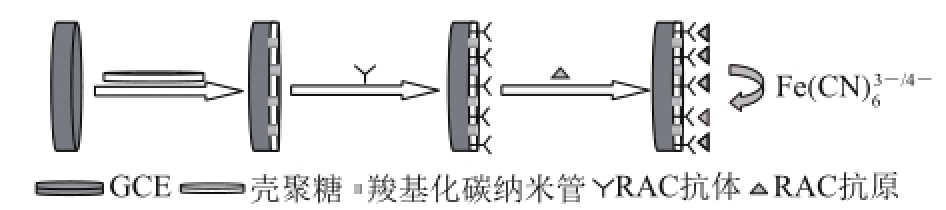
图1 免疫传感器的制备及免疫过程
Fig.1 Procedure for preparation of immunosensor and immune reaction
免疫传感器的制备流程见图1。取5 μL的MWNTs-COOH/CS混合液滴涂于GCE表面的中心位置,在室温条件下(25 ℃左右)自然晾干。然后取6 μL的RAC-anti滴涂于MWNTs-COOH/CS修饰的GCE表面,于4 ℃条件下孵育120 min。最后在电极表面滴涂5 μL 1%的牛血清白蛋白/磷酸盐缓冲溶液(phosphate buffered solution,PBS,pH 7.4)溶液,于4 ℃条件下约30 min,用于封闭传感器界面的活性基团。最终,制得检测所用的免疫传感器,于4 ℃保存待用。
1.3.3 电化学方法
在MWNTs-COOH/CS/RAC-anti修饰的免疫传感器表面依次滴涂不同质量浓度梯度(0~4.05 ng/mL)的RAC标准溶液中,在37 ℃条件下孵育25 min。采用三电极体系(工作电极为MWNTs-COOH/CS/RAC-anti/GCE,参比电极为Ag/AgCl电极,辅助电极为铂丝电极),于1.0 mmol/L K 3[Fe(CN) 6]+0.1 mol/L KCl+0.2 mol/L PBS(pH 7.0)进行电化学修饰过程的表征和RAC的检测分析。运用循环伏安法(电压-0.2~0.6 V,扫描速率50 mV/s)对于电极的构建步骤进行电化学表征,运用差分脉冲伏安法(电位-0.2~0.6 V)分析不同质量浓度梯度RAC的峰电流值I p与相对应的RAC质量浓度间关系,记录峰电流值I p,并依据其相关的数学模型对RAC质量浓度做标准曲线。
1.3.4 市售肉类量品中RAC的测定
1.3.4.1 量品前处理
准确称取4 g猪肉、牛肉、羊肉、鸡肉量品用绞肉机绞碎,置于25 mL的烧杯中,加入16 mL乙腈,振荡5 min以后,超声处理20 min,接着移入50 mL离心管中,室温离心10 min(6 000 r/min),取上清液10 mL,在60 ℃条件下用氮气吹干,然后加入4 mL 的100 mmol/L的盐酸溶液(pH 2.0),再次室温6 000 r/min离心10 min,取上清液进行净化。对固相萃取柱分别用3 mL甲醇、3 mL去离子水、3 mL 0.2%的冰乙酸活化后,将上述提取液加入萃取柱,依次用3 mL 0.2%的冰乙酸溶液、3 mL去离子水、3 mL甲醇洗涤,再用3 mL 5%氨化甲醇溶液洗脱,将洗脱液于50 ℃条件下用氮气吹干,用甲醇定容至1 mL,再经0.45 μm滤膜过滤后进行检测。
1.3.4.2 电化学检测
在制备好的纳米免疫传感器表面滴加2 μL处理好的量品提取液,在37 ℃条件下孵育25 min,然后利用差分脉冲伏安法测定免疫反应响应电流,每个量品平行测定3 次,取3 次测定的电流值平均值作为该量品的免疫响应电流值,将该免疫响应电流值代入1.3.3节的免疫响应电流与RAC质量浓度的线性回归方程,计算猪肉等量品中RAC的含量。
1.3.4.3 HPLC检测
色谱条件:色谱柱为C 18柱(4.6 mm×250 mm,5 μm);流动相为戊烷磺酸钠溶液[取800 mL水,加20 mL冰醋酸和0.87 g 戊烷磺酸钠(C 5H 11O 3SNa·H 2O)混匀]-乙腈(78∶22,V/V);激发波长为226 nm,发射波长为306 nm;流速1 mL/min;进量量50 μL [26]。
准确称取25 mg RAC标准品,用甲醇溶解并定容于100 mL容量瓶中,作为储备液保存于4 ℃条件下。使用前依据需求配成相应质量浓度梯度的标准工作液,取50 μL量品溶液进量,记录其HPLC图谱,根据所得峰面积与对应的工作液质量浓度绘制标准曲线。分别取上述处理好的量品提取液50 μL,进行HPLC检测,依据上述标准曲线计算量品中RAC的质量浓度,并与电化学检测方法进行对比。
2.1 RAC纳米免疫传感器的电化学表征
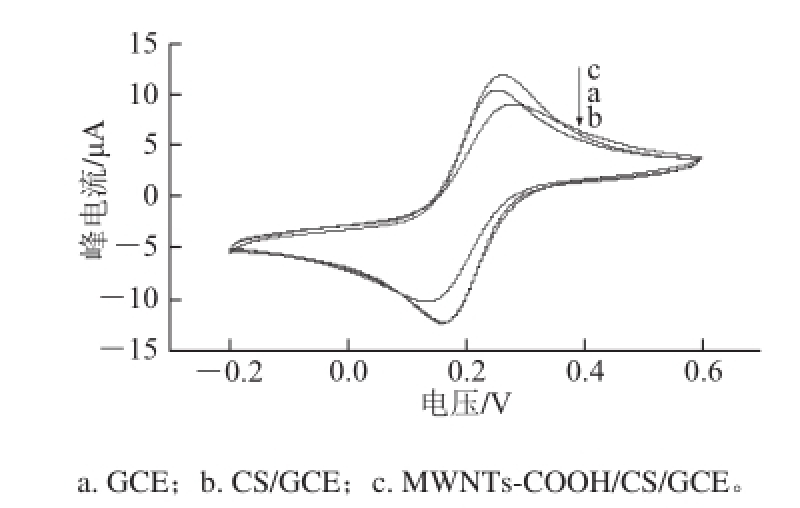
图2 不同修饰电极的循环伏安图
Fig.2 Cyclic voltammograms of different modified electrodes
在1.0 mmol/L K 3[Fe(CN) 6]+0.1 mol/L KCl+0.2 mol/L PBS(pH 7.0)的测试底液中,以循环伏安法对GCE(a)、CS/GCE(b)和MWNTs-COOH/CS/GCE(c)进行表征,表征结果见图2。Fe(CN) 6 3-/4-在裸玻碳电极上有一对较好的氧化还原峰。当在电极表面修饰CS后,修饰电极的氧化还原峰电流减少,这是由于CS的导电性不太好,对电子在电极表面上传递起一定的阻碍作用。相比较于CS/GCE,可以明显观察到MWNTs-COOH的引入提高了玻碳电极的响应电流信号,使MWNTs-COOH/CS/ GCE的氧化还原峰电流均增加,这是由于MWNTs-COOH通过CS固定在电极的表面,形成电子与电极之间电子传递的活性中心,MWNTs-COOH纳米微粒可视为于纳米尺寸的微电极,可作为电子与裸电极之间的传输通道,能够有效提高免疫传感器响应信号的灵敏度;用CS分散MWNTs-COOH,在增大RAC-anti在电化学免疫传感器表面固载量的同时,能够有效保证免疫传感器的稳定性。上述3 种情况下的电极根据Randles-Sevcik方程 [17],可以求出电极的电活性面积:
式中:I p为阳极峰电流/μA;A为有效电极面积/cm 2;C为K 3[Fe(CN) 6]浓度(此为1 mmol/L);D为扩散系数(6.7×10 -6cm 2/s);γ为电位变化速率(0.05 V/s);n为参与氧化还原反应的电子数(此处n=1)。根据计算得,CS/GCE和MWNTs-COOH/CS/GCE的有效电极面积分别为0.058、0.077 cm 2。可知,MWNTs-COOH的加入明显地提高了玻碳电极的有效活性面积(增加了32.76%),从而提高了免疫传感器的灵敏度。
当在MWNTs-COOH/CS/GCE表面滴加RAC-anti以后,氧化还原峰的电流减少并发生一定的偏移(图3),因为带正电荷的抗体蛋白经过静电相互作用牢固地吸附在MWNTs-COOH/CS表面上,由于抗体的绝缘性阻碍了电极表面的电子传递,这就说明RAC-anti已经成功固定在电极表面上。在MWNTs-COOH/CS/RAC-anti/GCE表面滴加RAC标准液以后,其峰位置进一步降低,表明RAC-anti和RAC已经成功结合进行特异性免疫反应。
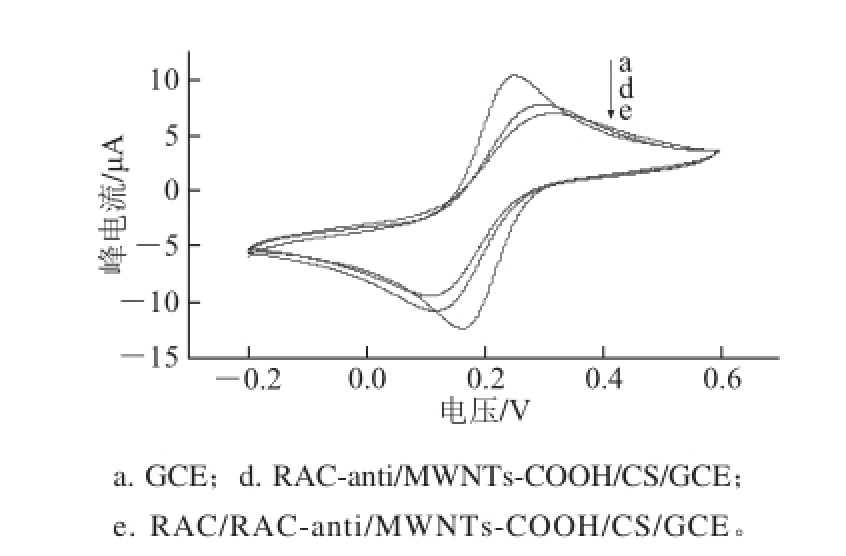
图3 修饰电极免疫前后的循环伏安图
Fig.3 Cyclic voltammograms of immunosensor before and after immune reaction
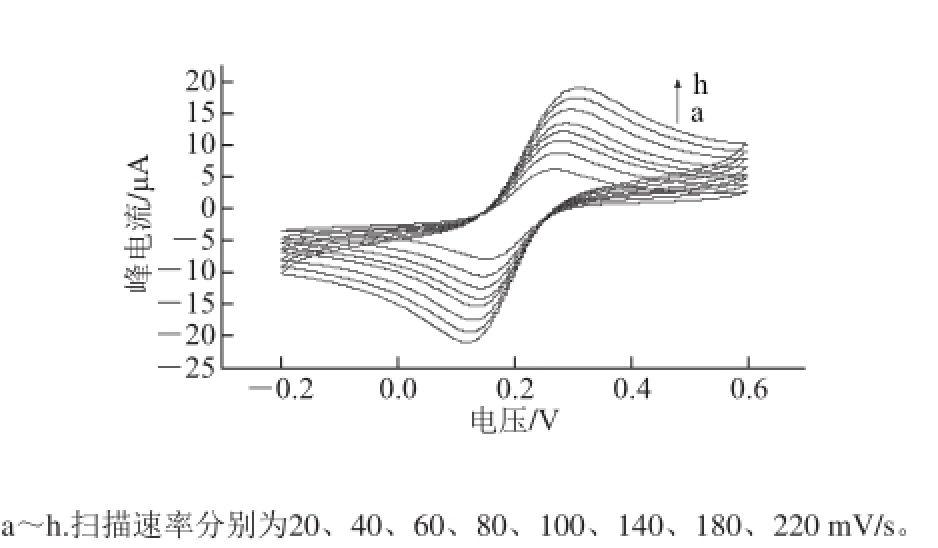
图4 电化学免疫传感器在不同扫描速率条件下的循环伏安图
Fig.4 Cyclic voltammograms of the immunosensor at different scan rates
将免疫传感器(MWNTs-COOH/CS/RAC-anti/RAC/ GCE)在不同扫描速率(20~220 mV/s)条件下以循环伏安法进行扫描,结果如图4所示。由图4可以得出,随着扫描速率的增加,氧化峰和还原峰的电流均增加,扫描得到的氧化峰和还原峰的电流值都分别与扫描速率的平方根呈线性关系:I p1=1.232 7x 1/2+1.227 4,线性相关系数R 2= 0.997 8;I p2=1.252 4x 1/2-2.412 4,线性相关系数R 2=0.998 0。说明发生于该免疫传感器表面的反应受扩散过程控制。
2.2 RAC纳米免疫传感器SEM表征

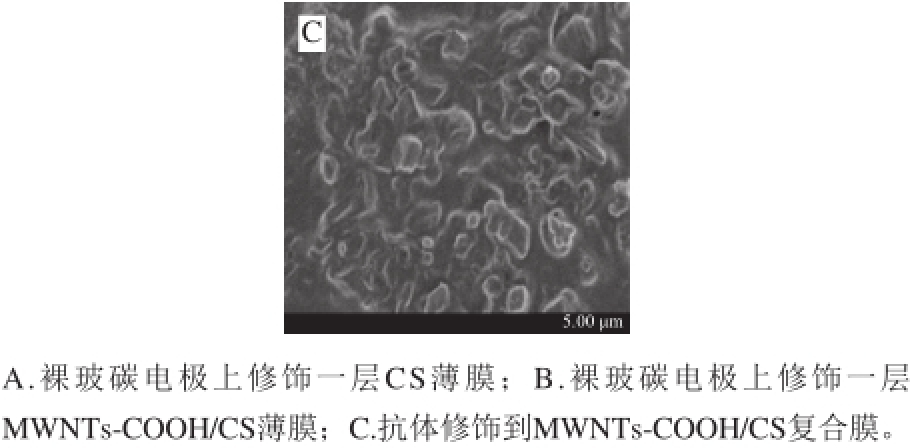
图5 不同修饰电极的SEM图
Fig.5 SEM images of different modified electrodes
图5 A为裸玻碳电极上修饰一层CS薄膜的SEM图。图5B为裸玻碳电极上修饰一层MWNTs-COOH/CS薄膜的SEM图,从图5B可以明显看出,多壁碳纳米管呈现特有的非常规整的多孔网状纳米纤维结构,且多壁碳纳米管的前处理使得碳纳米管末端断裂并羧基化,有利于抗体的固定。这种结构会增加传感器的表面积,可以显著增加抗体固载量,并可有效防止抗体从传感器上脱附泄漏,提高免疫响应电流值,从而提高传感器的灵敏度。图5C为抗体修饰到MWNTs-COOH/CS复合膜上时的SEM图,可以看出抗体微粒嵌到了MWNTs-COOH/CS膜的空隙当中。
2.3 免疫传感器制备及检测参数的优化
2.3.1 修饰液的用量
MWNTs-COOH/CS混合液的用量可能会对电子传递产生影响,本实验分别用1、3、5、7、9 μL的修饰液滴涂在活化稳定以后的玻碳电极表面中心位置,滴涂过程中应确保电极表面水平。以循环伏安法分析比较各个修饰量下峰电流的大小。经实验发现,电流逐渐增大,直至修饰量为5 μL时,峰电流达到最大,然后随着修饰量的增加电流逐渐减少。可能由于修饰量增加以后,修饰膜厚度较大影响了电子的传递。同时考虑到所用的电极直径为3 mm,电极表面积有限,修饰材料用量以3~6 μL为宜,所以选择修饰膜的用量为5 μL。
2.3.2 孵育时间与温度对免疫传感器的影响
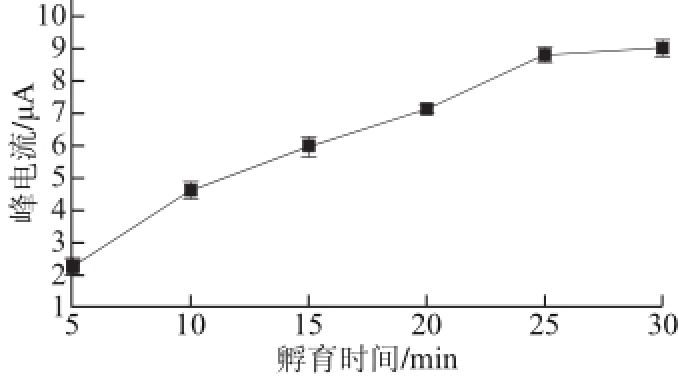
图6 孵育时间对免疫传感器DPV峰电流的影响
Fig.6 Effect of incubation time on DPV response of the immunosensor
RAC-anti与抗原(RAC标准液)的孵育时间和温度对免疫反应有重要的影响。为了选择较好的孵育时间,在MWNTs-COOH/CS/RAC-anti/GCE表面滴加2 μL的RAC标准溶液,控制反应时间,利用差分脉冲伏安法测定其响应电流的变化,如图6所示。在5~20 min范围内峰电流随着孵育时间的延长而增大,表明了抗原/抗体之间需要一定时间,来通过的特异性免疫反应形成稳定复合产物。孵育时间超过25 min后,峰电流的变化很小,表明固定的抗体与游离的抗原的结合达到相对饱和。在一定范围内,升高温度可加速免疫反应的进程,有利于生成免疫复合物,但温度过高会使具抗原与抗体的活性下降,乃至失去活性,不利于RAC的检测分析。在优化孵育时间的条件下,探究20~45 ℃范围内对免疫反应的影响,如图7所示。在20~35 ℃范围内,所构建的免疫传感器响应电流随温度升高而增大,并于约35 ℃时达到最大值,当温度高于35 ℃后,响应电流的值开始减少,可能原因是RAC-anti活性下降,导致免疫响应电流下降,故选取35 ℃为优化孵育温度,孵育时间为25 min。
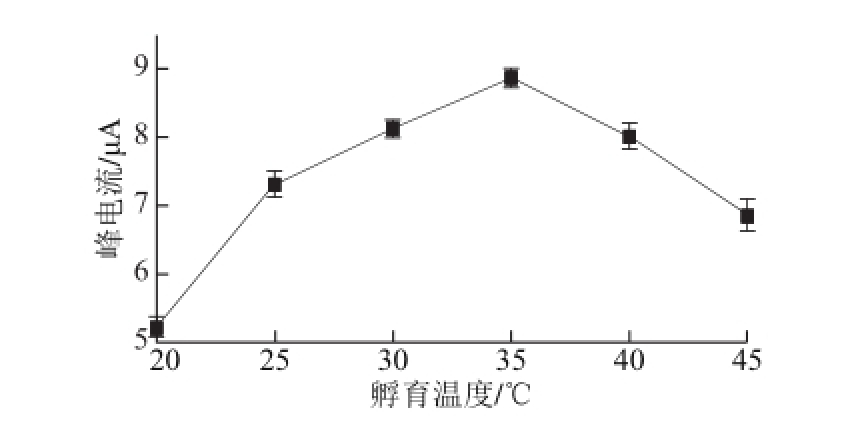
图7 孵育温度对免疫传感器DPV峰电流的影响
Fig.7 Effect of incubation temperature on DPV response of the immunosensor
2.3.3 电解质溶液pH值对免疫反应的影响
检测所用底液的pH值对响应信号的峰电流有显著的影响。相同条件下,不同的底液pH值将会导致扫描得出的峰电流不同。分析得出,当溶液的pH 7.0时,所得的检测信号峰电流I p最大,表明在pH 7.0时,检测体系能够达到较好的灵敏度,这可能是因为当测试底液过酸或者过碱时,抗体中部分基团的质子化或解离导致抗体活性有所改变或下降,同时考虑到CS在过酸或过碱条件下时容易解离,所以实验选择pH 7.0的磷酸盐缓冲溶液作为检测所用的电解质溶液。
2.4 不同质量浓度RAC对免疫传感器响应电流的影响
配制系列质量浓度的RAC标准溶液,按照1.3.4节的方法测得传感器在不同质量浓度标准溶液中的差分脉冲曲线,以峰电流为纵坐标,抗原质量浓度大小为横坐标,按此绘制RAC的标准曲线,如图8所示。在RAC质量浓度范围为0~4.05 ng/mL时,免疫反应电流I
p值随RAC质量浓度的增大而减小,且ΔI
p值下降量与C
RAC之间的关系满足线性关系方程:
![]() 线性相关系数R
2=0.990 4,其最低检测限为0.08 ng/mL(R
SN=3)。
线性相关系数R
2=0.990 4,其最低检测限为0.08 ng/mL(R
SN=3)。
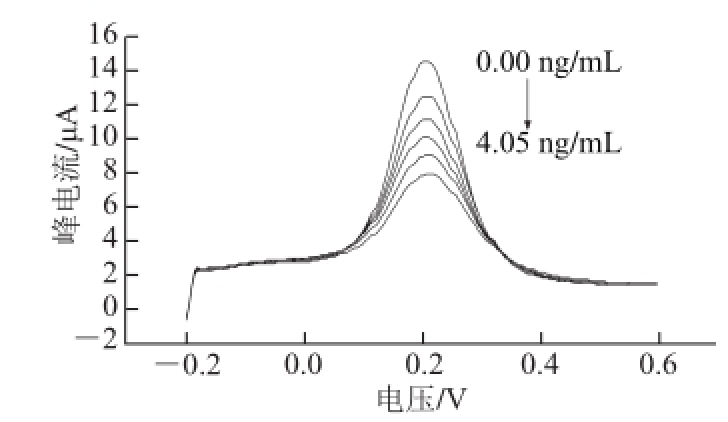
图8 RAC的校正曲线
Fig.8 Calibration curve of RAC
2.5 免疫传感器的特异性、稳定性与重复性
在制备好的RAC免疫传感器表面先后滴加同等质量浓度、同等体积的RAC和沙丁胺醇,其差分脉冲峰电流变化仅为3.85%,表明该免疫传感器的特异性较好。将制备好的免疫传感器连续扫描15 次,电流响应仅下降3.5%。然后将其置于-4 ℃避光保存,不同时间后用来检测RAC溶液,3 个月以后免疫响应电流变化率不超过5.0%,表明该传感器的稳定性较好。分别制备同一批次3 支免疫传感器和不用的3 个批次(每个批次2 支)的免疫传感器,进行RAC检测,同一批次的电流变化率不超过4.6%,不同批次的电流变化率不超过5.7%,表明该传感器重复性较好。
2.6 实际量品中RAC含量的检测结果
按1.3.4节方法处理,得到提取液,按照前面优化好的实验条件,以差分脉冲伏安法为检测方法检测4 种量品中RAC的含量,进行加标回收实验,并与HPLC法检测结果进行了对照,结果见表1。纳米免疫传感器法检测猪肉、牛肉、羊肉、鸡肉4 种鲜肉,只有猪肉检测出RAC,其含量为1.3 ng/g,HPLC也只有猪肉检测出RAC,含量为1.3 ng/g,二者的加标回收率分别为96%~102%和95.2%~106%,检测结果基本一致。
表1 样品中RAC含量测定的结果
Table 1 Analytical results for the determination of RAC in samples
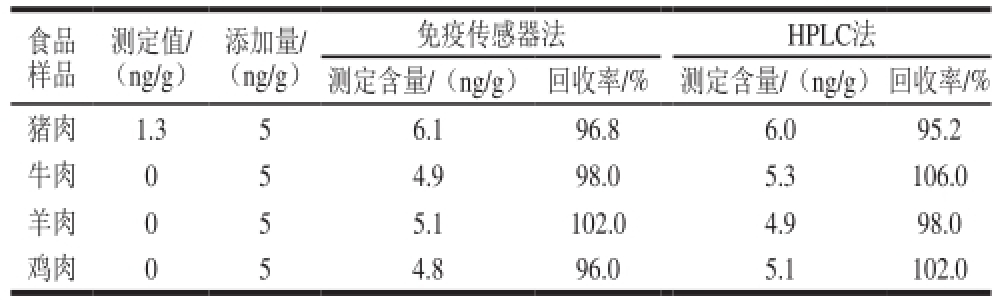
食品量品测定值/(ng/g)添加量/(ng/g)免疫传感器法HPLC法测定含量/(ng/g)回收率/%测定含量/(ng/g)回收率/%猪肉1.356.196.86.095.2牛肉054.998.05.3106.0羊肉055.1102.04.998.0鸡肉054.896.05.1102.0
利用MWNTs-COOH/CS复合膜修饰玻碳电极,制备了基于多壁碳纳米管增效的安培型RAC免疫传感器,提高了免疫传感器检测的灵敏度,其复合修饰材料添加量5 μL、免疫传感器孵育温度35 ℃、孵育时间25 min、电解质溶液pH 7.0;该传感器的抗干扰性、稳定性和重复性较好,用于实际肉品RAC的检测,其检测结果与HPLC法基本一致,因此可用于畜禽肉、饲料中RAC的快速检测。
参考文献:
[1] 邓发亮, 刘晓云, 唐时幸, 等. 莱克多巴胺人工抗原的合成与鉴定[J].食品科学, 2013, 34(18): 146-149. DOI:10.7506/spkx1002-6630-201318029.
[2] 黄怡, 张青杰, 刘敏, 等. 分子印迹固相萃取-高效液相色谱法测定饲料中莱克多巴胺[J]. 色谱, 2012, 30(1): 56-61. DOI:10.3724/ SP.J.1096.2012.10338.
[3] 郑海松, 陈雪娇, 杨小娇, 等. 肉及肉制品中莱克多巴胺的ELISA检测方法的建立[J]. 肉类研究, 2011, 25(10): 26-28. DOI:10.3969/ j.issn.1001-8123.2011.10.008.
[4] 王文珺, 李阳, 叶云锋, 等. 生物量本中莱克多巴胺检测方法的研究进展[J]. 中国畜牧兽医, 2015, 42(1): 140-146. DOI:10.16431/ j.cnki.1671-7236.2015.01022.
[5] 张洪才, 刘国艳, 商璟, 等. 多壁碳纳米管和分子印迹膜修饰电极检测猪尿液中莱克多巴胺[J]. 分析化学, 2012, 40(1): 95-100. DOI:10.3724/SP.J.1096.2012.10338.
[6] 蔡勤仁, 彭玉芬, 冯家望. 超高效液相色谱-电喷雾串联技术测定猪组织中7 种β-兴奋剂[J]. 现代食品科技, 2009, 25(4): 451-454. DOI:10.13982/j.mfst.1673-9078.2009.04.011.
[7] BAI Wanqiao, HUANG Huayu, LI Yan, et al. Direct preparation of well-dispersed graphene/gold nanorodcomposites and their application in electrochemical sensors fordetermination of ractopamine[J]. Electrochimica Acta, 2014, 117: 322-328. DOI:10.1016/ j.electacta.2013.11.175.
[8] 李辉, 蔡浩原, 陈兴, 等. 表面等离子体共振生物传感器连续检测莱克多巴胺[J]. 化学学报, 2010, 38(3): 381-384. DOI:10.3724/ SP.J.1096.2010.00381.
[9] 谢晶磊, 曹小妹, 寻艳, 等. 一种检测莱克多巴胺的复合碳纳米材料修饰电化学传感器[J]. 化学传感器, 2014, 34(2): 41-44. DOI:10.3969/j.issn.1008-2298.2014.02.005.
[10] 张洪才, 刘晓芳, 翁芝莹, 等. Nafion-Au-Nafion修饰玻碳电极循环伏安法测定莱克多巴胺[J]. 上海交通大学学报(农业科学版), 2010,28(6): 534-537. DOI:10.3969./j.issn.1671-9964.2010.06.011.
[11] SHEN Li, HE Pingli. An electrochemical immunosensor based on agarose hydrogel films for rapid determination of ractopamine[J]. Electrochemistry Communications, 2007, 9: 657-662. DOI:10.1016/ j.elecom.2006.10.049.
[12] 申宏丹, 窦红, 高春平, 等. 直接竞争酶联免疫法检测莱克多巴胺研究[J]. 动物医学进展, 2009, 30(8): 58-63. DOI:10.3969/ j.issn.1007-5038.2009.08.014.
[13] ZHANG Yong, MA Hongmei, WU Dan, et al. Label-free immunosensor based on Au@Ag 2S nanoparticles/magnetic chitosan matrix for sensitive determination of ractopamine[J]. Journal of Electroanalytical Chemistry, 2015, 741: 14-19. DOI:10.1016/ j.jelechem.2015.01.007.
[14] 付京花, 徐民俊. 饲料中莱克多巴胺检测前处理方法分析[J].饲料工业, 2009, 30(13): 39-41. DOI:10.3969/j.issn.1001-991X.2009.13.013.
[15] YANG Xin, WU Feng, CHEN Dizhao. An electrochemical immunosensor for rapid determination of clenbuterol by using magnetic nanocomposites to modify screenprinted carbon electrode based on competitive immunoassay mode[J]. Sensors and Actuators B: Chemical, 2014, 192: 529-535. DOI:10.1016/j.snb.2013.11.011.
[16] LAI Yanjun, BAI Jing, HAO Xin, et al. Graphene oxide as nanocarrier for sensitive electrochemical immunoassay of clenbuterol based on labeling amplification strategy[J]. Talanta, 2013, 107: 176-182. DOI:10.1016/j.talanta.2013.01.002.
[17] 王雪霞, 刘晓云, 彭运平. 莱克多巴胺残留检测方法及其进展[J]. 现代食品科技, 2010, 26(9): 1009-1012. DOI:10.3969/ j.issn.1673-9078.2010.09.026.
[18] 宋洋. 莱克多巴胺检测方法最新研究进展[J]. 食品研究与开发,2013, 34(13): 134-136. DOI:10.3969/j.issn.1005-6521.2013.13.037.
[19] LIU Su, LIN Qing, ZHANG Xiuming, et al. Electrochemical immunosensor for salbutamol detection based on CS-Fe 3O 4-PAMAMGNPs nanocomposites and HRP-MWCNTs-Ab bioconjugates for signal amplification[J]. Sensors and Actuators B: Chemical, 2011, 156: 71-78. DOI:10.1016/j.snb.2011.03.074.
[20] 许宇智, 苏星鹏, 赵欣, 等. 离子液体/多壁碳纳米管/壳聚糖修饰电极同时检测多巴胺、抗坏血酸及尿酸的研究[J]. 分析测试学报,2011, 30(11): 1235-1240. DOI:10.3969/j.issn.1004-4957.2011.11.006.
[21] MUZYKA K. Current trends in the development of the electrochemiluminescent immunosensors[J]. Biosensors and Bioelectronics, 2014, 54: 393-407. DOI:10.1016/j.bios.2013.11.011.
[22] 左晓磊, 邱伟, 韩爱云, 等. 莱克多巴胺在畜禽生产中的应用及残留[J]. 中国畜牧兽医, 2007, 34(9): 12-13. DOI:10.3969/ j.issn.1671-7236.2007.09.003.
[23] WARRINER K, REDDY S, NAMVAR A, et al. Developments in nanoparticles for use in biosensors to assess food safety and quality[J]. Trends in Food Science and Technology, 2014, 40: 183-199. DOI:10.1016/j.tifs.2014.07.008.
[24] 王广凤, 朱艳红, 陈玲, 等. 功能性纳米材料在电化学免疫传感器中的应用[J]. 分析化学, 2013, 41(4): 608-615. DOI:10.3724/ SP.J.1096.2013.20611.
[25] 牛司朋, 冯亚娟, 罗蕾, 等. Pt/Ni-氧化石墨烯修饰电极用于莱克多巴胺测定[J]. 传感器与微系统, 2013, 32(2): 35-37. DOI:10.13873/ j.1000-97872013.02.031.
[26] 张晶. 高效液相色谱法测定猪肉组织中莱克多巴胺的残留[J]. 福建畜牧兽医, 2007, 29(3): 12-14. DOI:10.3969/ j.issn.1003-4331.2007.03.053.
An Immunosensor for Rapid Determination of Ractopamine in Foods Based on Multi-Walled Carbon Nanotubes
ZHANG Yuanyuan, WANG Ruixin, LI Qiuwei, LI Shuguo*
(College of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China)
Abstract:A highly sensitive nanoimmunosensor for the determination of ractopamine (RAC) in food samples was constructed based on a glass carbon electrode modified with carboxylic multi-walled carbon nanotubes/chitosan (MWNTs-COOH/CS) composite film. Based on the specific immune reaction between antibody and antigen for RAC, the effect of immune response on immunosensor response current was investigated by cyclic voltammetry and differential pulse voltammetry using K
3[Fe(CN)
6] as the probe. The results showed that immune response currents increased linearly with the cube root of RAC concentration in the range of 0.05-4.05 ng/mL (I
p= - 4.524 4
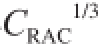 + 14.259, R
2= 0.990 4) with limit of detection (LOD) of 0.08 ng/mL (R
SN= 3). Excellent specificity, stability and reproducibility of the prepared MWNTs-COOH/CS/RAC-anti immunosensor were observed under the selected conditions. The developed method was applied to the determination of RAC in pork, beef, mutton, and chicken samples. The results agreed well with those obtained by HPLC method. Being faster than HPLC method, this immunosensor is practicable for rapid determination of RAC in food samples.
+ 14.259, R
2= 0.990 4) with limit of detection (LOD) of 0.08 ng/mL (R
SN= 3). Excellent specificity, stability and reproducibility of the prepared MWNTs-COOH/CS/RAC-anti immunosensor were observed under the selected conditions. The developed method was applied to the determination of RAC in pork, beef, mutton, and chicken samples. The results agreed well with those obtained by HPLC method. Being faster than HPLC method, this immunosensor is practicable for rapid determination of RAC in food samples.
Key words:ractopamine (RAC); nanoimmunosensor; multi-walled carbon nanotubes (MWCNTs); rapid determination;food safety
DOI:10.7506/spkx1002-6630-201608030
中图分类号:TS225.1
文献标志码:A
文章编号:1002-6630(2016)08-0170-06
DOI:10.7506/spkx1002-6630-201608030. http://www.spkx.net.cn
收稿日期:2015-07-24
基金项目:国家自然科学基金面上项目(20876165);河北科技大学大学生科技创新计划项目(2014262)
作者简介:张媛媛(1989—),女,硕士研究生,研究方向为食品科学与安全。E-mail:993581667@qq.com
*通信作者:李书国(1969—),男,教授,博士,研究方向为粮油食品安全技术。E-mail:shuguolee@126.com
引文格式: