表1 梯度洗脱程序
Table 1 Setting up of gradient elution program

时间/min流速/(μL/min)流动相体积分数/% A B 0.0030080.020.0 2.0030080.020.0 3.0030010.090.0 6.5030080.020.0 8.0030080.020.0
李腾飞 1,赵风年 1,张 超 1,江泽军 1,刘广洋 1,王 静 1,*,刘海金 2,徐 平 2,金茂俊 1,金 芬 1,邵 华 1,王珊珊 1,郑鹭飞 1,佘永新 1,*
(1.中国农业科学院农业质量标准与检测技术研究所,北京 100081;2.西藏自治区农畜产品质量安全检验检测中心,西藏 拉萨 850000)
摘 要:建立番茄中植物激素——水杨酸和赤霉酸的高效液相色谱-三重四极杆质谱检测方法。量品经乙酸-乙腈提取,采用C 18固相萃取柱净化,C 18色谱柱分离,0.5%甲酸-甲醇溶液作为流动相进行梯度洗脱,质谱采用电喷雾负离子模式电离,多反应监测模式定性,基质标准曲线外标法定量。水杨酸的响应值在1.25~20.00 ng/mL范围内具有良好的线性关系,相关系数(R 2)为0.998 4;赤霉酸的响应值在10~1 000 ng/mL范围内呈良好的线性关系,相关系数(R 2)为0.993 3,在3 个加标含量条件下,水杨酸(1.25、2.50、5.00 μg/kg)、赤霉酸(10.0、50.0、100.0 μg/kg)的回收率分别为87.6%~95.3%和83.8%~96.5%,相对标准偏差不高于6.9%,方法的检出限分别为0.01、0.15 ng/mL。
关键词:水杨酸;赤霉酸;高效液相色谱-串联质谱法;番茄
LI Tengfei, ZHAO Fengnian, ZHANG Chao, et al. Simultaneous determination of salicylic acid and gibberellic acid in tomato by high performance liquid chromatography tandem mass spectrometry[J]. Food Science, 2016, 37(8): 182-186. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608032. http://www.spkx.net.cn
植物内源激素是植物体内合成的一系列结构不同的小分子有机化合物,既可调控植物自身的生长发育,又可通过与植物所生存的外部环境相互作用调节其对环境的适应 [1-4]。由于植物内源激素在植物生命活动中发挥着重要作用,对其定量检测已引起了广泛的关注 [5]。植物内源激素的检测方法主要包括毛细管电泳法 [6-7]、气相色谱法 [8]、高效液相色谱法 [9-10]、气相色谱-质谱联用法 [11-13]、液相色谱-质谱联用法 [14-17]等。
然而,植物内源激素在植物体内的含量很低(通常在μg/kg,甚至ng/kg水平),基体成分复杂,并且对温度等外界条件敏感,在不同器官中呈现动态分布,这对其痕量、高灵敏度、精确定量检测提出了更高要求 [18-19]。液相色谱串联质谱法具有很强的定性定量能力,是一种更为可靠地分析植物激素的方法 [20-22]。水杨酸是一种小分子酚类物质,能够诱导植物提高抗病性 [23-24];赤霉酸是一种四环二萜酸,可控制茎的伸长、打破种子休眠、控制开花和性别表达等 [25-26]。目前对番茄中水杨酸和赤霉酸含量同时检测的研究较少,本实验建立一种高效液相色谱-三重四极杆质谱联用方法,对不同生长阶段番茄中水杨酸和赤霉酸的含量进行了分析。
1.1 材料与试剂
水杨酸(纯度为97.0%) 中国食品药品检定研究院;赤霉酸(纯度99.0%) 德国Dr. Ehrenstofer公司;甲醇、乙腈、正己烷(均为色谱纯) 美国Mreda科技公司;甲酸(色谱纯) 迪马公司;氨水、氯化钠、无水硫酸镁(均为分析纯) 北京化工厂;其他试剂均为分析纯;实验用水为Milli-Q超纯水。
1.2 仪器与设备
1200液相色谱仪 美国Agilent Technologies公司;API 5000三重四极杆串联质谱仪 美国AB Sciex质谱系统公司;高速匀浆机 德国Braun公司;高速冷冻离心机 美国Thermo科技公司;Vortex-Genie 2旋涡混合器美国Scientific Industries公司;MilliQ纯水机 法国Millipore公司;TTL-DC II型氮吹仪 北京同泰联科技发展有限公司;C 18SPE(Sep-Pak Vac C 18)小柱 美国Waters公司。
1.3 方法
1.3.1 量品前处理
1.3.1.1 提取
用高速匀浆机破碎番茄量品后,称取10 g试量(精确至0.01 g),于50 mL离心试管中,加入10 mL 含1%乙酸-乙腈溶液,剧烈振荡1 min,加入4 g氯化钠和4 g无水硫酸镁,充分振荡涡旋1 min,5 000 r/min离心5 min。
1.3.1.2 净化
分别用3 mL甲醇和水活化C 18固相萃取柱,取1 mL用氨水调节pH值为8(氨水含量约体积分数5%)的上清液上量,用1 mL正己烷淋洗,3 mL含5%乙酸-甲醇溶液洗脱。将洗脱液氮吹至干,1 mL甲醇复溶,过0.22 μm有机滤膜,上机测定。
1.3.2 液相色谱条件
色谱柱:XTerra ®MS C 18柱(2.1 mm×150 mm,5 μm);柱温30 ℃;进量体积5 μL;流动相:0.5%甲酸溶液(A)和甲醇(B)。洗脱梯度见表1;流速300 μL/min。
表1 梯度洗脱程序
Table 1 Setting up of gradient elution program

时间/min流速/(μL/min)流动相体积分数/% A B 0.0030080.020.0 2.0030080.020.0 3.0030010.090.0 6.5030080.020.0 8.0030080.020.0
1.3.3 质谱条件
离子源:电喷雾离子源;扫描方式:负离子模式;喷雾电压:-4 500 V;离子源温度:500 ℃;气帘气压:20 psi;碰撞气压:9 psi;雾化气压:40 psi;辅助气压:40 psi;射入电压:-10 V;碰撞室出口电压:-17 V;多反应离子监测模式;水杨酸和赤霉酸的定性离子对和定量离子对的去簇电压、碰撞能量见表2。
表2 水杨酸和赤霉酸的母离子、子离子、去簇电压及碰撞能量
Table 2 Parent iron, product ion, declustering potential (DP), collision energy (CE) of SA and GA
3

注:*.定量离子。
分析物母离子子离子去簇电压/V碰撞能量/eV水杨酸137.092.8*-35-23 65.0-40赤霉酸345.0142.9*-146-21 220.9-17
2.1 量品前处理条件优化
2.1.1 提取溶剂的选择
考察不同体积分数(0.1%、1%、5%)的乙酸-乙腈溶液对番茄中的水杨酸和赤霉酸提取效果,结果表明,以体积分数1%乙酸-乙腈溶液作为提取剂其提取效率最高,水杨酸和赤霉酸的回收率均可达83.8%以上,而单纯有机溶剂的提取效率较差。因此,本方法选用体积分数1%乙酸-乙腈作为提取溶剂。
2.1.2 净化条件的选择
本实验分别选择了快速量品前处理(quick, easy,cheap, effective, rugged, safe,QuEChERS)技术方法、SPE方法(C 18柱和MAX混合阴离子交换柱),优化了不同洗脱溶剂的种类和用量,以基质效应定量表示净化效果,比较了不同条件的净化效率。结果表明,3 种方法的净化效率从高到低依次是C 18柱、MAX柱和QuEChERS方法。由于C 18和乙二胺-N-丙基硅烷(primary secondary amine,PSA)对水杨酸和赤霉酸有一定的吸附作用,导致QuEChERS方法的回收率较低,水杨酸和赤霉酸的回收率在40%~60%之间;而采用C 18柱的SPE方法回收率最高,水杨酸和赤霉酸的回收率分别在87.6%~95.3%、83.8%~96.5%之间。综合考虑净化效率和成本(MAX柱成本较高),选取了C 18柱作为番茄中水杨酸和赤霉酸的富集净化柱,并筛选和优化了上量、活化、淋洗和洗脱溶剂,确定了最佳净化程序。本实验采用体积分数5%氨水碱化上量,甲醇和水活化,正己烷淋洗,3 mL体积分数5%乙酸-甲醇溶液能完全洗脱水杨酸和赤霉酸。
2.2 质谱条件的优化
根据目标物的性质,采用负离子扫描模式,结果表明:水杨酸和赤霉酸进入一级质谱后,易产生稳定的[M-H] -分子离子峰。水杨酸的母离子为m/z 137.0,[M-H] -离子作为母离子进入二级质谱后发生断裂产生不同的碎片离子,见图1A。m/z 92.8特征碎片是由母体脱去—COOH生成,其响应值高且稳定,因此,将137.0>92.8作为定量离子对。
赤霉酸的母离子为345.2,[M-H] -离子作为母离子进入二级质谱后发生断裂或重排等反应产生不同的碎片离子,见图1B。赤霉酸二级质谱的特征碎片m/z为142.9、220.9和239.2,其中m/z 142.9的响应值高且稳定,因此,将345.0>142.9作为定量离子对。确定目标物的定量、定性离子对后,对其质谱参数进行优化,优化结果见1.3.3节。水杨酸和赤霉酸总离子流图和提取离子流图见图2。

图1 水杨酸(A)和赤霉酸(B)的二级质谱图
Fig.1 Product ion mass spectra of SA (A) and GA
3(B)
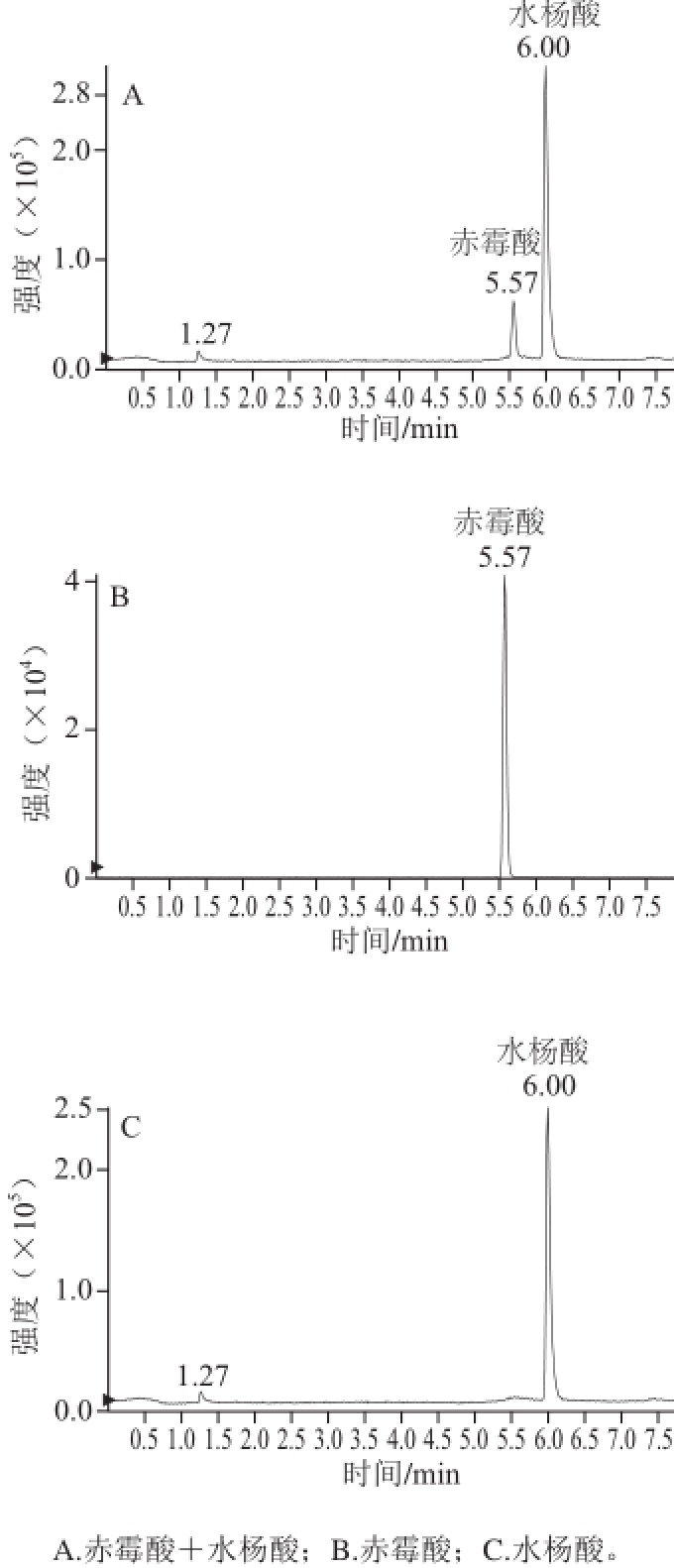
图2 赤霉酸和水杨酸总离子流图和提取离子流图
Fig.2 Total ion chromatogram and extract ion chromatogram of GA
3(50 ng/mL) and SA (5 ng/mL)
2.3 线性范围与检出限
以甲醇作为溶剂,分别配制不同含量梯度的2 种工作液,使水杨酸含量为1.25、2.5、5、10、20 μg/kg和赤霉酸的含量为10、20、50、100、200、1 000 μg/kg。将不同含量的标准溶液在上述选定的高效液相色谱-三重四极杆质谱条件下分别进行测定,通过液相色谱-质谱数据处理软件绘制标准曲线和计算回归方程及其相关系数。结果表明:2 种物质在以上含量范围内,含量与其峰面积呈良好的线性关系,水杨酸线性回归方程为y=1.27×10 5x+ 4.98×10 5,R 2=0.998 4;赤霉酸线性回归方程为y=4.34×10 3x+4.66×10 4,R 2=0.993 3。取信噪比等于3所对应的待测物质量浓度作为检出限,该方法水杨酸、赤霉酸的检出限分别为0.01、0.15 ng/mL。
2.4 回收率和精密度结果
为评价方法的准确性,分别测定了番茄中水杨酸和赤霉酸的加标回收率。选择新采集的番茄作为基质量品,分别添加3 个水平(低、中、高)的上述2 种物质标准溶液,平行测定3 次,以基质加标为基准,计算平均回收率。表3显示,水杨酸添加含量为1.25、2.50、5.00 μg/kg的回收率在87.6%~95.3%之间,相对标准偏差不大于6.9%;赤霉酸添加含量为10.0、50.0、100.0 μg/kg的回收率在83.8%~96.5%之间,相对标准偏差不大于6.7%。本方法准确、快速、灵敏度高,可用于番茄中植物内源激素的测定。
表3 番茄中水杨酸和赤霉酸的平均回收率及相对标准偏差
Table 3 Average recoveries of different spiked levels and relative standard deviations (RSDs) for SA and GA
3in tomato

分析物添加水平/(μg/kg)回收率/%相对标准偏差/% (n=3)水杨酸1.2595.36.0 2.5095.16.9 5.0087.64.6赤霉酸10.083.86.7 50.096.56.5 100.088.26.3
2.5 实际量品分析
表4 不同番茄样品中水杨酸和赤霉酸的含量
Table 4 Contents of SA and GA
3in different tomato samples
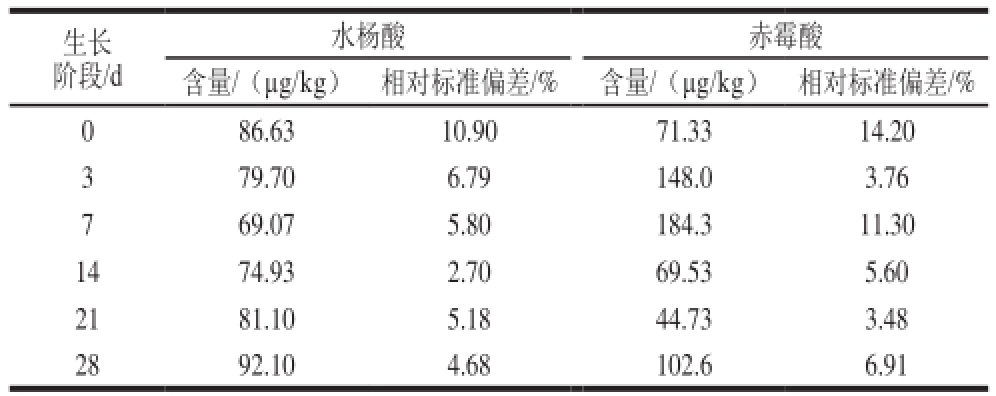
生长阶段/d水杨酸赤霉酸含量/(μg/kg)相对标准偏差/%含量/(μg/kg)相对标准偏差/% 0 86.6310.90 71.3314.20 3 79.706.79 148.03.76 7 69.075.80 184.311.30 1474.932.70 69.535.60 2181.105.18 44.733.48 2892.104.68 102.66.91
为验证该方法在实际量品中的检测能力,采用上述方法对不同生长阶段(0、3、7、14、21、28 d)的番茄量品进行了水杨酸和赤霉酸含量的测定,每个量品重复测定3 次,结果见表4。实验表明,本方法的灵敏度、检出限和精密度能够满足番茄中内源植物激素的测定。
本研究通过对量品前处理方法和色谱质谱条件的筛选和优化,建立了番茄量品中内源性植物激素——水杨酸和赤霉酸的高效液相色谱-三重四极杆质谱检测方法,并应用于实际量品的分析。该方法分析时间短、检出限低、线性范围宽、回收率高,可适用于番茄等量品中水杨酸和赤霉酸的测定分析。
参考文献:
[1] COLEBROOK E H, THOMAS S G, PHILLIPS A L, et al. The role of gibberellin signalling in plant responses to abiotic stress[J]. Journal of Experimental Biology, 2014, 217(1): 67-75. DOI:10.1242/jeb.089938.
[2] IQBAL N, UMAR S, KHAN N A, et al. A new perspective of phytohormones in salinity tolerance: regulation of proline metabolism[J]. Environmental and Experimental Botany, 2014, 100: 34-42. DOI:10.1016/j.envexpbot.2013.12.006.
[3] TANK J G, PANDYA R V, THAKER V S. Phytohormones in regulation of the cell division and endoreduplication process in the plant cell cycle[J]. RSC Advances, 2014, 49(24): 12605-12613. DOI:10.1039/C3RA45367G.
[4] 许智宏, 李家洋. 中国植物激素研究: 过去、现在和未来[J]. 植物学通报, 2006, 23(5): 433-442. DOI:10.3969/ j.issn.1674-3466.2006.05.001.
[5] 符继红, 孙晓红, 王吉德, 等. 植物激素定量分析方法研究进展[J]. 科学通报, 2010, 55(33): 3163-3176. DOI:10.1007/s11434-010-4243-8.
[6] LIU Bifeng, ZHONG Xuehua, LU Yingtang. Analysis of plant hormones in tobacco flowers by micellar electrokinetic capillary chromatography coupled with on-line large volume sample stacking[J]. Journal of Chromatography A, 2002, 945(1): 257-265. DOI:10.1016/ S0021-9673(01)01503-5.
[7] LIU Xin, MA Li, LIN Yawei, et al. Determination of abscisic acid by capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Chromatography A, 2003, 1021(1): 209-213. DOI:10.1016/ j.chroma.2003.09.004.
[8] 刘志勇, 沈春章, 董元彦. 气相色谱法速测油菜中的乙烯释放量[J]. 化学与生物工程, 2006, 23(2): 55-56. DOI:10.3969/ j.issn.1672-5425.2006.02.020.
[9] 周艳明, 忻雪. 高效液相色谱法测定果蔬中7 种植物激素的残留量[J].食品科学, 2010, 31(18): 301-304.
[10] DOBREV P I, HAVLÍČEK L, VÁGNER M, et al. Purification and determination of plant hormones auxin and abscisic acid using solid phase extraction and two-dimensional high performance liquid chromatography[J]. Journal of Chromatography A, 2005, 1075(1/2): 159-166. DOI:10.1016/j.chroma.2005.02.091.
[11] CLAUDIA B, ANIA K, JOACHIM K. Comprehensive chemical derivatization for gas chromatography-mass spectrometry-based multi-targeted profiling of the major phytohormones[J]. Journal of Chromatography A, 2003, 993(1): 89-102. DOI:10.1016/S0021-9673(03)00356-X.
[12] BARKAWI L S, TAM Y Y, TILLMAN J A, et al. A high-throughput method for the quantitative analysis of indole-3-acetic acid and other auxins from plant tissue[J]. Anal Biochemistry, 2008, 372(2): 177-188. DOI:10.1016/j.ab.2007.08.009.
[13] CATHERINE R, LARS G K, JOEL P A, et al. A rapid method for profiling of volatile and semi-volatile phytohormones using methyl chloroformate derivatisation and GC-MS[J]. Metabolomics, 2005,11(6): 1922-1933. DOI:10. 1007/ s11306-015-0837-0.
[14] DURGBANSHI A, ARBONA V, POZO O, et al. Simultaneous determination of multiple phytohormones in plant extracts by liquid chromatography-electrospray tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8437-8442. DOI:10.1021/jf050884b.
[15] PAN Xiangqing, WELTI R, WANG Xuemin. Simultaneous quantification of major phytohormones and related compounds in crude plant extracts by liquid chromatography-electrospray tandem mass spectrometry[J]. Phytochemistry, 2008, 69(8): 1773-1781. DOI:10.1016/j.phytochem.2008.02.008.
[16] 李艳, 徐继林, 郑立洋, 等. 高效液相色谱-三重四极杆质谱法同时测定羊栖菜5 个部位中10 种植物激素含量[J]. 色谱, 2014, 32(8): 861-866. DOI:10.3724/SP.J.1123.2014.03049.
[17] CUI Kunyuan, LIN Yaying, ZHOU Xi, et al. Comparison of sample pretreatment methods for the determination of multiple phytohormones in plant samples by liquid chromatography-electrospray ionizationtandem mass spectrometry[J]. Microchemical Journal, 2015, 121: 25-31. DOI:10.1016/j.microc.2015.02.004.
[18] SCHMELZ E A, ENGELBERTH J, ALBORN H T, et al. Simultaneous analysis of phytohormones, phytotoxins, and volatile organic compounds in plants[J]. Proceedings of the National Academy of Sciences, 2003, 100(18): 10552-10557. DOI:10.1073/ pnas.1633615100.
[19] 白玉, 杜甫佑, 刘虎威. 植物激素检测技术研究进展[J]. 生命科学,2010, 22(1): 36-44. DOI:10.3969/j.issn.1672-352X.2003.02.027.
[20] 陈菲, 陈丽璇, 刘鸿洲, 等. 质谱技术在植物内源激素检测中的应用[J]. 亚热带植物科学, 2010, 39(4): 69-73. DOI:10.3969/ j.issn.1009-7791.2010.04.018.
[21] CAI Baodong, YE Ercui, YUAN Bifeng, et al. Sequential solvent induced phase transition extraction for profiling of endogenous phytohormones in plants by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, 2015, 1004: 23-29. DOI:10.1016/j.jchromb.2015.09.031.
[22] PAN Xiangqing, WELTI R, WANG Xuemin. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry[J]. Nature Protocols, 2010,5(6): 986-992. DOI:10.1038/nprot.2010.37.
[23] DELANEY T P, UKNES S, VERAOOIJ B, et al. A central role of salicylic acid in plant disease resistance[J]. Science, 1994, 266: 1247-1250.
[24] 鲍峰伟, 杨运红, 苏国岁, 等. 高效液相色谱法测定烟草中的水杨酸[J]. 烟草科技, 2011(6): 52-55. DOI:10.3969/ j.issn.1002-0861.2011.06.013.
[25] 陈红平, 刘新, 王川丕, 等. 分散固相萃取-超高压液相色谱-串联质谱法测定茶叶中赤霉酸和α-萘乙酸[J]. 分析化学, 2012, 40(7): 1059-1064. DOI:10.3724/SP.J.1096.2012.11310.
[26] 王伟华, 韩占江, 孟庆艳, 等. 基于HPLC-MS/MS的红枣中氯吡脲与赤霉酸同时检测方法的建立[J]. 中国食品学报, 2014, 14(3): 219-224.
Simultaneous Determination of Salicylic Acid and Gibberellic Acid in Tomato by High Performance Liquid Chromatography Tandem Mass Spectrometry
LI Tengfei
1, ZHAO Fengnian
1, ZHANG Chao
1, JIANG Zejun
1, LIU Guangyang
1, WANG Jing
1,*, LIU Haijin
2,XU Ping
2, JIN Maojun
1, JIN Fen
1, SHAO Hua
1, WANG Shanshan
1, ZHENG Lufei
1, SHE Yongxin
1,*
(1. Institute of Quality Standard and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences, Beijing 100081,China; 2. Tibet Testing Center of Quality and Safety for Agricultural and Animal Husbandry Products, Lhasa 850000, China)
Abstract:A sensitive and selective method was developed using high performance liquid chromatography-positive ion mode electrospray ionization-tandem mass spectrometry (HPLC-MS/MS) for the simultaneous determination of salicylic acid(SA) and gibberellic acid (GA 3) in tomato. The analytes were extracted with a mixture of acetic acid and acetonitrile; the extract was purified with solid-phase extraction (SPE) on an octadecylsilane (C 18) column. Then SA and GA 3in the extract were separated on a reversed phase C 18column using a gradient elution program with 0.5% formic acid-methanol as the mobile phase. Qualitative analysis was performed with electrospray ionization in anion mode (ESI -) under multiple reaction monitoring (MRM) mode. The matrix-matched calibrations were used for quantitation. The calibration curves showed a good linearity in the concentration range of 1.25-20.00 and 10-1 000 ng/mL for SA and GA 3, with correlation coefficients (R 2)of 0.998 4 and 0.993 3, respectively. The average recoveries of SA and GA 3in tomato were in the range of 87.6%-95.3% and 83.8%-96.5% at three spiked concentration levels, and relative standard deviations (RSD, n = 3) were less than 6.9%. The limits of quantitation (LOQ) for SA and GA 3were 0.01, and 0.15 (ng/mL), respectively. The method could be used for the rapid and accurate detection of these hormones in tomato.
Key words:salicylic acid; gibberellic acid; high performance liquid chromatography tandem mass spectrometry(HPLC-MS/MS); tomato
DOI:10.7506/spkx1002-6630-201608032
中图分类号:O657.6;S482.3
文献标志码:A
文章编号:1002-6630(2016)08-0182-05
DOI:10.7506/spkx1002-6630-201608032. http://www.spkx.net.cn
收稿日期:2015-09-06
基金项目:“十二五”国家科技支撑计划项目(2014BAD13B05-05)
作者简介:李腾飞(1987—),男,博士研究生,研究方向为食品安全检测。E-mail:litengfeibeyond@126.com
*通信作者:王静(1963—),女,教授,博士,研究方向为食品安全检测。E-mail:w_jing2001@126.com佘永新(1972—),男,研究员,博士后,研究方向为食品安全检测。E-mail:0891syx@163.com
引文格式:李腾飞, 赵风年, 张超, 等. 高效液相色谱-三重四极杆质谱法同时测定番茄中水杨酸和赤霉酸[J]. 食品科学, 2016,37(8): 182-186.