李亚楠 1,王 瑞 1,李 涛 2,王云贵 3,黄登宇 1,*
(1.山西大学生命科学学院,食品药品快速检测中心,山西 太原 030006;2.山西先锋科技开发有限公司,山西 太原 030006;3.深圳易瑞生物技术有限公司,广东 深圳 518101)
摘 要:建立检测动物组织中呋喃妥因代谢物的直接竞争化学发光酶免疫法。采用棋盘法确定抗体和酶标抗原的最佳稀释度,通过单因素试验优化包被条件、封闭液种类和竞争反应时间,建立直接竞争抑制曲线,并对方法的灵敏度、特异性、准确度和精密度进行方法学评价。结果表明,经优化,最佳反应条件为抗体稀释度1∶4 000,酶标抗原稀释度1∶80,包被条件为37 ℃ 2 h后4 ℃过夜,封闭液为1%牛血清白蛋白,竞争反应1 h。该方法的线性检测范围为0.030~10.595 ng/mL,IC 50为0.559 ng/mL;加标回收率为84.9%~103.4%,批内变异系数为3.4%~7.8%,批间变异系数为4.7%~11.8%;除与呋喃妥因原药交叉反应率为36.2%,与其他结构类似物及衍生化试剂交叉反应率均小于0.1%。该方法灵敏、准确,可用于动物组织中呋喃妥因代谢物的快速筛查。
关键词:呋喃妥因;1-氨基-乙内酰脲;直接竞争化学发光酶免疫检测;动物组织
李亚楠, 王瑞, 李涛, 等. 直接竞争化学发光酶免疫法检测呋喃妥因代谢物[J]. 食品科学, 2016, 37(8): 231-235.
LI Yanan, WANG Rui, LI Tao, et al. Detection of furantoin metabolite by direct competitive chemiluminescene enzyme immunoassay[J]. Food Science, 2016, 37(8): 231-235. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608042. http://www.spkx.net.cn
硝基呋喃类兽药是一类人工合成的广谱抗菌药,用于预防和治疗由大肠杆菌和沙门氏菌引起的胃肠道感染,主要包括呋喃妥因、呋喃唑酮、呋喃它酮和呋喃西林 [1-2]。这类药物进入动物体后,很快代谢为相应的代谢物1-氨基-乙内酰脲(1-amino-hydantoin,AHD)、3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone,AOZ)、5-甲基吗啉-3-氨基-2-恶唑烷酮(3-amino-5-morpolinomethyl-2-oxazolidone,AMOZ)和氨基脲(semicarbazide,SEM) [3],并在动物体内长期稳定存在 [4]。由于硝基呋喃类药物及其代谢物对人体有潜在致癌、致突变作用,很多国家禁止用于食品生产的动物使用此类药物 [5]。但是此类抗生素成本低、预防和治疗细菌感染效果明显,因此仍然被非法使用 [6-7]。
目前,检测动物源食品中AHD的方法有高效液相色谱法 [8]、液相色谱-串联质谱法 [9-11]、胶体金免疫层析法 [12-13]和酶联免疫吸附法 [2,14-15]。仪器分析法虽然准确度和精确度高、重复性好,且可同时检测多种物质,但是检测时间长、成本高、操作技术要求高 [16];胶体金免疫层析法操作简便、快速,但是只可对待测物进行半定量检测,且准确度低;酶联免疫吸附法具有较高的准确度和精确度、较强的特异性,技术要求不高,可实现大批量检测。化学发光酶免疫(chemiluminescene enzyme immunoassay,CLEIA)法将化学发光反应与免疫反应相结合,通过过氧化物酶与化学发光底物作用,检测化学发光信号,进而对待测物进行定量检测;具有酶联免疫吸附法操作简便、快速等特点,但是灵敏度更高 [17],现已广泛用于食品分析检测中 [18-20]。
本实验制备得到了AHD酶标抗原,优化主要反应条件,建立了检测AHD的dc-CLEIA方法,可用于食品中AHD残留的快速筛查,为研制AHD快速检测试剂盒提供技术支持。
1.1 材料与试剂
猪里脊肉、鸡胸肉、鲤鱼肉 市购。
AHD单克隆抗体 北京艾旗斯德科技有限公司;AHD、1-(2-硝基苯亚甲基)-氨基乙内酰脲(1-[(2-nitrobenzylidene)-amino]-imidazolidin-2,4-dione,NPAHD)、辣根过氧化物酶(horseradish peroxidase,HRP)、鲁米诺 美国Sigma公司;半抗原1-(4-羧基苯亚甲基)-氨基乙内酰脲(1-[(4-carbo-benzylidene)-amino]-imidazolidin-2,4-dione,CPAHD) 本实验室自制;其他化学试剂均为国产分析纯。
将鲁米诺、过氧化氢脲和对碘苯酚按照物质的量比为5∶3∶7配制化学发光液 [21]。
1.2 仪器与设备
96 孔化学发光板 美国Thermo公司;INFINITE 200PRO酶标仪 瑞士Tecan公司;UV-1600PC紫外-可见分光光度计 上海美普达仪器公司。
1.3 方法
1.3.1 制备酶标抗原(CPAHD-HRP)
采用活性酯法制备酶标抗原 [22],具体操作如下:称取2.5 mg CPAHD溶于100 µL 2,2-二甲氧基丙烷中,加入1.8 mg N-羟基丁二酰亚胺和3.4 mg N,N'-二环己基碳二亚胺,混匀,室温条件下避光搅拌反应15 h,得A液;称取2.6 mg HRP溶于1.0 mL磷酸盐缓冲溶液(phosphate buffer saline,PBS,pH 7.4,0.01 mol/L)中,得B液;将A液逐滴加入B液中,室温条件下搅拌反应3 h。将反应后混合液移至透析袋中,PBS透析3 d后,4 500 r/min离心5 min,取上清液,即为偶联物CPAHD-HRP,用紫外-可见分光光度计进行扫描。
1.3.2 AHD直接竞争CLEIA法操作步骤
用碳酸盐缓冲液(pH 9.6,0.05 mol/L)将AHD单克隆抗体稀释后,每孔100 μL加入到96 孔化学发光板中进行包被;甩干孔内液体,用PBST溶液(含0.05% Tween-20,pH 7.4,0.01 mol/L的PBS)洗板3 次,在吸水纸上拍干,每孔加入200 μL封闭液,37 ℃封闭2 h,洗板拍干;每孔加入50 μL NPAHD溶液或量品溶液和50 μL酶标抗原,37 ℃反应,洗板拍干;每孔加入100 μL化学发光液,室温避光反应4 min,用酶标仪测各孔化学发光强度(relative light unit,RLU)。
1.3.3 直接竞争CLEIA法条件优化
采用棋盘法确定抗体和酶标抗原的最佳工作浓度,设置抗体稀释度为1∶1 000、1∶2 000、1∶4 000,1∶8 000、1∶16 000,酶标抗原稀释度为1∶10、1∶20、1∶40、1∶80、1∶160、1∶320,按照1.3.2节的步骤测定RLU值,同时做阴性对照(不加NPAHD溶液),每个实验3 次重复,计算平均值。根据B/B 0(B为加NPAHD时RLU值,B 0为不加NPAHD时RLU值)值确定最佳组合。
通过单因素试验确定最佳包被条件、封闭液种类和竞争时间。分别设置3 组包被条件:4 ℃包被过夜(1组)、37 ℃包被2 h后4 ℃包被过夜(2组)和37 ℃包被2 h(3 组);3 种不同封闭液:1%脱脂乳粉(1组)、1%明胶(2组)和1% 牛血清白蛋白(bovine serum albumin,BSA)(3组);4 个竞争时间:40、60、120、150 min,按照1.3.2节的步骤测定化学发光强度RLU值,每个条件3 次重复。绘制各条件下标准曲线,计算IC 50(IC 50为B/B 0为0.5时相应的NPAHD质量浓度)和RLU max/IC 50(RLU max为最大化学发光值)。以IC 50和RLU max/IC 50作为确定最佳条件的依据,IC 50越小,RLU max/ IC 50越大,灵敏度越高 [19]。
1.3.4 量品前处理
取1.0 g量品,加入4 mL超纯水均质;加入0.5 mL HCl溶液(1.00 mol/L)和100 μL邻硝基苯甲醛(0.01 mol/L),混匀,37 ℃振荡反应16 h;加入5 mL K 2HPO 4溶液(0.1 mol/L)、0.4 mL NaOH溶液(1mol/L)和5 mL乙酸乙酯,室温振荡1 min;4 500 r/min离心10 min,取上清液至洁净容器中,氮气吹干;加入1.5 mL正己烷重新溶解,再加入0.5 mL PBS(pH 7.4,0.01 mol/L)混匀;4 500 r/min离心10 min,取下层水相用于CLEIA测定 [23]。
1.3.5 方法学评价
1.3.5.1 建立直接竞争CLEIA法标准曲线
配制质量浓度为100、20、4、0.8、0.16、0.032 ng/mL的NPAHD溶液,按照1.3.2节的步骤及上述优化后最佳反应条件进行操作,测定RLU值,每个质量浓度3 次重复。以NPAHD溶液质量浓度常用对数值为横坐标,B/B 0值为纵坐标,绘制标准曲线,得出线性方程,计算灵敏度IC 50和线性范围(IC 20~IC 80)。
1.3.5.2 直接竞争CLEIA法特异性测定
直接竞争CLEIA法的特异性用交叉反应率(cross reactivity,CR)衡量,NPAHD结构类似物的CR越小,该方法的特异性越好。
将NPAHD结构类似物呋喃妥因、呋喃唑酮、呋喃它酮、呋喃西林、AHD、AOZ、AMOZ、SEM及其相应代谢物衍生物3-(2-硝基苯亚甲基)-氨基-2-恶唑烷酮(3-[(2-nitro-benzylidene)-amino]-2-oxazolidone,NPAOZ)、5-(4-吗啉基)-3-(2-硝基苯亚甲基)-氨基-2-恶唑烷酮(5-(4-morpholinymethyl)-3-{[(2-nitrophenyl)methylene]amino}-2-oxazolidinone,NPAMOZ)、2-硝基苯亚甲基-氨基脲(2-nitrobenzaldehyde-semicarbazone,NPSEM)和衍生化试剂对醛基苯甲酸(carboxybenzaldehyde,4-CBA)、邻硝基苯甲醛分别配制成100、20、4、0.8、0.16、0.032 ng/mL系列质量浓度,按照1.3.2节的步骤进行测定,按下式计算CR。
1.3.5.3 直接竞争CLEIA法准确性和精密度测定
准确性表示检测值与真实值的符合程度,可用加标回收率衡量;精密度表示该检测方法的重复性,可用批内变异系数和批间变异系数衡量。通过对准确性和精密度的测定,可以验证该方法的可靠性。
对空白猪肉、鸡肉和鱼肉进行加标回收实验,分别添加1、5 ng/g和10 ng/g三个水平的AHD标准品。每个水平做5 次重复,并分批进行5 次实验。按照1.3.4节的步骤对量品进行前处理后用所建立的CLEIA法测定,计算回收率、批内变异系数和批间变异系数。
1.3.5.4 2 种CLEIA法量品检测限的比较
取空白猪肉20 份,按照1.3.4节的步骤进行处理后分别采用建立的直接竞争CLEIA法与间接竞争CLEIA法进行测定(在前期研究中,本实验室已建立了AHD检测的间接竞争CLEIA法,见文献[21]),依据各自线性方程计算对应量品的NPAHD质量浓度。量品最低检测限为对应量品NPAHD质量浓度平均值加3 倍标准差。
2.1 酶标抗原CPAHD-HRP的紫外鉴定
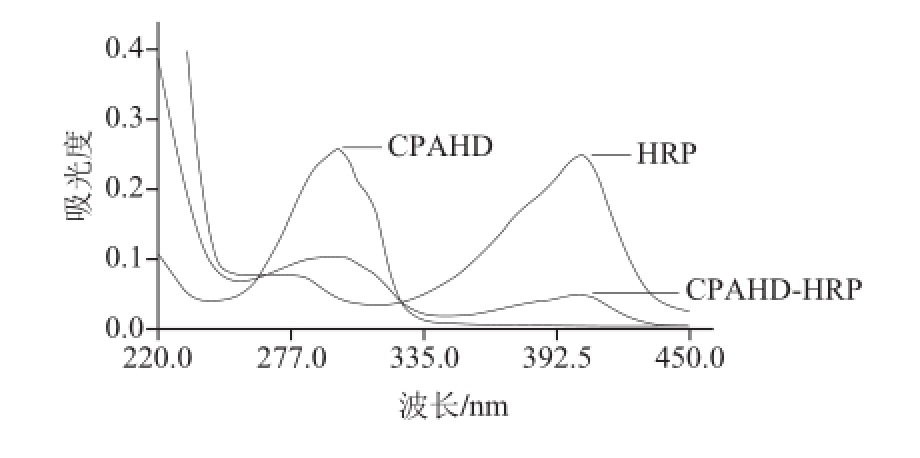
图1 CPAHD、HRP和CPAHD-HRP紫外扫描图谱
Fig.1 UV spectra of CPAHD, HRP and CPAHD-HRP
由图1可见,CPAHD的特征吸收峰在298 nm波长处,HRP的特征吸收峰在403 nm波长处;CPAHD-HRP分别在297 nm和401 nm波长处有两处吸收峰,同时具有CPAHD和HRP的特征,且与CPAHD和HRP相比,吸收峰发生了偏移,说明CPAHD-HRP偶联成功。
2.2 最佳反应条件的确定
2.2.1 抗体与酶标抗原稀释度的确定
表1 不同抗体和酶标抗原稀释度条件下的B/B
0值
Table 1 B/B
0values of different dilutions of antibody and enzyme-labeled antigen
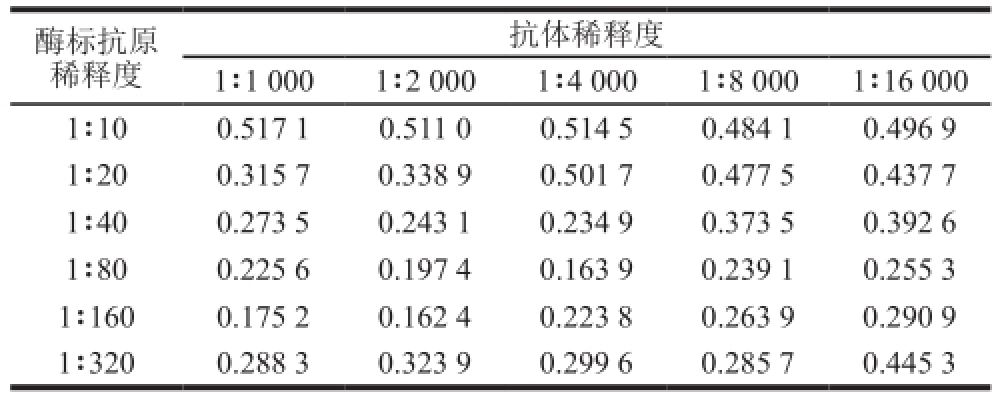
酶标抗原稀释度抗体稀释度1∶1 0001∶2 0001∶4 0001∶8 0001∶16 000 1∶100.517 1 0.511 0 0.514 5 0.484 1 0.496 9 1∶200.315 7 0.338 9 0.501 7 0.477 5 0.437 7 1∶400.273 5 0.243 1 0.234 9 0.373 5 0.392 6 1∶800.225 6 0.197 4 0.163 9 0.239 1 0.255 3 1∶1600.175 2 0.162 4 0.223 8 0.263 9 0.290 9 1∶3200.288 3 0.323 9 0.299 6 0.285 7 0.445 3
由表1可见,抗体稀释度为1∶2 000,酶标抗原稀释度为1∶160时,B/B 0值最小,为0.162 4;抗体稀释度为1∶4 000,酶标抗原稀释度为1∶80时,B/B 0值为0.163 9。竞争化学发光酶免疫反应中,B/B 0越小,灵敏度越高;适当加大抗体或酶标抗原稀释度,可提高灵敏度。结合考虑抗体与酶标抗原的成本,选择抗体稀释度为1∶4 000,酶标抗原稀释度为1∶80。
2.2.2 包被条件的确定
由图2可见,3 种包被条件下,IC 50逐步增大,RLU max/IC 50先增大后减小。第2组(37 ℃包被2 h后4 ℃包被过夜)的RLU max/IC 50最大,表明先37 ℃包被,有助于抗体在化学发光板上快速吸附,再4 ℃孵育过夜,可使抗体包被均匀,灵敏度提高。因此选择37 ℃包被2 h后4 ℃包被过夜为最佳包被条件。
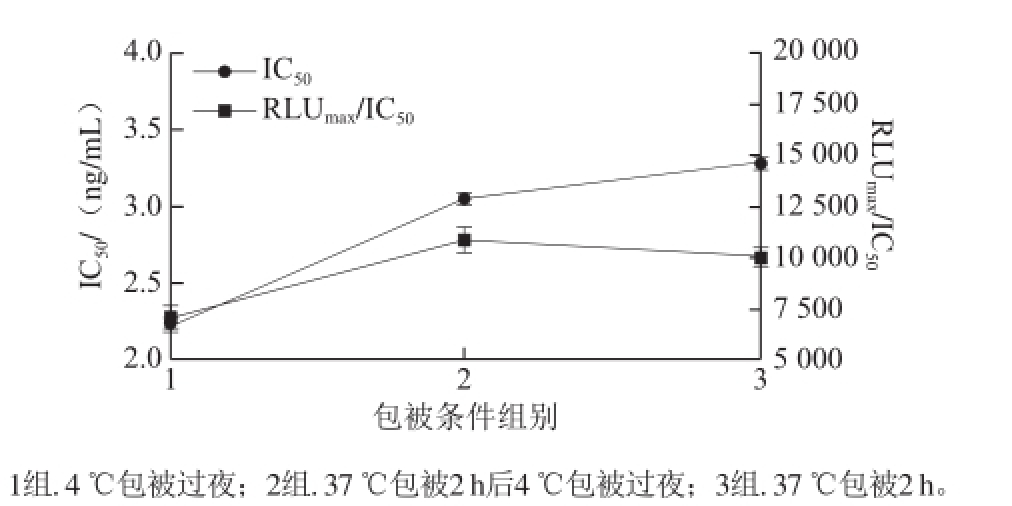
图2 AHD CLEIA法包被条件优化
Fig.2 Optimization of coating conditions for dc-CLEIA of AHD
2.2.3 封闭液的确定
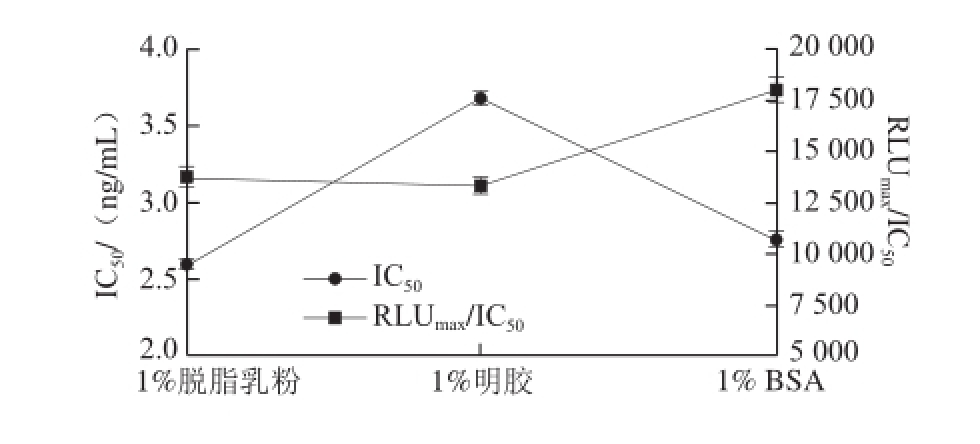
图3 AHD dc-CLEIA法封闭液优化
Fig.3 Optimization of blocking liquid for dc-CLEIA of AHD
由图3可见,明胶封闭时的IC 50最高,1%脱脂乳粉和1% BSA封闭时的IC 50接近;1% BSA封闭时的RLU max/IC 50最大,1%明胶和1%脱脂乳粉封闭时的RLU max/IC 50相差不大。因此综合考虑IC 50和RLU max/IC 50,选择BSA为最佳封闭液。
2.2.4 竞争时间的确定
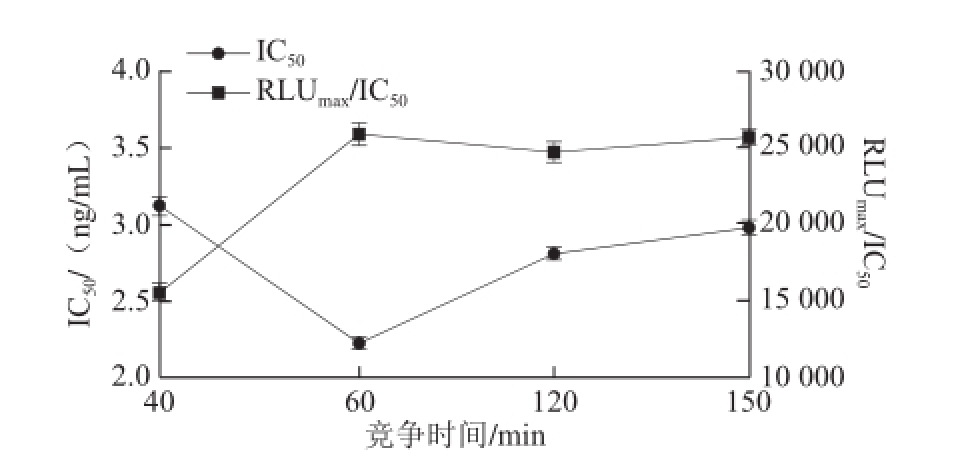
图4 AHD dc-CLEIA法竞争时间优化
Fig.4 Optimization of competitive reaction time for dc-CLEIA of AHD
如图4所示,随着竞争反应时间的延长,IC 50先减小后增大,1 h时最小;RLU max/IC 50先增大后趋于稳定,1 h时最大。因此选择1 h为最佳竞争时间。
2.3 方法学评价
2.3.1 标准曲线的建立
最佳反应条件下建立的标准曲线方程为y=-0.234 9x+ 0.440 8,IC 50为0.559 ng/mL,在0.030~10.595 ng/mL范围内,呈线性关系,可进行精确检测。
2.3.2 特异性实验结果
表2 AHD-CLEIA法特异性测定结果
Table 2 Specificity of AHD-CLEIA
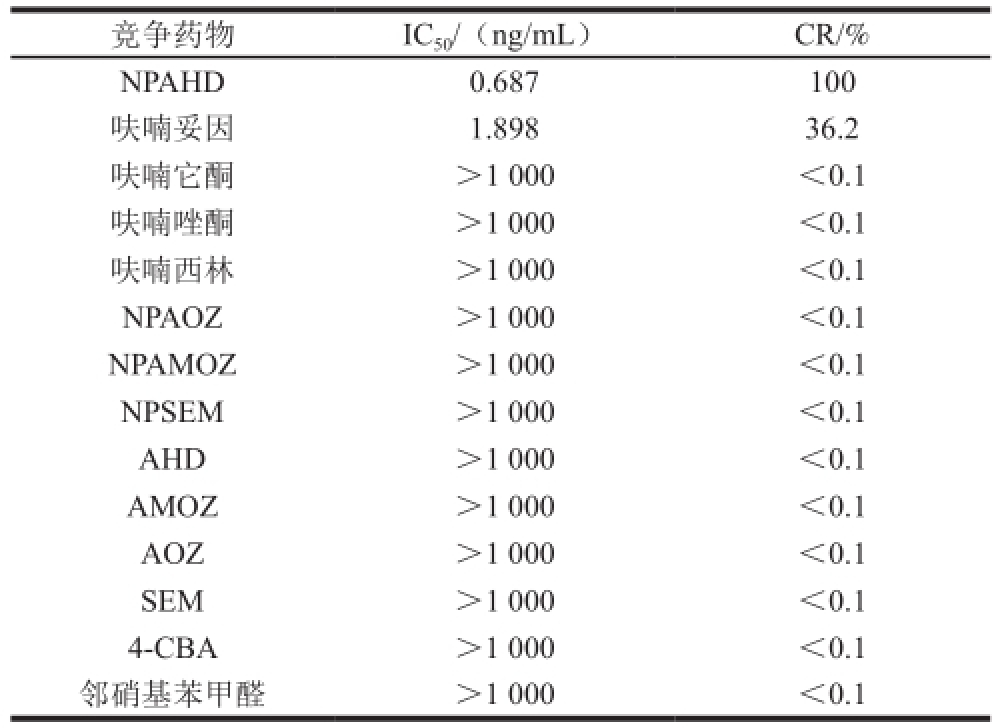
竞争药物IC 50/(ng/mL)CR/% NPAHD0.687100呋喃妥因1.89836.2呋喃它酮>1 000<0.1呋喃唑酮>1 000<0.1呋喃西林>1 000<0.1 NPAOZ>1 000<0.1 NPAMOZ>1 000<0.1 NPSEM>1 000<0.1 AHD>1 000<0.1 AMOZ>1 000<0.1 AOZ>1 000<0.1 SEM>1 000<0.1 4-CBA>1 000<0.1邻硝基苯甲醛>1 000<0.1
由表2可知,AHD直接竞争CLEIA法对呋喃妥因原药的CR为36.2%,与其他结构类似物及衍生化试剂的CR均小于0.1%。但是呋喃妥因原药在动物体内分解代谢快,在实际量品检测中不存在呋喃妥因原药与抗体竞争性结合。表明该方法所用AHD单克隆抗体特异性好。
2.3.3 准确性和精密度实验结果
表3 AHD-CLEIA法的准确性和精密度实验结果
Table 3 Accuracy and precision of AHD-CLEIA
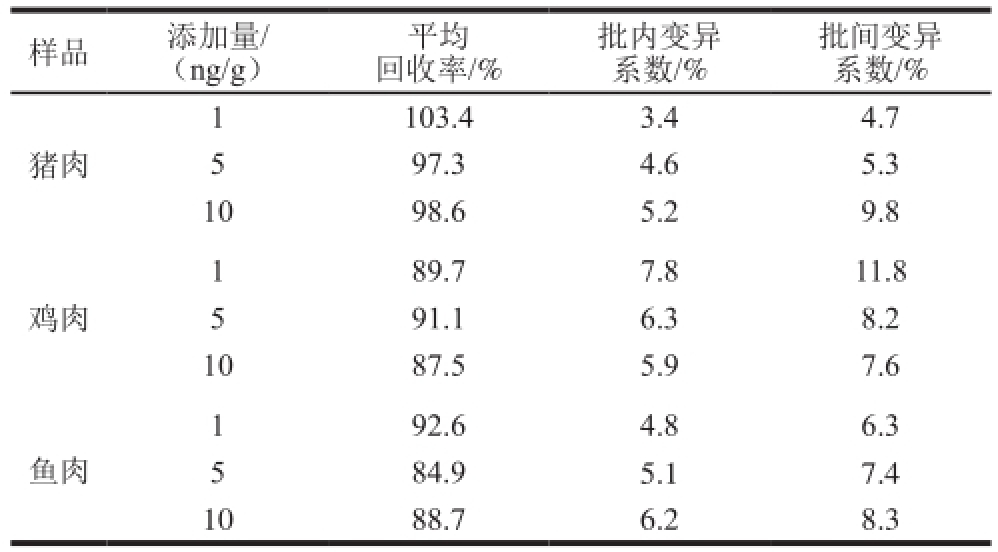
量品添加量/(ng/g)平均回收率/%批内变异系数/%批间变异系数/% 1猪肉103.43.44.7 5 97.34.65.3 1098.65.29.8 89.77.811.8 5 91.16.38.2 1087.55.97.6 1鸡肉92.64.86.3 5 84.95.17.4 1088.76.28.3 1鱼肉
对空白猪肉、鸡肉和鱼肉量品进行3 个水平的加标回收实验,测定结果见表3,加标回收率在84.9%~103.4%之间,相应的批内变异系数在3.4%~7.8%之间,批间变异系数在4.7%~11.8%之间。表明该方法的准确度高、重复性好。
2.3.4 2 种CLEIA法量品检测限的比较
2 种CLEIA法对猪肉量品的最低检测限测定结果见表4。本研究建立的直接竞争CLEIA法在猪肉量品中的检测限低于间接竞争CLEIA法,且操作更为简便、检测时间更短。
表4 2 种CLEIA法样品检测限的比较
Table 4 Comparison of limit of detection between the two CLEIA methods μg/kg
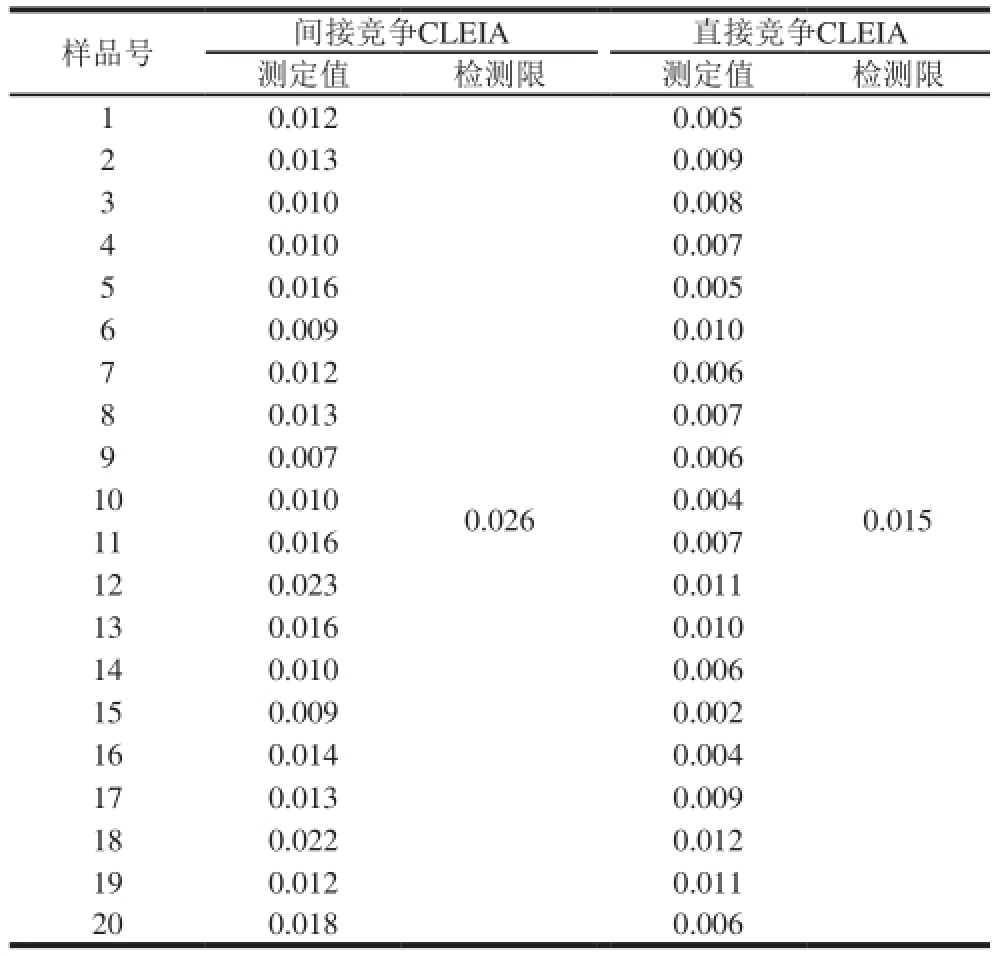
量品号间接竞争CLEIA直接竞争CLEIA测定值检测限测定值检测限1 0.0120.005 0.0130.009 3 0.0100.008 4 0.0100.007 5 0.0160.005 6 0.0090.010 7 0.0120.006 8 0.0130.007 9 0.0070.006 100.0100.004 110.0160.007 120.0230.011 130.0160.010 140.0100.006 150.0090.002 160.0140.004 170.0130.009 180.0220.012 190.0120.011 200.0180.006 2 0.0260.015
本实验建立了检测动物组织中AHD残留的直接竞争化学发光法,IC 50为0.559 ng/mL,低于Jiang Wenxiao等 [2]建立的酶联免疫法的0.68 ng/mL,表明其灵敏度较高;在0.030~10.595 ng/mL范围内可进行精确检测。对猪肉、鸡肉、鱼肉在1、5、10 ng/g三个添加水平的回收率在84.9%~103.4%之间,批内变异系数低于10%,批间变异系数低于12%。猪肉量品检测限为0.015 μg/kg,低于国家标准中液相色谱-串联质谱法的0.5 µg/kg [24]。本实验建立的AHD直接竞争CLEIA法与王瑞等 [21]建立的AHD间接竞争CLEIA法相比,灵敏度较高,量品检测限较低,且省去了加入酶标二抗反应这一步,检测时间更短。因此,本研究建立的直接竞争CLEIA法灵敏度、准确度和精确度高,且操作简便、快速,可用于食品中AHD残留的大量筛查。但是由于该方法标准曲线中B/B 0值偏低,在实际检测中可能导致测定结果偏低。
参考文献:
[1] CHENG C C, HSIENH K H, LEI Y C, et al. Development and residue screening of the furazolidone metabolite, 3-amino-2-oxazolidinone(AOZ), in cultured fish by an enzyme-linked immunosorbent assay[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5687-5692. DOI:10.1007/BF02399637.
[2] JIANG Wenxiao, LUO Pengjie, WANG Xia, et al. Development of an enzyme-linked immunosorbent assay for the detection of nitrofurantoin metabolite, 1-amino-hydantoin, in animal tissues[J]. Food Control,2012, 23: 20-25. DOI:10.1016/j.foodcont.2011.05.014.
[3] JIA Qi, YU Shifeng, CHENG Ni, et al. Stability of nitrofuran residues during honey processing and nitrofuran removal by macroporous adsorption resins[J]. Food Chemistry, 2014, 162: 110-116. DOI:10.1016/j.foodchem.2014.04.046.
[4] BARBOSA J, MOURA S, BARBOSA R, et al. Determination of nitrofurans in animal feeds by liquid chromatography-UV photodiode array detection and liquid chromatography-ionspray tandem mass spectrometry[J]. Analytica Chimica Acta, 2007, 586: 359-365. DOI:10.1016/j.aca.2006.11.053.
[5] VASS M, HRUSKA K, FRANEK M. Nitrofuran antibiotics: a review on the application, prohibition and residual analysis[J]. Veterinarni Medicina, 2008, 53(9): 469-500.
[6] KIM D, KIM B, HYUNG S W, et al. An optimized method for the accurate determination of nitrofurans in chicken meat using isotope dilution-liquid chromatography/mass spectrometry[J]. Journal of Food Composition and Analysis, 2015, 40: 24-31. DOI:10.1016/ j.jfca.2014.12.005.
[7] 陈丽惠, 洪超, 贾玉珠. 市售动物源食品中硝基呋喃类药物代谢物残留量的调查研究[J]. 中国卫生检验杂志, 2014, 24(24): 3602-3604.
[8] 辛少平, 邓建朝, 杨贤庆, 等. 高效液相色谱法测定硝基呋喃类药物代谢物及其在对虾体内的代谢[J]. 食品科学, 2014, 35(24): 151-157. DOI:10.7506/spkx1002-6630-201424029.
[9] 杨琳, 傅红, 刘强. 水产品及其苗种中硝基呋喃代谢物的高效液相色谱-串联质谱法测定[J]. 食品科学, 2010, 31(12): 206-211.
[10] 杨雯筌, 辛志宏, 殷耀, 等. LC-MS-MS检测蜂花粉中硝基呋喃类代谢物[J]. 食品科学, 2013, 34(16): 183-190. DOI:10.7506/spkx1002-6630-201316037.
[11] 潘胜东, 赵永纲, 陈晓红, 等. 固相萃取-超快速液相色谱-串联质谱法测定鸡蛋中4 种硝基呋喃代谢物残留[J]. 中国卫生检验杂志,2014, 24(1): 24-27.
[12] 柳爱春, 刘超, 赵芸, 等. 免疫胶体金法快速检测水产品中硝基呋喃类代谢物的研究[J]. 浙江农业学报, 2013, 25(1): 95-102. DOI:10.3969/j.issn.1004-1524.2013.01.18.
[13] 徐向霞, 向军俭, 唐勇, 等. 猪肉中1-氨基乙内酰脲的胶体金免疫层析法快速检测[J]. 分析测试学报, 2010, 29(7): 680-685. DOI:10.3969/j.issn.1004-4957.2010.07.007.
[14] LI Jun, LIU Juxiang, WANG Jianping. Multidetermination of four nitrofurans in animal feeds by a sensitive and simple enzyme-linked immunosorbent assay[J]. Journal of Agricultural and Food Chemistry,2009, 57(6): 2181-2185. DOI:10.1021/jf8035098.
[15] 徐一平, 金征宇, 胥传来. ELISA方法检测呋喃妥因代谢物1-氨基乙内酰脲[J]. 食品工业科技, 2008, 29(8): 272-275. DOI:10.13386/ j.issn.1002-0306.2008.08.063.
[16] 徐一平, 胥传来. 动物源食品中硝基呋喃类物质及其代谢物残留的检测技术研究[J]. 食品科学, 2007, 28(10): 590-593.
[17] 楚金申, 许杨, 何庆华, 等. 直接竞争化学发光酶免疫法检测猪肉中磺胺嘧啶[J]. 食品科学, 2011, 32(10): 124-129.
[18] FANG Qingkui, WANG Limin, HUA Xiude, et al. An enzymelinked chemiluminescent immunoassay developed for detection of butocarboxim from agricultural products based on monoclonal antibody[J]. Food Chemistry, 2015, 166(1): 372-379. DOI:10.1016/ j.foodchem.2014.06.060.
[19] 孙文佳, 沈玉栋, 孙远明, 等. 化学发光酶免疫法检测猪肉中氯丙嗪残留[J]. 分析化学, 2012, 40(9): 1397-1402. DOI:10.3724/ SP.J.1096.2012.20054.
[20] ZHU Bin, ZHU Fan, XU Zhenlin, et al. Indirect competitive chemiluminescent enzyme immunoassay method for determination of dimethyl phthalate in soy sauce and liquor[J]. Chinese Journal of Analytical Chemistry, 2015, 43(7): 1027-1032. DOI:10.1016/S1872-2040(15)60839-8.
[21] 王瑞, 吕月霞, 黄登宇, 等. 呋喃妥因代谢物化学发光酶联免疫检测方法的研究[J]. 中国兽药杂志, 2015, 49(4): 35-41.
[22] 赵银丽. 恩诺沙星残留免疫学快速检测技术研究[D]. 杨凌: 西北农林科技大学, 2013.
[23] 国家质量监督检验检疫总局. SN/T 3380—2012 出口动物源食品中硝基呋喃代谢物残留量的测定: 酶联免疫吸附法[S].
[24] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 20752—2006 猪肉、牛肉、鸡肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定: 液相色谱-串联质谱法[S].
Detection of Furantoin Metabolite by Direct Competitive Chemiluminescene Enzyme Immunoassay
LI Yanan
1, WANG Rui
1, LI Tao
2, WANG Yungui
3, HUANG Dengyu
1,*
(1. Food and Drug Rapid Inspection Center, College of Life Science, Shanxi University, Taiyuan 030006, China;2. Shanxi Vanguard Technology Co. Ltd., Taiyuan 030006, China;3. Shenzhen Bioeasy Biotechnologies Co. Ltd., Shenzhen 518101, China)
Abstract:A direct competitive chemiluminescene enzyme immunoassay (dc-CLEIA) was developed to detect furantoin metabolite in animal tissues. The optimal dilutions of monoclonal antibody and enzyme labeled antigen were determined by chequerboard titration. The effects of coating conditions, blocking solution and competitive reaction time were investigated by single-factor experiments. The optimized reaction conditions were determined as follows: 4 000-fold dilution of monoclonal antibody 80-fold dilution of enzyme labeled antigen, 2 h incubation at 37 ℃ for coating followed by overnight storage at 4 ℃, blocking with 1% BSA, and 1 h competitive reaction. The linear detection range of the developed CLEIA was 0.030-10.595 ng/mL, and the 50% inhibitory concentration (IC 50) value was 0.559 ng/mL. The recoveries in negative samples ranged from 84.9% to 103.4%. The intra-assay and inter-assay coefficients of variation were 3.4%-7.8% and 4.7%-11.8%, respectively. The cross-reactivity values were lower than 0.1% with other structural analogues and derivatives expect for furantoin original drug (36.2%). The CLEIA method was sensitive and accurate, and thus suitable for the fast screening of furantoin metabolite in food samples.
Key words:furantoin; 1-amino-hydantoin (AHD); direct competitive chemiluminescent enzyme immunoassay; animal tissues
DOI:10.7506/spkx1002-6630-201608042
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)08-0231-05
DOI:10.7506/spkx1002-6630-201608042. http://www.spkx.net.cn
收稿日期:2015-07-20
作者简介:李亚楠(1989—),女,硕士研究生,研究方向为食品新工艺与食品安全。E-mail:nan4050@163.com
*通信作者:黄登宇(1968—),男,副教授,博士,研究方向为食品安全检测。E-mail:Huangdy1110@126.com
引文格式: