郭东花,白 红,石 佩,杨艳青,李高潮,范崇辉*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:为探讨不同时期套袋对油桃果实风味品质的影响,对陕西关中主栽油桃品种“瑞光19号”进行了3 个不同时期的桃专用果袋套袋实验。以不套袋果实为对照,利用固相微萃取-气相色谱-质谱联用技术测定果实的挥发性物质。结果表明:供试桃共检测到83 种挥发性物质。其中特征香气物质的总含量从高到低的顺序为:对照>盛花后40 d套袋(2014年5月14日)>盛花后45 d套袋(2014年5月19日)>盛花后50 d套袋(2014年5月24日)。与不套袋果实相比,不同时期套袋果实均提高了醇类物质的相对含量,但降低了醛类、酯类和酮类物质的相对含量;本实验共检测到3 种内酯类和2 种萜类特征香气物质,其中芳樟醇和γ-癸内酯存在显著相关性;此外,套袋主要影响了“瑞光19号”果实的香气成分和果面着色情况,果实套袋时间越早着色越好,其中盛花后40 d套袋后果实的着色好并且果香味浓,综合表现最佳。
关键词:油桃;套袋时期;挥发性物质;固相微萃取;气相色谱-质谱联用;着色
郭东花, 白红, 石佩, 等. 不同时期套袋对“瑞光19号”油桃果实挥发性成分及着色的影响[J]. 食品科学, 2016, 37(8): 242-247. DOI:10.7506/spkx1002-6630-201608044. http://www.spkx.net.cn
GUO Donghua, BAI Hong, SHI Pei, et al. Effects of bagging at different stages on volatiles and color of “Ruiguang No.19”nectarine fruits[J]. Food Science, 2016, 37(8): 242-247. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608044. http://www.spkx.net.cn
“瑞光19号”为中熟油桃(Prunus persica var. nectarina)品种,在陕西关中地区7月中旬成熟,果实着玫瑰红色,外观艳丽而深受消费者喜爱。但果实着色率较低,种植者为提高桃果实品质而多选用纸袋对果实进行套袋。虽然前人得出套袋改善果实的外观品质,但对果实的内在品质如挥发性物质也会产生一定的影响,尤其是不同品种套袋时间不同也会导致果实的风味品质效果不一 [1]。Wang Yiju等 [2]发现,不套袋桃果实的总挥发性成分的含量及C 6化合物和酯类要显著高于套袋果实,γ-癸内酯、δ-癸内酯的质量浓度要显著低于不套袋果实,认为套袋可能导致桃果实风味降低;Li Bin等 [3]研究了不同时期套袋对“湖景蜜露”果实香气品质的影响,发现盛花后50 d左右套一层橘黄色果袋能提高果实香气品质。
本研究以陕西主栽油桃品种“瑞光19号”为材料,在2013年对该油桃进行了7 种不同果袋套袋实验,测定了果实的香气化合物相对含量及其他品质指标,得出以双层外黄内红纸袋对油桃的综合品质改善较好,因此本次实验采用2013年筛选出的较优果袋对油桃进行了3 个不同时期套袋处理,利用固相微萃取-气相色谱-质谱(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)联用技术,分析桃果实的挥发性物质,并测定其外观品质指标,以期合理确定出该果袋适宜的套袋时期,为种植者改善桃果实品质提供参考依据。
1.1 材料与试剂
供试油桃品种为西北农林科技大学桃种质资源圃的“瑞光19号”,9 a生树,株行距为3 m×4 m,三主枝自然开心形,选择干周、冠径及树势等基本一致的果实作为实验树。
供试果袋(双层外黄内红纸袋,规格为14 cm×18 cm,外层为全木浆纸,内层为石蜡纸) 陕西精工科技有限公司。
2-辛醇(色谱纯) 上海晶纯生化科技公司。
1.2 仪器与设备
SL3001N型电子天平、ISQ GC-MS联用仪 美国Thermo Fisher Scientific公司;HP-INNOWAX弹性石英毛细管柱(30 m×0.25 mm,0.25 μm)、恒温磁力搅拌器 美国Troemner公司;SPME手动进量手柄、75 μm聚二甲基硅氧烷(polydimethylsiloxane,PDMS)萃取头 美国Supelco公司;HR2168匀浆机 荷兰皇家飞利浦公司;YQ-Z-48A颜色测定仪 深圳三恩驰科技有限公司。
1.3 方法
1.3.1 实验分组
实验设4 个处理:不套袋(对照)、盛花后40 d套袋(2014年5月14日)、盛花后45 d套袋(2014年5月19日)、盛花后50 d套袋(2014年5月24日)。3 次重复,单株小区,随机排列。于7月3日统一除外袋,7月6日除内袋,7月14日沿树冠外围距地面1.5~2 m处随机采收30 个果实,带回品质分析室进行测定。
1.3.2 挥发性成分测定
1.3.2.1 SPME取量
每个处理分别取大小均匀的10 个果实,用匀浆机打成匀浆,取15 g果肉匀浆,并加入5 g无水氯化钠,同时加入4 μL 0.5 mg/mL2-辛醇标量于30 mL的螺丝口量品瓶中,立即用锡箔纸密封瓶口并旋紧瓶盖,置于50 ℃恒温磁力搅拌器上,磁力搅拌速率为500 r/min,平衡10 min,然后SPME吸附40 min,立即插入色谱气化室,解吸3 min,进行GC-MS分析 [4-9]。
1.3.2.2 仪器分析
GC条件:HP-INNOWAX弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);进量口温度200 ℃;进量方式:不分流进量;升温程序:40 ℃保持2.5 min,10 ℃/min升至110 ℃,然后以6 ℃/min 升温至230 ℃,维持8 min;载气为高纯He(99.999%),流速1.0 mL/min [7]。
MS条件:电子电离源;电离电压为70 eV;离子源温度250 ℃;离子扫描,质量扫描范围35~500 u。
1.3.2.3 定性及定量分析
挥发性组分的定性分析:量品经过GC进行分离后,形成不同的色谱峰。运用计算机检索并与图谱库(NIST 2011)的标准质谱图对照,参考正反匹配度以及相关文献[6-10],当匹配度和纯度大于800(最大值1 000)的鉴定结果才予以报道。各组分质谱经NIST/ Wiley检索及资料分析,再结合有关文献进行人工图谱分析以确定各化学成分。
果实中挥发性物质的定量采用内标法分析:以2-辛醇作为内标进行含量计算。按下式 [10]计算:
1.3.3 品质指标测定
用YQ-Z-48A颜色测定仪测定果实色差,每个处理取10 个果实测定其赤道部位4 个方向果皮亮度值L*(值越大,亮度越高),红色饱和度a*(值越大,红色越深)和黄色饱和度b*(值越大,黄色越深)
[11],计算色饱和度
![]() (值越大,越容易着色),色度角h=arctan(b*/a*)(代表综合颜色指标,0~180依次分为紫红、红、橙、黄、黄绿、绿、蓝绿色,即h=0,紫红色;h=90,黄色;h=180,蓝绿色)。采用马志本等
[12]方法测定果皮花青苷,采用高俊风
[13]方法测定叶绿素和类胡萝卜素含量,重复3 次,取平均值,均以湿质量计。
(值越大,越容易着色),色度角h=arctan(b*/a*)(代表综合颜色指标,0~180依次分为紫红、红、橙、黄、黄绿、绿、蓝绿色,即h=0,紫红色;h=90,黄色;h=180,蓝绿色)。采用马志本等
[12]方法测定果皮花青苷,采用高俊风
[13]方法测定叶绿素和类胡萝卜素含量,重复3 次,取平均值,均以湿质量计。
1.4 数据处理
采用Excel 2003软件进行数据统计,用SPSS 19.0软件对数据进行差异显著性分析。
2.1 不同时期套袋对“瑞光19号”油桃果实香气成分的影响
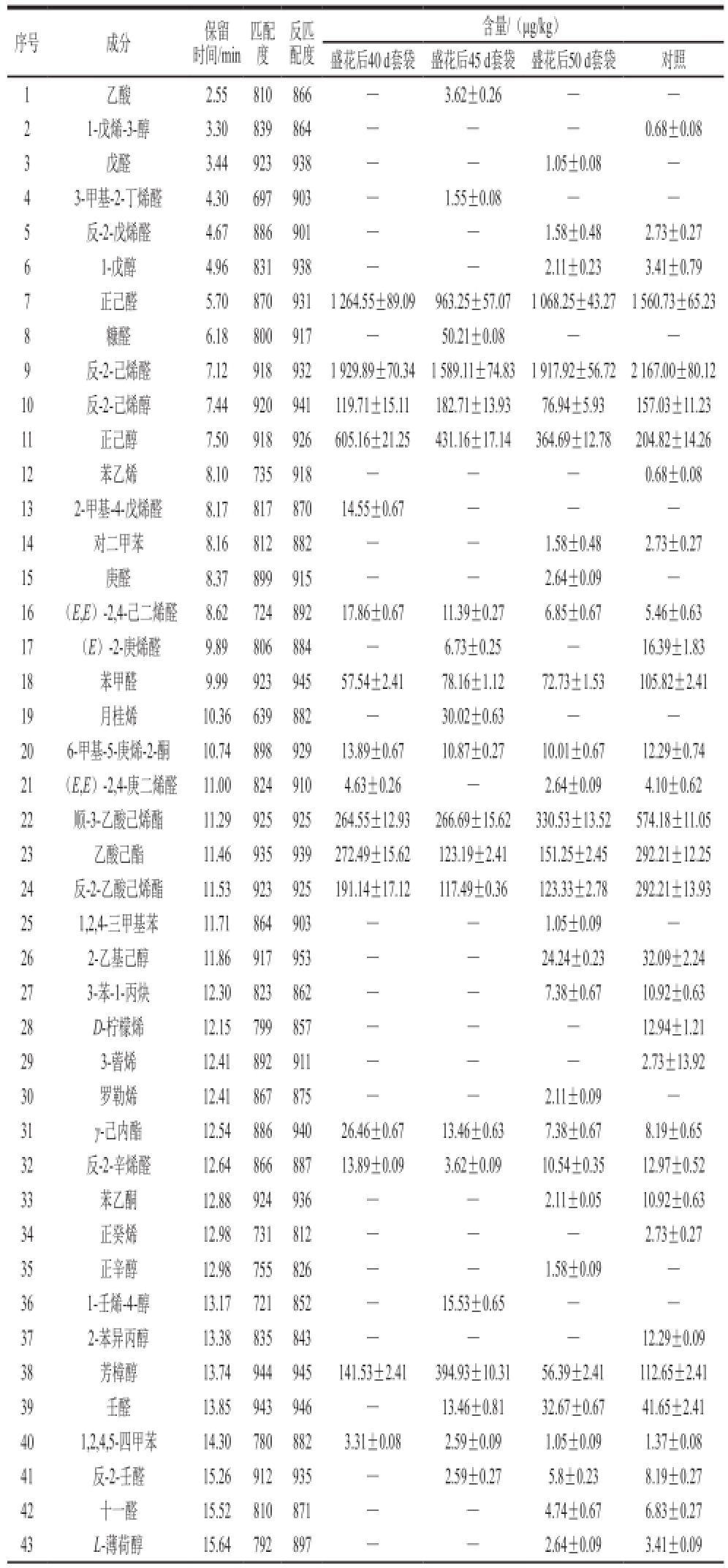
表1 不同时期套袋油桃果实挥发性物质含量
Table 1 Volatiles contents of nectarine fruit bagged at different stages
序号成分保留时间/min匹配度反匹配度含量/(μg/kg)盛花后40 d套袋 盛花后45 d套袋盛花后50 d套袋对照1乙酸2.55810866—3.62±0.26——21-戊烯-3-醇3.30839864——0.68±0.08 3戊醛3.44923938——1.05±0.08—43-甲基-2-丁烯醛4.30697903—1.55±0.08——5反-2-戊烯醛4.67886901——1.58±0.482.73±0.27 61-戊醇4.96831938——2.11±0.233.41±0.79 7正己醛5.708709311 264.55±89.09963.25±57.071 068.25±43.271 560.73±65.23 8糠醛6.18800917—50.21±0.08——9反-2-己烯醛7.129189321 929.89±70.341 589.11±74.831 917.92±56.722 167.00±80.12 10反-2-己烯醇7.44920941119.71±15.11182.71±13.9376.94±5.93157.03±11.23 11正己醇7.50918926605.16±21.25431.16±17.14364.69±12.78204.82±14.26 12苯乙烯8.10735918——0.68±0.08 132-甲基-4-戊烯醛8.1781787014.55±0.67——14对二甲苯8.16812882——1.58±0.482.73±0.27 15庚醛8.37899915——2.64±0.09—16(E,E)-2,4-己二烯醛8.6272489217.86±0.6711.39±0.276.85±0.675.46±0.63 17(E)-2-庚烯醛9.89806884—6.73±0.25—16.39±1.83 18苯甲醛9.9992394557.54±2.4178.16±1.1272.73±1.53105.82±2.41 19月桂烯10.36639882—30.02±0.63——206-甲基-5-庚烯-2-酮10.7489892913.89±0.6710.87±0.2710.01±0.6712.29±0.74 21(E,E)-2,4-庚二烯醛11.008249104.63±0.26—2.64±0.094.10±0.62 22顺-3-乙酸己烯酯11.29925925264.55±12.93266.69±15.62330.53±13.52574.18±11.05 23乙酸己酯11.46935939272.49±15.62123.19±2.41151.25±2.45292.21±12.25 24反-2-乙酸己烯酯11.53923925191.14±17.12117.49±0.36123.33±2.78292.21±13.93 251,2,4-三甲基苯11.71864903——1.05±0.09—262-乙基己醇11.86917953——24.24±0.2332.09±2.24 273-苯-1-丙炔12.30823862——7.38±0.6710.92±0.63 28D-柠檬烯12.15799857——12.94±1.21 293-蒈烯12.41892911——2.73±13.92 30罗勒烯12.41867875——2.11±0.09—31γ-己内酯12.5488694026.46±0.6713.46±0.637.38±0.678.19±0.65 32反-2-辛烯醛12.6486688713.89±0.093.62±0.0910.54±0.3512.97±0.52 33苯乙酮12.88924936——2.11±0.0510.92±0.63 34正癸烯12.98731812——2.73±0.27 35正辛醇12.98755826——1.58±0.09—361-壬烯-4-醇13.17721852—15.53±0.65——372-苯异丙醇13.38835843——12.29±0.09 38芳樟醇13.74944945141.53±2.41394.93±10.3156.39±2.41112.65±2.41 39壬醛13.85943946—13.46±0.8132.67±0.6741.65±2.41 401,2,4,5-四甲苯14.307808823.31±0.082.59±0.091.05±0.091.37±0.08 41反-2-壬醛15.26912935—2.59±0.275.8±0.238.19±0.27 42十一醛15.52810871——4.74±0.676.83±0.27 43L-薄荷醇15.64792897——2.64±0.093.41±0.09
续表1
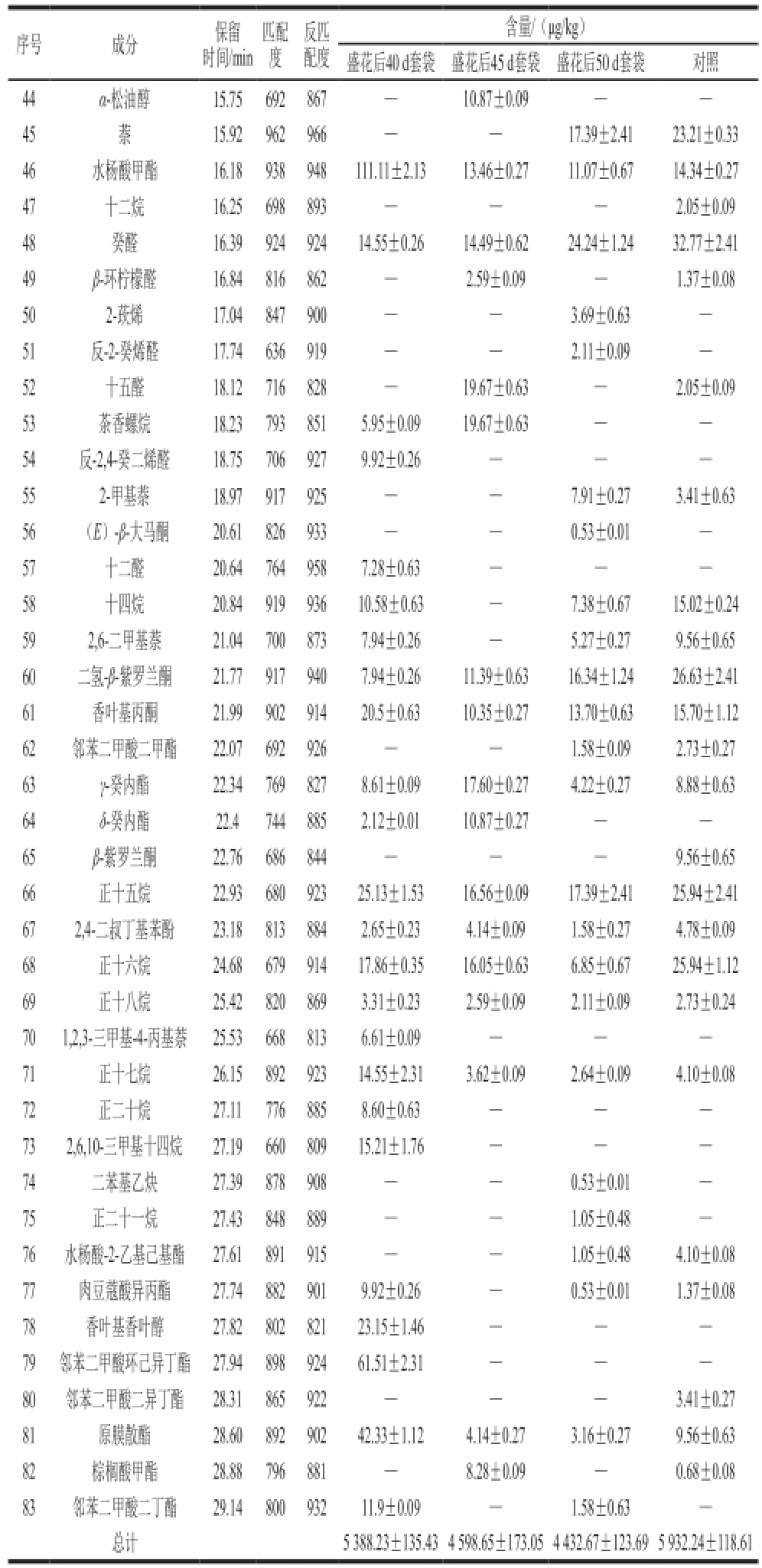
注:—.未检出。下同。
序号成分保留时间/min匹配度反匹配度含量/(μg/kg)盛花后40 d套袋 盛花后45 d套袋盛花后50 d套袋对照44α-松油醇15.75692867—10.87±0.09——45萘15.92962966——17.39±2.4123.21±0.33 46水杨酸甲酯16.18938948111.11±2.1313.46±0.2711.07±0.6714.34±0.27 47十二烷16.25698893——2.05±0.09 48癸醛16.3992492414.55±0.2614.49±0.6224.24±1.2432.77±2.41 49β-环柠檬醛16.84816862—2.59±0.09—1.37±0.08 502-莰烯17.04847900——3.69±0.63—51反-2-癸烯醛17.74636919——2.11±0.09—52十五醛18.12716828—19.67±0.63—2.05±0.09 53茶香螺烷18.237938515.95±0.0919.67±0.63——54反-2,4-癸二烯醛18.757069279.92±0.26——552-甲基萘18.97917925——7.91±0.273.41±0.63 56(E)-β-大马酮20.61826933——0.53±0.01—57十二醛20.647649587.28±0.63——58十四烷20.8491993610.58±0.63—7.38±0.6715.02±0.24 592,6-二甲基萘21.047008737.94±0.26—5.27±0.279.56±0.65 60二氢-β-紫罗兰酮21.779179407.94±0.2611.39±0.6316.34±1.2426.63±2.41 61香叶基丙酮21.9990291420.5±0.6310.35±0.2713.70±0.6315.70±1.12 62邻苯二甲酸二甲酯22.07692926——1.58±0.092.73±0.27 63γ-癸内酯22.347698278.61±0.0917.60±0.274.22±0.278.88±0.63 64δ-癸内酯22.47448852.12±0.0110.87±0.27——65β-紫罗兰酮22.76686844——9.56±0.65 66正十五烷22.9368092325.13±1.5316.56±0.0917.39±2.4125.94±2.41 672,4-二叔丁基苯酚23.188138842.65±0.234.14±0.091.58±0.274.78±0.09 68正十六烷24.6867991417.86±0.3516.05±0.636.85±0.6725.94±1.12 69正十八烷25.428208693.31±0.232.59±0.092.11±0.092.73±0.24 701,2,3-三甲基-4-丙基萘25.536688136.61±0.09——71正十七烷26.1589292314.55±2.313.62±0.092.64±0.094.10±0.08 72正二十烷27.117768858.60±0.63——732,6,10-三甲基十四烷27.1966080915.21±1.76——74二苯基乙炔27.39878908——0.53±0.01—75正二十一烷27.43848889——1.05±0.48—76水杨酸-2-乙基己基酯27.61891915——1.05±0.484.10±0.08 77肉豆蔻酸异丙酯27.748829019.92±0.26—0.53±0.011.37±0.08 78香叶基香叶醇27.8280282123.15±1.46——79邻苯二甲酸环己异丁酯27.9489892461.51±2.31——80邻苯二甲酸二异丁酯28.31865922——3.41±0.27 81原膜散酯28.6089290242.33±1.124.14±0.273.16±0.279.56±0.63 82棕榈酸甲酯28.88796881—8.28±0.09—0.68±0.08 83邻苯二甲酸二丁酯 29.1480093211.9±0.09—1.58±0.63—总计 5 388.23±135.434 598.65±173.054 432.67±123.695 932.24±118.61
由表1可以看出:4 种处理后的“瑞光19号”油桃果实中共检测出83 种挥发性物质。每种处理后挥发性物质成分的总含量从高到低的顺序依次为:对照>盛花后40 d套袋>盛花后45 d套袋>盛花后50 d套袋。
此外,本实验检测出25 种共同物质成分:主要包括顺3-乙酸己烯酯、乙酸乙酯、反-2-乙酸己烯酯、γ-己内酯、γ-癸内酯、水杨酸甲酯和原膜散酯7 种酯类物质,正己醛、(E)-2-己烯醛、(E,E)-2,4-庚二烯醛、苯甲醛、反-2-辛烯醛和癸醛6 种醛类物质,反-2-己烯醇、正己醇和芳樟醇3 种醇类物质,6-甲基-5-庚烯-2-酮、β-二氢紫罗兰酮和香叶基丙酮3 种酮类物质以及6 种烃类物质等。而套袋处理后不共有的挥发性组分为25 种物质,其中盛花后40 d套袋后果实中含有8 种特有物质,盛花后45 d套袋后果实中含有7 种特有物质,盛花后50 d套袋后果实含有10 种特有物质,这些特有的物质主要表现在烃类、醛类、醇类和酯类等物质成分的不同。
2.2 不同时期套袋对“瑞光19号”果实各类挥发性组分的差异分析
表2 不同时期套袋油桃果实挥发性物质的分类
Table 2 Classification of volatile compounds in nectarine fruit bagged at different stages
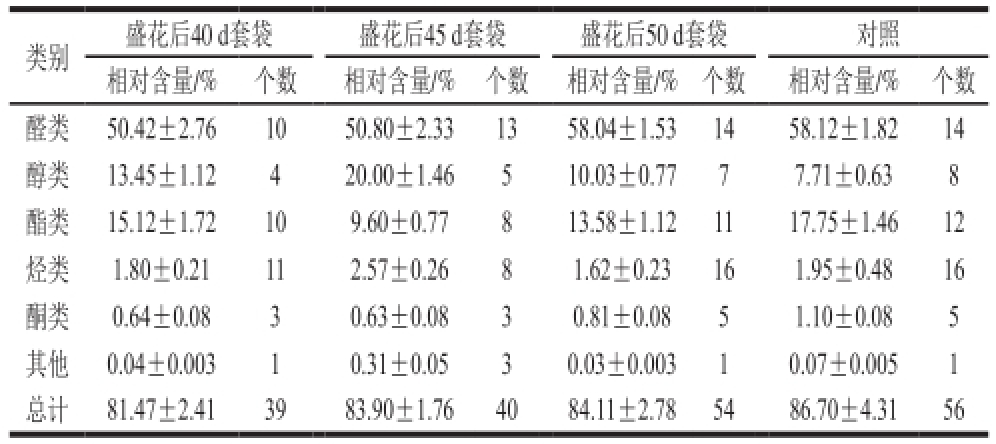
类别盛花后40 d套袋盛花后45 d套袋盛花后50 d套袋对照相对含量/%个数相对含量/%个数相对含量/%个数相对含量/%个数醛类50.42±2.761050.80±2.331358.04±1.531458.12±1.8214醇类13.45±1.12420.00±1.46510.03±0.7777.71±0.638酯类15.12±1.72109.60±0.77813.58±1.121117.75±1.4612烃类1.80±0.21112.57±0.2681.62±0.23161.95±0.4816酮类0.64±0.0830.63±0.0830.81±0.0851.10±0.085其他0.04±0.00310.31±0.0530.03±0.00310.07±0.0051总计81.47±2.413983.90±1.764084.11±2.785486.70±4.3156
由表2中组分个数可以看出:4 种处理含有的主要挥发性物质组分为醛类、酯类、醇类、烃类和酮类物质,还有少量的其他物质。此外,不同时期套袋后果实的组分数量较对照呈下降趋势,其中主要表现在醇类和酯类物质组分数目上的的减少。
从表2中各类组分相对含量可知,不同时期套袋后检测到的总挥发性物质均占色谱流出组分总含量的80%以上。此外,3 种不同时期套袋后果实的醛类、酯类和酮类物质的相对含量较对照均呈降低趋势,但其醇类物质的相对含量较对照则有所增多,其中以盛花后45 d套袋后果实的酯类物质所占的相对含量最低为9.60%,比对照降低了8.15%,但其醇类物质的相对含量高达20%,比对照提高了12.29%。说明套袋对“瑞光19号”果实的挥发性组分具有一定的影响,且不同时期套袋产生的效果也大小不一。
2.3 不同时期套袋对“瑞光19号”油桃果实特征香气含量的影响
目前已从桃果实中鉴定出100多种香气物质,在这些香气物质中只有为数不多的特征性香气物质对其香气品质具有重要作用。其中,C 6醛和醇属于“青香型”,而酯和内酯属“果香型”,而萜类和酮类是桃果实中最主要的“花香型”香气物质 [14]。由表3可看出,本实验共检测13 种特征香气,其中“花香型”2 种、“青香型”2 种、“果香型”8 种,在“果香型”成分中有3 种既具有果香又具有甜香味的内酯类化合物,分别是γ-己内酯、γ-癸内酯和δ-癸内酯。此外,还检测出1 种苦味的苯甲醛,但不同时期套袋后果实的苯甲醛含量均较对照有所降低;同时在不同时期套袋果实中未检测到花香味成分β-紫罗兰酮。说明套袋会影响“瑞光19号”果实的特征香气成分的合成。
表3 不同时期套袋油桃果实的特征香气含量
Table 3 Characteristic aroma compounds in nectarine fruit bagged at different stages
μg/kg

序号成分 盛花后40 d套袋盛花后45 d套袋盛花后50 d套袋对照特征香气 [14-19]18苯甲醛57.54±2.4178.16±1.1272.73±1.53105.82±12.41苦味9反-2-已烯醛1 929.89±70.341 589.11±74.831 917.92±56.722 167.00±80.12青香10反-2-己烯醇119.71±15.11182.71±13.9396.94±5.93157.03±11.23青香青香味成分含量总计2 106.25±50.631 849.98±21.762 077.87±13.932 324.03±33.93 22顺-3-乙酸己酯264.55±12.93266.69±15.62330.53±13.52574.18±11.05果香24反-2-乙酸己酯 191.14±17.12117.49±2.41123.33±2.78292.21±12.25果香23乙酸己酯272.49±15.62133.19±15.62141.25±2.45292.21±13.93甜香31γ-己内酯26.46±0.6713.46±0.638.38±0.678.19±0.65甜香,果香63γ-癸内酯8.61±0.0917.61±0.274.22±0.278.88±0.63甜香,果香64δ-癸内酯2.12±0.0110.87±0.27——甜香,果香28D-柠檬烯——12.94±1.21甜香56(E)-β-大马酮——0.53±0.01—果香果香味成分含量总计765.35±12.63559.31±11.93608.23±12.931 188.61±20.23果香38芳樟醇141.53±2.41394.93±10.3156.39±2.41112.65±1.63花香65β-紫罗兰酮——9.56±0.65花香花香味成分含量总计141.53±10.21394.93±8.9356.39±3.93122.21±13.93特征香气总计3 013.15±87.632 804.22±53.932 742.49±43.933 634.84±37.89
此外,香气物质对果实风味的影响不仅与其含量有关,还与其种类多少有关。从表3可看出,本实验中不套袋果实的特征香气物质的总含量与物质种类数均高于套袋后的果实;而3 个不同时期套袋处理后果实均含有10 种特征香气物质,但不同时期处理间果实含有的特征香气含量不同。因此综合油桃特征香气的总含量和物质种类数从高到低的顺序为:对照>盛花后40 d套袋>盛花后45 d套袋>盛花后50 d套袋。同时,根据李杨昕等 [15]研究得出“青香型”与“果香型”香气成分的比值越低则果实的香味越佳,由此在本实验3 个不同套袋时期中以盛花后40 d套袋后果实的香味表现较好,盛花后45 d套袋后的果实表现次之。
2.4 不同时期套袋对“瑞光19号”油桃果实外观着色的影响
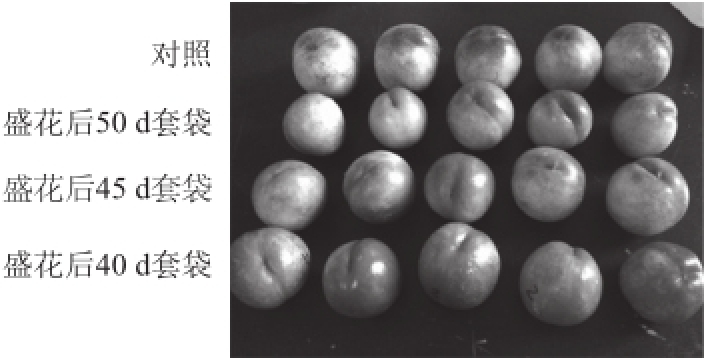
图1 同时期套袋对“瑞光19号”果实外观品质的影响
Fig.1 Effect of different bagging stages on exterior quality of“Ruiguang No.19” fruit
由图1可看出,3 个不同时间套袋后桃果实的外观着色均优于不套袋的对照果实,此外,在3 个套袋时期中以盛花后40 d套袋后桃果实的着色效果最明显,盛花后45 d和50 d套袋后果实的着色次之。
表4 不同时期套袋对油桃果实着色的影响
Table 4 Effect of bagging at different stages on the color of nectarine fruit
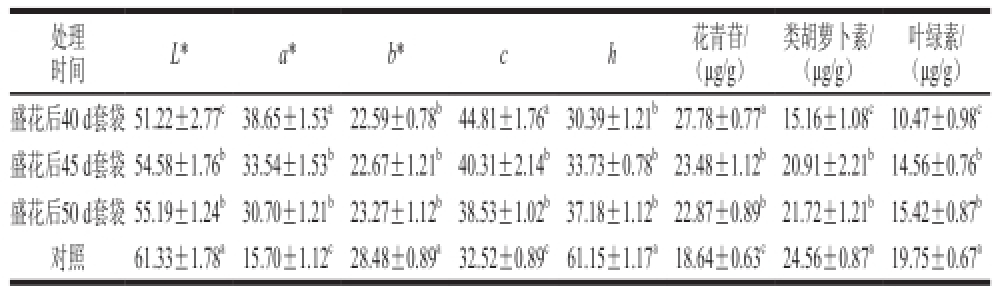
注:经邓肯氏新复极差测验,同列不同小写字母表示差异显著(P<0.05)。
叶绿素/(μg/g)盛花后40 d套袋 51.22±2.77 c38.65±1.53 a22.59±0.78 b44.81±1.76 a30.39±1.21 b27.78±0.77 a15.16±1.08 c10.47±0.98 c盛花后45 d套袋 54.58±1.76 b33.54±1.53 b22.67±1.21 b40.31±2.14 b33.73±0.78 b23.48±1.12 b20.91±2.21 b14.56±0.76 b盛花后50 d套袋55.19±1.24 b30.70±1.21 b23.27±1.12 b38.53±1.02 b37.18±1.12 b22.87±0.89 b21.72±1.21 b15.42±0.87 b对照61.33±1.78 a15.70±1.12 c28.48±0.89 a32.52±0.89 c61.15±1.17 a18.64±0.63 c24.56±0.87 a19.75±0.67 a处理时间L*a*b*ch花青苷/(μg/g)类胡萝卜素/(μg/g)
由表4可看出,套袋对“瑞光19号”果实的着色较对照存在显著差异。套袋提高了果实的红色饱和度(a*)、色饱和度(c)以及花青苷的含量;降低了光亮度(L*)、黄色饱和度(b*)、色度角(h)类胡萝卜素和叶绿素的含量,说明套袋后果实更容易着红色。
同时,在3 个不同时期套袋果实之间,盛花后40 d套袋后果实的外观着色指标均较盛花后45 d和50 d套袋处理后呈显著差异,主要表现在a*、c值和花青苷含量上,而且套袋时间越早a*、c值以及花青苷的含量越大,同量L*、b*、h值及类胡萝卜素和叶绿素的含量则越小,说明套袋时间越早越容易促进果实表面着色。
2.5 不同时期套袋果实共有的特征香气与果面着色品质的相关性
表5 特征香气与着色品质的相关系数
Table 5 Correlation coefficients between characteristic volatiles and color quality
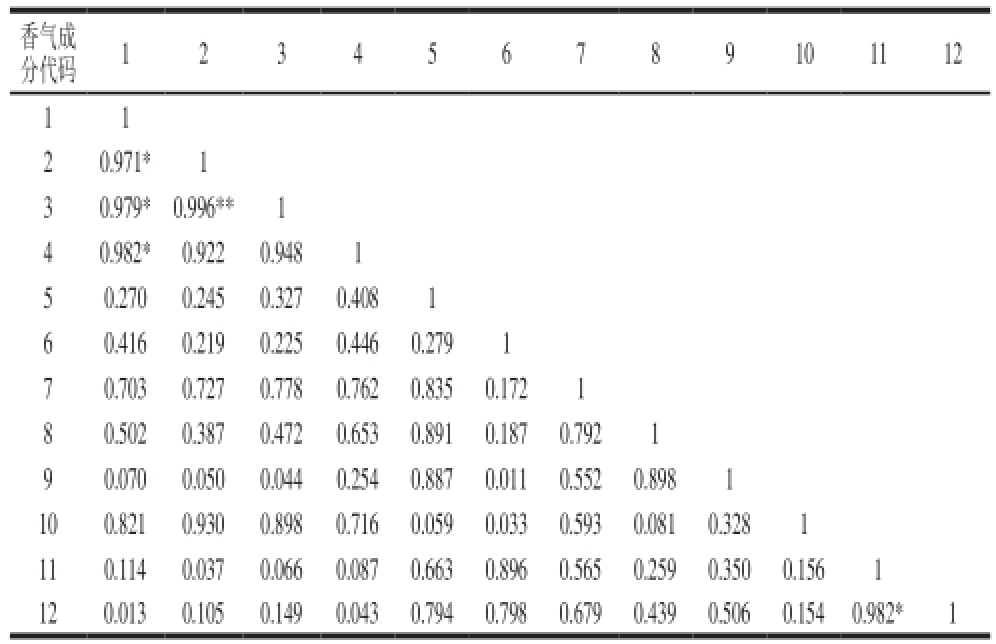
注:*.差异显著(P<0.05);**.差异极显著(P<0.01);1.花青苷;2.类胡萝卜素;3.叶绿素;4.苯甲醛;5.反-2-己烯醛;6.反-2-己烯醇;7.顺-3-乙酸己酯;8.反-2-乙酸己酯;9.乙酸己酯;10. γ-己内酯;11. γ-癸内酯;12.芳樟醇。
香气成分代码123456789101112 11 20.971* 1 30.979* 0.996** 1 40.982* 0.922 0.948 1 50.270 0.245 0.327 0.408 1 60.416 0.219 0.225 0.446 0.279 1 70.703 0.727 0.778 0.762 0.835 0.172 1 80.502 0.387 0.472 0.653 0.891 0.187 0.792 1 90.070 0.050 0.044 0.254 0.887 0.011 0.552 0.898 1 100.821 0.930 0.898 0.716 0.059 0.033 0.593 0.081 0.328 1 110.114 0.037 0.066 0.087 0.663 0.896 0.565 0.259 0.350 0.156 1 120.013 0.105 0.149 0.043 0.794 0.798 0.679 0.439 0.506 0.154 0.982* 1
由表5可看出,花青苷、类胡萝卜素和叶绿素之间存在显著相关性,同时类胡萝卜素与叶绿素存在极显著相关性,但它们与特征香气成分之间的相关程度却不高;此外,在9 种特征香气之间γ-癸内酯与芳樟醇之间存在显著相关性,其他成分之间相关性则不明显。因此,说明油桃“瑞光19号”果实中的“花香型”萜类成分与内酯类成分之间的转化或合成可能具有一定的影响。
香气物质赋予果实特征风味,在果实风味构成中具有决定性作用 [20]。本实验检测出的83 种挥发性物质成分中,有共同成分,也有一些各自特有的物质。套袋处理后“瑞光19号”果实特征香气的物质种类和含量与不套袋果实相比均有所减少,尤其体现在“果香型”方面,这可能是导致油桃套袋后风味变淡的原因。此外,在3 个不同时期套袋处理中,套袋时间越长的果实其香气含量越高,可能与光照时间或果实成熟期的降雨量有关。Jia Huijian等 [21]研究套袋对桃果实的影响认为,果实照光越多果实香气越低;席万鹏等 [14]认为桃果实香气物质的合成也会受灌溉水分条件的影响。套袋可以使果实在发育成熟阶段处于微生态环境,因此探讨套袋微环境对果实香气物质合成的关键机理仍需进一步实验来证明。
此外,本实验中不同时期套袋后果实的γ-己内酯含量均高于对照,这一结果与李芳芳等 [22]研究的结果一致,即套袋能促进香气物质γ-己内酯的合成。同时,不同时期套袋还影响了油桃果实的“花香型”物质β-紫罗兰酮的合成。β-紫罗兰酮是类胡萝卜素在类胡萝卜素双加氧酶(carotenoid cleavage dioxygenase,CCD)的作用下降解形成的 [23-24]。本实验验中套袋提高了花青苷含量但降低了类胡萝卜素的含量从而导致底物减少,也可能是套袋引起了CCD关键酶发生变化。特别是套袋时期的早晚会显著影响花青苷的积累 [25]。在本实验中,各项着色指标与特征香气成分之间的相关性不明显,但Brandi等 [26]曾发现,类胡萝卜素双加氧酶4在不同品种桃果实色泽形成和香气物质的形成中具有重要作用。由此推测果实在合成一些香气物质的过程中果实的着色物质并不直接作用,而是需要一些除了关键酶之外还可能存在的合成基因诱导。但目前在桃果实上还没有克隆到任何萜类的合成基因 [27],因此关于果实香气合成的关键基因是今后亟待进一步研究的内容。
套袋对“瑞光19号”油桃果实的挥发性物质具有一定的影响,且不同套袋时期影响表现不一,其中盛花后40 d套袋后果实的果香味较其他套袋时期的果实较浓。4 种处理果实含有的主要组分为烃类、醛类、酯类、醇类和酮类等物质。套袋降低了果实的醛类、酯类和酮类物质的含量,但增加了醇类的含量,同时在这些香气物质中有个别的特征香气成分之间还存在一定的相关性。此外,不同时期套袋均提高了果实的花青苷和a*值和c值,并且在适宜的套袋时期内,套袋时间越早越有利于果实着色。因此,综合果实的香气成分及着色指标得出盛花后40 d(2014年5月14日)对“瑞光19号”果实进行套袋效果最佳。
参考文献:
[1] 李桂祥, 马瑞娟, 俞明亮, 等. 套袋对桃果实品质影响的研究进展[J]. 江苏农业科学, 2011, 39(6): 265-267. DOI:10.15889/ j.issn.1002-1302.2011.06.226.
[2] WANG Yiju, YANG Chunxiang, LIU Chunyan, et al. Effects of bagging on volatiles and polyphenols in “Wanmi” peaches during endocarp hardening and final fruit rapid growth stages[J]. Journal of Food Science, 2010, 75(9): 455-460. DOI:10.1111/j.1750-3841.2010.01817.x.
[3] LI Bin, JIA Huijuan, ZHANG Xiaomeng. Effects of fruit preharvest bagging on fruit quality of peach (Prunus persica Batsch cv. Hujingmilu)[J]. Journal of Plant Physiology and Molecular Biology,2006, 32(3): 280-286.
[4] 高华君, 王少敏, 刘嘉芬. 红色苹果套袋与除袋机理研究概要[J]. 中国果树, 2000, 5(2): 46-48. DOI:10.3969/ j.issn.1000-8047.2000.02.024.
[5] 胡花丽, 王贵禧, 李艳菊. 桃果实风味物质的研究进展[J]. 农业工程学报, 2007, 23(4): 280-287. DOI:10.3321/j.issn:1002-6819.2007.04.056.
[6] 张晓萌. 桃果实成熟过程中香气成分形成及其生理机制研究[D]. 杭州: 浙江大学, 2005.
[7] 李明, 王利平, 张阳, 等. 水蜜桃品种间果香成分的固相微萃取-气质联用分析[J]. 园艺学报, 2006, 33(5): 1071-1074. DOI:10.3321/ j.issn:0513-353X.2006.05.029.
[8] 张红梅, 常明勋, 何玉静. 固相微萃与GC-MS联用分析水蜜桃挥发性成分[J]. 食品科学, 2009, 30(20): 391-393.
[9] 邓翠红, 李丽萍, 韩涛, 等. 京艳桃果实香气成分的气相色谱-质谱测定[J]. 食品科学, 2008, 29(6): 304-307. DOI:10.3321/ j.issn:1002-6630.2008.06.064.
[10] 罗华, 李敏, 宋红日, 等. 套袋处理对肥城桃果实香气成分的影响[J]. 湖北农业科学, 2012, 51(22): 5072-5075. DOI:10.14088/j.cnki.issn0439-8114.2012.22.062.
[11] 高志红, 宋琴芳, 徐长宝. 套袋对新川中岛桃果实品质的影响[J]. 中国南方果树, 2008, 37(2): 61-63.
[12] 马志本, 程玉娥. 关于苹果果实表面花青素含量的化学测定[J]. 中国果树, 1984(4): 49-51.
[13] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 204-205.
[14] 席万鹏, 郁松林, 周志钦. 桃果实香气物质生物合成研究进展[J]. 园艺学报, 2013, 40(9): 1679-1690.
[15] 李杨昕, 王贵禧, 梁丽松. ‘大久保' 桃常温贮藏过程中香气成分变化及其与乙烯释放的关系[J]. 园艺学报, 2011, 38(1): 35-42.
[16] 王贵章, 王贵禧, 梁丽松, 等. 桃果实芳香挥发物及其生物合成研究进展[J]. 食品科学, 2014, 35(17): 278-284. DOI:10.7506/spkx1002-6630-201417053.
[17] SCHWAB W, DAVIDOVICH-RIKANATI R, LEWINSOHN E. Biosynthesis of plant-derived flavor compounds[J]. The Plant Journal,2008, 54(4): 712-732. DOI:10.1111/j.1365-313X.2008.03446.x.
[18] ZIPORA T, ANNE P, ELAZAR F, et al. Taste and aroma of fresh and stored mandarins[J]. Journal of the Science of Food and Agriculture,2011, 91(1): 14-23. DOI:10.1002/jsfa.4146.
[19] 乜兰春, 孙建设, 陈华君, 等. 苹果不同品种果实香气物质研究[J]. 中国农业科学, 2006, 39(3): 641-646. DOI:10.3321/ j.issn:0578-1752.2006.03.030.
[20] 胡亚东. 不同纸质果袋对桃发育果实花青苷形成的影响[D]. 杭州:浙江大学, 2004.
[21] JIA Huijian, ARAKI A, OKAMOTO G. Influence of fruit bagging on aroma volatiles and skin coloration of ‘Hakuho'peach (Prunus persica Batsch)[J]. Postharvest Biology and Technology, 2005, 35(1): 61-68. DOI:10.1016/j.postharvbio.2004.06.004.
[22] 李芳芳, 张虎平, 何子顺, 等. 套袋对 ‘库尔勒香梨' 果实糖酸组分与香气成分的影响[J]. 园艺学报, 2014, 41(7): 1443-1450.
[23] 贾惠娟, 张晓萌, 李斌. 果实香气成分的研究进展[C]//中国园艺学会桃分会成立大会暨学术研讨会. 郑州: 2007.
[24] REMORINI D, TAVARINI S, INNOCENTI E D, et al. Effect of rootstocks and harvesting time on the nutritional quality of peel and flesh of peach fruits[J]. Food Chemistry, 2008, 110(2): 361-367. DOI:10.1016/j.foodchem.2008.02.011.
[25] 宋松. 无纺布果袋调控水蜜桃果实色泽发育的研究[D]. 杭州: 浙江大学, 2013.
[26] BRANDI F, BAR E, MOURGUES F, et al. Study of ‘Redhaven' peach and its white-fleshed mutant suggests a key role of CCD4 carotenoid dioxygenase in carotenoid and norisoprenoid volatile metabolism[J]. BMC Plant Biology, 2011, 11(1): 24. DOI:10.1186/1471-2229-11-24.
[27] MONTERO-PRADO P, BENTAYEB K, NERÍN C. Pattern recognition of peach cultivars (Prunus persica L.) from their volatile components[J]. Food Chemistry, 2013, 138(1): 724-731. DOI:10.1016/ j.foodchem.2013.10.145.
Effects of Bagging at Different Stages on Volatiles and Color of “Ruiguang No.19” Nectarine Fruits
GUO Donghua, BAI Hong, SHI Pei, YANG Yanqing , LI Gaochao, FAN Chonghui*
(College of Horticulture, Northwest A&F University, Yangling 712100, China)
Abstract:An experiment was performed to investigate the effects of 3 bagging stages on fruit flavor quality of “Ruiguang No.19” nectarine the major cultivar grown in Guanzhong region of Shaanxi province with the non-bagged samples as the control. Solid phase microextraction-gas chromatography-mass spectrometry (SPME-GC-MS) was used to analyze volatiles of nectarine fruits. A total of 83 volatile compounds were detected, and the total content of characteristic aroma volatile compounds in bagged fruits at different days after full blossom was in the decreasing order: control > bagging at 40 days > 45 days > 50 days. Compared with control, the bagged fruits increased the relative content of alcohols, but decreased the contents of aldehydes, esters and ketones. Three lactones and 2 terpenes were detected as characteristic aroma compoundsand linalool contenthad a significant correlation with γ-decalactone content. In addition, bagging mainly affected the aroma componects and color of “Ruiguang No.19” fruit. An earlier bagging time was better for the peel coloration of fruits. Bagging at 40 days after full blossom showed good peel coloration, strong fruit aroma and the best overall quality.
Key words:nectarine; bagged time; volatiles; solid phase microextraction (SPME); gas chromatography-mass spectrometry(GC-MS); color
DOI:10.7506/spkx1002-6630-201608044
中图分类号:S662.1
文献标志码:A
文章编号:1002-6630(2016)08-0242-06
收稿日期:2015-07-29
基金项目:“十二五”国家科技支撑计划项目(2014BAD16B04);陕西省科技统筹创新工程计划项目(2015KTCL02-29)
作者简介:郭东花(1987-),女,硕士研究生,研究方向为果树生理与生态。E-mail:1990648381@qq.com
*通信作者:范崇辉(1956-),男,教授,本科,研究方向为果树生理与栽培。E-mail:apple19561019@163.com
引文格式: