朱建鹏
1,吕毅斌
2,殷军艺
1,舒 枝
2,王小银
1,聂少平
1,谢明勇
1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江中药业股份有限公司,江西 南昌 330096)
摘 要:目的:研究健胃消食片原材料 浸膏中多糖的理化性质及其胃排空功能。方法:采用水提醇沉法从健胃消食片浸膏中提取多糖JXP(得率5.44%),通过比色法测定多糖化学成分,高效凝胶渗透色谱检测多糖纯度和相对分子质量,离子交换色谱分析单糖组成,以及利用红外光谱表征多糖红外特征,并进一步通过体内动物实验研究多糖对小鼠胃排空功能的影响。结果:健胃消食片原材料浸膏中多糖的中性糖含量为46.6%,糖醛酸含量为45.7%,蛋白质含量为1.3%。高效凝胶渗透色谱结果显示健胃消食片原材料浸膏中多糖相对分子质量集中在380 000左右。JXP主要由葡萄糖和半乳糖醛酸组成,两者物质的量比为1.2∶1,另含少量阿拉伯糖、半乳糖、甘露糖和木糖。红外光谱图显示JXP含有羧基基团,为吡喃糖构型酸性多糖。胃排空实验发现健胃消食片原材料浸膏中多糖能显著促进小鼠胃排空,特别是当多糖作用剂量为100 mg/kg(以小鼠体质量计)时,效果最为明显。结论:健胃消食片原材料浸膏中多糖为酸性混合杂多糖,其对小鼠胃排空功能具有促进作用。
关键词:健胃消食片;多糖;理化性质;胃排空
多糖作为生命活动的四大基本物质之一 [1],在生物体生命活动中扮演着重要角色,多糖由单糖经糖苷键聚合而成,分子质量较大,由几百至几万个单糖构成,是高分子化合物,依据来源不同,多糖可分为植物多糖、动物多糖和微生物多糖。现今,已有几百种多糖从天然产物中分离出来,研究发现山药多糖 [2]、黑木耳多糖 [3]、冬虫夏草多糖 [4]及茶叶多糖 [5]等都具有良好的生物活性。许多活性多糖组分具有良好的胃肠道调节功能,如交叉菜属多糖能抑制结肠炎 [6],海藻硫酸化多糖能抑制非甾体抗炎药引起的胃肠道损伤 [7],党参多糖有提高小肠动力、促进胃液分泌、增加胃黏膜和胃壁的厚度,促进微型肠道绒毛增长等作用 [8]。
2010年《中华人民共和国药典》 [9]收载了健胃消食片,其主要成分为太子参、陈皮、山药、麦芽(炒)、山楂5 味中药材。健胃消食片为治疗胃肠道消化障碍功能的常用药,能健脾消食,治疗脾胃虚弱、消化不良等症 [10]。健胃消食片具有增强胃动力、改善胃分泌功能、提高胃蛋白酶活性、提高免疫力等作用 [11]。虽然现有报道说明健胃消食片中的挥发油 [12]、解脂酶 [13]和橙皮苷 [14]等成分起到了健胃消食的作用,但是其中富含的复合多糖组分是否也起到重要作用,目前尚未报道。因此,利用中药药理学方法对健胃消食片原材料浸膏中多糖对胃肠道作用进行研究,可以更好地阐明健胃消食片发挥功效的物质基础,具有良好的科学研究意义。
1.1 动物、材料与试剂
昆明小鼠,体质量(20.0±2.0) g,雌雄各半,由南昌大学实验动物科学部提供。
健胃消食片原材料浸膏由江中集团提供;多潘立酮购于湖南千金湘江药业股份有限公司。
岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、果糖、半乳糖醛酸、Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500、蓝色葡聚糖、葡萄糖醛酸标准品(纯度≥99.4%) 美国Sigma公司;透析袋(截留相对分子质量3 500) 国药集团化学试剂有限公司;考马斯亮蓝G-250(进口分装) 美国Fluke公司;牛血清白蛋白(生化试剂) 美国Amresco公司;95%食用级乙醇、氯仿、正丁醇、苯酚、醋酸钠、硝酸钠、叠氮钠、浓硫、氢氧化钠和碳酸氢钠等均为国产分析纯。
1.2 仪器与设备
TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;Agilent 1260高效液相色谱仪 美国安捷伦公司;Dionex ICS-5000 DC离子交换色谱仪、Nicolet 5700傅里叶红外光谱仪 美国Thermo公司;HH-4数显恒温水浴锅 常州市华普达数学仪器有限公司;N-1100型旋转蒸发仪 上海爱朗仪器有限公司;ANKE TDL-5-A离心机 上海安亭分析仪器有限责任公司;ALPHA 1-2 LD冷冻干燥机 德国Martin Christ公司;PHS-3B紧密pH计 上海雷磁仪器厂;Milli-Q超纯水仪 美国Millipore公司;AL 104电子天平 梅特勒-托利多仪器(上海)有限公司;TWCL-G磁力搅拌器北京瑞成伟业仪器设备有限公司。
1.3 方法
1.3.1 健胃消食片原材料浸膏中多糖的制备及得率分析取健胃消食片原材料浸膏适量,加入蒸馏水配成
25 mg/mL的浸膏液,醇沉收集多糖沉淀,用Sevag法(氯仿-正丁醇体积比为4∶1)脱蛋白(多糖溶液与Sevag试剂体积比为4∶1),反复脱除至无明显蛋白层,离心收集多糖溶液,透析冻干得到多糖制品,记为JXP。根据下式计算多糖得率。
1.3.2 多糖化学成分分析
以葡萄糖为标准品,采用苯酚-硫酸法测定多糖中的中性糖含量 [15];以牛血清白蛋白为标准品,采用考马斯亮蓝法测定多糖中的蛋白质含量 [16];以半乳糖醛酸为标准品,采用硫酸-咔唑法测定多糖中的糖醛酸含量 [17]。
1.3.3 多糖纯度及相对分子质量分析
取健胃消食片原材料浸膏中多糖,配制成2 mg/mL多糖溶液,采用高效凝胶渗透色谱对其纯度进行鉴定 [18]。以葡萄糖、Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500、蓝色葡聚糖为标准品,得到不同保留时间对相对分子质量的标准曲线 [19]。
色谱条件:色谱柱Ultrahydrogel TMLinear Column(7.8 mm×300 mm,10 μm);柱温35 ℃;流动相为0.1 mol/L NaNO 3溶液(添加0.02% NaN 3);流速0.6 mL/min;进样量20 μL。采用G1362A示差检测器进行检测,示差检测器温度35 ℃;ChemStation色谱工作站采集分析数据。
1.3.4 多糖的单糖组成分析
多糖水解:称取10 mg样品,在冰浴中加入1 mL 12 mol/L的浓硫酸,冰浴中磁力搅拌30 min,加入5 mL蒸馏水,90 ℃油浴2 h,用蒸馏水稀释至100 mL定容,得到多糖水解母液 [20]。
标准曲线的绘制:称取岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、果糖、半乳糖醛酸和葡萄糖醛酸共11 种单糖约10 mg,制备单一标准品和混合标准品母液。利用单糖单一标准品进行定性,单糖混合标准品母液稀释成不同浓度梯度进样,得到不同单糖的标准曲线,进行定量测定。
离子色谱工作条件 [21]:Dionex ICS-500离子交换色谱系统,脉冲安培检测器,色谱柱为CarboPac TMPA20;流动相为A液(250 mmol/L NaOH溶液)、B液(H 2O)和C液(1 mol/L醋酸钠)3 种;柱温30 ℃;流速0.5 mL/min;进样量10 μL;Chromeleon色谱工作站采集处理数据;表1为梯度洗脱程序。
表1 离子交换色谱梯度洗脱程序
Table 1 Elution conditions for ion exchange chromatography (IEC)
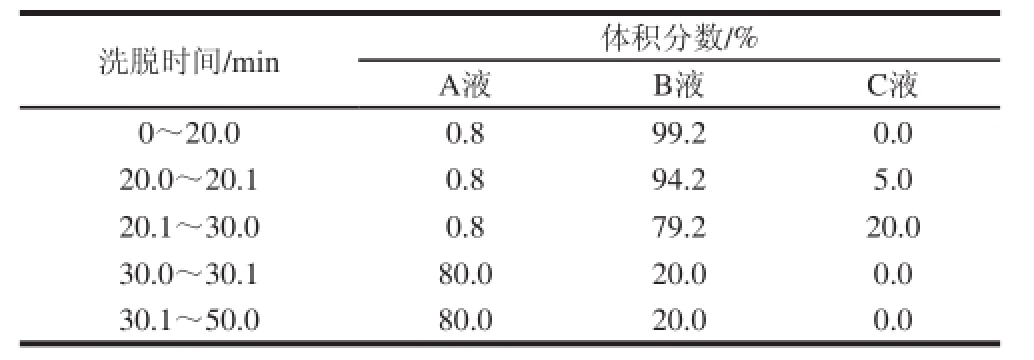
洗脱时间/min体积分数/% A液B液C液0~20.00.899.20.0 20.0~20.10.894.25.0 20.1~30.00.879.220.0 30.0~30.180.020.00.0 30.1~50.080.020.00.0
1.3.5 多糖红外光谱扫描
取干燥的多糖样品1 mg,KBr法压片,用Nicolet 5700傅里叶红外光谱仪在4 000~400 cm –1范围内进行扫描 [22]。
1.3.6 健胃消食片原材料浸膏中多糖对正常小鼠胃排空功能的影响
取昆明小鼠72 只,体质量(20.0±2.0) g,雌雄各半,随机分成6 组:空白对照组、浸膏组(500 mg/kg)、多潘立酮组(20 mg/kg)、健胃消食片原材料浸膏中多糖低(50 mg/kg)、中(100 mg/kg)、高(200 mg/kg)剂量组(简称多糖低、中、高剂量组)。实验前称量小鼠体质量,非空白对照组以0.1 mL/10 g(以小鼠体质量计,下同)的剂量给药,空白对照组给予等体积生理盐水,每日一次,连续7 d。第7天禁食不禁水12 h,称小鼠体质量,给药2 h后灌胃0.001 g/mL甲基橙溶液0.2 mL,眼球取血,15 min后将小鼠脱臼处死,剖腹取胃,置于烧杯中,加入10 mL蒸馏水,用手术剪沿胃大弯剪开,将胃内容物洗于蒸馏水中,用0.05 g/mL NaHCO 3调节溶液pH 6.0~6.5,5 000 r/min离心10 min,取上清液在420 nm波长处比色,测定吸光度(A 420 nm)。取0.2 mL 0.001 g/mL的甲基橙溶液,用蒸馏水定容至10 mL,摇匀后测定A 420 nm,作为基数甲基橙吸光度 [23]。按下式计算小鼠胃排空率。
式中:A 1为基数甲基橙吸光度;A 2为胃中残留物甲基橙吸光度。
1.4 数据统计分析
采用SPSS 19.0软件对实验数据进行方差齐性和正态检验,通过单因素方差分析进行数据差异显著性分析。
2.1 健胃消食片原材料浸膏中多糖化学成分分析
采用水提醇沉法从250 g健胃消食片原材料浸膏中提取多糖,经过脱蛋白质、透析等步骤得到13.6 g多糖,即多糖JXP得率为5.44%。通过比色法得到健胃消食片原材料浸膏中多糖JXP的中性糖、糖醛酸和蛋白质质量分数分别为(46.6±1.6)%、(45.7±7.7)%、(1.3±0.0)%,其中糖醛酸含量和中性糖含量相当,总糖含量较高,蛋白质含量较低,可能是由于浸膏粉为水提物喷雾干燥而成,复溶浸膏过程中除去了一部分蛋白质所致。
2.2 多糖纯度及相对分子质量分析

图1 健胃消食片原材料浸膏中多糖高效凝胶渗透色谱图
Fig. 1 HPGPC chromatogram of polysaccharide in raw materials from JXP
图1 为健胃消食片原材料浸膏中多糖的高效凝胶渗透色谱图,多糖相对分子质量分布较为集中,有一峰面积较大的主峰,由保留时间和高效凝胶渗透色谱标准曲线得到主峰相对分子质量在380 000左右。
2.3 多糖的单糖组成分析
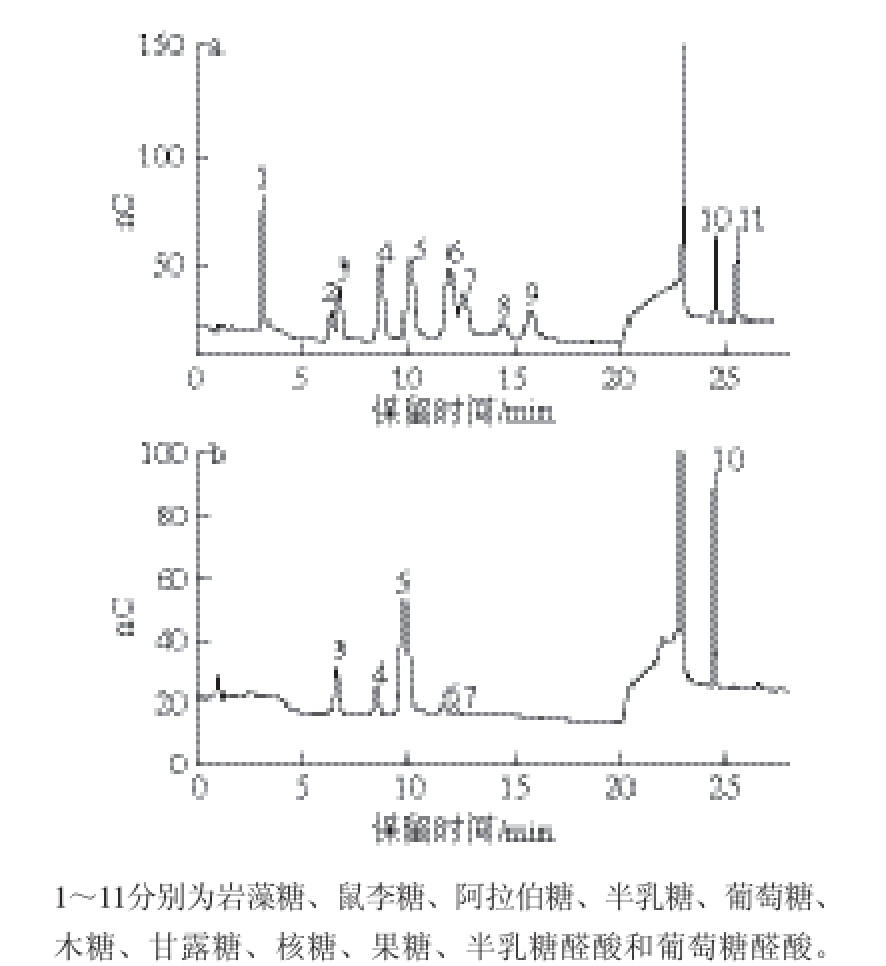
图2 单糖混合标准品(a)及健胃消食片原材料浸膏中多糖(b)的离子色谱图
Fig. 2 IEC chromatogram of mixed monosaccharide standards (a) and JXP (b)
图2a为11 种单糖混标的离子色谱图,各单糖之间的分离度相对较好。利用梯度浓度进样,结合峰面积得到各个单糖的标准曲线方程,其中葡萄糖和半乳糖醛酸的标准曲线回归方程分别为y=1.863 3x+0.307 0(R 2=0.999)和y=0.805 4x+0.051 2(R 2=0.999)。由图2b可知,健胃消食片原材料浸膏中的多糖为杂多糖,主要由葡萄糖和半乳糖醛酸组成,另含少量阿拉伯糖、半乳糖、甘露糖和木糖,其定量结果见表2,其中半乳糖醛酸和葡萄糖物质的量比约为1.2∶1。
表2 健胃消食片来源多糖单糖含量分析
Table 2 Monosaccharide composition of JXP
糖葡萄糖半乳糖醛酸半乳糖甘露糖木糖0.223.2±0.325.7±1.94.8±0.02.2±0.81.2±0.2
2.4 多糖红外光谱分析
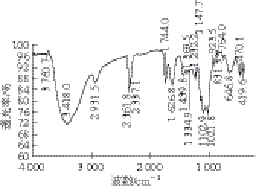
图3 健胃消食片原材料浸膏中多糖红外光谱图Fig. 3 Infrared spectrum of JXP
图3 为健胃消食片原材料浸膏中多糖的红外吸收光谱,其光谱特征如下:3 418.0 cm –1处的吸收峰为糖类O—H的伸缩振动,2 931.5 cm –1为甲基或亚甲基C—H的伸缩振动,1 400~1 200 cm –1是糖类的C—H的变角振动,以上3 个特征峰说明所提取的物质为多糖;1 744.0 cm –1处的吸收峰说明含羧基基团,1 626.8 cm –1处的吸收峰说明含—NH 2,1 439.8 cm –1为N—H的变角振动,这说明有蛋白质的存在;1 200~950 cm –1为吡喃环的吸收峰 [24]。
2.5 健胃消食片原材料浸膏中多糖的胃排空功能
表3 健胃消食片原材料浸膏中多糖的胃排空功能
Table 3 Gastric emptying activity of JXP

注:*. 与空白对照组比较,差异显著(P<0.05);**. 与空白对照组比较,差异极显著(P<0.01);∆. 与浸膏组比较,差异显著(P<0.05);#. 与多潘立酮组比较,差异极显著(P<0.01)。
kg)胃排空率/%给药后体质量/g 67.68±7.3828.84±2.87 74.94±7.59*29.02±2.51多糖中剂量组10083.71±6.42** ∆#28.88±3.15多糖低剂量组5074.33±9.40*29.26±2.56浸膏组50075.24±3.21*28.69±2.48多潘立酮组2074.18±7.55*29.70±2.15
由表3可知,与空白对照组比,健胃消食片原材料浸膏、多潘立酮、健胃消食片原材料浸膏中多糖能明显促进小鼠胃排空(P<0.05或P<0.01),其中当健胃消食片原材料浸膏中多糖给药剂量为100 mg/kg时,能极显著促进小鼠胃排空(P<0.01)。此外,中剂量多糖促进小鼠胃排空的功能明显强于浸膏组(P<0.05),同时还极显著强于多潘立酮组(P<0.01)。由前文结果可知,健胃消食片原材料浸膏中多糖得率为5.44%,且组分以多糖为主,可知500 mg/kg的浸膏中含有多糖27.2 mg/kg,但其对小鼠胃排空功能的促进作用略强于50 mg/kg的多糖,由此可知多糖作为健胃消食片浸膏的活性组分之一,和浸膏的其他活性组分共发挥同作用,促进小鼠胃排空。
健胃消食片原材料浸膏由陈皮、山药、麦芽(炒)、山楂4 味中药材组成,成分复杂。先前有诸多学者对各原料的多糖进行了单独研究,如赵秀玲 [25]将陈皮多糖分离为了PSM、PSE、PST、PSF 4 种组分,进一步研究发现4 种组分主要由Glu、Gal、Ara和Rha 4 种单糖组成。王刚等 [26]纯化山药多糖得两种均一多糖S 1和S 2,组成均为葡萄糖,相对分子质量分别为62 000和7 300。大麦芽粗多糖经DEAE-Cellulose柱分离纯化得到中性多糖和酸性多糖 [27]。李艳红 [28]和Steve [29]等分离纯化山楂多糖的到3 个级分HFP-Ⅰ、HFP-Ⅱ、HFP-Ⅲ,红外光谱分析发现HFP-Ⅱ的构型可能是α,β-D吡喃型多糖。本研究结果显示,健胃消食片原材料浸膏中多糖的糖醛酸含量较高,蛋白质含量较低,均一性较好,为β-吡喃糖构型,主要由葡萄糖和半乳糖醛酸构成,有一定依据可循。同时傅紫琴等 [30]通过观察发现,山药多糖对小鼠胃排空也有促进作用,与本研究的结果一致。但是本研究所得多糖组分来自于混合原料,其组成较为复杂,关于多糖类型以及各组分多糖的功能作用和混合组分的功能作用之间存在怎样的联系和区别,还需要后续进一步详细、系统性地研究。
参考文献:
[1] LOWE J B, MARTH J D. A genetic approach to mammalian glycan function[J]. Annual Review of Biochemistry, 2003, 72(1): 643-691. DOI:10.1146/annurev.biochem.72.121801.161809.
[2] YU Jiang, ZHOU Mengneng, LU Qiuju. Effects of yam polysaccharides on P-selectin expression and macrophage infi ltration in diabetic nephropathy model rats[J]. Clinical and Experimental Medical Sciences, 2015, 3(1): 11-21. DOI:10.12988/cems.2015.521.
[3] ZHAO Shuang, RONG Chengbo, LIU Yu, et al. Extraction of a soluble polysaccharide from Auricularia polytricha and evaluation of its anti-hypercholesterolemic effect in rats[J]. Carbohydrate Polymers, 2015, 122: 39-45. DOI:10.1016/j.carbpol.2014.12.041.
[4] LEE J S, KWON D S, LEE K R, et al. Mechanism of macrophage activation induced by polysaccharide from Cordyceps militaris culture broth[J]. Carbohydrate Polymers, 2015, 120: 29-37. DOI:10.1016/ j.carbpol.2014.11.059.
[5] NIE Shaoping, XIE Mingyong. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids, 2011, 25(2): 144-149. DOI:10.1016/j.foodhyd.2010.04.010.
[6] KALITNIK A A, MARCOV P A, ANASTYUK S D, et al. Gelling polysaccharide from Chondrus armatus and its oligosaccharides: the structural peculiarities and anti-infl ammatory activity[J]. Carbohydrate Polymers, 2015, 115: 768-775. DOI:10.1016/j.carbpol.2014.04.070.
[7] SILVA R O, SANTANA A P M, CARVALHO N S, et al. A sulfatedpolysaccharide fraction from seaweed Gracilaria birdiae prevents naproxen-induced gastrointestinal damage in rats[J]. Marine Drugs, 2012, 10(12): 2618-2633. DOI:10.3390/md10122618.
[8] MA Fangli, SHEN Xuemei, SHI Jun, et al. The efficacy trials and researches of Codonopsis colysaccharide on improving digestive functions[J]. Medicinal Plant, 2013, 4(11/12): 43-47.
[9] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010: 56-59.
[10] 万俊, 包志丹, 王向烨, 等. 健胃消食口服液治疗小儿功能性消化不良的临床观察[J]. 实用临床医药杂志, 2012, 16(1): 94-96. DOI:10.3969/j.issn.1672-2353.2012.01.032.
[11] 金鑫, 刘鸿雁, 周建平. 健脾消食丸药效学研究[J]. 中成药, 2004, 26(1): 43-45. DOI:10.3969/j.issn.1001-1528.2004.01.015.
[12] 王赛君, 伍振峰, 杨明, 等. 挥发油在中成药数据库中的应用特点与现状分析[J]. 中国中药杂志, 2014, 39(17): 3379-3383. DOI:10.4268/ cjcmm20141735.
[13] 黎海彬, 方昆阳, 吕翠婷, 等. 决明子, 山楂提取物不同配比降血脂作用的研究[J]. 中药材, 2007, 30(5): 573-575. DOI:10.3321/ j.issn:1001-4454.2007.05.027.
[14] 林佑. 陈皮对消化系统作用研究进展[J]. 中医学, 2012(1): 37-40.
[15] 贾东升, 温春秀, 赵江丽, 等. 固体制剂中多糖含量测定的样品预处理方法研究[J]. 药物分析杂志, 2015, 35(3): 409-413.
[16] 栾晓红, 赵峡, 王清池. 缢蛏多糖的提取, 分离和结构分析[J]. 中国海洋药物, 2015, 34(2): 23-28.
[17] 李蓉, 孙书娟, 江晓路. 虫草多糖的分离纯化及结构鉴定[J]. 中国药师, 2015(3): 407-409. DOI:10.3969/j.issn.1008-049X.2015.03.016.
[18] 李志平, 张弛, 周维清, 等. 巢湖蓝藻酸性多糖的理化性质及其体外抗氧化作用[J]. 食品科学, 2015, 36(5): 7-12. DOI:10.7506/spkx1002-6630-201505002.
[19] 史文涛, 庞文生, 胡娟. 高效凝胶色谱法测定太子参均一多糖分子量[J]. 中国民族民间医药杂志, 2015, 24(2): 20; 30.
[20] 董兰芳, 张琴, 许明珠. 方格星虫多糖的分离纯化及单糖组成[J].食品科学, 2015, 36(1): 109-112. DOI:10.7506/spkx1002-6630-201501021.
[21] 静李, 仁勇李, 立娜梁. 毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成[J]. 分析化学, 2015, 40(9): 1415-1420. DOI:10.3724/ SP.J.1096.2012.20061.
[22] 李志平, 张弛, 周维清, 等. 巢湖蓝藻酸性多糖的理化性质及其体外抗氧化作用[J]. 食品科学, 2015, 36(5): 7-12. DOI:10.7506/spkx1002-6630-201505002.
[23] 陈奇. 中药药理研究方法学[M]. 北京: 人民卫生出版社, 2006: 861-862. [24] 韦革宏, 李素俭. 根瘤菌菌体及胞外多糖红外光谱特征[J]. 应用与环境生物学报, 1999, 5(3): 310-314. DOI:10.3321/j.issn:1006-687X.1999.03.016.
[25] 赵秀玲. 陈皮生理活性成分研究进展[J]. 食品工业科技, 2013, 34(12): 376-381.
[26] 王刚, 杜士明, 肖淼生, 等. 山药多糖的提取分离及山药总多糖的含量测定[J]. 中国医院药学杂志, 2007, 27(10): 1414-1416. DOI:10.3321/j.issn:1001-5213.2007.10.028.
[27] 杨延超, 徐德平. 大麦芽多糖的降血糖活性及结构解析[J]. 食品与生物技术学报, 2012, 31(10): 1087-1092. DOI:10.3969/ j.issn.1673-1689.2012.10.013.
[28] 李艳红. 山楂多糖的提取, 分离纯化及结构研究[D]. 太原: 山西大学, 2006: 74-82.
[29] STEVE W C, WANG Q I. Cell wall polysaccharides in cereals: chemical structures and functional properties[J]. Structural Chemistry, 2009, 20(2): 291-297. DOI:10.1007/s11224-009-9441-0.
[30] 傅紫琴, 蔡宝昌, 卞长霞, 等. 山药及其麸炒品的多糖成分对脾虚小鼠胃肠功能的影响[J]. 药学与临床研究, 2008, 16(3): 181-183. DOI:10.3969/j.issn.1673-7806.2008.03.006.
Physicochemical Properties of Polysaccharide from the Extract of Raw Materials for Jianwei Xiaoshi Pills Preparation and Its Gastric Emptying Activity
ZHU Jianpeng
1, LÜ Yibin
2, YIN Junyi
1, SHU Zhi
2, WANG Xiaoyin
1, NIE Shaoping
1, XIE Mingyong
1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. Jiangzhong Pharmaceutical Co. Ltd., Nanchang 330096, China)
Abstract:Objective: To explore the physicochemical properties of the polysaccharide extracted from raw materials used to produce Jianwei Xiaoshi pills (named as JXP), and its effect on gastric emptying activity. Methods: JXP was obtained from Jianwei Xiaoshi pills extract by water extraction and alcohol precipitation with a yield of 5.44%. Chemical composition, purity and relative molecular weight and monosaccharide composition of JXP were determined by colorimetric method, HPGPC and ion exchange chromatography (IEC), respectively. JXP was also characterized by infrared spectroscopy. Then, the effect of JXP on gastric emptying in mice was analyzed. Results: JXP contained 46.6% neutral polysaccharides, 45.7% acidic polysaccharides and 1.3% protein. HPGPC analysis showed that JXP was homogeneous, and its relative molecular weight ranged at around 380 000. Glucose and galacturonic acid were the major monosaccharides in JXP with a molar ratio of 1.2:1. It also contained a small amount of arabinose, galactose, mannose and xylose. Carboxyl groups were contained in the confi guration of acidic pyranose. JXP could signifi cantly promote gastric emptying in mice, especially at a dose of 100 mg/kg body weight. Conclusion: JXP contains mixed acidic heteropolysaccharides, which can promote gastric emptying.
Key words:Jianwei Xiaoshi pills; polysaccharide; physicochemical properties; gastric emptying
DOI:10.7506/spkx1002-6630-201611007
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)11-0037-05
引文格式:
朱建鹏, 吕毅斌, 殷军艺, 等. 健胃消食片原材料浸膏中多糖的理化性质及其胃排空功能[J]. 食品科学, 2016, 37(11): 37-41. DOI:10.7506/spkx1002-6630-201611007. http://www.spkx.net.cn ZHU Jianpeng, LÜ Yibin, YIN Junyi, et al. Physicochemical properties of polysaccharide from the extract of raw materials for Jianwei Xiaoshi pills preparation and its gastric emptying activity[J]. Food Science, 2016, 37(11): 37-41. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611007. http://www.spkx.net.cn
收稿日期:2015-06-30
基金项目:“十二五”国家科技支撑计划项目(2012BAD33B06);食品科学与技术国家重点实验室目标导向项目(SKLF-ZZA-201301);教育部“新世纪优秀人才支持计划”项目(NCET-12-0749)
作者简介:朱建鹏(1990—),男,硕士研究生,研究方向为食品科学与工程。E-mail:18166032940@163.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学,食品营养与安全。E-mail:myxie@ncu.edu.cn