蔡 俊
1,陈季旺
1,2,*,王 茹
1,丁文平
1,2,吴永宁
1,3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023;3.国家食品安全风 险评估中心,北京 100021)
摘 要:为确定适用于多肽体外抗氧化活性的测定方法,以丁基羟基茴香醚(butyl hydroxylanisole,BHA)、VC和生育酚(vitamin E,VE)为对照,测定大豆肽的还原能力、螯合Fe 2+能力、清除2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基及抑制脂质体氧化的活性。结果显示:在质量浓度为0~30 mg/mL时,大豆肽还原能力随质量浓度的增加而增强,与BHA、VE、VC类似,大豆肽最大还原能力仅为0.487。大豆肽抑制脂质体氧化的活性弱于BHA和VE,但具有较稳定的增加趋势,最大抑制率达到20.6%;在质量浓度为0~15 mg/mL时,大豆肽螯合Fe 2+能力随质量浓度的增加而增强,最大螯合率为38.7%。然而,未检测出BHA、VE、VC具有螯合Fe 2+的能力;在质量浓度为0~3.0 mg/mL时,大豆肽清除ABTS +·活性与 VC基本相同,大于BHA和VE,ABTS +·清除率最大为61.2%。大豆肽DPPH自由基清除率最大仅为2.1%,清除DPPH自由基活性远低于VC(45.0%)、BHA(10.1%)和VE(10.7%),表明螯合Fe 2+能力、清除ABTS +·及抑制脂质体氧化活性的测定方法适合用于评价大豆肽体外抗氧化活性。
关键词:多肽;体外抗氧化活性;测定方法;适用性
蔡俊, 陈季旺, 王茹, 等. 多肽体外抗氧化活性测定方法的比较[J]. 食品科学, 2016, 37(11): 52-57. DOI:10.7506/ spkx1002-6630-201611010. http://www.spkx.net.cn
CAI Jun, CHEN Jiwang, WANG Ru, et al. Comparison of various methods for measuring antioxidant activities of polypeptide in vitro[J]. Food Science, 2016, 37(11): 52-57. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611010. http://www.spkx.net.cn
随着食品工业的快速发展,为了保证食品独特的色、香、味等食用品质,抗氧化剂已广泛应用于食品工业。由于食品种类繁多、生产工艺不同、成品保存方式多样化等均会影响食品氧化变质,因此对适用于不同食品加工环境的抗氧化剂种类和品质有了更高要求。同时,食品安全问题的产生及绿色健康的意识逐渐形成,使人们开始减少人工合成抗氧化剂的应用,逐渐转向安全无毒副作用的天然抗氧化剂,包括动植物蛋白水解的多肽类等,这类抗氧化物质具有活性强、安全性高、无毒副作用等特点。
已报道的多种应用于抗氧化肽体外抗氧化活性的测定方法,例如硫代巴比妥酸(thiobarbituric acid, TBA)法 [1]、油脂过氧化值(peroxide value of fat,POV)测定方法 [2]反映多肽抑制脂质氧化的能力,电子自旋共振捕集法(electron spin resonance,ESR)、化学发光法 [3]、邻苯三酚法 [4]、抗氧化能力指数(oxygen radical absorbance capacity,ORAC) [5]等反映多肽清除氧自由基的能力,邻二氮菲法、水杨酸法 [6]、比色法 [3]等反映多肽清除羟自由基的能力,清除2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azino-bis (3-ethylbenzothiazoline -6-sulfonic acid) diammonium salt,ABTS)自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基 [7]反映多肽清除自由基的能力,铁离子还原/抗氧化能力(ferric reducing/ antioxidant power,FRAP)法 [8]、铁氰化钾法 [9]测定多肽的还原能力,菲啰嗪(Ferrozine)法 [10]测定多肽螯合Fe 2+的能力,邻苯二酚紫 [11]测定多肽螯合Cu 2+能力等。但具体实验中不同的方法测定多肽抗氧化活性的结果差别较大,所得结论甚至相反,对后续研究人员造成困扰。目前的研究大多直接沿用上述方法评价多肽的体外抗氧化活性,少有其适用性及适用原因的探讨。
本实验采用还原能力、螯合Fe 2+能力、清除ABTS +·、DPPH自由基及抑制大豆卵磷脂氧化活性5种常用的方法测定大豆肽的体外抗氧化活性,明确适用于大豆肽体外抗氧化活性的评价方法并探讨适用原因,以期为抗氧化活性肽的研发提供技术支撑。
1.1 材料与试剂
大豆肽粉(以干基计,蛋白质含量90.0%、肽含量80%、灰分6.5%、粗脂肪1%) 中食都庆(山东)生物技术有限公司;丁基羟基茴香醚(butyl hydroxylanisole,BHA)(纯度99.9%) 郑州瑞佳食品添加剂有限公司;VC(纯度99.9%) 河南盛之德商贸有限公司;VE(纯度98%)、大豆卵磷脂(纯度99.9%) 西亚试剂有限责任公司;ABTS、Ferrozine、DPPH Sigma-Aldrich(上海)贸易有限公司;铁氰化钾、磷酸氢二钠、磷酸二氢钠、三氯乙酸、六水合三氯化铁、无水乙醇、过硫酸钾、氯化亚铁、氯化铁、硫代巴比妥酸、盐酸、氯仿 国药集团化学试剂有限公司;其中盐酸为优级纯;其余均为分析纯。
1.2 仪器与设备
DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;TGL-16C高速离心机 上海安亭科学仪器厂;DF-101S集热式恒温加热磁力搅拌机 巩义市予华仪器有限责任公司;电子万用炉 北京市光明医疗仪器厂;XH-C漩涡混合器 金坛市医疗仪器厂;WF J7200型可见分光光度计 尤尼柯(上海)仪器有限公司;WHY-2(SHA-B)往返水浴恒温振荡器 金坛梅香仪器有限公司。
1.3 方法
1.3.1 多肽还原能力的测定
参照荣建华等 [12]方法进行测定。在比色管中依次添加1 mL样品(对照组用1 mL去离子水代替)、2.5 mL l g/100 mL的铁氰化钾和2.5 mL 0.2 mol/L pH 6.6的磷酸盐缓冲液,混匀后50 ℃保温20 min。快速冷却10 min后加入2.5 mL 10 g/100 mL的三氯乙酸(trichloroacetic,TCA),混匀后以4 000 r/min离心10 min。取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1 g/100 mL的FeCl 3溶液,混匀静置10 min,于700 nm波长处测定吸光度(A 700 nm)。
1.3.2 螯合Fe 2+能力的测定
参照Teheri等 [13]的方法并稍作修改。取0.5 mL样品,加入3.2 mL蒸馏水,然后加入0.1 mL 2 mmol/L的FeCl 2溶液混匀,静置3 min。加入0.2 mL 5 mmol/L的Ferrozine溶液混匀(以去离子水为空白组),反应10 min后,于562 nm波长处测定吸光度。每组平行测定3次,取平均值计算样品的清除率。按下式计算Fe 2+螯合率。
1.3.3 清除自由基活性
1.3.3.1 ABTS +·清除率的测定
参照胥莉等 [14]的方法并稍作修改。将7 mmol/L的ABTS溶液10 mL和7.35 mmol/L的K 2S 20 8溶液5 mL混合后在室温下避光放置12~16 h形成ABTS储备液,使用前用无水乙醇稀释成ABTS工作液,使其在734 nm波长处的吸光度为0.70±0.02。吸取50 μL样品与ABTS工作液3 mL混合均匀,室温反应10 min后,于734 nm波长处测定其吸光度(A 样品),空白组以水代替样品(A 空白)。按下式计算ABTS +·清除率。
1.3.3.2 DPPH自由基清除率的测定
参照Xie Zhengjun等 [10]的方法并稍作修改。在试管中加入50 μL样品和3 mL 50 μg/mL的 DPPH溶液(无水乙醇为溶剂),混匀后在室温条件下避光放置30 min。在517 nm波长处测吸光度,以蒸馏水为空白。按下式计算DPPH自由基清除率。
1.3.4 抑制脂质体氧化活性
1.3.4.1 脂质体制备
将大豆卵磷脂添加到10 mmol/L pH 7.4的磷酸缓冲液中,冰浴振荡直至完全溶解 [15],配制成质量浓度为15 mg/mL的脂质体。
1.3.4.2 硫代巴比妥酸反应物(thiobarbituric acidreactive substances,TBARS)的测定
参照吴瑕等 [1]的测定方法并稍作修改。1 mL样品溶液(对照用1 mL水代替1 mL样品溶液)与5 mL的脂质体溶液混合,脂质的氧化由铁的氧化还原反应引发,将0.1 mL浓度为50 mmol/L的FeCl 3和0.1 mL浓度为30 mmol/L的抗坏血酸加入脂质体氧化体系中。样品在37 ℃水浴中保温l h后,并迅速测定TBARS值。
取1 mL样品加入3 mL三氯乙酸-盐酸溶液(2.5 g TCA与0.6 mL 0.6 mol/L HCl混合后稀释到100 mL)、3 mL TBA溶液(0.02 mol/L),混匀后,沸水浴中反应30 min,冷却。取5 mL样品加入等体积的氯仿,3 000 r/min下离心30 min,532 nm波长处测定吸光度值。TBARS值以每升脂质氧化样品溶液中丙二醛的毫克数表示。
式中:A 532 nm为样品的吸光度值;V s为样品的体积(1 mL);9.48为常量,与硫代巴比妥酸反应物的稀释倍数和摩尔消光系数有关。
1.4 数据统计分析
采用软件Microsoft Offi ce Excel 97-2003作图及实验数据处理。
2.1 多肽还原能力
抗氧化剂的还原能力与抗氧化活性成正相关。根据还原能力的测定方法,在700 nm波长处测定的吸光度值越大,则抗氧化剂的还原能力越强 [12]。由图1可知,在0.05~0.30 mg/mL范围内,随质量浓度的增加,BHA、VC、VE的吸光度增大,还原能力增强,VC的增加幅度最大,其次是BHA,VE的增加幅度不明显,最大质量浓度时吸光度仅为0.153,远远低于相同质量浓度下的VC和BHA。0.05 mg/mL时,VC的还原能力是BHA的1.4 倍,随着质量浓度的增大,两者还原能力的差别越来越明显,0.30 mg/mL时,VC的还原能力是BHA的3.2倍,增加了1.8 倍。
在5~30 mg/mL的范围内,大豆肽的还原能力随质量浓度的增加而增大,增加程度与BHA相当。当吸光度约为0.5时,大豆肽、BHA和VC的质量浓度依次为30、0.20、0.1 mg/mL,大豆肽的质量浓度分别为BHA、VC的150、300 倍。由图1可知,大豆肽的还原能力约是VE的2~3 倍,但质量浓度是VE的100 倍,说明相同质量浓度时大豆肽的还原能力要远远低于VE、BHA和VC。

图1 大豆肽还原能力
Fig. 1 Reducing power of soybean peptide
VC的强还原能力可能与其分子结构中的二烯醇式结构和内酯环结构有关,该结构使得VC性质极为活泼,分子中的二烯醇基具有极强的还原性,易被氧化为二酮基,成为去氢VC [16]。BHA与VE较低的还原能力可能其自身或反应体系的极性有关。本实验为水溶液反应体系,使用的BHA与VE均为脂溶性抗氧化剂,导致混合后BHA或VE不能与铁氰化钾充分接触,使最终生成的显色物质浓度低,呈现较低的还原能力。大豆肽较低的还原能力可能与本身含有的或暴露出的含硫氨基酸、酸性氨基酸和疏水性氨基酸 [17]的数量太少有关。
因此,还原能力的测定方法不适合用于评价大豆肽的体外抗氧化能力。
2.2 多肽螯合Fe 2+能力
啡咯嗪是一种发色螯合剂,能强烈螯合Fe 2+,形成一种稳定的红色配合物,在562 nm波长处有强吸收,当有螯合试剂存在时,啡咯嗪螯合Fe 2+形成的配合物质量浓度下降,导致红色减退,通过测定颜色的减退可以估计共存的螫合剂螯合金属离子的能力 [18]。
表1 大豆肽螯合FFee
22+能力
Table 11 FFee
22+-chelating capacity of soybean peptidee

0.150.660±0.0050.681±0.0030.638±0.004 7.50.438±0.00331.6±1.0 0.200.682±0.0010.701±0.0060.646±0.00610.00.408±0.00236.2±0.9 0.250.691±0.0060.721±0.0040.641±0.00712.50.398±0.00437.8±1.1 0.300.715±0.0040.741±0.0020.637±0.00515.00.392±0.00138.7±0.6
由表1可知,测定BHA、VE螯合Fe 2+能力时,最低质量浓度(0.05 mg/mL)的吸光度分别为0.641、0.662,略大于未添加任何抗氧化剂的空白组的吸光度。然而,随着质量浓度的增大,两者吸光度未见降低反而越来越大。吸光度增加的原因可能是脂溶性抗氧化剂如BHA、VE与水溶液体系混合后导致整个反应体系变浑浊,该现象随质量浓度的增大而加剧,因此该方法不能用于BHA、VE的体外抗氧化活性测定。
在0.05~0.30 mg/mL的范围内,VC的吸光度变化不明显。低质量浓度处吸光度减小,说明VC具有微弱的螯合Fe 2+能力,质量浓度的增大并未增加该抗氧化能力,说明该方法不适合用于评价VC的体外抗氧化能力。
在质量浓度为2.5~15.0 mg/mL时,大豆肽呈现良好的螯合Fe 2+的能力。随着质量浓度的增大,螯合能力逐渐增强。当质量浓度达到10 mg/mL时,螯合率为36.2%,继续增加大豆肽质量浓度,其螯合Fe 2+能力较为稳定,最大为38.7%。大豆肽具有良好的螯合Fe 2+能力,其可能的原因有三点:一是大豆肽中含有组氨酸,组氨酸是金属结合氨基酸;二是大豆肽的侧链氨基酸具有能与螯合Fe 2+的COO -结构;三是大豆肽或其组成氨基酸具有—CH=N:结构,能螯合Fe 2+[19]。
因此,螯合Fe 2+离子能力的测定方法适合用于大豆肽的体外抗氧化活性测定。
2.3 多肽清除自由基能力
2.3.1 清除ABTS +·能力
ABTS +·清除法已广泛用于抗氧化剂的体外抗氧化活性的测定。在反应体系中,ABTS经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS +·,抗氧化剂与ABTS +·发生反应使反应体系褪色,在ABTS +·的特征吸收波长下(734 nm)检测吸光度的变化,能反映抗氧化剂清除ABTS +·能力的高低 [20]。
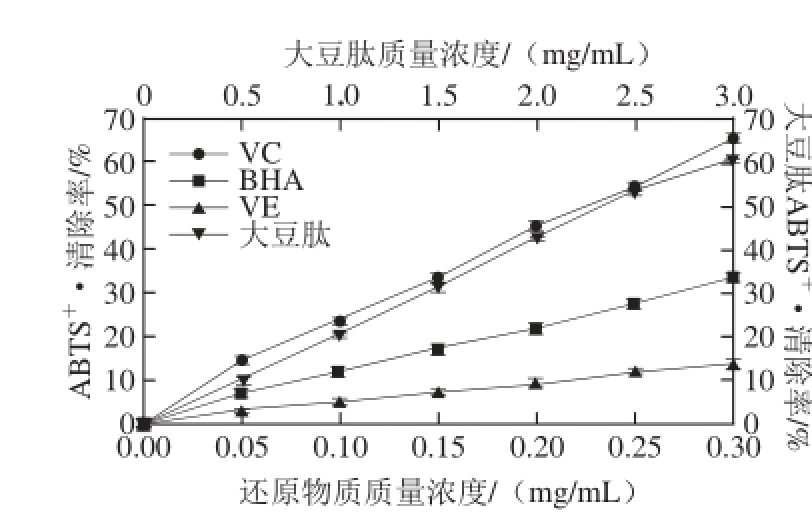
图2 大豆肽清除ABBTTSS
+·能力
Fig. 2 ABTS radical scavenging capacity of soybean peptide
由图2可知,质量浓度在0.05~0.30 mg/mL范围内,随着质量浓度的增加,3 种抗氧化剂对ABTS +·的清除率增大,并且BHA对ABTS +·的清除能力高于VE,VC的清除能力显著高于BHA。VC对ABTS +·的清除能力是BHA的1.9~2.2 倍,是VE的4.7 倍左右。质量浓度为0.5~3.0 mg/mL时,大豆肽清除ABTS +·的能力也随质量浓度的增加而增强,清除能力与VC相当。
大豆肽具有良好的清除ABTS +·能力是因为富含供氢体,具有提供氢质子的能力,可使具有高度氧化性的自由基还原,从而能终止自由基连锁反应,起到清除或抑制自由基的目的 [12]。大豆肽的抗氧化性可能与其氨基酸组成有关,许多氨基酸都表现出抗氧化性,例如胱氨酸、缬氨酸、亮氨酸、赖氨酸、组氨酸、精氨酸和色氨酸等 [21]。
2.3.2 清除DPPH自由基能力
DPPH自由基是一种稳定的以氮为中心的质子自由基,其乙醇溶液呈紫色,并在517 nm波长处有强烈吸收。在有自由基清除剂存在时,自由基清除剂提供一个电子与DPPH的孤对电子配对而使其褪色,褪色程度与其接受的电子成定量关系 [22]。
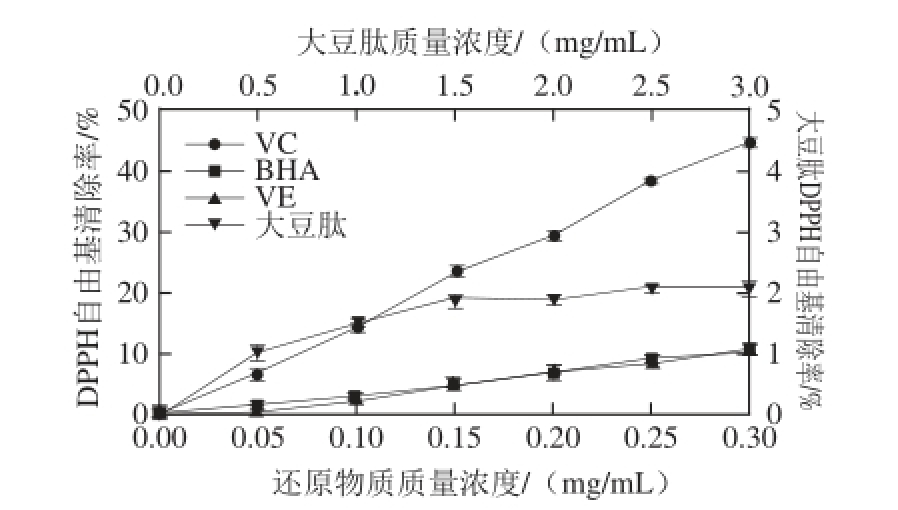
图3 大豆肽清除DPPPPHH 自由基能力
Fig. 3 DPPH radical scavenging capacity of soybean peptide
由图3可知,在0.05~0.30 mg/mL的范围内,随着质量浓度的增加,BHA、VE、VC清除DPPH自由基的活性增强,BHA、VE清除DPPH自由基活性的增加趋势几乎一致,但都小于VC。相同质量浓度时VC清除DPPH自由基的能力是BHA、VE的4.5 倍左右。在0.5~3.0 mg/mL的范围内,大豆肽清除DPPH自由基的能力极低,最大清除率仅为2.1%。
自由基均含有未配对电子,使DPPH自由基或ABTS +·具有强氧化性,VC对这2 种自由基较高的清除活性是因为其自身所具备极强的还原能力。VE对DPPH自由基或ABTS +·的清除能力与其他酚类抗氧剂类似,都是与活性较高的自由基ROO•相结合,形成稳定的化合物,起到链终止的作用 [23]。BHA是通过自身脱氢,与活性DPPH自由基或ABTS +·结合达到清除目的 [ 24]。
大豆肽对DPPH自由基和ABTS +·清除活性的差异可能原因:一是ABTS采用去离子水为溶剂配制储备液,以无水乙醇稀释成工作液,DPPH采用无水乙醇配制溶液,加入相同质量浓度、微量体积的大豆肽溶液时,大豆肽不能充分接触DPPH自由基,显示出较低的活性;二是大豆肽与DPPH自由基发生反应后,未参与反应的大豆肽和DPPH自由基及两者反应产生的产物留在各自溶液体系中,当溶剂量不足时,局部浓度过高引起的浑浊程度要比大豆肽与DPPH自由基作用产生的褪色程度高,使吸光度变大(50 μL 30 mg/mL的大豆肽与3 mL DPPH混合溶液的吸光值为0.716,空白组为0.673)。三是DPPH自由基是一种稳定的以N为中心的自由基,相对于DPPH自由基,活化后的ABTS +·更敏感 [25]。
因此,清除ABTS +·测定方法更适合评价大豆肽的体外抗氧化能力。
2.4 多肽抑制脂质氧化能力
TBARS法测定的是脂质氧化终产物之一的丙二醛(malondialdehyde,MDA)及其他可以与TBA反应的物质的质量浓度。在较低pH值(pH 3.0左右)和高温下,丙二醛等可以与TBA生成粉红色物质,该物质在532 nm波长处有特征吸收。吸光度越小,说明生成的丙二醛等物质的含量越少 [26]。

图4 大豆肽的TBARRSS值
Fig. 4 TBARS value of soybean peptide
由图4可知,添加了BHA和VE的脂质体具有明显的抑制脂质氧化的能力,并且随着质量浓度的增大,脂质体的吸光度值越来越小。添加了0.10 mg/mL BHA后脂质体的TBARS值为4.92 mg/L,与未添加任何抗氧化剂的脂质体TBARS值12.93 mg/L相比,抑制率达到了62.0%。继续增加BHA质量浓度,BHA抑制脂质氧化能力的增加趋势开始变缓,添加了0.30 mg/mL BHA后脂质体的TBARS值为3.55 mg/L,抑制率为72.5%。
添加了0.10 mg/mL VE后脂质体TBARS值为6.98 mg/L,与未添加任何抗氧化剂的脂质体TBARS值12.93 mg/L相比,抑制率达到了46.0%。继续增加VE的质量浓度,抑制脂质氧化能力的增加趋势也开始变缓,最终添加0.30 mg/mL VE后脂质体的TBARS值为4.98 mg/L,抑制率为61.5%。
低质量浓度的VC具有较低的抑制脂质氧化活性,然而,继续增大质量浓度,脂质体TBARS值开始增加,并且维持在12.58~13.21 mg/L,与未添加抗氧化剂的脂质体TBARS值12.93 mg/L几乎相同。
随着大豆肽质量浓度的增大,脂质体TBARS值减小,抗氧化能力增强,但与BHA相比,增幅较平缓。当大豆肽质量浓度从5 mg/mL增加到30 mg/mL时,脂质体的TBARS值由12.10 mg/L减少到10.30 mg/L,与未添加任何抗氧化剂的脂质体相比(TBARS值12.93 mg/L),抑制率分别为6.4%、20.6%,说明大豆肽具有较好的抑制脂质氧化的能力。
BHA通过化学键的断裂,释放出体积小、亲和力强的氢自由基,氢自由基可以迅速与脂类等化合物链式反应生成的自由基结合,生成稳定的化合物,从而终止脂类等的氧化还原反应,达到抑制脂质过氧化的目的 [24,27]。VE能将一个自由基中间体氧化成醌,将ROO·转变成化学性质不活泼的ROOH,中断脂类过氧化的连锁反应起到抗氧化的作用 [28]。
Minotti等 [29]认为Fe 2+被完全氧化为Fe 3+或Fe 3+被完全还原为Fe 2+均不能使脂质过氧化启动,因此,凡是能影响铁离子氧化还原过程的因素均会影响脂质过氧化的发生。本实验中,VC能引起铁离子氧化还原反应启动脂质的氧化,VC在脂质体系中不仅没有表现出对脂质的抗氧作用,反而引起脂质的加速氧化过程,使TBARS值升高,与实验后期结果相吻合。同时,低质量浓度下的VC表现出的抑制脂质过氧化的能力可能与其螯合Fe 2+有关,当Fe 2+被螯合,催化脂质氧化的Fe 3+减少,一定程度上能抑制脂质的过氧化。螯合Fe 2+实验结果显示低质量浓度VC具有螯合Fe 2+的能力。
大豆肽在脂质体系中的具有抑制脂质过氧化的能力可能有以下原因:一是与大豆肽含有的疏水性氨基酸有关,Chen Huaming [30]和Rajapakse [31]等认为多肽的N-端为疏水性氨基酸(例如缬氨酸或亮氨酸)时,抗氧化活性较高。因为疏水性氨基酸能使抗氧化肽与脂肪酸的相互作用增强,提高了其捕捉脂质自由基的能力;二是大豆肽分子会包裹住脂质分子,阻止其氧化;三是大豆肽侧链氨基酸能提供氢自由基;四是大豆肽具有良好的螯合Fe 2+能力 [19]。Hernándezledesma等 [32]将等摩尔的氨基酸混合物与相应肽的抗氧化性比较,前者的抗氧化能力要高,说明肽键或者肽的空间结构对抗氧化活性有负面影响。这也可能是大豆肽抑制脂质氧化能力较低的原因。
考虑到抑制脂质体氧化活性方法是直观反应大豆肽对脂质氧化的抑制效果,因此,该方法较适合评价大豆肽的体外抗氧化能力。
采用还原能力、螯合Fe 2+能力、清除ABTS +·或DPPH自由基活性及抑制脂质体氧化活性方法测定大豆肽的体外抗氧化活性,结果表明这些测定方法对多肽体外抗氧化活性的评价具有适用性,选择较适合的测定方法能更准确测定多肽的抗氧化活性。
本实验中,大豆肽的体外抗氧化活性主要表现为螯合Fe 2+能力、清除ABTS +·及抑制脂质体氧化能力;3 种抗氧化剂中VC具有较好的还原能力和清除自由基能力,BHA具有较好的还原能力、清除ABTS +·活性及较强的抑制脂质氧化能力,VE具有良好的抑制脂质氧化能力。说明螯合Fe 2+能力、清除ABTS +·及抑制脂质体氧化活性的测定方法更适用于多肽体外抗氧化能力的评价,还原能力及清除DPPH自由基能力不适合评价大豆肽的体外抗氧化能力。
参考文献:
[1] 吴瑕, 江连洲, 王鑫, 等. 大豆蛋白酶水解物抗氧化活性的研究[J].中国粮油学报, 2010, 25(11): 37-42.
[2] 周柏玲, 李蕾, 孙秋雁, 等. 玉米醇溶蛋白复合膜包衣对核桃仁酸败抑制效果的研究[J]. 农业工程学报, 2004, 20(3): 180-183. DOI:10.3321/j.issn:1002-6819.2004.03.043.
[3] 陈海光, 叶丹杰. 氧自由基及其清除剂[J]. 仲恺农业技术学院学报, 2002, 15(1): 53-60.
[4] 陈金娥, 丰惠君, 张海容. 红茶、绿茶、乌龙茶活性成分抗氧化性研究[J]. 食品科学, 2009, 30(3): 62-66. DOI:10.3321/ j.issn:1002-6630.2009.03.013.
[5] 续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报, 2006, 22(8): 1015-1021. DOI:10.3321/ j.issn:1001-1978.2006.08.029.
[6] 马震雷, 郑萍. 海参多肽提取工艺研究[J]. 安徽农业科学, 2012, 40(34): 16815-16817. DOI:10.3969/j.issn.0517-6611.2012.34.107.
[7] WANG Bin, LI Zhongrui, CHI Changfeng, et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of sphyrna lewini muscle[J]. Peptides, 2012, 36(2): 240-250. DOI:10.1016/j.peptides.2012.05.013.
[8] 赵文恩, 李茜倩. FRAP法测定大枣枣皮红色素的总抗氧化能力[J].郑州大学学报(工学版), 2011, 32(3): 28-35. DOI:10.3969/ j.issn.1671-6833.2011.03.007.
[9] 黄海兰, 徐波, 李增新, 等. 崂山蘑菇抗氧化成分提取及其活性研究[J]. 食品科学, 2005, 26(9): 61-66. DOI:10.3321/ j.issn:1002-6630.2005.09.009.
[10] XIE Zhengjun, HUANG Junrong, XU Xueming, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry, 2008, 111(2): 370-376. DOI:10.1016/ j.foodchem.2008.03.078.
[11] WANG L L, XIONG Youling L.. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9186-9192. DOI:10.1021/jf051213g.
[12] 荣建华, 李小定, 谢笔钧. 大豆肽体外抗氧化效果的研究[J]. 营养卫生, 2002, 23(11): 118-120. DOI:10.3321/ j.issn:1002-6630.2002.11.031.
[13] TEHERI A, SABEENA FARVIN K H, CHARLOTTE J, et al. Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J]. Food Chemistry, 2014(142): 318-326. DOI:10.1016/j.foodchem.2013.06.113.
[14] 胥莉, 李阳, 刘学波. 车前子总黄酮和总多糖粗提物的体外抗氧化性能对脑神经细胞的保护作用[J]. 食品科学, 2013, 34(11): 142-146.
[15] 刘明, 罗远栩, 倪辉, 等. 固态发酵大豆制备的抗氧化肽的活性分析[J]. 大豆科学, 2007, 26(3): 381-385. DOI:10.3969/ j.issn.1000-9841.2007.03.020.
[16] 王春利, 李京东. 荼多酚和维生素C对橄榄油抗氧化性的影响[J]. 化学工程师, 2012(9): 57-59.
[17] 张晖, 唐文婷, 王立, 等. 抗氧化肽的构效关系研究进展[J].食品与生物技术学报, 2013, 32(7): 673-679. DOI:10.3969/ j.issn.1673-1689.2013.07.001.
[18] SILVA B A, MALVA J O, DIAS A C P. St. John’s Wort (Hypericum perforatum) extracts and isolated phenolic compounds are effective antioxidants in several in vitro models of oxidative stress[J]. Food Chemistry, 2008, 110(3): 611-619. DOI:10.1016/ j.foodchem.2008.02.047.
[19] KONG B H, XIONG Youling L.. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action +[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 6059-6068. DOI:10.1021/jf060632q.
[20] 郑善元, 陈填烽, 郑文杰, 等. 单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(9): 2417-2423. DOI:10.3964/j.issn.1000-0593(2010)09-2417-07.
[21] 何慧, 谢笔钧, 杨卓, 等. 大豆蛋白和玉米蛋白酶解肽及其活性研究[J]. 粮油食品科技, 2002, 10(1): 14-16. DOI:10.3969/ j.issn.1007-7561.2002.01.007.
[22] 樊梓鸾, 王振宇. 红豆越橘体外抗氧化和抗细胞增殖活性研究[J]. 现代食品科技, 2010, 26(10): 1081-1086. DOI:10.3969/ j.issn.1673-9078.2010.10.011.
[23] 李良, 王鉴, 祝宝东, 等. 生育酚的高效抗氧化性及其应用[J]. 四川化工, 2006, 9(4): 16-19.
[24] 刘晓辉, 解庆柱, 刘刚, 等. 简述抗氧化剂的作用机理及其应用[J]. 2011年山东畜牧兽医学会动物营养与饲料科学专业委员会年会论文集, 2011:108-111.
[25] 王会, 郭立, 谢文磊. 抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业, 2006, 32(3): 92-98. DOI:10.3321/j.issn:0253-990X.2006.03.026.
[26] OHKAWA H, OHISHI N, YAGI K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J]. Analytical Biochemistry, 1979, 95(2): 351-358. DOI:10.1016/0003-2697(79)90738-3.
[27] 朱雪梅, 吴俊锋, 胡蒋宁, 等. α-生育酚在花生油、芝麻油和菜籽油中的抗氧化效能[J]. 食品与发酵工业, 2013, 39(10): 85-90.
[28] 刘岭, 陈复生, 薛静玉. 复配抗氧化剂的研究进展[J]. 中国食品添加剂, 2013, 2(21): 172-176. DOI:10.3969/j.issn.1006-2513.2012.02.021.
[29] MINOTTI G, AUST S D. The role of iron in the initiation of lipid peroxidation[J]. Chemistry and Physics of Lipids, 1987, 44(2/3/4): 191-208. DOI:10.1016/0009-3084(87)90050-8.
[30] CHEN H M, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.
[31] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properti es[J]. Food Research International, 2005, 38(2): 175-182. DOI:10.1016/j.foodres.2004.10.002.
[32] HERNÁNDEZLEDESMA B, DÁVALOS A, BAR TOLOMEB, et al. Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin. Identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 588-593. DOI:10.1021/jf048626m.
Comparison of Various Methods for Measuring Antioxidant Activities of Polypeptide in Vitro
CAI Jun
1, CHEN Jiwang
1,2,*, WANG Ru
1, DING Wenping
1,2, WU Yongning
1,3
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan 430023, China; 3. National Center for Food Safety Risk Assessment, Beijing 100021, China)
Abstract:Various methods including reducing power, Fe 2+-chelating, 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) radical scavenging, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging and liposome oxidation inhibition capacity assays were used for evaluating the antiox idant activities of soybean peptide employing butyl hydroxylanisole (BHA), VC and VE as controls, aiming to investigate the applicability of these assays for measuring the antioxidant activities of polypeptide in vitro. The results showed that the reducing power of soybean peptide increased with its concentration in the range of 0–30 mg/mL, attaining a maximum value of only 0.487, and BHA, VC, and VE similarly exhibited reducing power in a concentration-dependent manner. The inhibitory activity of soybean peptide against liposome oxidation was lower than that of BHA and VE, and this antioxidant activity exhibited a stable upward trend with increasing concentration of soybean peptide, reaching maximum percentage inhibition of 20.6%. Fe 2+-chelating capacity of soybean peptide increased up to 38.7% with its con centration in the range of 0–15 mg/mL, whereas BHA, VE and VC had no such activity. Soybean peptide in the concentration range of 0–3.0 mg/mL possessed ABTS radical scavenging activity very similar to that of VC and higher than that of BHA and VE, and the maximum scavenging percentage was 61.2%. However, the maximum DPPH radical scavenging percentage of soybean peptide was only 2.1%, which was much lower than that of VC (45.0%), BHA (10.1%), and VE (10.7%). Therefore, Fe 2+-chelating capacity, ABTS radical scavenging, and liposome oxidation inhibition c apacity assays can be used to investigate the antioxidant activity of soybean peptide in vitro.
Key words:polypeptide; antioxidant activity in vitro; assay; applicability
DOI:10.7506/spkx1002-6630-201611010
中图分类号:TS201.4
文献标志码:A
文章编号:
引文格式:
收稿日期:2015-07-20
基金项目:粮食公益性行业科研专项(201513006-3);湖北省自然科学基金面上项目(2014CFB888);
武汉市国际合作项目(201231234466);武汉轻工大学研究生创新基金项目(2014cx013)
作者简介:蔡俊(1989—),男,硕士,研究方向为食品营养与安全。E-mail:cai7413@126.com
*通信作者:陈季旺(1970—),男,教授,博士,研究方向为食品营养与安全。E-mail:jiwangchen1970@126.com