程雅韵,郑 琳,李官浩,金 清*
(延边大学农学院,吉林 延吉 133002)
摘 要:为了更好地研究北方地区传统黄豆酱中低营养菌株的分布及其功能特性,对采集于不同地区的黄豆酱样品进行低营养菌株的筛选、分离及纯化,并研究其产胞外酶特性。结果共分离出114 株低营养菌株,其中69 株产纤维素酶,81 株产淀粉酶,112 株产脂肪酶,72 株产β-葡萄糖苷酶,59 株产蛋白酶。通过16S rRNA基因序列分析对产酶活性高的代表菌株进行鉴定,鉴定出5 种类别菌株,分别为枯草芽孢杆菌(Bacillus subtilis)、高地芽孢杆菌(Bacillus altitudinis)、短小芽孢杆菌(Bacillus pumilus)、萎缩芽孢杆菌(Bacillus atrophaeu)、阿萨尔基亚芽孢杆菌(Bacillus axarquiensis)。所筛选的产酶活性高的低营养菌株短小芽孢杆菌HS1-4和枯草芽孢杆菌HS5-13耐盐性高,对环境的抗耐性强,具有广阔的应用前景。
关键词:黄豆酱;低营养菌株;筛选;产酶特性
黄豆酱别名黄酱,是以黄豆、面粉为主要原料,经蒸煮、制曲、发酵等工艺酿造而成的半流动状发酵食品 [1]。黄豆酱中含有蛋白质、蛋白黑素、肽类、异黄酮、维生素等大量有益于人体的生理活性物质 [2],具有很高的营养保健功能。长期以来,黄豆酱作为我国传统调味品,以其适宜的口感、浓郁的香味和诱人的色泽,深受全国各地人民的喜爱 [3]。
传统黄豆酱是经过3~4 个月自然发酵形成的。空气中的微生物自然接种到酱醅中,接入到酱醅中的微生物为了满足自身生长代谢需要而分泌出大量的酶(如脂肪酶、淀粉酶、蛋白酶、纤维素酶、β-葡萄糖苷酶) [4],微生物酶系能够分解蛋白质、淀粉和脂肪,形成小分子化合物,例如氨基酸、有机酸等,使原料中的成分发生一系列复杂的生物化学变化 [5]。这些化合物赋予了黄豆酱特殊的风味以及丰富的营养,使得黄豆酱具有抗衰老、降低胆固醇、促进营养物质吸收等功能 [6]。
低营养菌株是指在营养匮乏的环境中仍能利用环境中的有机物质获得能量供其自身代谢生长的菌株。它具有独特的生理适应机制,具有营养竞争优势,体内还储有抗性因子能抵御不良环境,能长期存在于一种极低的代谢状态下 [7-9]。因此,应加大对此类菌株的研究,以便将其用应于各种环境条件下的食品生产中。
目前,关于传统黄豆酱中低营养菌株的研究仍未见报道。本实验以采集于北方不同地区的家庭自制传统黄豆酱为原料,研究低营养菌株在黄豆酱中的分布及其酶学特性,及其在黄豆酱发酵与风味形成过程中发挥的作用,筛选并鉴定出产酶活性高的低营养菌株,为黄豆酱中微生物的深入研究提供理论依据,同时为更好地应用于食品发酵工业奠定基础。
1.1 材料、试剂、菌株与培养基
传统发酵黄豆酱分别采集于山东省3 种(HS1、HS2、HS5)、吉林省6 种(HJ-1、HJ-2、HJ-3、HJ-5、HJ-7、HJ-8)、辽宁省1 种(HL3)、黑龙江省2 种(HH1、HH2)。
完达山脱脂奶粉购于延吉百货大楼超市。
三丁酸甘油酯、可溶性淀粉、羧甲基纤维素、柠檬酸铁、七叶苷、NaCl、刚果红、甘油均为分析纯 上海阿拉丁生化科技股份有限公司;碘酒 美国Spectrum公司;API 50CHB试剂盒 法国BioMereux公司。
标准菌株枯草芽孢杆菌KACC 10114由韩国农村振兴厅提供。
营养肉汤培养基(nutrient broth,NB)、营养琼脂培养基(nutrient agar,NA)、R2A培养基(reasoner’s 2A,R2A) 青岛高科园海博生物技术有限公司。
R2A培养基:3.2 g R2A液态培养基溶于1000 mL蒸馏水;营养琼脂培养基:33 g营养琼脂培养基溶于1 000 mL蒸馏水;产纤维素酶鉴别培养基:R2A琼脂培养基+0.4 g/100 mL(培养基)羧甲基纤维素;产淀粉酶鉴别培养基:R2A琼脂培养基+0.5 g/100 mL(培养基)可溶性淀粉;产蛋白酶鉴别培养基:R2A琼脂培养基+1 g/100 mL(培养基)脱脂牛奶;产脂肪酶鉴别培养基:R2A琼脂培养基+1 g/100 mL(培养基)三丁酸甘油酯;产β-葡萄糖苷酶鉴别培养基:R2A琼脂培养基+0.3 g/100 mL(培养基)七叶苷+0.02 g/100 mL(培养基)柠檬酸铁。
1.2 仪器与设备
DNP-9082BS-Ⅲ电热恒温培养箱、SW-CJ-IFD超净工作台 中国上海新苗医疗器械机械制造有限公司;SX-700高压蒸汽灭菌器 日本TOMY公司。
1.3 方法
1.3.1 低营养菌株的总数测定、初步筛选和纯化
取黄豆酱样品10 g溶解于90 mL生理盐水中,即为10 -1稀释度样液,按10 倍梯度递增稀释后均匀涂布于R2A固态培养基上,28 ℃恒温培养48 h,直至长出明显菌落 [10-12]。选择平均菌落数在30~300 CFU之间的平皿和稀释度,低营养菌株总数按下式计算。
挑选出的单一菌落依次划线在营养琼脂培养基上,并按照样品来源及稀释度进行编号,编号后置于培养箱中,28 ℃恒温培养24 h。
1.3.2 产胞外酶菌株的筛选
将筛选出的菌株分别接种到产淀粉酶、脂肪酶、蛋白酶、纤维素酶、β-葡萄糖苷酶鉴别培养基上,28 ℃恒温培养(48±2) h,观察接种菌株周围培养基是否出现相应现象:1)在产蛋白酶、脂肪酶鉴别培养基中,产酶菌株周围出现透明圈;2)产纤维素酶鉴别培养基经刚果红染色30 min后,用1 mL、1 mol/L NaCl溶液清洗,产酶菌株周围出现透明圈 [13];3)产淀粉酶鉴别培养基经碘酒染色30 min后,产酶菌株周围出现透明圈;4)产β-葡萄糖苷酶选择培养基中,产酶菌株周围出现褐色水解斑。
1.3.3 菌种的鉴定
细菌总DNA的提取:将产酶活性高的代表菌株接种到5 mL R2A液态培养基中,28 ℃培养48 h,6 000 r/min离心10 min收获菌体,采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法提取细菌总DNA,并进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。引物使用:27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。PCR产物经纯化后,送于韩国SolGent公司进行序列测定,最后把所得菌株的DNA序列信息输入美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库进行局部序列比对,用基本检索工具(basic local alignment search tool,BLAST)进行分析 [13]。
1.3.4 发酵液粗酶活力的测定
将筛选菌株和标准菌株活化后接种于营养液态培养基中,37 ℃ 摇床培养48 h后,4 000 r/min离心20 min,收集上清液即为粗酶液,粗酶液适当稀释后用于酶活力的测定。
采用羧甲基纤维素酶活力测定法测定纤维素酶活力,以单位酶量每分钟水解底物羧甲基纤维素钠产生1 mg葡萄糖为一个酶活力单位 [14]。采用3,5-二硝基水杨酸显色法测定淀粉酶活力,可溶性淀粉为底物,单位酶量30 min 水解释放1 mg麦芽糖为1 个酶活单位 [15]。福林-酚法测定蛋白酶活力,以单位酶量每分钟水解酪蛋白生成1 μg酪氨酸为一个酶活力单位 [16-17]。脂肪酶活力以橄榄油为底物,以每分钟催化脂肪水解产生1 μmol脂肪酸所需的酶量为一个酶活力单位 [18]。β-葡萄糖苷酶活力以对硝基苯-β-D-吡喃葡萄糖苷(p-nitrophenyl α-D-glucopyranoside,pNPG)为底物,单位酶量每分钟产生1 μmol对硝基苯酚为一个酶活力单位 [19]。
1.3.5 菌株特性的测定
筛选胞外酶活性高的菌株进行菌落、菌体、芽孢特征及细胞色素氧化酶特性分析,并利用API 50CHB试剂盒进行生化鉴定。
1.3.6 菌株耐盐性的测定
将筛选菌株分别接种在100 mL加0、5、10、20 g氯化钠的营养液态培养基中,在37 ℃条件下摇瓶培养64 h,每4 h取样,在650 nm波长处测定吸光度并绘制生长曲线。
1.4 数据统计分析
实验重复3 次,并用SPSS 19.0软件对数据进行显著性分析,P<0.05表示差异显著;P>0.05表示差异不显著。
2.1 传统发酵黄豆酱样品中低营养菌株的总数
通过对12 个黄豆酱样品进行低营养菌株总数测定,其计数结果如表1所示。采集的12种传统发酵黄豆酱中均有低营养菌株的分布,且数量均在10 5以上,可知黄豆酱样品中的大量微生物能够在低营养条件下广泛分布和生长。
表1 传统发酵黄豆酱样品中低营养菌株总数
Table 1 Microbial counts of oligotrophic strains in traditional fermented soybean paste

样品名称菌落总数/(CFU/g)样品名称菌落总数/(CFU/g)HS22.2×10 6HJ26.8×10 5HL33.3×10 6HJ32.3×10 7HJ14.3×10 6HH14.6×10 6HJ81.3×10 6HJ72.5×10 6HS52.2×10 6HJ51.9×10 6HS22.1×10 6HH22.6×10 5
2.2 产胞外酶菌株的筛选
从12 个传统发酵黄豆酱中利用R2A培养基根据菌落和形态特征分离了114 株低营养菌株,利用鉴别培养基进一步分析了产胞外酶的特性,具有产胞外酶广谱性且活性较高菌株的产酶特性结果如表2所示。
表2 传统发酵黄豆酱中分离低营养菌株的产胞外酶特性
Table 2 Extracellular enzymatic activities of oligotrophic strains isolated from traditional fermented soybean paste

注:-. 无透明圈;+、++、+++. 透明圈直径分别为1.0、1.0~3.0、3.0~5.0 mm。
产胞外酶特性纤维素酶淀粉酶蛋白酶脂肪酶β-葡萄糖苷酶HS1-8+++++++++++++++HS1-9+++++++++++++++HS1-3+++++++++++++++HS1-4+++++++++++++++HJ5-9+++++++++++++++HJ5-4+++++++++++++++HH2-9+++++++++++++++HS5-13+++++++++++++++HJ8-4+++++++++++++HJ8-10+++++++++++++HJ8-2++++++++++++++HS5-2+++++++++++HS5-3+++++++++++HS5-9++++++++++++HS5-12+++++++++++HS5-13+++++++++++++++HH2-3++++++++++HH2-5++++++++++++++HH2-7++++++++++++++HJ5-1+++++++++++++HJ5-7+++++++++++++HJ7-1+++++++++++++HJ7-2++++++++++++++HJ7-5++++++++++++++HJ7-6++++++++++++++HJ7-7+++++++++++++HJ7-9++++++++++++++HS1-1++++++++++++HS1-6++++++++++++++HS1-7++++++++++++++HJ2-9-+-++++++HL3-10+--++++++HS1-2+++--++++++菌株编号
从黄豆酱样本中筛选出的114 株低营养菌株中共有69 株菌株产纤维素酶,其中HH2、HS2、HJ1、HH1、HS5、HJ7、HS1样品中菌株产生的纤维素酶含量较高;81 株产淀粉酶,59 株产蛋白酶,112 株菌株产脂肪酶,72 株产β-葡萄糖苷酶,且产酶状况良好。
传统酱类发酵过程中微生物分泌多种胞外酶如纤维素酶、淀粉酶、蛋白酶、脂肪酶、β-葡萄糖苷酶等。纤维素酶可以水解纤维素,使细胞壁破裂 [20],利于其他酶类能进一步水解底物,提高细胞内含物(如蛋白质、淀粉、油脂及糖等)的提取率,加快发酵速度,改善食品质量,简化生产工艺 [21]。富含此类菌株的豆酱具有消除抗营养因子,促进生物健康生长的作用。淀粉酶在豆酱发酵成熟的过程中可以降解原料中的淀粉,提高淀粉的利用率,改变总糖和还原糖含量,改善黄豆酱的色泽,提高酱的风味 [22];蛋白酶可以催化蛋白质水解产生主要呈味物质——游离氨基酸,更利于人体吸收,减少大豆蛋白水解过程中苦味肽、苦味氨基酸的生成,改善豆酱的风味 [23];脂肪酶在发酵过程中作用于脂肪中的酯键,将脂肪分解成脂肪酸和甘油以及帮助形成酱色的多酚氧化酶,改善了黄豆酱的风味又提高了营养价值 [24]。黄豆酱的主要成分大豆中脂肪含量约占25%,脂肪酶水解脂肪产生对人体有益的亚油酸等必需脂肪酸,既降低胆固醇又具有保健功能;β-葡萄糖苷酶将黄豆酱中异黄酮转化为更容易消化吸收的苷元,提高吸收率,改善风味和保健功能 [25]。
本实验中,从传统黄豆酱中筛选出的低营养菌株具有良好的产胞外酶特性,这些菌株及所分泌的胞外酶复合作用使黄豆酱在发酵过程中分解纤维素、淀粉、蛋白质、脂肪和异黄酮,提高糖、游离氨基酸、必需氨基酸和功能性苷元的含量,改善豆酱的色泽、风味和质量,同时提高营养价值和功能性。对筛选的产酶活性较高的代表性菌株在发酵条件、酶学特性等方面进行深入研究,可充分开发其利用价值,以应用到黄豆酱发酵及其他食品工业中。
2.3 菌种的鉴定
综合代表菌株的产酶特性,对产酶活性高的代表菌株进行了16S rRNA序列鉴定。表3结果显示,代表菌株被鉴定为5 种,大部分为枯草芽孢杆菌(Bacillus subtilis),其余为高地芽孢杆菌(Bacillus altitudinis)、短小芽孢杆菌(Bacillus pumilus)、萎缩芽孢杆菌(Bacillus atrophaeus)、阿萨尔基亚芽孢杆菌(Bacillus axarquiensis),其中绝大部分为枯草芽孢杆菌(Bacillus subtilis),且同源性较高。
表3 16S rRNA序列同源性分析结果
Table 3 Results of 16S rRNA sequence homology analysis
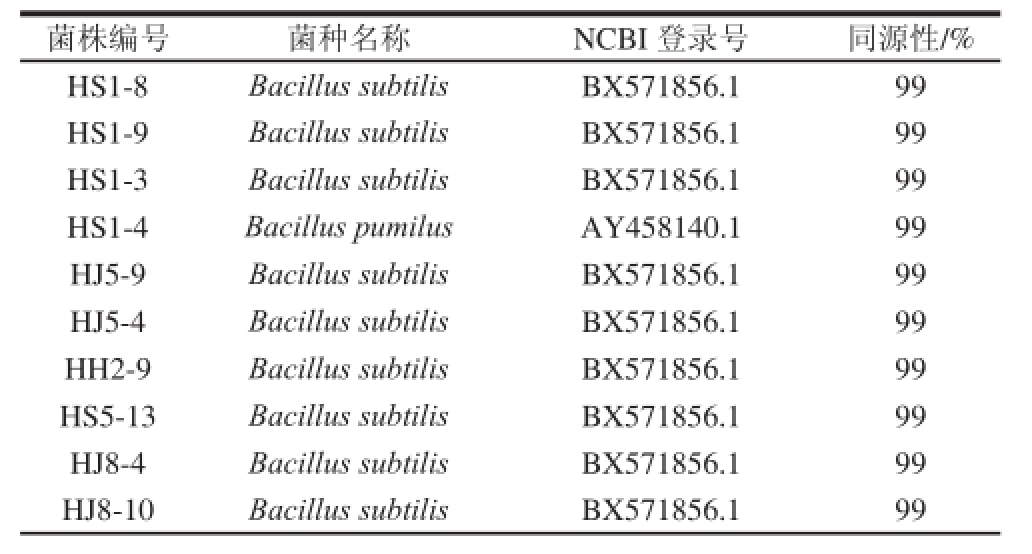
菌株编号菌种名称NCBI 登录号同源性/% HS1-8Bacillus subtilisBX571856.199 HS1-9Bacillus subtilisBX571856.199 HS1-3Bacillus subtilisBX571856.199 HS1-4Bacillus pumilusAY458140.199 HJ5-9Bacillus subtilisBX571856.199 HJ5-4Bacillus subtilisBX571856.199 HH2-9Bacillus subtilisBX571856.199 HS5-13Bacillus subtilisBX571856.199 HJ8-4Bacillus subtilisBX571856.199 HJ8-10Bacillus subtilisBX571856.199
续表3

?
2.4 产胞外酶优良菌株酶学特性分析
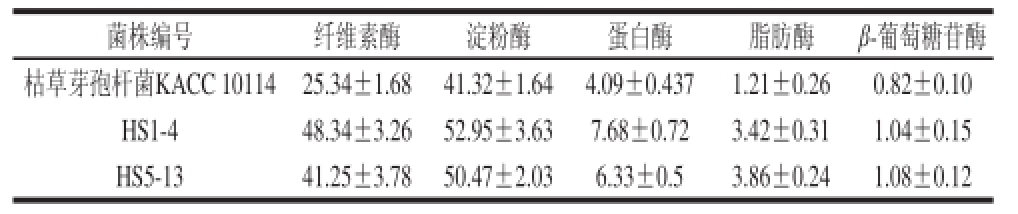
产胞外酶菌株中短小芽孢杆菌HS1-4和枯草芽孢杆菌HS5-13菌株产酶特性比其他菌株优良,将HS1-4和HS5-13菌株和标准菌株枯草芽孢杆菌KACC 10114分别接种在营养肉汤培养基上,37 ℃摇床培养48 h后离心、收集上清液分别测定了胞外酶的活性,结果如表4所示。菌株HS1-4和HS5-13的纤维素酶、淀粉酶、蛋白酶、脂肪酶和β-葡萄糖苷酶活性均高于标准菌株枯草芽孢杆菌KACC 10114,进一步验证了筛选菌株优良的产胞外酶特性。
表4 传统发酵黄豆酱中分离出的菌株HS1-4 和 HS5-13的产胞外酶活力
Table 4 Extracellular enzyme activity of HS1-4 and HS5-13 isolated from traditional fermented soybean paste U/mL
?
2.5 产胞外酶优良菌株生化特性分析
将产胞外酶菌株中短小芽孢杆菌HS1-4和枯草芽孢杆菌HS5-13分别接种在NA平板上观察了菌落形状,用显微镜观察了细胞形状及芽孢特征,分析了氧化酶特性。菌株HS1-4和HS5-13在NA平板上长出的菌落均为白色、平坦、边缘不整齐、表面有褶皱和无光泽,革兰氏染色为阳性,菌体杆状,芽孢中生,细胞色素氧化酶阳性。利用API 50CHB试剂盒进行生化特性分析,结果如表5所示。API 50 CH鉴定结果表明,在供试的49 种碳源中,短小芽孢杆菌HS1-4能够利用甘油、L-阿拉伯糖、核糖、D-木糖、D-葡萄糖、D-果糖、D-甘露糖、肌醇、甘露醇、α-甲基-D-葡萄糖苷、N-乙酰-葡糖胺、熊果苷、柳醇、纤维二糖、麦芽糖、七叶灵、海藻糖、蔗糖、棉子糖、龙胆二糖、肝糖、D-来苏糖、D-塔格糖、葡萄糖酸盐,枯草芽孢杆菌HS5-13能够利用甘油、L-阿拉伯糖、核糖、D-木糖、D-葡萄糖、D-果糖、D-甘露糖、甘露醇、山梨醇、α-甲基-D-葡萄糖苷、N-乙酰-葡糖胺、苦杏仁苷、熊果苷、柳醇、纤维二糖、麦芽糖、乳糖、七叶灵、海藻糖、蔗糖、肝糖、淀粉、D-棉子糖、木糖醇、β-龙胆二糖。
表5 传统发酵黄豆酱中分离出的菌株HS1-4和HS5-13的生化特性
Table 5 Biochemical characteristics of HS1-4 and HS5-13 isolated from traditional fermented soybean paste

注:+. 结果阳性;-. 结果阴性。
编号底物反应结果 编号底 物反应结果HS1-4HS5-13HS1-4HS5-13 0对照--25七叶灵++1甘油 ++26柳醇++2赤藓糖醇--27纤维二糖++3D-阿拉伯糖--28麦芽糖++4L-阿拉伯糖++29乳糖-+5核糖++30蜜二糖--6D-木糖++31蔗糖++7L-木糖--32海藻糖++8阿东醇--33菊糖--9β-甲基-木糖苷--34松三糖--10半乳糖--35D-棉子糖++11D-葡萄糖++36淀粉-+12D-果糖++37肝糖++13D-甘露糖++38木糖醇-+14L-山梨糖--39β-龙胆二糖++15鼠李糖--40D-松二糖+-16半乳糖醇--41D-来苏糖--17肌醇+-42D-塔格糖+-18甘露醇++43D-海藻糖--19山梨醇-+44L-海藻糖--20α-甲基-D-甘露糖苷--452-酮基-葡萄糖酸盐--21α-甲基-D-葡萄糖苷++465-酮基-葡萄糖酸盐--22N-乙酰-葡糖胺++47葡萄糖酸盐+-23苦杏仁苷-+48D-阿拉伯糖醇--24熊果苷++49L-阿拉伯糖醇--
2.6 产胞外酶优良菌株耐盐性分析
为了更好地应用于传统黄豆酱发酵剂,对HS1-4和HS5-13菌株的耐盐性进行了分析,结果如图1所示。低浓度的Na +和Cl -可以促进微生物生长,2 株菌株在培养12 h后进入对数期,48 h后生长稳定,在盐含量为5%时生长良好,2 株菌株均可以利用于酱类发酵剂。


图1 盐含量对传统发酵黄豆酱中分离菌株HS1-4和HS5-13生长的影响
Fig. 1 Effect of salt concentration on the growth of HS1-4 and HS5-13 isolated from traditional fermented soybean paste
本实验主要运用平板稀释法,通过初步筛选纯化,从东北三省和山东地区共12 种传统发酵黄豆酱中分离出114 株低营养菌株。通过对产酶特性分析发现,69 株产纤维素酶、81 株产淀粉酶、112 株产脂肪酶、72 株产β-葡萄糖苷酶、59 株产蛋白酶。通过16S rRNA基因序列分析对产胞外酶菌株进行鉴定,鉴定出5 种类别低营养菌株,分别为枯草芽孢杆菌(Bacillus subtilis)、高低芽孢杆菌(Bacillus altitudinis)、短小芽孢杆菌(Bacillus pumilus)、萎缩芽孢杆菌(Bacillus atrophaeus)、阿萨尔基亚芽孢杆菌(Bacillus axarquiensis),菌株表现出较高的同源性。对产酶特性良好的HS1-4和HS5-13菌株进行了形态学和生化特性鉴定,结果表明2 种菌株均表现出芽孢杆菌典型特征,且在5 g/100 mL盐含量下生长良好。因此,菌株HS1-4和HS5-13可以应用于传统发酵黄豆酱发酵剂,提高产品的风味和质量。
参考文献:
[1] 陈方博. 传统豆酱中蛋白酶和淀粉酶高产菌株的选育[D]. 哈尔滨:黑龙江大学, 2010: 1-2. DOI:10.7666/d.y1695925.
[2] 范俊峰, 李里特, 张艳艳, 等. 传统大豆发酵食品的生理功能[J]. 食品科学, 2005, 26(1): 250-254. DOI:10.3321/ j.issn:1002-6630.2005.01.059.
[3] 孙常雁. 自然发酵黄豆酱中主要微生物酶系的形成及作用[D]. 哈尔滨: 东北农业大学, 2007: 3-13. DOI:10.7666/d.y1165406.
[4] 武俊瑞. 东北传统发酵特色食品中主要微生物多样性研究[D]. 沈阳: 沈阳农业大学, 2013: 8-9.
[5] 索化夷, 赵欣, 骞宇, 等. 永川毛霉型豆豉在发酵过程中微生物总量与区系变化规律[J]. 食品科学, 2015, 36(19): 124-131. DOI:10.7506/ spkx1002-6630-201519022.
[6] 马艳莉, 李里特. 发酵豆制品酿造过程中组分和营养功能因子的变化及调控[J]. 食品科学, 2012, 33(3): 292-299. DOI:10.3969/ j.issn.1009-7848.2011.09.009.
[7] 杨菌, 杨淑霞, 邹强, 等. 1株具有低营养抗逆特性的嗜麦芽寡养单胞菌的分离和鉴定[J]. 成都医学院学报, 2012, 7(2): 181-183. DOI:10.3969/j.issn.1674-2257.2012.02.008.
[8] 夏辉. 净水贫营养细菌的筛选及其低营养特性的研究[D]. 武汉: 华中农业大学, 2006: 3-9. DOI:10.7666/d.y1004492.
[9] 夏辉, 梁运祥. 1株净水贫营养细菌的筛选及其低营养特性的初步研究[J]. 华中农业大学学报, 2006, 25(5): 530-534. DOI:10.3321/ j.issn:1000-2421.2006.05.017.
[10] 柴洋洋, 葛箐萍, 宋刚, 等. 传统发酵豆酱中酵母菌的分离、筛选及功能酵母的鉴定[J]. 中国食品学报, 2013, 13(3): 183-188.
[11] KATAOKA S. Functional effects of Japanese style fermented soy sauce and its components[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 227-234. DOI:10.1263/jbb.100.227.
[12] LEE S, KIM J, BAEK S, et al. Isolation and characterization of oligotrophic strains with high enzyme activity from buckwheat sokseongjang[J]. Korean Journal of Food Science and Technology, 2011, 43(6): 735-741.
[13] CHEN Y S, YANAG IDA F, SHNOHARA T. Isolation and identification of lactic acid bacteria from soil using an enrichment procedure[J]. Letters in Applied Microbiology, 2005, 40(2): 195-200. DOI:10.1111/j.1472-765X.2005.01653.x.
[14] 刘湧涛. 枯草芽孢杆菌对中草药有效成分提取的研究[D]. 长春: 吉林大学, 2015: 17-21.
[15] 杨慧, 王振华, 潘康成. 芽孢杆菌产淀粉酶活性的研究[J]. 现代食品科技, 2007(2): 90-93. DOI:10.3969/j.issn.1007-5739.2007.02.066.
[16] GB/T 23527—2009 蛋白酶制剂[S].
[17] 杨旭, 屈小玄, 郭庆贺, 等. 牛奶中蛋白酶活力测定的方法比较[J]. 中国乳品工业, 2014, 42(6): 48-51. DOI:10.3969/ j.issn.1001-2230.2014.06.013.
[18] 夏宇, 周文化, 邓学良, 等. 脂肪酶高产菌株的筛选及产酶条件优化[J].中南林业科技大学学报, 2013, 33(9): 116-120. DOI:10.14067/ j.cnki.1673-923x.2013.09.003.
[19] 陈梅. 斜卧青霉β-葡萄糖苷酶的性质和功能研究及基因表达谱分析[D].济南: 山东大学, 2013: 29-30.
[20] 石伟. 高产纤维素酶菌株的筛选及其在青贮饲料中的应用研究[D].西安: 西北大学, 2008: 25-26. DOI:10.7666/d.y1252815.
[21] LYND L R, WEIMER P J, van ZYL W H, et al. Microbial celluloseutilization: fundamentals and biotechnology[J]. Microbiology and Molecular Biology Review, 2002, 66(3): 506-577. DOI:10.1128/ MMBR.66.3.506-577.2002.
[22] 杨海泉, 刘龙, 李江华, 等. 碱性淀粉酶的发酵生产及其应用研究进展[J]. 生物工程学报, 2012, 28(4): 432-439. DOI:10.13345/ j.cjb.2012.04.001.
[23] 江信红. 黄鳝蛋白酶分离纯化、性质与应用研究[D]. 重庆: 西南师范大学, 2005: 773-776.
[24] 黄璜, 李宗军, 王远亮, 等. 各类微生物脂肪酶酶学性质及应用的研究进展[J]. 粮油食品科技, 2014, 22(1): 109-118. DOI:10.3969/ j.issn.1007-7561.2014.01.026.
[25] KUDANGA T, MWENJIE E. Extracellular cellulase production by tropical isolates of Aureobasidium pullulans[J]. Canadian Journal of Microbiology, 2005, 51(9): 773-776. DOI:10.1007/s10517-008-0273-5.
Isolation of Oligotrophic Strains in Traditional Fermented Soybean Paste and Analysis of Their Extracellular Enzyme-Producing Characteristics
CHENG Yayun, ZHENG Lin, LI Guanhao, JIN Qing*
(College of Agriculture, Yanbian University, Yanji 133002, China)
Abstract:Soybean paste is a Chinese traditional fermented food. Naturally fermented soybean paste contains rich microbial communities. In the present study, we isolated and purified bacterial strains from soybean paste samples collected from various regions to investigate the distribution and functional properties of oligotrophic strains in the traditional fermented soybean paste, and studied their extracellular enzyme-producing characteristics. Totally 114 oligAotrophic strains were obtained. Among them, 69 strains produced cellulase, 81 strains produced amylase, 112 strains produced lipase, 72 strains produced β-glucosidase, and 59 strains produced protease. We further identifi ed the representative strains highly active in producing enzymes through 16s ribosomal RNA gene sequencing. The identified five strains were Bacillus atrophaeus, Bacillus altitudinis, Bacillus axarquiensis, Bacillus pumilus and Bacillus subtilis, respectively. Among these, Bacillus pumilus HS1-4 and Bacillus subtilis HS5-13 had high salt tolerance and environment resistance, thereby having potential wide applications in the future.
Key words:soybean paste; oligotrophic strains; isolation; enzyme-producing characteristics
DOI:10.7506/spkx1002-6630-201611017
中图分类号:TS 201.3
文献标志码:A
文章编号:1002-6630(2016)11-0097-06
引文格式:
程雅韵, 郑琳, 李官浩, 等. 传统发酵黄豆酱中低营养菌株的筛选及产胞外酶特性分析[J]. 食品科学, 2016, 37(11): 97-102. DOI:10.7506/spkx1002-6630-201611017. http://www.spkx.net.cn
CHENG Yayun, ZHENG Lin, LI Guanhao, et al. Isolation of oligotrophic strains in traditional fermented soybean paste and analysis of their extracellular enzyme-producing characteristics[J]. Food Science, 2016, 37(11): 97-102. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611017. http://www.spkx.net.cn
收稿日期:2015-12-19
基金项目:国家自然科学基金地区科学基金项目 (31260362);吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2015第40号])
作者简介:程雅韵(1992—),女,硕士研究生,研究方向为食品微生物发酵。E-mail:1748731183@qq.com
*通信作者:金清(1971—),女,副教授,博士,研究方向为食品微生物发酵。E-mail:jinqing@ybu.edu.cn