
图1 菌株ZSM-1的菌落特征及显微结构
Fig. 1 Morphological characteristics of strain ZSM-1
孔望君,蒋会芳,冉火苗,王 傲,吕 曼,杨 柯,辛志宏*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:对分离自土壤的2 株编号为ZSM-1和ZS M-2的放线菌进行分类鉴定,提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)后经聚合酶链式反应(polymerase chain reaction,PCR)扩增菌株16S rDNA,基因测序并进行同源性分析,构建进化树并进行系统发育分析,结合培养特征、生理生化特征,将该2 株菌分别鉴定为纳士维尔链霉菌(Streptomyces nashvillensis)与土地戈登氏菌(Gordonia terrae)。
关键词:放线菌;鉴定;16S rDNA;系统发育分析
放线菌(Actinomycete)是一类具有分支状菌丝体、高(G+C)mol%含量的革兰氏阳性细菌 [1],广泛存在于不同的自然生态环境中,种类繁多、代谢功能各异。放线菌是拥有巨大应用价值的一类微生物类群,能产生多种有益代谢产物且具有很高的经济价值,目前从微生物中发现的大约8 000 种生物活性物质中,大约70 %是由放线菌产生的 [2]。目前临床上使用的抗生素有2/3来自放线菌 [3]。因此作为一类重要的微生物资源,放线菌的研究受到了世界各国学者的极大重视。常显波 [4]比较了不同方法的分离效果,并通过纯培养和16S rDNA系统发育分析对黄海冷水团、北极海区及青岛盐池的沉积物样品进行了放线菌多样性研究。胥秀英等 [5]对土壤放线菌的一种新分离技术进行了研究。结果表明,用加有氟哌酸、青霉素、制霉菌素的培养基,可以选择性地从土壤中分离放线菌,0.05%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)在40 ℃条件下处理土壤样品,可以促进放线菌的孢子萌发而获得更多的放线菌株,进一步提高放线菌的分离效果。焦少娟等 [6]从陕西杨凌地区不同类型土壤中分离出1 株对稻瘟病菌(Pyricularia grisea)、小麦赤霉病菌(Gibberella zeae)和小麦白粉病菌(Blumeria graminis)等病原菌均具有强烈拮抗作用的JSJ-129-08号菌株,并对其生物学活性进行了初步测定。孙强等 [7]对放线菌菌株MY02中的抗真菌成分进行了分离。Rajamanickam等 [8]从印度东南海岸的红树林根际土壤中分离出1 株能产生L-天冬酰胺酶(L-asparaginase)的放线菌KUA106,并研究了该菌发酵条件与酶产量之间的关系,结果表明KUA106产生L-天冬酰胺酶的最佳培养基组合是天冬酰胺、胰蛋白胨、葡萄糖和氯化钠。Fguira等 [9]对抗真菌链霉菌us80菌株中的活性成分进行了提纯和结构认定。叶海霞等 [10]以大肠杆菌和金黄色葡萄球菌为供试菌株筛选出对革兰氏阴性菌和革兰氏阳性菌均有较好抑制作用的放线菌菌株Y-71。王勇等 [11]对放线菌菌株BOS-009进行分离及鉴定,并对其拮抗活性进行研究。吴春燕等 [12]从三亚附近海域采集的海绵体内分离出一株具有较强抗血球凝集素1型、神经氨酸酶1型(hemagglutinin 1 neuraminidase 1,H1N1)活性的放线菌HA10201,其发酵液稀释20 倍后抑制率仍达68.1%(阳性对照利巴韦林抑制率为80.0%)。因此,放线菌依然是一类急待开发的微生物资源,在生物环保、食品、制药、发酵工业、农业生产等领域具有潜在的应用价值。
本实验对采自中山陵的土壤进行了放线菌的筛选,共得到16 株土壤放线菌,其中菌株ZSM-1、ZSM-2表型特征比较特殊,前者在高氏一号培养基上呈灰白色,菌丝体由内向外呈放射状生长,后者呈橘红色,表面光滑中央凸起。因此对这2 株菌形态特征、培养特征以及16S rDNA序列进行研究,对其进行分类鉴定,确定其种属地位,为放线菌的深入开发利用提供理论依据。
1.1 材料、试剂与培养基
土壤采自江苏省南京市中山陵。
D3350-01 E.Z.N.A细菌DNA提取试剂盒 美国Omega公司;DR001AM PCR试剂、Ver.3.0 D823A琼脂糖凝胶DNA提取试剂盒、D102A pMD19-T载体 日本TaKaRa公司。
培养特征、生理生化特性实验所用培养基均采用放线菌培养、分类鉴定常规培养基 [13-14]。
1.2 仪器与设备
Microfuge 22R台式微量冷冻离心机 美国Beckman公司;TP600型梯度PCR仪 日本TaKaRa公司;DYCP-31DN电泳仪 北京市六一仪器厂;JS-380C全自动数码凝胶成像分析仪 上海培清科技有限公司;SPX-25085H-II生化培养箱 上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 放线菌的分离纯化
取10 g土壤溶于90 mL无菌水中,180 r/min振荡20 min,即得到10 -1的土壤悬浮液。静置后,取1 mL上悬液依次梯度稀释,制备10 -2、10 -3、10 -4、10 -5、10 -6的土壤悬浮液,充分振荡,静置30 min备用。取上述土壤悬浮液(10 -4、10 -5、10 -6)100 μL注入高氏合成一号平板上(含质量分数0.05%的重铬酸钾),用无菌涂布器涂布均匀,每个土壤稀释浓度做3 个平行,置于28 ℃恒温培养箱内培养5~7 d后,观察菌落的生长情况,然后进行纯化、保存、备用。
1.3.2 菌株的初步鉴定
1.3.2.1 培养特征
参照《放线菌的分类和鉴定》和《链霉菌鉴定手册》中的方法。将菌株接种于高氏一号等8 种放线菌分类鉴定常规培养基上,28 ℃培养7~10 d,观察气生菌丝、基内菌丝、可溶性色素的颜色及表观特征。
1.3.2.2 生理生化特征
参照《放线菌的分类和鉴定》和《链霉菌鉴定手册》中的方法测定菌株的生理生化特性。测定指标包括:碳源利用、硝酸盐还原、纤维素水解、淀粉水解、明胶液化、产硫化氢及牛奶凝固与胨化。
1.3.2.3 16S rDNA 序列提取与PCR扩增
采用细菌DNA提取试剂盒提取放线菌基因组DNA,对其16S rDNA序列进行PCR扩增。PCR扩增反应体系包括:2×Taq Master Mix 12.5 μL、DNA 1 μL、Primer 1 1 μL、Primer 2 1 μL、ddH 2O 9.5 μL。引物为16S(F)(5’-AGAGTTTGATCCTGGCTCAG-3’)和16S(R)(5’-ACGGTTACCTTGTTACGACTT-3’);PCR反应条件为:94 ℃预变性3 min,94 ℃变性30 s,50 ℃退火45 s,72 ℃延伸100 s ,共35 个循环,最后72 ℃延伸7 min。
1.3.2.4 16S rDNA 序列克隆与分析
采用DNA回收试剂盒回收PCR产物,纯化后的PCR产物与pMD19-T载体连接,然后转化至E.coli DH5α感受态细胞中。将-70 ℃条件下保存的感受态细胞E.coli DH5α 100 μL中加入10 μL连接产物,轻轻混合均匀,冰中放置30 min,取出后42 ℃热激90 s,再在冰中放置5~10 min,加入890 μL LB液体培养基37 ℃振荡培养1 h。取200 μL菌液涂布于含100 μg/mL氨苄青霉素的LB平板上,倒置过夜培养,挑取白色单菌落培养。取0.5 μL菌液进行PCR扩增,引物为M13-RV和M13-47,电泳检测是否含有目的片段。PCR反应体系(共25 μL),包括2×Taq Master Mix 12.5 μL、模板DNA 1 μL、 M13-RV 1 μL、M13-47 1 μL、ddH 2O 9.5 μL。将含有目的DNA序列的菌液送交上海美吉生物有限公司进行序列测定。
1.3.2.5 16S rDNA序列系统发育树分析
获得序列后,在EzBioCloud数据库中进行比对,下载与供试菌株16S rDNA序列同源性相近的菌株序列,利用ClustalX软件进行序列的多重比对,利用MEGA5.0软件邻接(Neighbor-Joining,N-J)方法构建系统发育树,自展数为1 000。
2.1 菌株形态学观察
菌株ZSM-1在高氏一号培养基28 ℃培养7 d后,菌落正面灰白色,菌丝呈放射状,反面褐黄色(图1A、B)。电子显微镜扫描结果显示,菌株ZSM-1的孢子丝细长,有分支,光滑透明(图1C)。

图1 菌株ZSM-1的菌落特征及显微结构
Fig. 1 Morphological characteristics of strain ZSM-1
菌株ZSM-2在高氏一号培养基28 ℃培养7 d后,菌落正面呈苹果红色,光滑,中央凸起,反面苹果红色(图2A、B)。电镜扫描结果显示,菌株ZSM-2不产生芽孢,不形成细长的菌丝,呈大片的蜂窝状(图2C)。
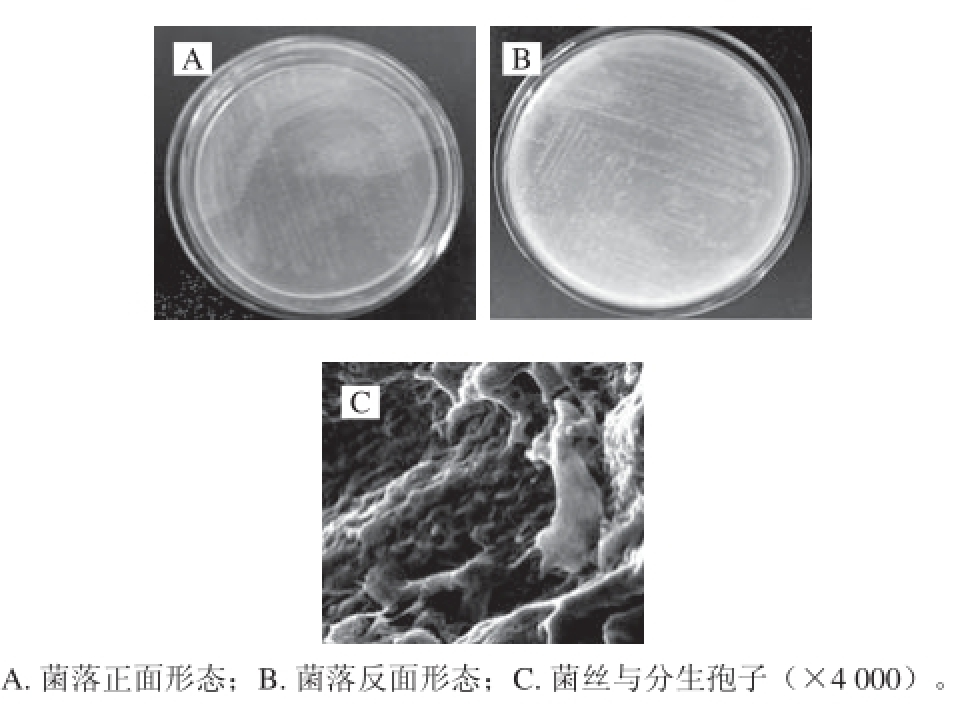
图2 菌株ZSM-2的菌落特征及显微结构
Fig. 2 Morphological characteristics of strain ZSM-2
2.2 培养特征观察
在放线菌分类鉴定的8 种常规培养基上,放线菌菌株ZSM-1、ZSM-2经28 ℃培养7~10 d后,培养特征见表1。将菌株ZSM-1与模式菌株Streptomyces nashvillensis [15],菌株ZSM-2与模式菌株Gordonia terrae [16-17]进行对比,菌丝及胞外色素颜色以《链霉菌鉴定手册》 [13]为参照。
表1 菌株ZSM-1、ZSM-2与对照菌株S.nashvillensis G. terrae的培养特征
Table 1 Growth characteristics of strains ZSM-1 and ZSM-2 and the control strains S. nashvillensis and G. terrae

注:NR. 未见报道。
培养基放线菌株ZSM-1S. nashvillensis放线菌株ZSM-2G. terrae麦芽膏酵母膏生长旺盛,气丝浅灰红色,基丝深褐色,无色素生长旺盛,气丝浅灰红褐色,基丝强褐色至浅灰褐色,无色素生长良好,无菌丝体,菌落呈玫瑰粉色,圆形有褶皱,中央凸起,无色素生长良好,无菌丝体,菌落呈粉红至橙黄色燕麦培养基生长旺盛,气丝白至浅粉色,基丝白至微灰色,产暗黄色色素生长旺盛,气丝白色至灰色,基丝白色至微灰色,产暗黄色色素生长良好,无菌丝体,菌落粉至金黄色,圆形,光滑,中央凸起,无色素NR无机盐淀粉生长良好,气丝浅黄白色,基丝灰黄色,无色素生长良好,气丝浅褐灰色,基丝黄褐色,无色素微弱生长,无菌丝体,菌落呈玫瑰粉色,光滑,无色素NR马铃薯琼脂生长旺盛,气丝浅黄白色,基丝微黄色,无色素生长旺盛,气丝少,基丝暗淡黄色至黄褐色,无色素生长旺盛,无菌丝体,菌落橙黄色,圆形,光滑,中央凸起,无色素NR察氏培养基生长良好,气丝白至微灰,基丝白至微黄,无色素生长旺盛,气丝白至淡鼠灰,基丝白至淡鼠灰,无色素微弱生长,无菌丝体,菌落呈荷花白色,光滑,无色素NR高氏一号生长旺盛,气丝白至微黄,基丝深橙黄色,无色素NR生长旺盛,无菌丝体,菌落呈苹果红色,光滑,中央凸起,无色素NR营养琼脂生长旺盛,无气丝,基丝白至微灰,产深褐色色素生长旺盛,无气丝,基丝白色,产褐色色素生长良好,无菌丝体,菌落呈金黄色,圆形,光滑,中央凸起,无色素生长良好,无菌丝体,菌落呈橙黄色,无色素甘油天冬氨酰生长旺盛,气丝鼠灰色,基丝浅黄白色,无色素生长旺盛,气丝白至灰白,基丝乳脂色至浅黄,无色素微弱生长,无菌丝体,菌落呈玫瑰粉色,光滑,无色素NR
2.3 菌株生理生化特性
2.3.1 碳源的利用
测定了菌株ZSM-1、ZSM-2对多种供试碳源的利用情况,结果见表2。通过菌株ZSM-1与S. nashvillensis [16]、ZSM-2与G. terrae碳源的利用情况比较发现,它们的碳源利用情况相一致。
表2 放线菌ZSM-1、ZSM-2与对照菌株S. nashvillensis G. terrae碳源利用
Table 2 Carbon utilization capacity of actinomycetes ZSM-1 and ZSM-2 and the control strains S. nashvillensis and G. terrae

注:+.利用;-.不利用。下同。
碳源ZSM-1S. nashvillensisZSM-2G. terrae L-阿拉伯糖++--鼠李糖++++棉子糖++--肌醇++--D-木糖++--D-果糖++++甘露醇++++蔗糖++++D-葡萄糖++++
2.3.2 酶学特征
菌株的酶学特征测定结果如表3所示。比较菌株ZSM-1与S. nashvillensis、Z SM-2与G. terrae的生理生化指标发现,它们的生理生化指标基本相符。
表3 放线菌ZSM-1、ZSM-2与对照菌株S. nashvillensis、G. terrae生理生化指标
Table 3 Physiological and biochemical properties of actinomycetes ZSM-1 and ZSM-2 and the control strainsS. nashvillensis

注:NR. 未见报道。
生理生化指标ZSM-1S. nashvillensisZSM-2G. terrae明胶液化++-NR牛奶凝固与胨化++-NR淀粉水解++++纤维素水解++-NR硫化氢产生----硝酸盐还原+NR++
2.4 系统发育学分析
系统发育树是基于共同祖先原则,用于描述生物传代谱系的常用表达方式,可以直观地表达分类群(物种或基因)之间的亲缘关系和进化方向 [18]。
序列测定结果表明,菌株ZSM-1和ZSM-2的16S rDNA序列全长分别为1 448 、1 445 bp(图3),在EzBioCloud数据库中经序列相似性搜索,发现菌株ZSM-1与链霉菌属的菌株高度相关,ZSM-2与戈登式菌属的菌株高度相关,说明菌株ZSM-1是链霉菌属的成员,ZSM-2是戈登式菌属的成员。与菌株ZSM-1相似性最高的链霉菌属的有效种为Streptomyces nashvillensis,相似性为99.45%,与菌株ZSM-2相似性最高的戈登式菌属的有效种为Gordonia terrae,相似性为100%。基于16S rDNA基因序列的系统发育分析显示菌株ZSM-1与链霉菌菌株Streptomyces nashvillensis聚为一支,自展值为100%,菌株ZSM-2与Gordonia terrae聚为一支,自展值为100%,表现出非常近的亲缘关系(图4、5),因此初步将菌株ZSM-1和ZSM-2分别鉴定为S. nashvillensis和G. terrae。
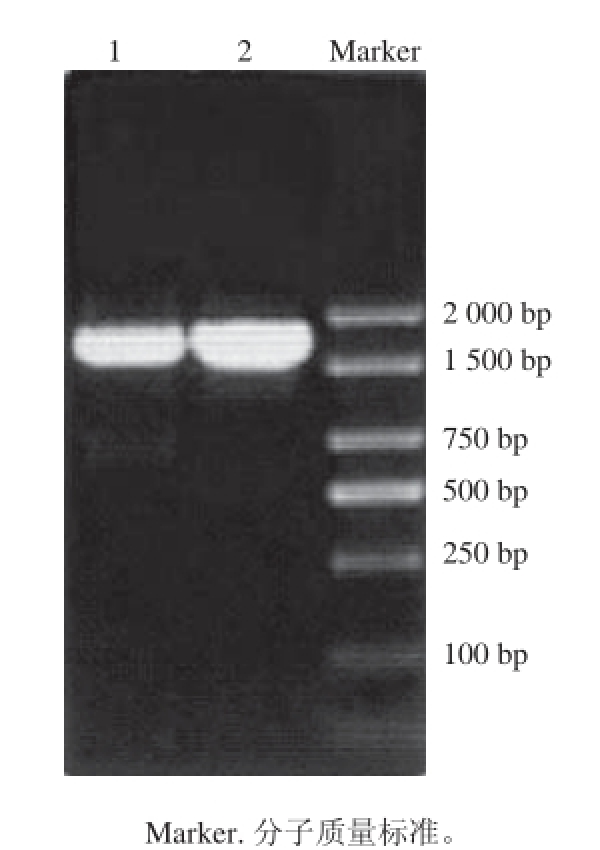
图3 ZSM-1和ZSM-2 16S rDNA的PCR扩增图谱
Fig. 3 PCR-amplifi ed fragments of the 16S rDNA from ZSM-1 and ZSM-2

图4 ZSM-1基于16S rDNA基因序列构建的系统发育树
Fig. 4 Phylogenetic tree constructed for ZSM-1 by Neighbor-Joining based on 16S rDNA gene sequences

图5 ZSM-2基于16S rDNA基因序列构建的系统发育树
Fig. 5 Phylogenetic tree constructed for ZSM-2 by Neighbor-Joining based on 16S rDNA gene sequences
综合培养特征、生理生化特征和16S rDNA序列分析结果,将菌株ZSM-1鉴定为放线菌纲Actinobacteria、链霉菌目Streptomycetales、链霉菌科Streptomycetaceae、链霉菌属Streptomyces、纳士维尔链霉菌Streptomyces nashvillensis。菌株ZSM-2鉴定为放线菌纲Actinobacteria、棒杆菌目Corynebacteriales、诺卡氏菌科Nocardiaceae、戈登式菌属Gordonia、土地戈登氏菌Gordonia terrae。
传统的放线菌分类鉴定主要通过观察菌种的形态特征、培养特征和生理生化特征等表型来确定其种属地位,鉴定的主要内容有:培养后观察菌落特征,显微镜下观察气生菌丝、基内菌丝、孢子丝的形状和生长状况,通过淀粉水解、碳源利用实验、明胶液化等酶活力测定实验 [19]。然而放线菌种类繁多,形态特征复杂,且少数形态特征和生理生化指标有可能随着环境的变化而发生改变,给分类鉴定工作带来不便。随着现代分子生物学的发展,DNA序列分析已被广泛应用到放线菌的鉴定中,尤其是通过分析放线菌16S rDNA序列来确定菌种在放线菌中的分类地位,已经成分鉴定放线菌的有效方法。
16S rDNA是编码原核生物核糖体小亚基rRNA(16S rRNA)的基因,是放线菌系统分类研究中最有用和最常用的分子钟,16S rDNA种类少,含量大(约占细菌RNA含量的80%),分子大小适中,存在于所有的生物中,进化具有良好的时钟性质,在结构与功能上具有高度的保守性 [20],素有“细菌化石”之称。由于其大小适中,约1.5 kb左右,既能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列,因此是种属鉴定的分子基础。
本实验采用培养特征、生理生化特征观察与分子生物学相结合的方法,对分离自土壤的2 株放线菌进行鉴定。提取菌株基因组DNA后,扩增16S rDNA基因片段并测序,测序结果在EzBioCloud数据库进行有效种的序列相似性搜索,下载与供试菌株16S rDNA序列同源性相近的菌株序列,构建16S rDNA基因序列进化树。根据进化树结果,结合培养特征、生理生化特征,将菌株ZSM-1鉴定为纳士维尔链霉菌Streptomyces nashvillensis,ZSM-2鉴定为土地戈登氏菌Gordonia terrae。
目前关于纳士维尔链霉菌和土地戈登氏菌的研究报道较少。纳士维尔链霉菌具有抑制阳性细菌和耐多种抗菌素的生物活性,宫彩霞 [21]将能够产生强抗肿瘤活性抗生素美达霉素(medermycin)的菌株AM-7161鉴定为纳士维尔链霉菌。Ikeda等 [22]利用同位素标记法研究了纳士维尔链霉菌所产抗生素Bellenamine的生物合成途径。Tsuchida等 [23]发现纳士维尔链霉菌能够产生抑制巴斯德菌(Pasteurella piscicida)的抗生素Tetrodecamycin和Dihydrotetrodecamycin,表明该菌具有产生抗生素的能力。研究报道发现Gordonia terrae可以降解污染土壤中的致癌性芳香族化合物奈。曹林等 [24]从活性污泥中分离出1 株Gordonia terrae,该菌株具有良好的异养硝化和好氧反硝化能力,能够去除活性污泥中的氨和氮,并且在硝化过程中没有亚硝酸盐氮或硝酸盐氮的累积。Hernandez-Perez等 [25]发现Gordonia terrae能够生物降解汽油中的高辛烷值调和组分。Wang Wei等 [26]发现土地戈登氏菌具有脱硫作用的遗传因子,可以将化石燃料燃烧产生的含硫化合物苯并噻吩(benzothiophene,BT)降解,避免造成环境污染。
放线菌的生长与代谢产物常常易受发酵条件和培养基成分的影响,不同的发酵条件与培养基往往产生不同的代谢产物。今后,将对菌株ZSM-1和ZSM-2的发酵条件进行优化,对其发酵产物进行分离纯化得到单体化合物,结合现代波谱学手段鉴定化合物的结构,以期发现具有生物活性的新型化合物。
参考文献:
[1] STACKEBRANDT E, RAINEY F A, WANDRAINEY N L. Proposal for a new hierarchic classifi cation system, Actinobacteria classis nov.[J]. International Journal of Systematic & Evolutionary Microbiology, 1997, 47(2): 479-491. DOI:10.1099/00207713-47-2-479.
[2] 姜云, 黄丽丽, 陈长卿, 等. 一株拮抗番茄叶霉病菌的放线菌筛选、鉴定及发酵条件研究[J]. 微生物学报, 2007, 47(4): 622-627. DOI:10.3321/j.issn:0001-6209.2007.04.011.
[3] 安德荣, 慕小倩, 刘翠娟, 等. 土壤拮抗放线菌的分离和筛选[J]. 微生物学杂志, 2002, 22(5): 1-3. DOI:10.3969/ j.issn.1005-7021.2002.05.001.
[4] 常显波. 不同环境海洋放线菌多样性研究2株放线菌新菌的分类鉴定[D]. 青岛: 中国海洋大学, 2011: 1-132. DOI:10.7666/d.y1928422.
[5] 胥秀英, 郑一敏. 土壤放线菌分离方法的初步研究[J]. 生物学杂志, 2000, 17(2): 17-18. DOI:10.3969/j.issn.2095-1736.2000.02.007.
[6] 焦少娟, 安德荣, 刘欢, 等. 土壤拮抗放线菌JSJ-129-08的筛选及活性产物的初步研究[J]. 西北农业学报, 2008, 17(5): 116-120. DOI:10.3969/j.iss n.1004-1389.2008.05.026.
[7] 孙强, 闫建芳, 刘秋, 等. 放线菌菌株MY02的鉴定及发酵液中抗真菌活性组分的分离[J]. 植物保护, 2007, 33(5): 71-74. DOI:10.3969/ j.issn.0529-1542.2007.05.015.
[8] USHA R, MALA K K, VENIL C K, et al. Screening of Actinomycetes from mangrove ecosystem for L-asparaginase activity and optimization by response surface methodology[J]. Polish Journal of Microbiology, 2011, 60(3): 213-221.
[9] FGUIRA F B, FOTSO S, AMEUR-MEHDI R B, et al. Purifi cation and structure elucidation of antifungal and antibacterial activities of newly isolated Streptomyces sp. strain US80[J]. Research in Microbiology, 2005, 156(3): 341-347. DOI:10.1016/j.resmic.2004.10.006.
[10] 叶海霞, 郭晓春, 丁祥, 等. 拮抗放线菌Y-71的鉴定及其代谢活性物质的性质[J]. 微生物通报, 2010, 37(8): 1182-1187. DOI:10.13344/ j.microbiol.china.2010.08.003.
[11] 王勇, 纪明山, 张文革, 等. 放线菌BOS-009的分离、拮抗活性及鉴定[J]. 农药, 2009, 48(2): 150-152. DOI:10.3969/ j.issn.1006-0413.2009.02.023.
[12] 吴春燕, 贺乐, 黄慧琴, 等. 抗流感病毒H1N1海绵放线菌的筛选及菌株HA10201的鉴定[J]. 中国海洋药物, 2012, 31(1): 6-9.DOI:10.13400/j.cnki.cjmd.2012.01.006.
[13] 中国科学院微生物所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975: 658-665.
[14] 杜连祥. 微生物学实验技术[M]. 北京: 中国轻工业出版社, 2006: 165.
[15] 阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992.
[16] TSUKAMURA M. Proposal of a new genus, Gordona, for slightly acid-fast organisms occurring in sputa of patients with pulmonary disease and in soil[J]. Journal of General Microbiology, 1971, 68(1): 15-26. DOI:10.1099/00221287-68-1-15.
[17] KIM S B, BROWN R, OLDFIELD C, et al. Gordonia amicalis sp. nov., a novel dibenzothiophene-desulphurizing actinomycete[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(6): 2031-2036. DOI:10.1099/00207713-50-6-2031.
[18] 韩凤侠. 共同祖先原则和系统发育树的解读[J]. 生物学通报, 2008, 43(9): 14-15. DOI:10.3969/j.issn.0006-3193.2008.09.006.
[19] 张纪忠. 微生物分类学[M]. 上海: 复旦大学出版社, 1990: 1-428.
[20] COENYE T, VANDAMME P. Intragenomic heterogeneity between multiple 16S ribosomal RNA operons in sequenced bacterial genomes[J]. FEMS Microbiology Letters, 2003, 228(1): 45-49. DOI:10.1016/S0378-1097(03)00717-1.
[21] 宫彩霞. 美达霉素产生菌菌种鉴定及调控基因med-ORF10的功能研究[D]. 武汉: 华中师范大学, 2010: 1-78. DOI:10.7666/d.y1681373.
[22] IKEDA Y, NAGANAWA H, KONDO S, et al. Biosynthesis of bellenamine by Streptomyces nashvillensis using stable isotope labeled compounds[J]. Journal of Antibiotics, 1992, 45(12): 1919-1924. DOI:10.7164/antibiotics.45.1919.
[23] TSUCHIDA T, IINUMA H, SAWA R, et al. Tetrodecamycin and dihydrotetrodecamycin, new antimicrobial antibiotics against Pasteurella piscicida produced by Streptomyces nashvillensis MJ885-mF8. II. structure determination[J]. Journal of Antibiotics, 1995, 48(10): 1110-1114. DOI:10.7164/antibiotics.48.1110.
[24] 曹林, 衣学文, 董滨, 等. 活性污泥中异养硝化-好氧反硝化菌的分离及其脱氮性能[J]. 净水技术, 2014(3): 91-95. DOI:10.3969/ j.issn.1009-0177.2014.03.018.
[25] HERNANDEZ-PEREZ G, FAYOLLE F, VANDECASTEELE J P. Biodegradation of ethyl t-butyl ether (ETBE), methyl t-butyl ether (MTBE) and t-amyl methyl ether (TAME) by Gordonia terrae[J]. Applied Microbiology & Biotechnology, 2001, 55(1): 117-121. DOI:10.1007/s002530000482.
[26] WANG W, MA T, LIAN K, et al. Genetic analysis of benzothiophene biodesulfurization pathway of Gordonia terrae strain C-6[J]. PLoS ONE, 2013, 8(12): e84386. DOI:10.1371/journal.pone.0084386.
Isolation and Identifi cation of Two Soil Actinomycetes ZSM-1 and ZSM-2
KONG Wangjun, JIANG Huifang, RAN Huomiao, WANG Ao, LÜ Man, YANG Ke, XIN Zhihong*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Actinomycete strains ZSM-1 and ZSM-2 isolated from soil were studied for their taxonomy. The 16S rDNA was amplifi ed by polymerase chain reaction (PCR) after the extraction of mycelial genomic DNA and the amplifi cation products were subjected to sequencing and homology analysis. A phylogenetic tree was established based on the sequences of 16S rDNA, and cultural characteristics, physiological and biochemical properties were evaluated as well. As a result, both strains were identifi ed as Streptomyces nashvillensis and Gordonia terrae, respectively.
Key words:Actinomycete; identifi cation; 16S rDNA gene; phylogenetic analysis
DOI:10.7506/spkx1002-6630-201611020
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2016)11-0114-06
引文格式:
孔望君, 蒋会芳, 冉火苗, 等. 两株土壤放线菌ZSM-1和ZSM-2的分离与鉴定[J]. 食品科学, 2016, 37(11): 114-119. DOI:10.7506/spkx1002-6630-201611020. http://www.spkx.net.cn
KONG Wangjun, JIANG Huifang, RAN Huomiao, et al. Isolation and identification of two soil actinomycetes ZSM-1 and ZSM-2[J]. Food Science, 2016, 37(11): 114-119. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611020. http://www.spkx.net.cn
收稿日期:2015-08-10
基金项目:2015年农产品质量安全风险评估项目(GJFP2015012)
作者简介:孔望君(1991—),男, 硕士研究生,研究方向为食品营养与安全。E-mail:2013108064@njau.edu.cn
*通信作者:辛志宏(1974—),男,教授,博士,研究方向为食品营养与安全。E-mail:xzhfood@njau.edu.cn