
杜静芳,缪璐欢,马欢欢,吕欣然,李 莹,白凤翎*,李 春,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
摘 要:阪崎肠杆菌(Enterobacter sakazakii)是引起新生儿败血症、脑膜炎和坏死性小肠结肠炎的条件致病菌,感染后死亡率高达80%。实验采用双层琼脂扩散法从淡水鱼肠道(19 株)和泡菜(7 株)中筛选出1 株来源于鲤鱼肠道的对Enterobacter sakazakii(10 6CFU/mL)具有较强拮抗作用的乳酸菌菌株LY-4。结果表明,抑菌活性物质存在于乳酸菌无细胞上清液(cell free supermatant,CFS)中,抑菌最佳培养时间为28 h。CFS经胃蛋白酶处理可完全丧失抑菌活性,中性蛋白酶和木瓜蛋白酶处理后抑菌活性降至76.44%和54.38%,对α-淀粉酶不敏感;在pH 3.0~4.5范围内保持抗菌活性稳定;经40~80 ℃范围内处理2 h后其拮抗活性基本不变,100 ℃和121 ℃处理2 h后活性降至79.57%和75.71%。初步判定菌株LY-4产生的抑菌物质为非糖基化类细菌素,并筛选出初步纯化抑菌物质的最佳萃取剂为乙酸乙酯,粗提物的最小抑菌浓度为6.0 mg/mL。经生理生化和16S rDNA鉴定为植物乳杆菌(Lactobacillus plantarum)。
关键词:乳酸菌;阪崎肠杆菌;鲤鱼肠道;筛选与鉴定;抑菌作用
阪崎肠杆菌(Enterobacter sakazakii)是近些年婴儿配方食品中新发现的肠杆菌科的一种条件致病菌 [1],1980年由黄色阴沟肠杆菌更名为阪崎肠杆菌(E. sakazakii),由其引发的婴儿和早产儿脑膜炎、败血症及坏死性结肠炎的病例已在全球相继出现,死亡率高达80%以上。研究证明,E. sakazakii可诱导肠壁上皮细胞产生NO引起IEC-6细胞死亡,增加坏死性小肠结肠炎的发病率 [2]。从1961年至今60多例关于E. sakazakii对不同人群感染率的报道显示婴儿属于E. sakazakii感染的高危人群 [3]。近几年国内也爆发了多起E. sakazakii的重大感染事件 [4],引起各界和研究人员的普遍关注。
乳酸菌通过形成乳酸、乙酸等有机酸、过氧化氢、双乙酰、乳酸菌素、罗伊菌素、羟基脂肪酸、环状肽等抑菌物质,有效地控制食品中致腐和致病微生物的生长 [5]。乳酸菌在自然界中分布广泛,从发酵乳制品、发酵肉制品、发酵面团、泡菜以及人畜胃肠道均可分离获得对金黄色葡萄球菌、沙门氏菌、副溶血弧菌、单核增生李斯特菌和大肠杆菌O157:H7等具有拮抗性的乳酸菌菌株 [6-10]。Saddam等 [11]研究分离自婴儿粪便中的Lb. acidophilus和Lb. cas ei,发现两者对E. sakazakii的抑菌圈直径分别达到22.0 mm和32.0 mm,并鉴定出抑菌物质为不耐热的细菌素类。Shaker等 [12]以牛奶为载体研究乳酸菌对E. sakazakii的抑制作用,发现5 h后E. sakazaki i数量开始变化,实验组中E. sakazakii的数量开始减少,7 d后降至3.08(lg(CFU/mL)),而对照组增加至5.40(lg(CFU/mL)),说明乳酸菌可显著抑制牛奶中E. sakazakii生长繁殖。Hunter等 [13]通过动物实验证实Lb. bulgaricus能够减少肠壁中NO的产生,保护肠细胞的完整性,降低由E. sakazakii引起的坏死性小肠结肠炎发病率。目前国内针对E. sakazakii拮抗性乳酸菌的筛选与研究未见报道。本实验从淡水鱼肠道和泡菜中筛选对E. sakazakii具有拮抗作用的乳酸菌菌株,对其抑菌作用物质进行初步研究,为应用乳酸菌生物制剂控制食品中E. sakazakii奠定理论与应用基础。
1.1 材料与仪器
1.1.1 菌株
应试菌株:Enterobacter sakazakii ATCC29004,购自中国工业微生物菌种保藏管理中心,由渤海大学食品科学研究院保藏;供试菌株:7 株乳酸菌分离自辽西地区传统发酵酸菜,19 株乳酸菌分离自鲤鱼、鳙鱼、鲫鱼和镜鲤等淡水鱼肠道。
1.1.2 培养基与试剂
MRS培养基、LB肉汤、营养琼脂 北京奥博星生物技术有限公司;细菌基因组DNA快速抽提试剂盒、DNA Marker-D、Taq PCR Master mix 生工生物工程(上海)股份有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司。
1.1.3 仪器与设备
DL-CJ-2N型超级洁净工作台 东联哈尔(北京)仪器制造有限公司;赛福智能生化培养箱 宁波海曙赛福实验仪器厂;5804R冷冻高速离心机 德国Eppendorf公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 德国艾本德股份有限公司;DYY-8C电泳仪北京市六一仪器厂;Cheimdox XRS凝胶成像仪 美国Bio-Rad公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;LabconcoFreeZone 2.5台式真空冷冻干燥机美国Labconco公司。
1.2 方法
1.2.1 乳酸菌菌株的拮抗实验
分别取渤海大学食品科学与工程学院微生物学与分子生物学实验室保藏的分离自淡水鱼肠道和泡菜中的乳酸菌,在MRS液体中活化3 代后取菌株24 h MRS发酵液经4 ℃、8 000 r/min离心5 min的菌体和上清液,上清液经0.45 μm滤器过滤获无细胞上清液(cell free supernatant,CFS);E. sakazakii ATCC29004在LB肉汤中活化(37 ℃恒温、静置培养12 h)至3 代,浓度维持在10 7CFU/mL水平(通过菌落计数得出),以稀释10 倍后浓度达到10 6CFU/mL的E. sakazakii菌悬液为指示菌,参照文献[14]利用双层琼脂扩散法进行拮抗性实验,筛选拮抗性强的乳酸菌菌株,设置3 个平行。
1.2.2 拮抗性乳酸菌的筛选与鉴定
参照方法1.2.1节筛选效果较好的乳酸菌菌株。
生理生化鉴定:对筛选的乳酸菌菌株参照《乳酸细菌分类鉴定及实验方法》和《常见细菌系统鉴定手册》中乳酸菌的鉴定方法进行生理生化鉴定 [15-16]。
分子生物学鉴定:选取筛选出的乳酸菌菌株对数期培养物用DNA快速抽提试剂盒提取菌株DNA。采用通用引物,正向引物为27f(5’-AGAGTTTGATCCTGGCTCAG-3’),反向引物为1492r(5’-TACGGYTACCTTTGTTACGACTT-3’)。PCR扩增反应体系(25 μL):上下游引物各1 μL,DNA模板1 μL,Taq PCR Master mix 12.5 μL,超纯水9.5 μL。PCR扩增反应程序:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,循环30 次,4 ℃保温。PCR产物大小经1.0%琼脂糖凝胶电泳检测验证后送生工生物工程(上海)股份有限公司进行测序。测得序列登录GenBank进行BLAST同源性比较,应用MEGA5.0软件构建系统发育进化树。
1.2.3 乳酸菌生长与拮抗活性曲线
取0.3 mL乳酸菌菌悬液接种于15 mL MRS液体培养基,置于37 ℃恒温培养箱中静置培养,每隔4 h取菌株CFS按照1.2.1节测定抑菌活性。同时,在580 nm波长处测定菌株细胞生长量和pH值。
1.2.4 乳酸菌拮抗性能研究
酶敏感性实验:在菌株CFS中分别加入胃蛋白酶、中性蛋白酶、木瓜蛋白酶和α-淀粉酶,使最终质量浓度达到1.0 mg/mL,37 ℃水浴中孵育2 h,参照1.2.1节测定抑菌活性。未经酶处理的菌株CFS为对照组。并计算抑菌活性丧失率。

热稳定性实验:将菌株CFS分别在40、60、80、100 ℃和121 ℃条件下处理2 h后,按照1.2.1节测定抑菌活性。
pH值实验:应用1.0 mol/L的HCl和1.0 mol/L的NaOH将菌株CFS的pH值分别调节为3.0、3.5、4.0、4.5、5.0、5.5和6.0,参照1.2.1节测定抑菌活性。
1.2.5 乳酸菌拮抗物质的初步提取
根据分子质量大小及耐热性可将乳酸菌产生的细菌素分为4 类 [17],本实验细菌素的初步分离纯化分2 步进行,先采用硫酸铵沉淀法确定分子质量的大致范围,后用有机溶剂来进行萃取初步纯化细菌素 [18]。
硫酸铵沉淀法:采用二次盐析法,加硫酸铵粉末到CFS中使其饱和度达到30%,4 ℃放置12 h后4 ℃、8 000 r/min离心30 min,取上清液继续加入硫酸铵至饱和度为80%,放置12 h后离心取沉淀,用无菌水溶解后测抑菌活性 [18]。
有机溶剂萃取:如果硫酸铵沉淀效果不佳,则可以认为该细菌素为小分子蛋白,采用有机溶剂萃取法来获取细菌素。选取乙酸乙酯、石油醚、乙醚作为萃取剂,参考文献[18]进行实验。取乳酸菌CFS 100 mL于干净的分液漏斗中,有机溶剂100 mL分5 次每次加入20 mL进行萃取,加入溶剂后沿同一方向轻轻振荡,使两者充分混匀后静置,待分层明显取有机相于另一个三角瓶中,将5 次萃取液合并,于45 ℃、100 r/min真空旋转蒸发直至溶液中无有机溶剂气味,将残留液转存于灭菌的离心管中,4 ℃保存备用。
1.2.6 乳酸菌最小抑菌浓度(minimal inhibitory concentration,MIC)的测定
MIC测定参考文献[19]两倍微量稀释肉汤法并稍作修改进行测定。用旋转蒸发器将乙酸乙酯萃取后的粗提物蒸发至无有机溶剂气味,真空冷冻干燥制成粉末,置于-18 ℃冰箱保存备用。用LB液体培养基将粗提物粉末稀释至终浓度为24.0、12.0、6.0、3.0、1.5、0.75、0.25、0.375 mg/mL。取5.0 mL为实验组,以不加粗提物的LB培养基为对照组,分别加入200 μL、10 6CFU/mL指示菌菌悬液,37 ℃恒温静置培养24 h,肉眼观察,无混浊现象的最低浓度为粗提物的最小抑菌浓度,每组重复3 次。
1.3 实验数据处理
采用Microsoft Excel 2010和Origin 8.0进行实验数据分析处理,数据平行3 次,结果表示为±s。
2.1 拮抗性乳酸菌的筛选
采用双层琼脂扩散法从2 种乳酸菌菌源中筛选出1 株对E. sakazakii抑菌效果较好的菌株见表1(其中乳酸菌菌体无抑制作用,未列出),指示菌菌悬液浓度调节至10 6CFU/mL。从中可以看出26 株乳酸菌均能够拮抗E. sakazakii,鱼源乳酸菌总体效果优于泡菜源乳酸菌,其中分离自鲤鱼肠道的菌株LY-4效果最好,抑菌圈直径为19.89 mm,因此,选取菌株LY-4进行后续实验。
表1 乳酸菌CFS对阪崎肠杆菌的抑制作用
Table 1 Antagonistic effect of CFS from lactic acid bacteria against E. sakazakii
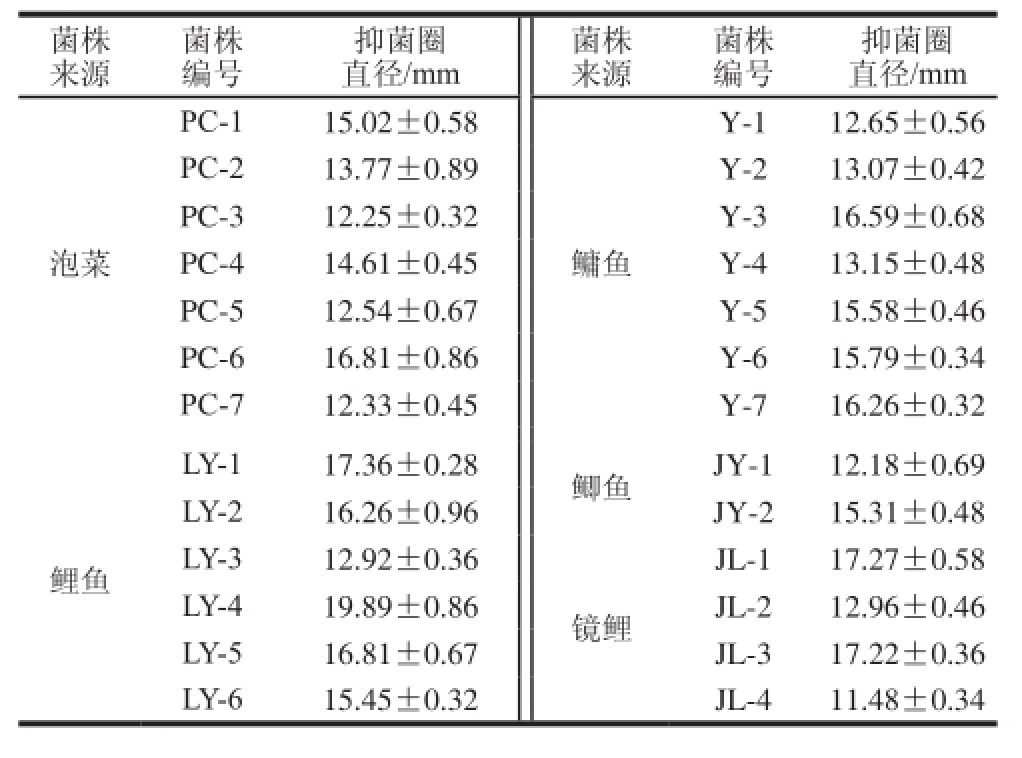
菌株来源菌株编号抑菌圈直径/mm菌株来源菌株编号抑菌圈直径/mm PC-115.02±0.58 Y-112.65±0.56 PC-213.77±0.89Y-213.07±0.42 PC-312.25±0.32Y-316.59±0.68 PC-414.61±0.45Y-413.15±0.48 PC-512.54±0.67Y-515.58±0.46 PC-616.81±0.86Y-615.79±0.34 PC-712.33±0.45Y-716.26±0.32泡菜鳙鱼LY-117.36±0.28鲫鱼JY-112.18±0.69 LY-216.26±0.96JY-215.31±0.48 LY-312.92±0.36镜鲤鲤鱼JL-117.27±0.58 LY-419.89±0.86JL-212.96±0.46 LY-516.81±0.67JL-317.22±0.36 LY-615.45±0.32JL-411.48±0.34
2.2 拮抗性乳酸菌的鉴定
菌株LY-4的生理生化鉴定结果见表2,依照文献[16]可初步判定菌株LY-4为乳杆菌属的Lb. plantarum。
表2 菌株LY-4的生理生化鉴定结果
Table 2 Physiological and biochemical identifi cation of strain LY-4

注:+. 反应呈阳性;-. 反应呈阴性。
项目结果项目结果阿拉伯糖-甘露醇+纤维二糖+甘露糖+七叶灵+松三糖+果糖+蜜二糖+半乳糖+棉子糖+葡萄糖+鼠李糖-葡萄糖酸盐-山梨醇-乳糖+蔗糖+麦芽糖+木糖+

图1 菌株LY-4的16S rRNA基因扩增电泳图
Fig. 1 PCR amplifi cation of the 16S rRNA gene of strain LY-4
图1 是菌株LY-4的16S rRNA基因扩增电泳图,可以看到在1 500 bp处出现特异性亮带,表明目标片段被成功扩增。扩增产物送至生工生物工程(上海)股份有限公司测序,获得菌株LY-4的16S rDNA核苷酸序列。将菌株测序结果与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库中进行BLAST比对,选取相似性较高的几株菌的16S rDNA序列,用MEGA5.05构建系统发育树,结果见图2。菌株LY-4与Lb. plantarum FJ378889.1在同一个分支上,置信度为99%,因此菌株LY-4被鉴定为植物乳杆菌(Lb. plantarum),此结果与生理生化鉴定结果一致。
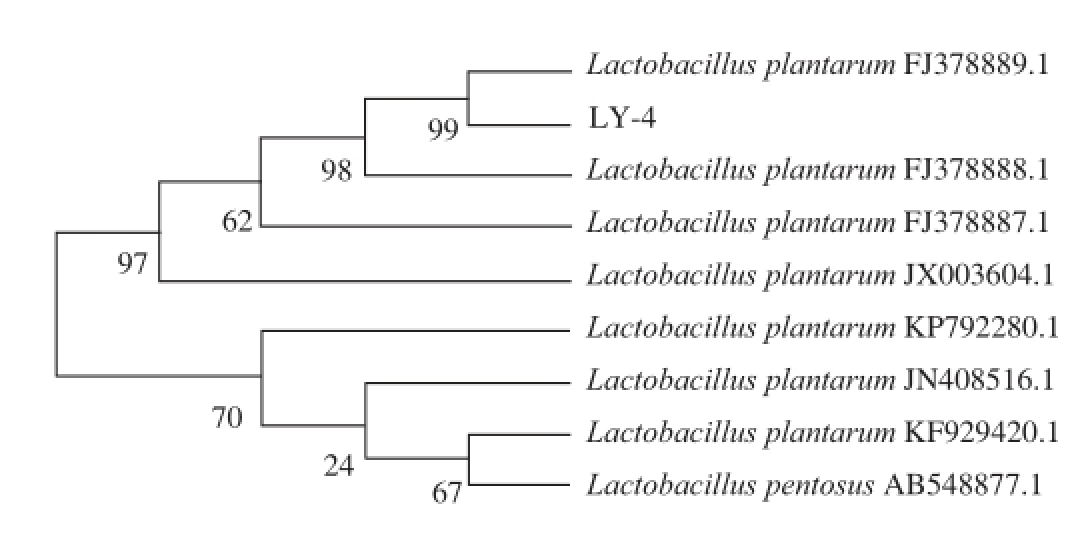
图2 菌株LY-4的16S rDNA系统发育树
Fig. 2 Phylogenetic tree of strain LY-4 based on 16S rDNA sequence
2.3 乳酸菌生长与拮抗活性曲线

图3 乳酸菌LY-4生长和拮抗活性曲线
Fig. 3 Growth and antagonistic activity curves of strain LY-4
菌株LY-4对E. sakazakii ATCC29004的抑菌活性、生长和pH值变化曲线如图3所示,菌株LY-4对ATCC29004的抑菌活性与细胞生长量之间呈现同步增长趋势,在稳定期表现为平稳状态。随着抑菌活性和细胞生长量的增加,pH值呈现迅速下降在16 h后趋于平稳状态。LY-4对ATCC29004的最大抑菌活性为28 h的CFS,说明在稳定后期菌株产生抑菌活性物质,因此28 h时菌株发酵液的CFS是作为研究抑菌作用的最佳选择。
2.4 乳酸菌拮抗性能结果
2.4.1 酶处理的影响
菌株LY-4的CFS经木瓜蛋白酶、中性蛋白酶、胃蛋白酶和α-淀粉酶37 ℃处理2 h后对ATCC29004的抑菌结果见表3,与对照组相比,经蛋白酶处理后对E. sakazakii的抑菌活性均降低,对胃蛋白酶的敏感性最高,抑菌活性完全丧失,其次是木瓜蛋白酶,活性丧失率为45.62%,变化最小的为中性蛋白酶。经α-淀粉酶处理后,菌株LY-4的活性基本不变。从酶处理的结果来看,可知LY-4的抑菌活性物质具有蛋白性质,可初步判定LY-4所产生的抑菌物质为非糖基化类蛋白 [20]。Jang等 [21]研究分离自泡菜的Pediococcus pentosaceus T1对Listeria monocytogenes有很好的抑制作用,对抑菌物质进一步分离纯化后发现为含有LysM结构域的蛋白,其分子质量为23 kD。Miao Jianyin等 [22]用基质辅助激光解吸飞行时间串联质谱(matrix-associated laser desorption-ionization time of fl ight mass spectrmtry,MALDI-TOF/MS)方法研究出分离自西藏藏灵菇中的Lb. paracase所产生的细菌素F1分子质量为2.1 kD,且有封闭的N末端,对真菌和细菌有抑制作用。
表3 酶处理对菌株LY-4拮抗阪崎肠杆菌活性的影响
Table 3 Effect of enzymatic treatment on antagonistic activity of strain LY-4 against E. sakazakii

酶种类抑菌圈直径/mm活性丧失率/%木瓜蛋白酶10.07±0.6945.62中性蛋白酶14.15±0.8423.56胃蛋白酶100 α-淀粉酶18.14±0.822对照18.51±0.110
2.4.2 热处理的影响
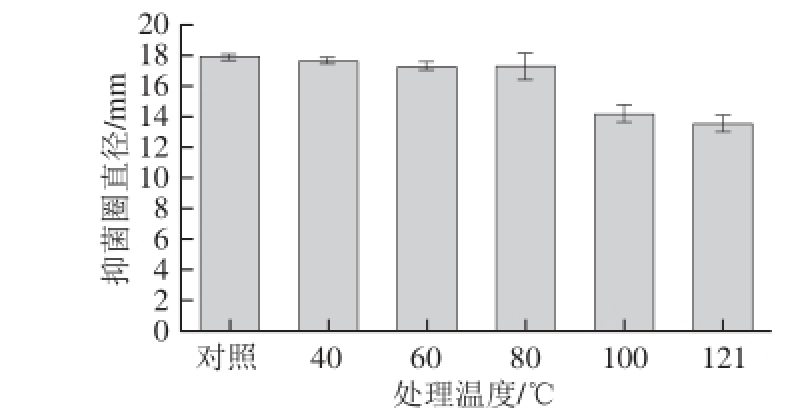
图4 热处理对菌株CFS拮抗阪崎肠杆菌活性的影响
Fig. 4 Effect of th ermal treatment on antagonistic activity of CFS against E. sakazakii
不同温度热处理后,菌株LY-4的CFS抑菌活性变化结果如图4所示。菌株LY-4的代谢产物经40、60 ℃和80 ℃处理2 h后,抑菌活性基本不变,经100 ℃和121 ℃处理2 h后E. sakazakii的抑菌活性仍保留原活性的79.57%和75.71%,表明其代谢产物具有较好的稳定性。这和Miao Jianyin [22]、Lü Xin [23]及Todorov [24]等的研究结果一致。
2.4.3 pH值处理的影响
不同pH值条件下菌株LY-4的CFS对阪崎肠杆菌的抑菌活性变化情况如图5所示。乳酸菌CFS的抑菌活性随着pH值的升高呈现逐渐降低趋势,其中,当pH 3.0时,抑菌效果最好;当pH值大于3.94(菌株CFS的pH值)时,抑菌活性基本不变;当pH值为4.5时,抑菌活性变为原来的87.28%;当pH值大于5.0时,抑菌活性消失(数据未列出),表明菌株CFS中除含有乳酸等酸性代谢物质,还具有其他抑菌活性成分,且该抑菌成分在酸性条件下活性较好。Lü Xin等 [23]研究分离自中国传统发酵蔬菜中的Lb. coryniformis MXJ32可产生Lactocin MXJ32A,能够抑制多种食源性致病菌,且具有很好的pH值耐受性和热稳定性。Casaburi等 [25]对分离自意大利传统发酵香肠中的Lactobacillus curvatus 54M16所产乳酸菌素经反相高效液相色谱(reversed phase highperformance liquid chromatography,RP-HPLC)纯化,通过MALDI-TOF/MS后得出分子质量为2.5 kD,该乳酸菌素具有很好的pH值耐受性。
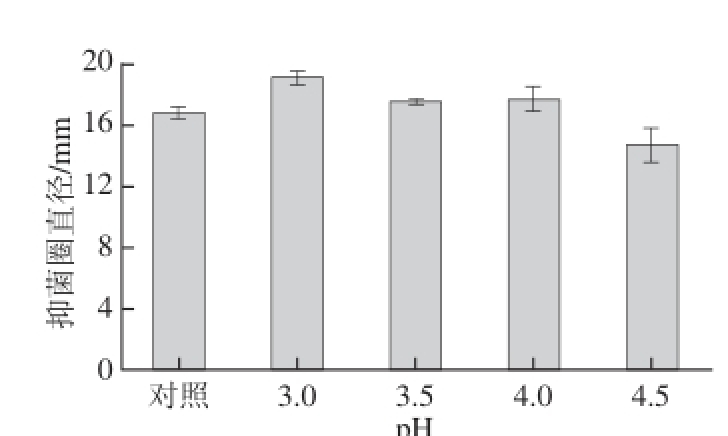
图5 pH值处理对菌株CFS拮抗阪崎肠杆菌活性的影响
Fig. 5 Effect of pH on antagonistic activity of CFS against E. sakazakii
2.5 乳酸菌拮抗物质的初步纯化菌株LY-4的CFS经二次盐析后收集的沉淀基本无抑菌效果,而CFS(pH值为3.94)的抑菌效果显著,结果如图6所示,硫酸铵沉淀无法初步纯化细菌素,认为该株菌所产抑菌物质为小分子质量的蛋白,采用有机溶剂萃取法初步纯化细菌素。

图6 菌株LY-4的CFS硫酸铵沉淀抑菌效果
Fig. 6 Antibacterial effect of CFS after ammonium sulfate precipitation
2.5.1 最佳萃取剂选择
选用乙酸乙酯、乙醚、石油醚3 种有机溶剂萃取,细菌素在有机溶剂中的溶解度大于在水相中的溶解度,因此抑菌活性物质大部分被萃取到有机相中,将有机相经旋转蒸发至无有机溶剂气味后进行抑菌实验,结果如表4和图7所示。相比对照组的抑菌效果(抑菌圈直径(18.35±0.41) mm),乙酸乙酯的萃取效果最好,萃取后抑菌圈直径明显大于乙醚、石油醚和未经萃取的CFS,乙醚效果次之,石油醚效果最差。乙酸乙酯初步纯化细菌素效果较为明显,粗提蛋白后的上层溶液抑菌效果微弱,可见初步粗提较为完全。因此选择乙酸乙酯为最佳萃取剂进行后续实验。
表4 菌株LY-4抑菌物质的有机溶剂粗提取抑菌效果
Table 4 Antimicrobial substances extracted from strain LY-4 mm

溶剂硫酸铵沉淀乙酸乙酯萃取乙醚萃取石油醚萃取有机相14.33±0.1723.91±0.9516.22±0.7215.50±0.64水相12.26±0.3513.69±0.4114.96±0.4114.96±0.48
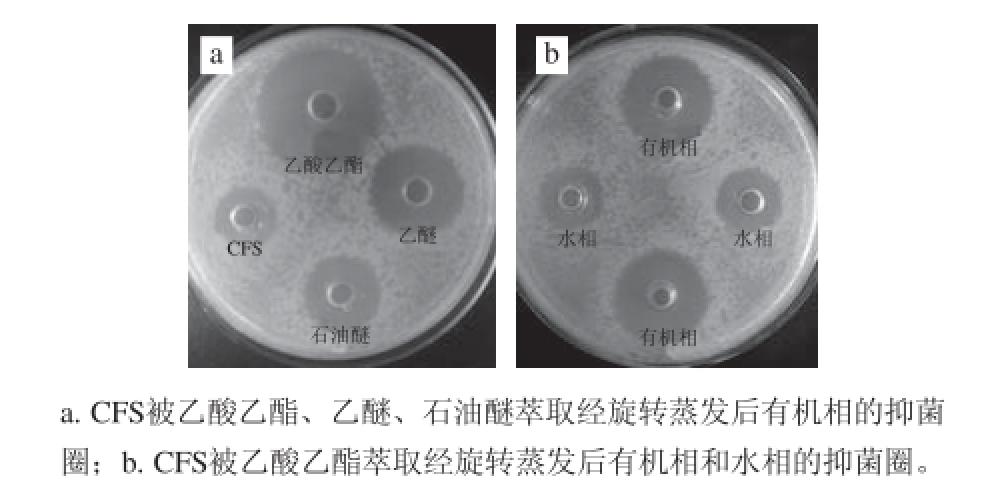
图7 有机溶剂萃取后抑菌效果
Fig. 7 Antibacterial effect of fractions obtained from successive organic solvent extraction of CFS
2.5.2 最小抑菌浓度MIC的测定结果
用无菌LB液体将粗提物粉末制成终质量浓度分别为24.0、12.0、6.0、3.0、1.5、0.75、0.25、0.375 mg/mL的溶液。取5.0 mL加入100 μL的10 6CFU/mL指示菌菌悬液,37 ℃静置、恒温培养24 h,肉眼观察6.0 mg/mL及其以上质量浓度的试管无混浊现象,确定6.0 mg/mL为粗提物对E. sakazakii的MIC。Lu Xin等 [17]研究分离自骆驼乳中的Lb. casei TN-2所产生的类细菌素物质对Escherichia coli ATCC25922和Staphylococcus aureus ATCC25923的MIC分别为2.5 mg/mL和5.0 mg/mL。
本实验分离的乳酸菌是一类对其他微生物有拮抗作用的细菌类群。本实验从淡水鱼肠道和泡菜中筛选出1 株拮抗E. sakazakii效果较好的乳酸菌菌株LY-4,其抑菌活性物质主要来自于菌株的CFS中,恒温静置培养28 h后的CFS抑菌活性最高。低酸环境能够协同抑菌活性,pH值在4.5以下均能抑制E. sakazakii生长。经121 ℃处理2 h后抑菌活性仍保留75.71%,说明该抑菌物质有较好的热稳定性。菌株CFS经不同蛋白酶处理后抑菌活性均有下降,对α-淀粉酶不敏感,可初步判定抑菌活性物质为非糖基化的细菌素类。对抑菌物质采用硫酸铵沉淀和有机溶剂萃取进行初步纯化,选出乙酸乙酯为该抑菌物质的最佳萃取剂,经旋转蒸发、真空冷冻干燥后进行抑菌实验得出该粗提物的最小抑菌浓度为6.0 mg/mL。经生理生化和16S rDNA鉴定为植物乳杆菌(Lb. plantarum)。
参考文献:
[1] 逯玉东, 闫春明, 王金月, 等. 海藻糖对阪崎肠杆菌温度耐受性的影响研究[J]. 现代农业科技, 2014(9): 296-297.
[2] ACKER J V, SMET F D, MUYLDEMANS G, et al. Outbreak of necrotizing enterocolitis associated with Enterobacter sakazakii in powdered milk formula[J]. Journal of Clinical Microbiology, 2001, 39(1): 293-297.
[3] GALLAGHER P G, BALL W S. Cerebral infarction due to CNS infection with Enterobacter sakazakii[J]. Pediatric Radiology, 1991, 21(2): 135-136. DOI:10.1007/BF02015629.
[4] 刘秀梅, 裴晓燕, 郭云昌. 中国安徽阜阳劣质婴儿配方粉中阪崎肠杆菌的污染[J]. 中国食品卫生杂志, 2005, 17(1): 10-12. DOI:10.3969/j.issn.1004-8456.2005.01.003.
[5] 白凤翎, 励建荣. 抗真菌性乳酸菌生物保护剂的研究进展[J]. 现代食品科技, 2014(5): 311-319. DOI:10.13982/j.mfst.1673-9078.2014.05.048.
[6] PRAGALAKI T, BLOUKAS J G, KOTZEKIDOU P. Inhibition of Listeria monocytogenes and Escherichia coli O157:H7 in liquid broth medium and during processing of fermented sausage using autochthonous starter cultures[J]. Meat Science, 2013, 95(3): 458-464. DOI:10.1016/j.meatsci.2013.05.034.
[7] SARANIYA A, JEEVARATNAM K. Purifi cation and mode of action of antilisterial bacteriocins produced by Lactobacillus pentosus SJ65 isolated from uttapam batter[J]. Journal of Food Biochemistry, 2014, 38(6): 612-619. DOI:10.1111/jfbc.12098.
[8] H-KITTIKUN A, BISCOLA V, El-GHAISH S, et al. Bacteriocinproducing Enterococcus faecalis KT2W2G isolated from mangrove forests in southern Thailand: purifi cation, characterization and safety evaluation[J]. Food Control, 2015, 54: 126-134. DOI:10.1016/ j.foodcont.2014.12.037.
[9] BALCIUNAS E M, MARTINEZ F A C, TODOROV S D, et al. Novel biotechnological applications of bacteriocins: a review[J]. Food Control, 2013, 32(1): 134-142. DOI:10.1016/j.foodcont.2012.11.025.
[10] GEREZ C L, TORRES M J, FONT V G, et al. Control of spoilage fungi by lactic acid bacteria[J]. Biological Control, 2013, 64(3): 231-237. DOI:10.1016/j.biocontrol.2012.10.009.
[11] SADDAM S, WAISHEH A, ANAS A, et al. Inhibition of Cronobacter sakazakii by heat labile bacteriocins produced by probiotic LAB isolated from healthy infants[J]. Journal of Food Science, 2013, 78(9): 1416-1420. DOI:10.111 1/1750-3841.12209.
[12] SHAKER R R, OSAILI T M, AYYASH M. Effect of thermophilic lactic acid bacteria on the fate of Enterobacter sakazakii during processing and storage of plain yogurt[J]. Journal of Food Safety, 2008, 28(2): 170-182. DOI:10.1111/j.1745-4565.2008.00111.x.
[13] HUNTER C J, WILLIAMS M, PETROSYAN M, et al. Lactobacillus bulgaricus prevents intestinal epithe lial cell injury caused by Enterobacter sakazakii induced nitric oxide both in vitro and in the newborn rat model of necrotizing enterocolitis[J]. Infection & Immunity, 2009, 77(3): 1031-1043. DOI:10.1016/ j.psychsport.2007.12.002.
[14] 于娜, 陈忠军. 具有抑菌作用乳酸菌的筛选及其抑菌物质特性的研究[J]. 食品科技, 2011, 36(5): 13-17. DOI:10.13684/j.cnki. spkj.2011.05.029.
[15] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 130-137. DOI:10.13344/j.microbiol. china.1999.01.007.
[16] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 289-294.
[17] LU Xin, HU Pan, DANG Ying, et al. Purification and partial characterization of a novel bacteriocin produced by Lactobacillus casei TN-2 isolated from fermented camel milk (Shubat) of Xinjiang Uygur Autonomous region, China[J]. Food Control, 2014, 43(5): 276-283. DOI:10.1016/j.foodcont.2014.03.020.
[18] 张瑜. LS-8乳酸菌细菌素的分离纯化[D]. 杨凌: 西北农林科技大学, 2013.
[19] 乔支红, 程永强, 鲁战会, 等. 乳酸对三种食源性致病菌的抑菌及杀菌作用[J]. 食品科技, 2008, 33(10): 187-191. DOI:10.13684/j.cnki. spkj.2008.10.072.
[20] SIP A, WIECKOWICZ M, OLEJNIK S A, et al. Anti-listeria activity of lactic acid bacteria isolated from golka, a regional cheese produced in Poland[J]. Food Control, 2012, 26(1): 117-124. DOI:10.1016/ j.foodcont.2012.01.014.
[21] JANG S, LEE J, JUNG U, et al. Identification of an anti-listerial domain from Pediococcus pentosaceus T1 derived from kimchi, a traditional fermented vegetable[J]. Food Control, 2014, 43: 42-48. DOI:10.1016/j.foodcont.2014.02.040.
[22] MIAO Jianyin, GUO Haoxian, OU Yangwen, et al. Purifi cation and characterization of bacteriocin F1, a novel bacteriocin produced by Lactobacillus paracasei subsp. tolerans FX-6 from Tibetan kefir, a traditional fermented milk from Tibet, China[J]. Food Control, 2014, 42(3): 48-53. DOI:10.1016/j.foodcont.2014.01.041.
[23] LÜ Xin, LI Lanhua, DANG Jing, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including anti biotic-resistant microorganisms[J]. Food Control, 2014, 46: 264-271. DOI:10.1016/ j.foodcont.2014.05.028.
[24] TODOROV S D, HO P, VAZ-VELHO M, et al. Characterization of bacteriocins produced by two strains of Lactobacillus plantarum isolated from Beloura and Chourico, traditional pork products from Portugal[J]. Meat Science, 2010, 84(3): 334-343. DOI:10.1016/ j.meatsci.2009.08.053.
[25] CASABURI A, MARTINO V D, FERRANTI P, et al. Technological properties and bacteriocins production by Lactobacillus curvatus 54M16 and its use as starter culture for fermented sausage manufacture[J]. Food Control, 2016, 59: 31-45. DOI:10.1016/ j.foodcont.2015.05.016.
Screening and Identifi cation of Lactic Acid Bacteria Antagonistic against Enterobacter sakazakii
DU Jingfang, MIAO Luhuan, MA Huanhuan, LÜ Xinran, LI Ying, BAI Fengling*, LI Chun, LI Jianrong
(National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food Science and Technology, Bohai University, Jinzhou 121013, China)
Abstract:Enterobacter sakazakii is an opportunistic pathogen that can cause neonatal septicemia and cephalomeningitis and necrotizing enterocolitis with mortality rate of 80%. Lactic acid bacteria with inhibitory activity against E. sakazakii were isolated from the intestine of freshwater fi sh and pickles by double-layer agar diffusion method. The lactic acid bacterial strain isolated from the intestine of common carp, named as LY-4, showed the highest inhibitory activity, which was mainly derived from its cell-free culture supernatant (CFS). The CFS showed the strongest antagonistic activity when the strain was cultured for 28 h. The antagonistic activity was lost entirely after treatment with pepsin, and degraded sharply to 76.44% and 54.38% by treatment with neutral protease and papain, respectively, but it was not sensitive to α-amylase, and was stable at pH 3.0–4.5. The antagonistic activity remained basically unchanged after thermal treatment at temperatures between 40 and 80 ℃ for 2 h, but declined to 79.57% and 75.71% of its original value after incubation at 100 ℃ and 121 ℃ for 2 h, respectively. The inhibitory substance was determined as a non-glycosylated bacteriocin, which was found to be the most extractable with ethyl acetate. The minimum inhibitory concentration (MIC) of this bacteriocin was 6.0 mg/mL. The strain LY-4 was identifi ed as Lactobacillus plantarum by physiological and biochemical characteristics and 16S rDNA sequence.
Key words:lactic acid bacteria; Enterobacter sakazakii; common carp intestine; screening and identifi cation; antagonism
DOI:10.7506/spkx1002-6630-201611022
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)11-0125-06
引文格式:
杜静芳, 缪璐欢, 马欢欢, 等. 拮抗阪崎肠杆菌乳酸菌的筛选鉴定及抑菌特性[J]. 食品科学, 2016, 37(11): 125-130.
DOI:10.7506/spkx1002-6630-201611022. http://www.spkx.net.cn DU Jingfang, MIAO Luhuan, MA Huanhuan, et al. Screening and identifi cation of lactic acid bacteria antagonistic against Enterobacter sakazakii[J]. Food Science, 2016, 37(11): 125-130. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611022. http://www.spkx.net.cn
收稿日期:2015-07-18
基金项目:辽宁省科技厅攻关项目“海水鱼加工副产物的高值化利用关键技术及产业化”(2015103020);辽宁省高等学校创新团队课题(LT2014024)
作者简介:杜静芳(1988—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:dujingfang2013@163.com
*通信作者:白凤翎(1964—),男,教授,博士,研究方向为食品安全与质量控制和食品微生物学。E-mail:baifl ing@163.com