广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化
高 鹏,韩金志,陆兆新,吕凤霞,赵海珍,张 充,别小妹*
(南京农业大学食品科学与技术学院,江苏 南京 210095)
摘 要:本研究从黑龙江传统自制酸菜中分离到1 株产抑菌活性物质的乳酸菌HLJ-174,其发酵产物排除有机酸、H
2O
2等干扰因素后对大肠杆菌、荧光假单胞菌、蜡样芽孢杆菌和藤黄微球菌等食品中常见的致病菌有广谱抑菌活性。通过形态学、生理生化和16S rRNA序列分析鉴定该菌株为植物乳杆菌(Lactobacillus plantarum),命名为Lactobacillus plantarum HLJ-174。研究了利用有机溶剂萃取的方法提取细菌素,发现正丁醇、乙酸乙酯萃取效果较好,正己烷、二氯甲烷、三氯甲烷、四氯化碳、丙酮、乙醇等没有效果。使用不同体积的正丁醇和乙酸乙酯(0.5、1.0、1.5、2.0、2.5、3.0 倍发酵液体积)萃取,发现1.5 倍发酵液体积的正丁醇效果最好。利用Sephadex LH-20对萃取产物进行了进一步分离,得到的活性物质对大肠杆菌和蜡样芽孢杆菌等具有较强的抑菌活性。
关键词:乳酸菌;细菌素;菌株鉴定;萃取
细菌素是某些细菌在代谢过程中通过核糖体合成的一类具有抑菌活性的多肽或前体多肽,对革兰氏阳性细菌和一些亲缘关系相近的乳酸菌有抑制作用
[1]。乳酸菌是“公认安全”(generally recognized as safe,GRAS)的微生物,其产物允许应用于食品中
[2]。到目前为止乳酸菌细菌素没有发现耐药菌,能抑制病原微生物、腐败性细菌的生长繁殖,在食品添加剂、饲料添加剂、医药等方面都有应用前景。
根据Bactibase数据库统计显示,目前发现且阐明一级结构的细菌素已经超过了170 种
[3],Nisin是被食品药品监督管理局(Food and Drug Administration,FDA)认可的唯一作为食品防腐剂的细菌素,在80多个国家和地区广泛地应用于食品工业
[4-5]。在乳杆菌属中,很多植物乳杆菌都可以产生细菌素,比如Lb. plantarum KLDS1.0391
[6]、Lb. plantarum LB-B1
[7]、Lb. plantarum LPCO10
[8]和Lb. plantarum KLAB21
[9]等。一般细菌素的抑菌谱窄,提取制备成本高,限制了其在食品工业中的大规模应用。筛选抑菌活性强和抑菌谱宽的细菌素产生菌是国内外细菌素研究的主要内容之一。
我国传统发酵乳制品种类多样,各地都形成了独特的发酵乳制品。为研究人员筛选抑菌谱广、抑菌活性强的细菌素产生菌提供了很好的条件。例如,周佳等
[10]从川西高原奶渣中分离出了肠球菌SAU-2,它产生的细菌素对热很稳定。张国强等
[11]从泡菜中筛选出一株产细菌素的乳酸菌SD-22,其产物对革兰氏阳性细菌和革兰氏阴性细菌均具有较好的抑制作用,对部分真菌也有抑制作用,但对酵母菌和青霉无抑制作用。杨吉霞等
[12]从来自西藏、云南等地的牦牛奶酪中筛选出具有广谱抗菌性的Y13、X29和X30共3 株乳酸菌。本研究从黑龙江农家自制酸菜中分离出一株抑菌谱较宽的产细菌素乳酸菌,鉴定为植物乳杆菌,并对其细菌素的提取纯化做了初步的研究,旨在为天然防腐剂开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑龙江传统酸菜制品,样品取回后贮藏于4 ℃冰箱备用。
1.1.2 培养基和试剂
MRS培养基、BCP培养基、LB培养基、PY基础培养基、PYG培养基、精氨酸产氨培养基、葡萄糖/葡萄糖酸盐产酸产气培养基、碳水化合物发酵产酸培养基、产硫化氢培养基。
革兰氏染色试剂盒 杭州百思生物技术有限公司;细菌基因组提取试剂盒 美国Omega公司;Taq DNA聚合酶、Gel Extraction Kit 日本TaKaRa公司;过氧化氢酶 美国Sigma公司;细菌鉴定通用引物:16SF:5’-AGAGTTTGATCCTGGCTCAG-3’,16SR:5’-CTACGGCTACCTTGTTACGA-3’。
1.1.3 仪器与设备
TOMY-SX-700全自动高压灭菌锅 日本Tomy公司;SW-CJ-IBU超净工作台 苏州安泰空气技术有限公司;Orion 3 STAR pH计 美国Thermo公司;Eclipse 80i光学显微镜 日本Nikon公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;PTC-100
TM聚合酶链式反应(polymerase chain reaction,PCR)仪 美国MJ Research公司;PowPac
TMHC164-5052高电流电泳仪美国Bio-Rad公司;JS-380C全自动数码凝胶成像分析仪上海培清科技有限公司。
1.1.4 指示菌
大肠杆菌(ATCC25922)、荧光假单胞菌(AS1.1802)、蜡样芽孢杆菌(AS1.1846)、藤黄微球菌(CMCC(B)2800)、串珠镰刀菌(30174) 中国普通微生物菌种保藏管理中心。
1.2 方法
1.2.1 样品的采集
无菌镊子夹取少量样品(或无菌注射器抽取液体样品)转接于10 mL已灭菌的离心管,标记编号,置于4 ℃冰箱保存待用。
1.2.2 乳酸菌的分离
无菌环境下,取少许样品置于MRS液体培养基中,37 ℃静置富集培养8 h。增菌培养液用无菌生理盐水按10 倍稀释法稀释,取10
-3、10
-4、10
-53 个浓度梯度各100 μL涂布于MRS固体培养基,37 ℃静置培养24 h,随机挑取菌落,继续在BCP固体培养基中划线分离,重复几次,最后得到黄色圈明显、菌落形态单一的单菌落,挑取单菌落。
1.2.3 产广谱抗菌作用细菌素乳酸菌的初筛
乳酸菌产抗菌活性物质的初筛具体流程如下:分离出的菌株接种于MRS液体培养基,37 ℃条件下培养48 h,测定得发酵液pH值为3.5,8 000 r/min离心15 min,取上清液。将指示菌(蜡样芽孢杆菌、大肠杆菌、荧光假单胞菌、藤黄微球菌)分别接种于LB液体培养基,37 ℃摇床培养10 h,按体积分数1%接种于含1.8%琼脂的LB培养基,制成带指示菌的固体培养基。用5 mm的打孔器打孔,再分别加入50 μL的上清液,37 ℃培养8 h,测量抑菌圈直径大小(大于5 mm为有抑菌活性)。
1.2.4 产广谱抗菌细菌素乳酸菌的复筛
乳酸菌产生的活性抗菌物质有有机酸、过氧化氢等物质,故需要逐一排除。
1.2.4.1 抗菌能力的筛选
初筛得到的菌株活化后,按体积分数1%接种新培养基,37 ℃条件下静置培养48 h,4 ℃条件下5 000×g离心15 min,得上清液,上清液采用琼脂扩散法测试其抑菌活性
[13-14]。
1.2.4.2 过氧化氢的排除
发酵离心得上清液,浓缩一倍备用。取浓缩上清液0.5 mL加入0.5 mL过氧化氢酶溶液(溶剂为pH值为5.2的磷酸盐缓冲溶液(phosphate buffer saline,PBS)),另取浓缩上清液0.5 mL加入0.5 mL pH 5.2的PBS溶剂为空白对照,37 ℃水浴处理2 h后采用琼脂扩散法测试其抑菌活性,观察加了过氧化氢酶的处理及对照抑菌圈变化
[15]。
1.2.4.3 有机酸的排除
发酵离心得上清液,以用乳酸调节pH值为3.5(与发酵48 h后发酵液pH值相同)的MRS培养基作为空白对照,采用琼脂扩散法测试其抑菌活性(鉴于细菌素的产量都非常低,故某些菌株的上清液有必要浓缩1 倍,提高细菌素的浓度,对照则同样浓缩处理)
[16]。
1.2.5 种属鉴定
1.2.5.1 生理生化鉴定
菌株从以下七方面(菌落形态及菌体观察、精氨酸产氨实验、葡萄糖和葡萄糖酸盐产酸产气实验、运动能力、硫化氢能力检测、碳水化合物发酵实验、耐盐性实验)进行生理生化鉴定,实验方法按照《伯杰细菌鉴定手册》
[17]及《乳酸细菌分类鉴定及实验方法》
[18]。
1.2.5.2 分子生物学鉴定
菌株基因组DNA提取:保藏的菌株174接种活化后于MRS培养基37 ℃静置培养14 h,取5 mL菌液4 ℃、5 000×g离心10 min,得菌体,按照细菌基因组提取试剂盒操作说明提取细菌总DNA。
PCR扩增:PCR扩增引物选择细菌鉴定通用引物,16SF和16SR。PCR反应体系:10 μmol/L上下游引物各1 μL、模板DNA 1 μL、2×PCR mixture 12.5 μL、ddH
2O补足25 μL,设阴性对照。PCR反应循环:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,30 个循环;72 ℃延伸10 min。PCR产物琼脂糖凝胶电泳观察,割胶回收,测序,测序结果在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上的GenBank序列数据库进行BLAST分析,在基因库中进行同源性比较,鉴定到种。
系统发育树的构建:测序所得的16S rRNA序列校对后,与NCBI的GenBank数据库进行BLAST分析,根据序列同源性,选取不同的模式菌株,采用MEGA 5.0的邻接(Neighbor-Joining,NJ)法构建系统发育树,确定菌株的种属关系。
1.2.6 细菌素初步分离纯化
1.2.6.1 有机溶剂种类对萃取效果的影响
将发酵液以8 000 r/min离心15 min,取上清。发酵上清液以1∶3的体积比与乙酸乙酯、正丁醇、正己烷、丙酮、三氯甲烷、二氯甲烷分别进行萃取,静置过夜,吸出有机相,45 ℃旋蒸,对旋蒸的产物用甲醇复溶。以大肠杆菌和蜡样芽孢杆菌为指示菌,琼脂扩散法检测其抑菌活性
[19]。
1.2.6.2 有机溶剂使用量对萃取效果的影响
以1.2.6.1节的结果选出萃取效果最好的2 种有机试剂,分别以不同的比例(有机溶剂的体积分别为0.5、1.0、1.5、2.0、2.5、3.0 倍的发酵液体积)与发酵液混合萃取,静置过夜,吸出有机相,45 ℃旋蒸,对旋蒸的产物用甲醇复溶。以大肠杆菌、蜡样芽孢杆菌和串珠镰刀菌为指示菌,琼脂扩散法检测其抑菌活性
[20]。
1.2.6.3 Sephadex LH-20纯化
Sephadex LH-20充分溶胀后装柱,80%甲醇平衡2 个柱体积后,有机溶剂萃取得到的样品上样1 mL,80%甲醇洗脱,流速3 mL/9 min,利用自动收集器收集馏分,每馏分接3 mL。馏分收集后,以大肠杆菌为指示菌,琼脂扩散法检测其抑菌活性。
2 结果与分析
2.1 产广谱抗菌作用细菌素乳酸菌的分离及筛选
从黑龙江来源的发酵食品中共分离纯化出菌株720 株,其中共筛选出对蜡样芽孢杆菌和大肠杆菌都有抑制效果的乳酸菌73 株。经过复筛、排酸实验、排除过氧化氢实验确定31 株菌的抑菌效果较好,它们对指示菌的抑菌效果如表1所示。其中菌株174的抑菌效果最好,对4 株指示菌荧光假单胞菌、大肠杆菌、藤黄微球菌和蜡样芽孢杆菌均具有广谱抑菌效果,并发现菌株174产物能够抑制真菌串珠镰刀菌。菌株174抑菌效果最好,抑菌谱最广,选定菌株174为研究菌株。
表1 乳酸菌发酵液对指示菌的抑菌作用
Table 1 Antibacterial activity of Lactobacilllluuss isoollaattee iinn fermentation brrootthh
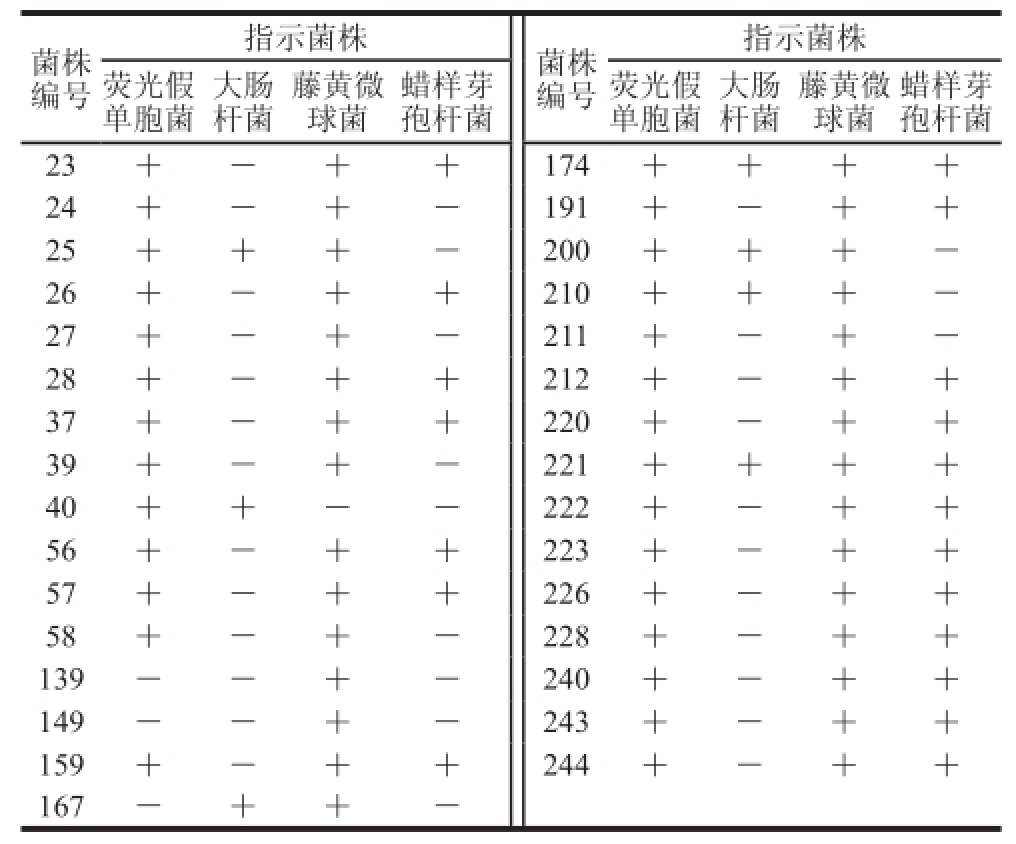
注:抑菌圈直径判断标准:直径<5 mm,无抑菌活性,记为“-”;直径≥5 mm,有抑菌活性,记为“+”。
蜡样芽孢杆菌23+-++174++++24+-+-191+-++25+++-200+++-26+-++210+++-27+-+-211+-+-28+-++212+-++37+-++220+-++39+-+-221++++40++--222+-++56+-++223+-++57+-++226+-++58+-+-228+-++139--+-240+-++149--+-243+-++159+-++244+-++167-++-菌株编号指示菌株荧光假单胞菌大肠杆菌指示菌株菌株编号藤黄微球菌蜡样芽孢杆菌荧光假单胞菌大肠杆菌藤黄微球菌
2.2 目标菌株鉴定
2.2.1 生理生化鉴定
菌株174在MRS培养基上生长良好;菌落呈乳白色,圆形,表面光滑,凸起,培养液中生长物很混浊;革兰氏染色为革兰氏阳性菌;菌体无鞭毛,无芽孢产生,呈杆状形态,结果如图1所示。
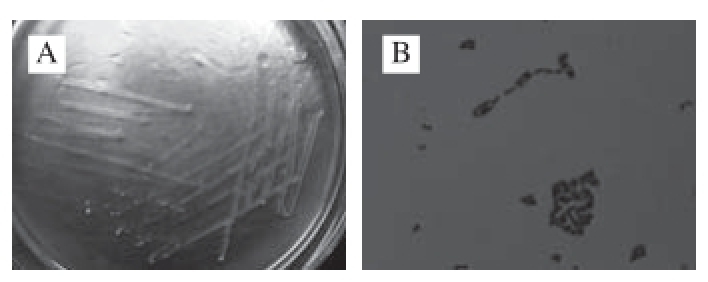
图1 菌株174菌落形态(A)及革兰氏染色图(B)
Fig. 1 Colony morphology (A) of strain 174 and its Gram staining (B)
菌株174不产过氧化氢酶;在含0、3 g/100 mL NaCl的培养基中生长,4.5、18 g/100 mL NaCl培养基中不能生长;不发酵精氨酸产氨;不产硫化氢;无运动性;能发酵葡萄糖但不能产气,但是能够在发酵葡萄糖酸钠的同时产气,当发酵核糖时,能够发酵核糖,但是不产气,糖代谢实验结果如表2所示。
表2 菌株174生理生化鉴定结果
Table 2 Physiological and biochemical identifi cation of strain 174

注:+. 反应呈阳性;-. 反应呈阴性。
项目结果项目结果阿拉伯糖-蜜二糖+纤维二糖+棉子糖+果糖+鼠李糖-半乳糖+核糖+葡萄糖+水杨苷+葡萄糖酸钠+蔗糖+乳糖+木糖+山梨醇+4.5 g/100 mL NaCl-海藻糖+18 g/100 mL NaCl-麦芽糖+精氨酸产氨-甘露醇+运动-甘露糖+产硫化氢-
2.2.2 菌株分子生物学鉴定
利用16S rRNA引物进行PCR扩增,得到约1 600 bp的PCR扩增产物,琼脂糖凝胶电泳图见图2。
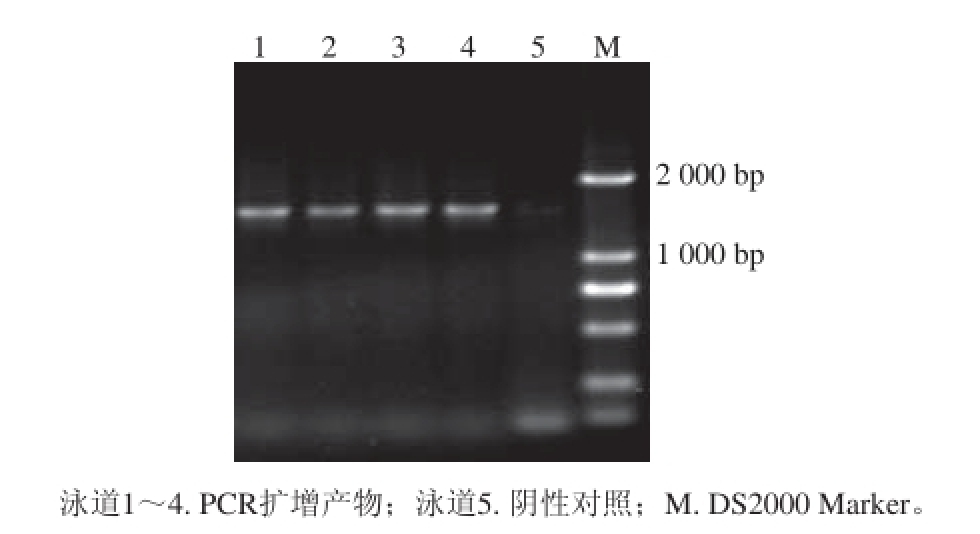
图2 16S rRNA PCR扩增产物琼脂糖凝胶电泳图
Fig. 2 Electrophoresis of PCR-amplifi ed products of 16S rRNA
16S rRNA PCR扩增产物回收,测序共得到1 590 个碱基,采用NCBI数据库中的BLAST程序比对菌株的16S rRNA序列和GenBank中的核酸数据,发现菌株与植物乳杆菌的相似性为99%。基于16S rRNA的系统发育树如图3所示,由2.2.1节中的生理生化鉴定结果结合分子生物学鉴定结果,鉴定该菌株为植物乳杆菌,命名为Lactobacillus plantarum HLJ-174。
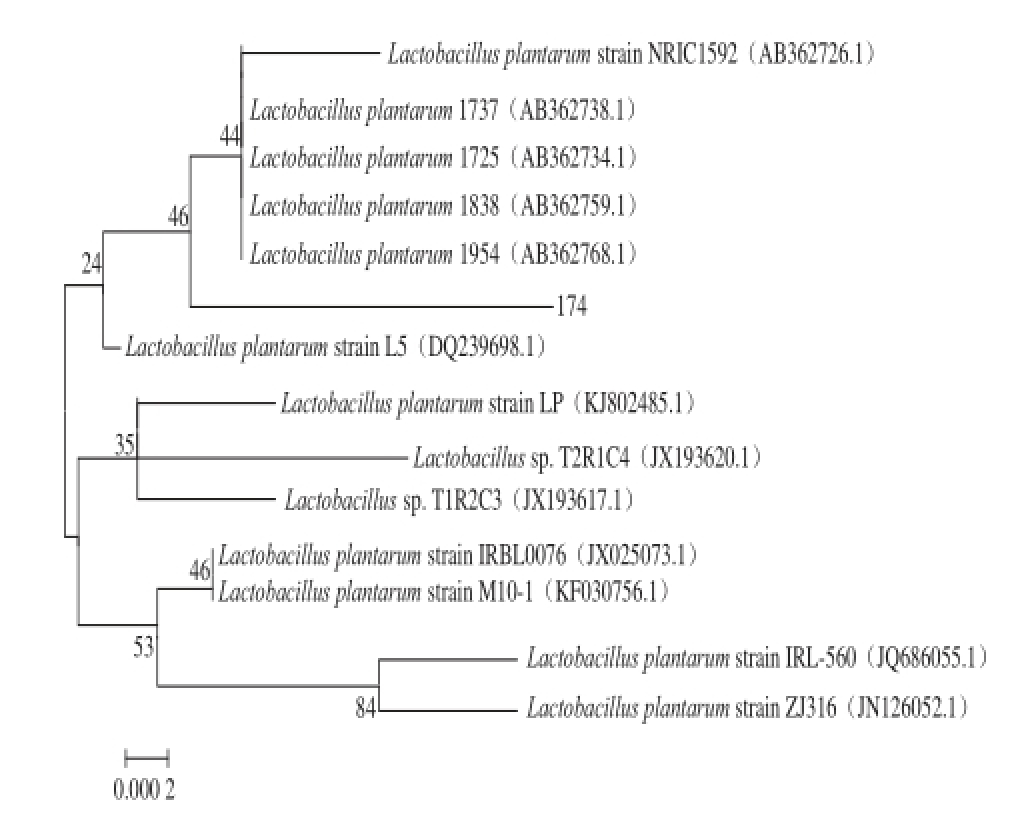
图3 菌株Lactobacillus plantaarruumm HLJ-174的系统进化树
Fig. 3 Phylogenetic tree of Lactobacillus plantarum HLJ-174 based on 16S rRNA sequence
2.3 Lactobacillus plantarum HLJ-174细菌素提取方法研究
2.3.1 不同有机溶剂抽提细菌素效果比较
表3 不同有机溶剂萃取相抑菌效果
Table 3 Antibacterial effects of extracts obtained with different organic solvents

注:-. 无抑菌圈。
三氯甲烷011.90四氯化碳011.20丙酮--乙醇--
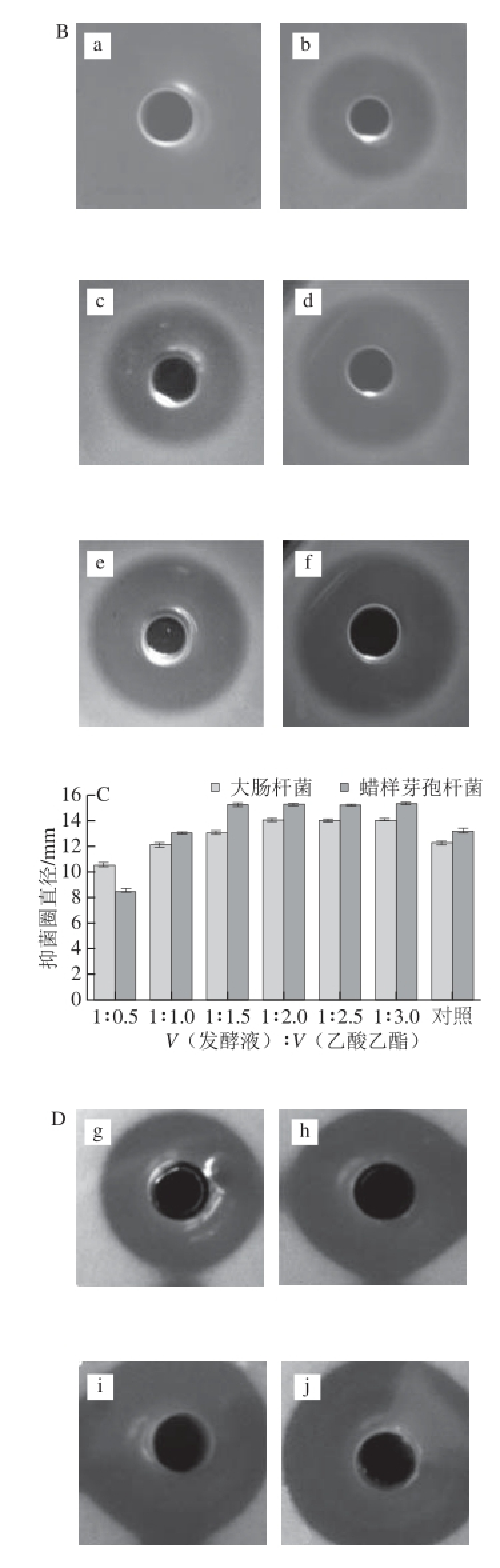
首先采用有机溶剂萃取法,对发酵浓缩液进行萃取提纯,结果见表3。在有机溶剂与发酵浓缩液体积比为3∶1的条件下,正丁醇和乙酸乙酯的萃取效果较好,均出现了明显的分层现象,没有沉淀出现,上层有机相旋蒸后得到粗提物,有明显的抑菌作用,萃余相没有抑菌活性。而正己烷、二氯化碳、三氯化碳、四氯化碳萃取后形成分层状态,没有沉淀出现,在萃取相中没有检测到抑菌活性,萃余相有抑菌活性。丙酮与乙醇萃取后不分层,也无沉淀产生。抑菌作用如图4所示,a和b分别为正丁醇和乙酸乙酯萃取得到,萃取相有抑菌作用,萃余相无活性,抑菌圈直径分别可以达到17.02、12.18 mm。c、d、e、f、g和h为正己烷、二氯化碳、三氯化碳、四氯化碳、丙酮和乙醇萃取后产物抑菌图,萃取相没有抑菌活性,而萃余相还保留有抑菌活性。由上述结果可以看出正丁醇和乙酸乙酯是适合的萃取剂,而正丁醇能最大限度得到细菌素产物,效果最好。

图4 不同有机溶剂抽提细菌素产物抑菌效果
Fig. 4 Antibacterial effects of bacteriocins extracted with different organic solvents
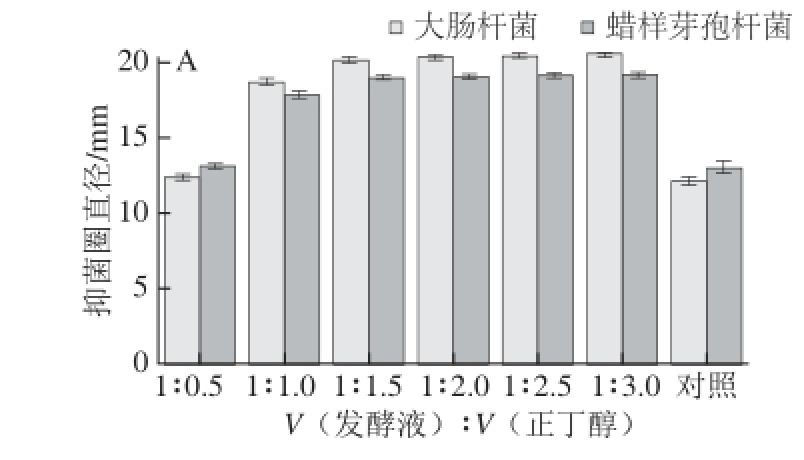
2.3.2 单一有机溶剂、不同有机溶剂用量抽提效果比较
由2.3.1节可以知道,正丁醇和乙酸乙酯是萃取效果较好的2 种有机溶剂,在此基础上,分别利用不同体积的正丁醇和乙酸乙酯萃取发酵液,旋蒸产物的抑菌效果结果如图5所示,不论是使用正丁醇还是乙酸乙酯萃取发酵液,在发酵液与有机溶剂的体积比达到1∶1.5之后,萃取的效果基本不变,所以确定1.5 倍有机溶剂体积为最佳的有机溶剂用量。同时,由图5可知,正丁醇的萃取效果好于乙酸乙酯。综合以上的实验结果,当使用1.5 倍正丁醇萃取发酵液时,萃取效果最好。
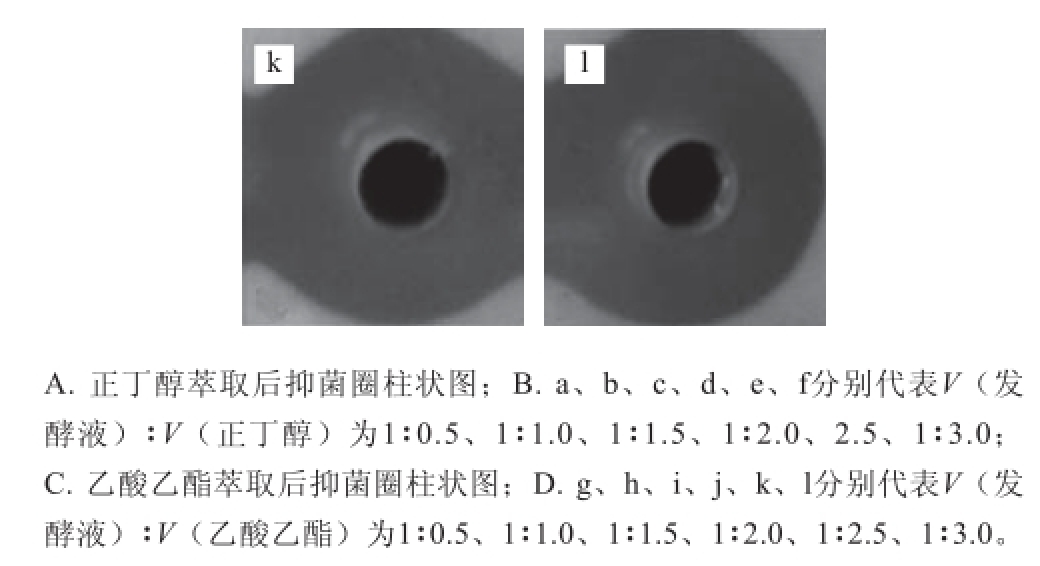
图5 不同正丁醇和乙酸乙酯与发酵液比例萃取产物的抑菌效果
Fig. 5 Antibacterial effects of extracts obtained with different ratios of butanol and acetate to the fermentation broth
2.4 Lactobacillus plantarum HLJ-174产细菌素的Sephadex LH-20凝胶过滤纯化
以1.5 倍发酵液体积的正丁醇萃取得到的产物浓缩30 倍得到的活性样品,经Sephadex LH-20凝胶过滤后,以大肠杆菌和蜡样芽孢杆菌为指示菌检测,得到一个活性洗脱峰,如图6所示,第58~61管均检测到抑菌活性。同时将洗脱下来的活性峰物质进行抑菌检测,发现对大肠杆菌、蜡样芽孢杆菌、藤黄微球菌、荧光假单胞菌和串珠镰刀菌等都有抑菌活性。
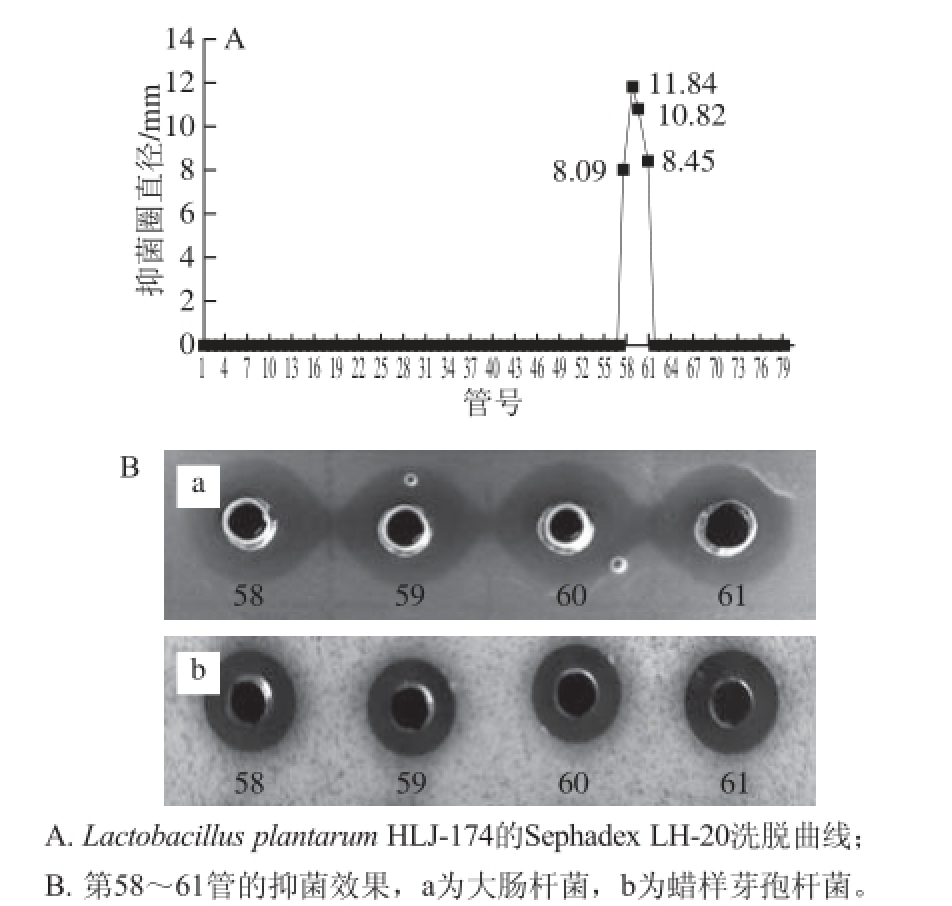
图 66 Lactobacillus plantarum HLJ-174产细菌素的Sephadex LH--2200洗脱曲线和抑菌活性
Fig. 6 Elution curve of bacteriocin from Lactobacillus plantarum HLJ-174 on Sephadex LH-20 and detection of the active fractions
3 讨 论
本研究从来自黑龙江的酸菜中筛选出一株具有较强抑菌活性的菌株,经过菌株生理生化鉴定和分子生物学鉴定,确认该菌株为植物乳杆菌,命名为Lactobacillus plantarum HLJ-174。细菌素一般抑制与产生菌同种近源的菌株,绝大部分乳酸菌细菌素能够抑制革兰氏阳性菌等致病菌和腐败菌。从目前已经报道的植物乳杆菌细菌素来看,只有一部分的细菌素能够同时抑制革兰氏阳性与阴性菌株,对真菌也有抑菌效果的很少。比如张艾青
[20]泡菜中筛出的植物乳杆菌产的细菌素对革兰氏阳性和部分革兰氏阴性菌有抑菌效果,未见对真菌有抑菌作用。刘书亮等
[21]等从醪糟中筛选出的P185对多数的革兰氏阴性菌和革兰氏阳性菌及一些真菌具有较强抑制作用。而本研究Lactobacillus plantarum HLJ-174的产物可以抑制大肠杆菌、荧光假单胞菌、藤黄微球菌、蜡样芽孢杆菌等多种革兰氏阳性菌和革兰氏阴性菌,同时还能够抑制串珠镰刀菌等真菌的生长,属于广谱的细菌素。
在植物乳杆菌细菌素产物分离纯化中,一般采取硫酸铵沉淀、疏水层析、离子交换色谱、超滤法、凝胶色谱和高效液相色谱法(high performance liquid chromatography,HPLC)。比如沈雷
[22]通过硫酸铵沉淀、离子交换、凝胶过滤和反向高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)的方法分离得到Plantaricin ZJ217。陈琳等
[23]利用超滤方法截留植物乳杆菌KLDS1.0391发酵液中的细菌素,获得了很好的效果。在Lactobacillus plantarum HLJ-174产物的提取与纯化中,首先使用了有机溶剂萃取
[24]的方法。实验以大肠杆菌和蜡样芽孢杆菌为指示菌,从多种有机溶剂中筛选出正丁醇和乙酸乙酯作为萃取剂对发酵液进行萃取获得产物,同时找到了合适的萃取剂用量,在综合考虑成本以及后续处理问题后,以1.5 倍发酵液体积为萃取有机溶剂用量。实验结果表明正丁醇的效果好于乙酸乙酯。细菌素是一段短的肽链形成,是两性分子,同时具有亲水性和疏水性,正丁醇的疏水性强于乙酸乙酯,且正丁醇的极性比乙酸乙酯大,使用正丁醇的萃取效果好,说明此细菌素的极性较大,更易溶于强极性溶剂。萃取剂的疏水性也并非是决定细菌素在有机溶剂中溶解度的决定性因素,比如鲁吉珂等
[25]就发现利用有机溶剂提取Nisin时,溶剂疏水性差异可能不是决定Nisin分离提取的主要因素,而Nisin在有机相和水相的交界处富集浓缩存在溶剂特异性。所以,最后选定正丁醇作为最佳的萃取剂,以1.5 倍发酵液体积的正丁醇体积为最佳用量。在此基础上测得抑制大肠杆菌抑菌圈直径达到19 mm以上,抑制蜡样芽孢杆菌抑菌圈直径可以达到18 mm以上。萃取后产物浓缩30 倍,利用LH-20分离,得到一个活性峰,对大肠杆菌、蜡样芽孢杆菌和串珠镰刀菌等有强抑菌效果。
参考文献:
[1] 陈静, 张玉苍, 何连芳. 乳酸菌产细菌素的研究进展及其应用前景[J]. 安徽农业科学, 2011, 39(4): 1925-1927. DOI:10.3969/ j.issn.0517-6611.2011.04.015.
[2] FRANKOS V H, SCHMITT D F, HAWS L C, et al. Generally recognized as safe (GRAS) evaluation of hexylresorcinol for use as a processing aid for prevention of melanosis in shrimp[J]. Regulatory Toxicology and Pharmacology, 1991, 14(2): 202-212. DOI:10.1016/0273-2300(91)90007-I.
[3] HAMMAMI R, ZOUHIR A, HAMIDA J B, et al. BACTIBASE: a new web-accessible database for bacteriocin characterization[J]. BMC Microbiology, 2007, 7(1): 89. DOI:10.1186/1471-2180-7-89.
[4] 袁静, 李元端, 刘变芳, 等. 乳酸菌的细菌素及乳链菌肽在食品工业中的发酵与应用[J]. 哈尔滨商业大学学报(自然科学版), 2002, 18(5): 533; 544-549. DOI:10.3969/j.issn.1672-0946.2002.05.018.
[5] 李平兰, 张篪, 江汉湖. 乳酸菌细菌素研究进展[J]. 微生物学通报, 1998, 25(5): 295-298. DOI:10.13344/j.microbiol.china.1998.05.015.
[6] GONG H S, MENG Xiecheng, WANG Han. Plantaricin MG active against Gram-negative bacteria produced by Lactobacillus plantarum KLDS1.0391 isolated from “Jiaoke”, a traditional fermented cream from China[J]. Food Control, 2010, 21(1): 89-96. DOI:10.1016/ j.foodcont.2009.04.005.
[7] XIE Ying, AN Haoran, HAO Yanling, et al. Characterization of an anti-Listeria bacteriocin produced by Lactobacillus plantarum LB-B1 isolated from koumiss, a traditionally fermented dairy product from China[J]. Food Control, 2011, 22(7): 1027-1031. DOI:10.1016/ j.foodcont.2010.12.007.
[8] JIMÉNEZ-DÍAZ R, RIOS-SANCHEZ R, DESMAZEAUD M, et al. Plantaricins S and T, two new bacteriocins produced by Lactobacillus plantarum LPCO10 isolated from a green olive fermentation[J]. Applied and Environmental Microbiology, 1993, 59(5): 1416-1424. DOI:10.1128/aem.00034-0170.
[9] PARK H D, RHEE C H. Antimutagenic activity of Lactobacillus plantarum KLAB21 isolated from kimchi Korean fermented vegetables[J]. Biotechnology Letters, 2001, 23(19): 1583-1589. DOI:10.1023/A:1011921427581.
[10] 周佳, 刘书亮,胡欣洁, 等. 产宽谱pH细菌素乳酸菌的筛选鉴定、毒力检测及细菌素特性研究[J]. 食品科学, 2012, 33(11): 194-199.
[11] 张国强, 樊明涛, 师俊玲, 等. 一株从泡菜中分离的产细菌素乳杆菌的鉴定及细菌素特性研究[J]. 食品科学, 2011, 32(3): 171-175.
[12] 杨吉霞, 贺稚非, 陈宗道. 牦牛奶酪中产细菌素乳酸菌菌株的筛选[J].食品科学, 2015, 36(3): 122-126. DOI:10.7506/spkx1002-6630-201503023.
[13] LUO Fan, FENG Su, SUN Qun, et al. Screening for bacteriocinproducing lactic acid bacteria from kurut, a traditional naturallyfermented yak milk from Qinghai-Tibet plateau[J]. Food Control, 2011, 22(1): 50-53. DOI:10.1016/j.foodcont.2010.05.006.
[14] SCHILLINGER U, LÜCKE F K. Antibacterial activity of Lactobacillus sake isolated from meat[J]. Applied and Environmental Microbiology, 1989, 55(8): 1901-1906.
[15] 张国强, 师俊玲, 杨自文. 1株乳酸菌所产类细菌素Lactobacillin SD-22的初步研究[J]. 食品与发酵工业, 2008, 34(5): 51-54. DOI:10.13995/j.cnki.11-1802/ts.2008.05.002.
[16] 袁玮. 贵州省苗族腌酸汤中产乳酸菌素菌的筛选与初步研究[D]. 武汉: 华中农业大学, 2010.
[17] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 北京: 科学出版社, 1984: 729-795.
[18] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 110-128.
[19] 许亦峰, 罗晓蕾, 施碧红. 不同提取剂对粗细菌素提取效果的影响[J]. 微生物学杂志, 2013, 33(1): 35-38. DOI:10.3969/ j.issn.1005-7021.2013.01.008.
[20] 张艾青. 产广谱细菌素植物乳杆菌的初步研究及其在在泡菜中的应用[D]. 雅安: 四川农业大学, 2007.
[21] 刘书亮, 张艾青, 田刚, 等. 植物乳杆菌P158的生长曲线及其细菌素的特性[J]. 核农学报, 2009, 23(6): 1021-1025.
[22] 沈雷. 植物乳杆菌ZJ217产细菌素的研究[D]. 杭州: 浙江工商大学, 2013.
[23] 陈琳, 孟祥晨. 超滤法分离植物乳杆菌KLDS1.0391发酵液中的细菌素[J]. 食品科学, 2011, 32(5): 198-201.
[24] 谢继辉, 陈晓琳, 张明. 有关细菌素分离纯化方法的评价[J]. 安徽农学通报, 2008, 14(15): 60-61. DOI:10.3969/ j.issn.1007-7731.2008.15.026.
[25] 鲁吉珂, 黎业娟, 吴霄玥, 等. 有机溶剂沉淀法提取乳酸链球菌素的效果[J]. 食品科学, 2012, 33(10): 84-86.
Isolation and Identifi cation of Lactic Acid Bacterial Strain with Broad-Spectrum Antibacterial Activity and Extraction and Purifi cation of Bacteriocin Produced by It
GAO Peng, HAN Jinzhi, LU Zhaoxin, LÜ Fengxia, ZHAO Haizhen, ZHANG Chong, BIE Xiaomei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:A lactic acid bacterial strain, Lactobacillus HLJ-174, was isolated from naturally fermented Chinese sauerkraut from Heilongjiang province. The bacteriocin produced by it showed a strong antibacterial activity against Escherichia coli, Pseudomonas fluorescens, Bacillus cereus and Micrococcus aureus after elimination of some interference factors such as organic acid and hydrogen peroxide. Based on morphological, physiological and biochemical characteristics and 16S rDNA sequence analysis, the strain HLJ-174 was identifi ed as Lactobacillus plantarum. The bacteriocin from HLJ-174 was extracted with organic solvent, and higher extraction effi ciency was obtained using butanol and ethyl acetate, but it was not extractable with other organic solvents such as hexane, methylene chloride, chloroform, carbon tetrachloride, acetone and ethanol. Furthermore, the addition of different volumes (0.5-, 1.0-, 1.5-, 2.0-, 2.5- and 3.0-fold) of butanol or ethyl acetate to the fermentation broth was applied to extract the bacteriocin, and the results showed that the best extraction efficiency was achieved by using 1.5-fold volume of butanol as the extraction solvent. The extract was further purifi ed by Sephadex LH-20 chromatography, and the purifi ed product exhibited a strong antibacterial activity against Escherichia coli and Bacillus cereus.
Key words:Lactobacillus; bacteriocin; strain identifi cation; extraction
DOI:10.7506/spkx1002-6630-201611028
中图分类号:TS252.54
文献标志码:A
文章编号:1002-6630(2016)11-0160-07
引文格式:
高鹏, 韩金志, 陆兆新, 等. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化[J]. 食品科学, 2016, 37(11): 160-166.
DOI:10.7506/spkx1002-6630-201611028. http://www.spkx.net.cn
GAO Peng, HAN Jinzhi, LU Zhaoxin, et al. Isolation and identifi cation of lactic acid bacterial strain with broad-spectrum antibacterial activity and extraction and purifi cation of bacteriocin produced by it[J]. Food Science, 2016, 37(11): 160-166. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611028. http://www.spkx.net.cn
收稿日期:2015-08-06
作者简介:高鹏(1991—),男,硕士研究生,研究方向为食品微生物。E-mail:2014808088@njau.edu.cn
*通信作者:别小妹(1964—),女,教授,博士,研究方向为食品微生物及生物技术。E-mail:bxm43@njau.edu.cn