表1 复合酶配比响应面试验因素与水平
Table 1 Factors and levels used in central composite design experiments for the optimization of enzyme mixing ratio

张 笛,曾庆梅*,王 琳,闫春明,高 雅
(合肥工业大学 农产品生物化工教育部工程研究中心,安徽 合肥 230009)
摘 要:为改善传统水提法提取得率低的问题,研究微波辅助酶法提取绞股蓝皂苷工艺。采用响应面法筛选酶法提取中复合酶的最佳配比,确定了复合酶最佳配比为果胶酶-半纤维素酶-纤维素酶质量比为4∶5∶5,再利用单因素试验结合Box-Behnken设计法优化提取工艺。结果表明:影响微波辅助酶法提取绞股蓝皂苷主要因素为复合酶添加量、酶解温度、酶解时间、微波时间,优化得到的最佳工艺参数为复合酶添加量1.8%、酶解温度52 ℃、酶解时间2 h、微波时间4 min,此工艺条件下绞股蓝皂苷得率为7.88%。该提取方法与传统水提法相比,产品得率增加了68%,且提取温度较低,工艺可操作性强。
关键词:微波;复合酶法;响应面法;绞股蓝皂苷
引文格式:
张笛, 曾庆梅, 王琳, 等. 微波辅助酶法提取绞股蓝皂苷工艺优化[J]. 食品科学, 2016, 37(12): 1-6. DOI:10.7506/ spkx1002-6630-201612001. http://www.spkx.net.cn
ZHANG Di, ZENG Qingmei, WANG Lin, et al. Optimization of microwave-assisted enzymatic extraction of gypenosides from Gynostemma pentaphyllum[J]. Food Science, 2016, 37(12): 1-6. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201612001. http://www.spkx.net.cn
绞股蓝为葫芦科绞股蓝属多年生草质藤木,又名五叶参、七叶胆,主要分布在我国湖南、广西、云南、四川等省份,历来有“南方人参”的美誉[1]。20世纪70年代以来,日本和中国的学者已从绞股蓝中分离出80多种绞股蓝皂苷,发现其中4种绞股蓝皂苷[2]分别与人参皂苷Rb1、Rb3、Rd和F2同构异名,并且研究[3-5]表明绞股蓝中皂苷的含量是人参的3 倍。现代药理学研究及临床实验[6-11]证明,绞股蓝皂苷为绞股蓝的主要功能性组分,具有降血脂、抗诱变、抗衰老、增强免疫力和保护肝脏等作用。
近几年对绞股蓝皂苷的研究多数集中在绞股蓝药理作用和皂苷单体的分离纯化等方面,而忽略了对绞股蓝皂苷提取工艺的研究[12]。目前已见报道的绞股蓝提取工艺研究大多集中在传统的水提[13]、醇提[1]、超声提取[14]、单一酶种提取[15-16],而这些方法不同程度地存在皂苷得率提高不大、耗能大等问题[13]。
通常的酶法提取只考察一种酶的酶解破壁实验,无法同时发挥不同酶种特有的优势,本实验针对绞股蓝细胞壁组成,同时采用果胶酶、半纤维素酶、纤维素酶,充分发挥各自的酶解优势,复合酶解破壁。同时引入操作简单、能耗小、效率高的微波提取技术,绞股蓝粉末在快速振动的微波电磁场中吸收电磁能,细胞内部的极性分子发生高频振动和摩擦,温度迅速上升,瞬间的内外压力差超过细胞壁的承受能力而导致细胞破裂[17-20],从而辅助提高复合酶解破壁提取绞股蓝的效果,增加绞股蓝皂苷的溶出率。第一步先通过响应面试验筛选复合酶最佳配比,然后利用单因素试验结合Box-Behnken设计[21]对微波辅助酶法提取绞股蓝皂苷的工艺参数进行优化,进而开发一种高效破壁提取绞股蓝皂苷的新技术。
1.1 材料与试剂
绞股蓝 神农金康原生态茶业有限公司;Amberlite XAD-2大孔树脂 上海金穗生物科技有限公司;冰乙酸、高氯酸、无水乙醇、柠檬酸等(均为分析纯) 国药集团化学试剂有限公司;纤维素酶、半纤维素酶、果胶酶(均为食品级,酶活均为50 000 U/g)江苏锐阳生物科技有限公司;人参皂苷Re标准品中国食品药品检定研究院。
1.2 仪器与设备
FD-1真空干燥箱 北京博医康技术公司;JP-500C微型植物粉碎机 永康市久品工贸有限公司;PB-10 型pH计 美国Stangardize公司;MP-70107FL微波炉广东格兰仕微波生活电器制造有限公司;UV-1600紫外分光光度计 美国Spectrophotometer公司;TB-215D型电子天平 北京赛多利斯仪器有限公司;HH-2数显恒温水浴锅 江苏省金坛市仪器研究所;SIGMA 3K15高速冷冻离心机 德国Sigma公司;XW-80A微型漩涡混合仪 上海沪西分析仪器有限公司。
1.3 方法
1.3.1 绞股蓝皂苷的提取工艺流程
绞股蓝全草→真空干燥→粉碎过60 目筛→准确称取2.0 g预处理过的绞股蓝粉末→添加一定比例蒸馏水→800 W微波间歇处理一定时间→柠檬酸调节pH值→添加复合酶50 ℃条件下酶解一定时间→70 ℃灭酶30 min→离心(3 000 r/min,10 min)→过滤→滤液4 ℃冷藏柜中静置过夜→离心(5 000 r/min,10 min)得上清液→Amberlite XAD-2离子交换大孔树脂层析→70%乙醇溶液洗脱→60 ℃水浴挥干→绞股蓝皂苷晶体
1.3.2 绞股蓝皂苷得率的测定
按照《保健食品检验与评价技术规范》[22]进行测定。
1.3.3 复合酶最佳组合的确定
针对绞股蓝细胞壁特点和皂苷分布部位[23],选用纤维素酶、果胶酶及半纤维素酶进行复配,采用响应面法优化纤维素酶、半纤维素酶和果胶酶的组合比例。以充分发挥不同酶种的优势,最大限度地破坏细胞结构,提高皂苷得率。
设定pH 5.0,准确称取2.0 g预处理过的绞股蓝粉末于100 mL三角瓶中,以1∶30(g/mL)料液比加入蒸馏水[24],800 W条件下微波2 min[25],之后用柠檬酸调节pH值为规定值,按照响应面试验设计方案(表1)加入不同质量分数的纤维素酶、半纤维素酶及果胶酶进行混合,50 ℃酶解1 h,70 ℃灭酶30 min,再按1.3.2节方法测定并计算总皂苷得率,根据试验结果利用Design-Expert 8.0.6进行响应面分析,并通过验证实验优化出效果较好的复合酶组合进行后续实验。
表1 复合酶配比响应面试验因素与水平
Table 1 Factors and levels used in central composite design experiments for the optimization of enzyme mixing ratio

1.3.4 绞股蓝皂苷提取单因素试验
预设料液比1∶30(g/mL)、pH 5.0、复合酶添加量1%(质量分数,果胶酶-半纤维素酶-纤维素酶质量比1∶1∶1)、酶解温度50 ℃、酶解时间1.0 h、微波时间2 min。准确称取预处理过的绞股蓝粉末2.0 g,以料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、复合酶添加量(0.9%、1.2%、1.5%、1.8%、2.1%)、酶解时间(0.5、1.0、1.5、2.0、2.5 h)、酶解pH值(4.4、4.6、4.8、5.0、5.2)、酶解温度(40、50、60、70、80 ℃)、微波时间(2、4、6、8、10 min)6 个单因素为变量,每一个单因素试验筛选出最优条件作为下一个单因素的常规量,每个处理组均重复3 次。按照1.3.1节和1.3.2节方法提取、测定并计算绞股蓝皂苷得率,根据单因素试验结果进行方差分析确定影响显著的因素。
1.3.5 绞股蓝皂苷提取响应面试验设计
利用响应面中Box-Behnken设计结合单因素试验确定的4 个影响绞股蓝皂苷得率的显著因素,进行四因素三水平的试验设计(表2),建立数学回归模型并分析。
表2 绞股蓝皂苷提取响应面试验因素及水平
Table 2 Factors and levels used in central composite design experiments for for the optimization of extraction parameters
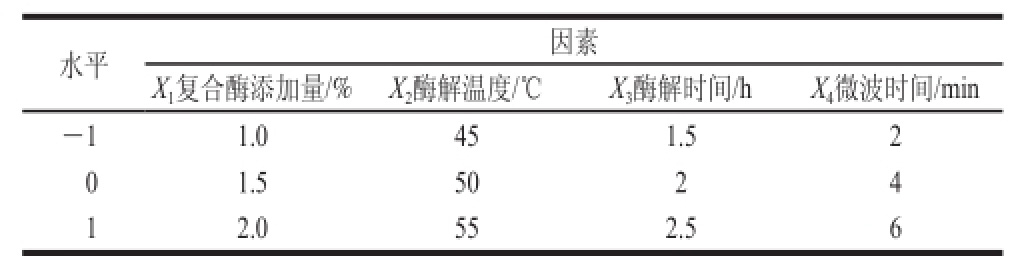
2.1 复合酶最佳配比的确定
表3 复合酶配比响应面优化试验方案及结果
Table 3 Experimental design and results of response surface methodology for the optimization of enzyme mixing ratio
对试验数据(表3)进行逐步回归,剔除影响不显著的拟合项,可得到其二次多项式方程为:
Y=0.23+7.89A+8.07B+13.94C+7.63AC-12.92A2-8.61B2-18.73C2
表4 复合酶配比回归方程各项的方差分析
Table 4 Anal y sis of variance of all terms in regression equation for the optimization of enzyme mixing ratio

注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。下同。
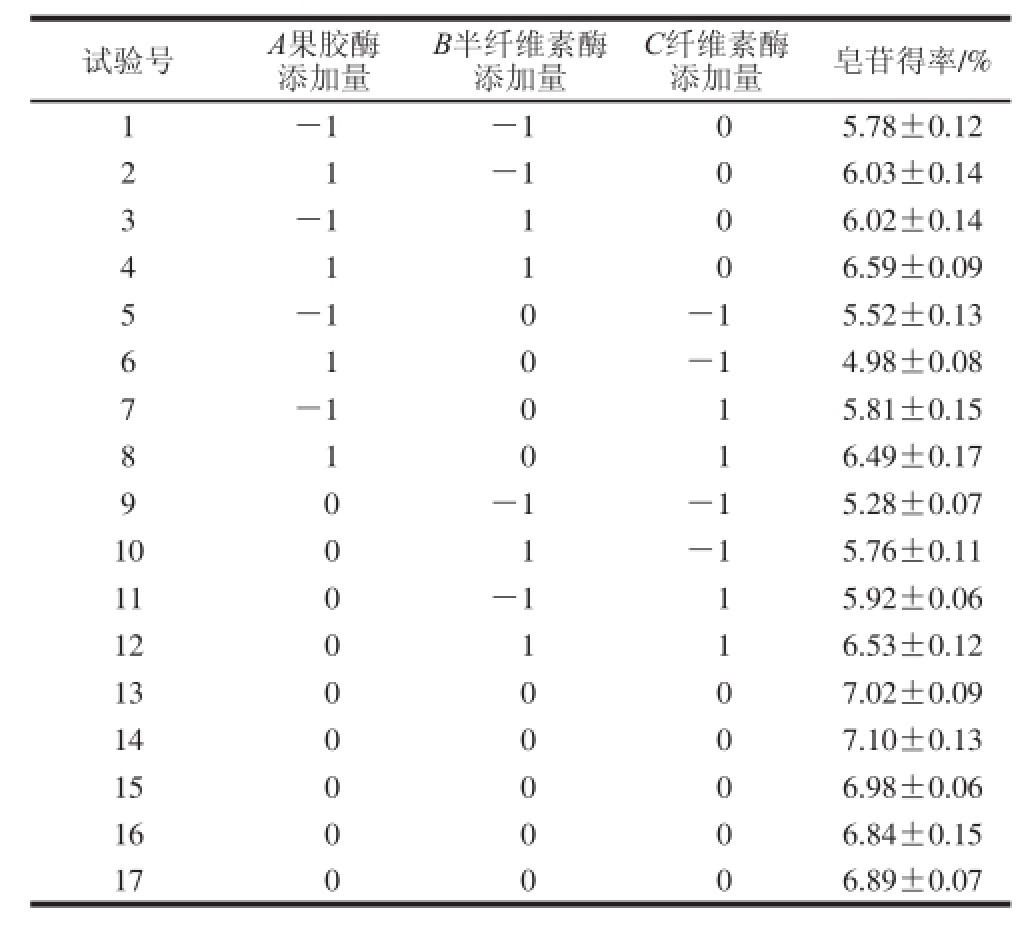
由表4可以看出,果胶酶添加量对绞股蓝皂苷得率影响最小,纤维素酶添加量影响最大;该回归模型P<0.01(极显著),失拟项P>0.05(不显著),模型的决定系数R2=0.976 4,说明模型拟合程度良好;校正决定系数![]() ,表明预测值与实测值之间具有高度相关性;综上说明试验设计可靠,因此可以用此二次多项式回归模型对绞股蓝皂苷得率进行分析和预测。由Design-Expert 8.0.6软件对回归模型进行数学分析获得复合酶的最佳组合为果胶酶、半纤维素酶和纤维素酶添加量分别为0.44%、0.47%、0.46%,绞股蓝皂苷得率的最大理论值为7.08%。
,表明预测值与实测值之间具有高度相关性;综上说明试验设计可靠,因此可以用此二次多项式回归模型对绞股蓝皂苷得率进行分析和预测。由Design-Expert 8.0.6软件对回归模型进行数学分析获得复合酶的最佳组合为果胶酶、半纤维素酶和纤维素酶添加量分别为0.44%、0.47%、0.46%,绞股蓝皂苷得率的最大理论值为7.08%。
2.2 复合酶配比验证实验结果
鉴于实际操作的局限,将条件设定为果胶酶添加量0.4%、半纤维素酶添加量0.5%、纤维素酶添加量0.5%,并结合料液比1∶30(g/mL)、酶解时间2 h进行实验,在50 ℃条件下进行绞股蓝皂苷提取,3 次平行实验绞股蓝皂苷得率(7.03%、7.10%和7.06%)平均值为7.06%。实际值与预测值差异不显著,采用响应面法优化得到的参数可以作为下一步实验的基础数据。
2.3 提取工艺单因素试验结果

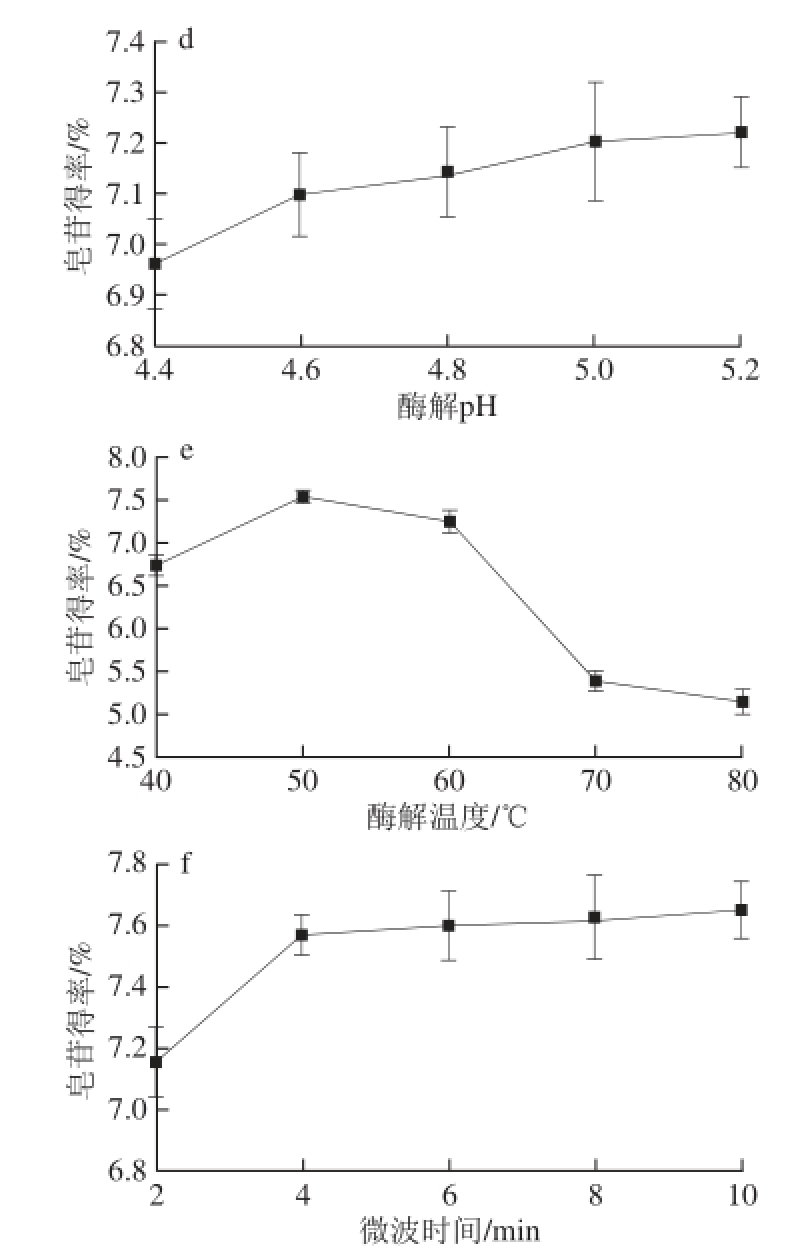
图1 单因素试验结果
Fig. 1 Results of single factor experiments showing the effects of extraction parameters on the yield of gypenosides
a.料液比;b.复合酶添加量;c.酶解时间;d.酶解pH值;e.酶解温度;f.微波时间。
由图1a可知,溶剂用量过少时提取得率不高,这可能是因为过少的溶剂不利于绞股蓝粉末的充分溶解,造成酶与底物接触不充分。过大的溶剂用量则稀释了酶溶液、不利于酶解反应的高效进行,同样造成提取效果下降。综合考虑溶剂消耗、提取效果、后续调配需求等实际问题,选择料液比1∶30(g/mL)为宜。
由图1b可知,随着复合酶添加量的增加,酶与底物接触机会相应增大,可使绞股蓝细胞壁破解,内容物随之释放出来。但当复合酶添加量超过1.5%后,皂苷得率的增加程度不明显,其原因可能是由于底物完全被酶分子所饱和,继续增加的酶分子失去了与底物结合的机会,造成酶解反应速度降低,也可能是因为不同酶种的竞争机制造成酶活降低[26],导致皂苷得率相应降低。因此从控制成本和皂苷得率综合考虑,选择复合酶添加量1.5%为宜。
由图1c可知,绞股蓝皂苷得率随酶解时间的延长增加,从提高生产效率的角度看,酶解时间超过2.0 h 后,继续延长酶解时间对皂苷提取意义不大,因此选择酶解时间在2.0 h为宜。
由图1d可知,pH值在4.4~5.2之间,皂苷得率随pH值的上升而增加,但皂苷得率变化不大,这可能是由复合酶的酶种特性决 定的,在这段pH值范围内复合酶能保持较高的酶活。弱酸性的提取环境有利于提取液的后期杀菌,降低杀菌温度和杀菌时间从而更好地保留绞股蓝皂苷,为绞股蓝皂苷的产业化应用提供了很好的前提条件[27]。综合考虑皂苷得率和杀菌效果,选择酶解pH 4.8为宜。
由图1e可知,随着酶解温度的升高,绞股蓝皂苷得率升高,但当温度超过50 ℃时,皂苷的提取率反而下降。过高的酶解温度导致酶结构发生变化而失去活性[15],当温度超过70 ℃后酶基本失活,失去了添加复合酶的破壁优势。所以酶解温度控制在50 ℃为宜。
经预实验发现,在800 W微波条件下,用时2 min提取液可达70 ℃,为防止部分皂苷由于长时间微波作用产生热降解,本实验固定微波功率在800 W,2 min间歇微波处理。由图1f可知,在累积微波时间4 min后,继续延长微波时间绞股蓝皂苷得率提高不大,这可能是因为4 min时微波的破壁作用已充分进行,之后微波时间的延长所带来绞股蓝皂苷得率的微弱提高大多是因为温度的提升所带来的,考虑到节约能耗和时间,选择微波时间在4 min左右为宜。
表5 单因素试验方差分析
Table 5 Analysis of variance of single factor experiment
通过单因素试验方差分析(表5)确定各因素的显著性先后顺序为酶解温度、复合酶添加量、酶解时间、微波时间、酶解pH值、料液比,其中影响极显著的4 个因素分别为酶解温度、酶添加量、酶解时间、微波时间。
2.4 绞股蓝皂苷提取工艺响应面试验结果
表6 绞股蓝皂苷提取Box-Behnken设计方案与结果
Table 6 Box-Behnken design with experimental values of gypenosides yield
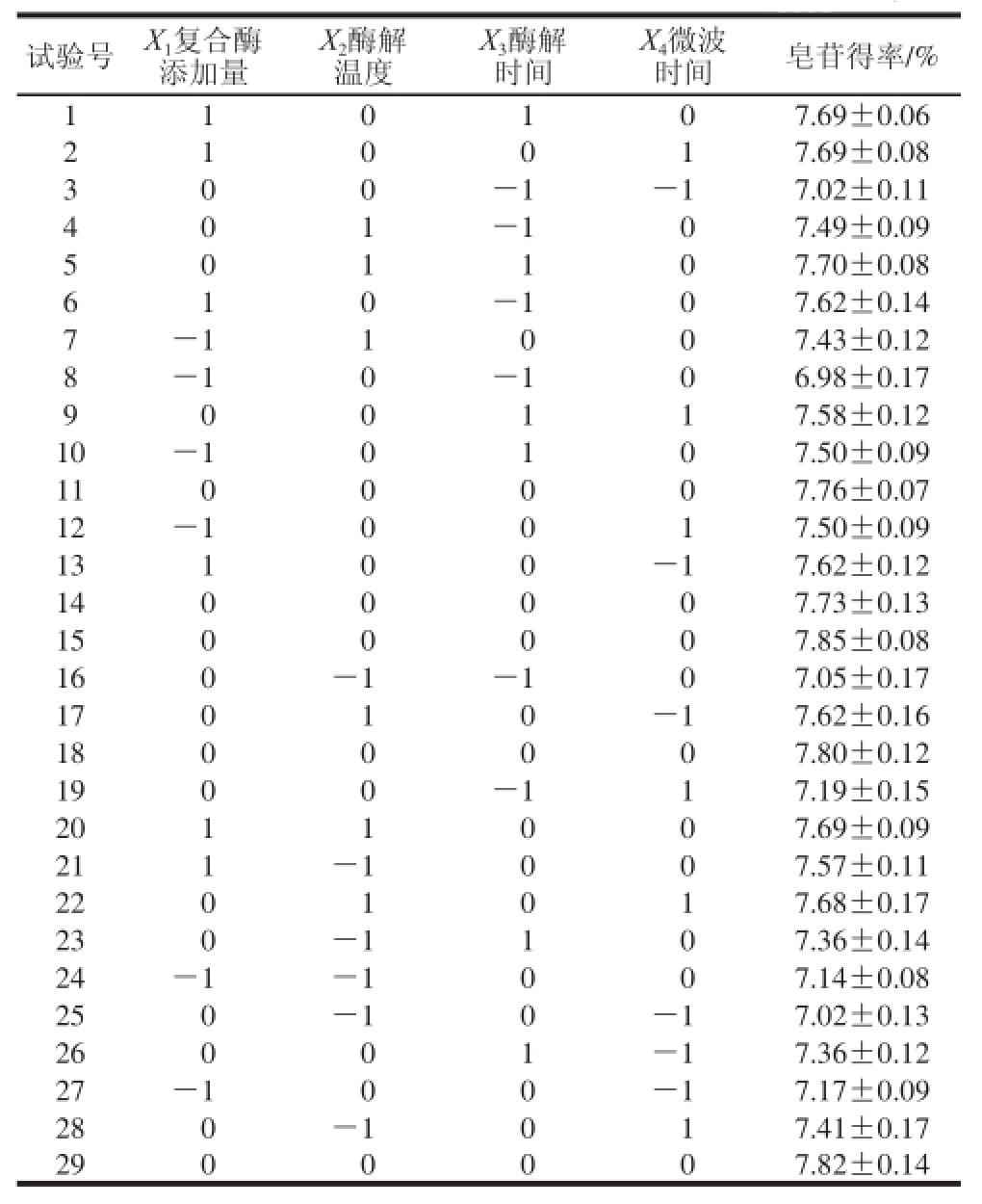
对表6试验数据进行逐步回归多次拟合,剔除影响不显著的拟合项后,可得到其二次多项式方程为:

表7 绞股蓝皂苷提取回归方程各项的方差分析
Table 7 Analysis of variance of all terms in regression equation for the optimization of extraction parameters
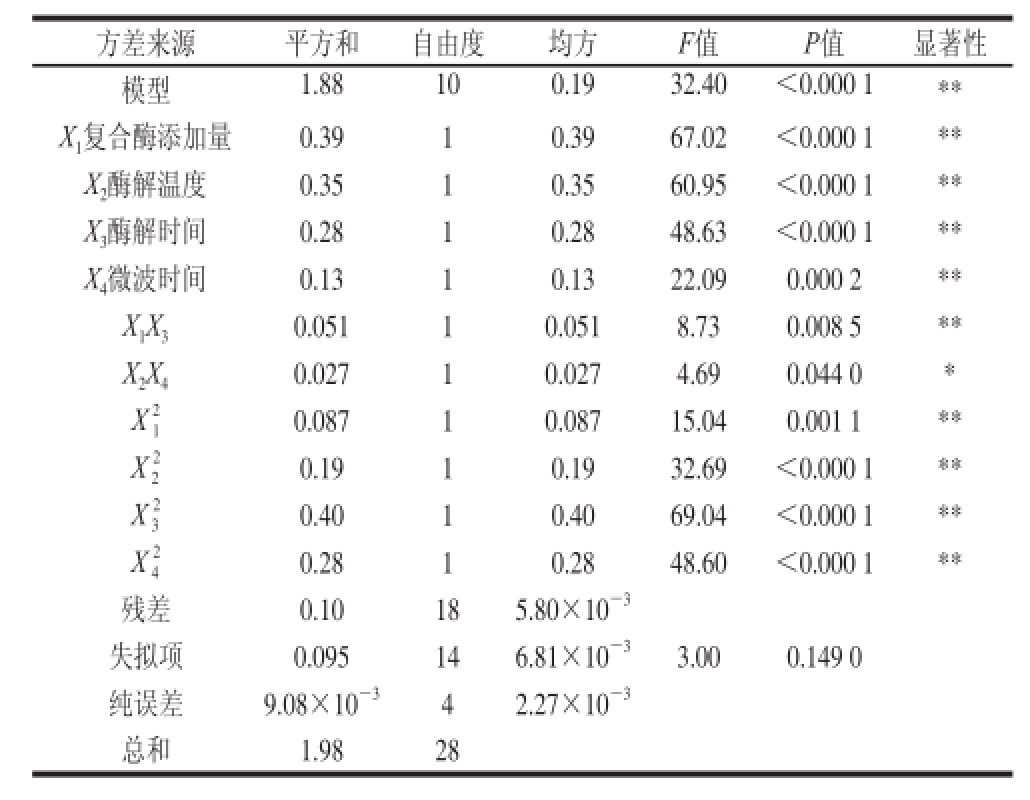
由表7可以看出,该模型P<0.01(极显著),失拟项P>0.05(不显著);同时模型的决定系数R2=0.95,说明模型拟合程度良好;校正决定系数R2Adj=0.92,表明预测值与实测值之间具有高度相关性;再次变异系数CV=1.02%,也说明其置信度较高。因此可以用此回归模型对绞股蓝皂苷得率进行分析和预测。
通过Design-Expert 8.0.6软件对回归模型进行数学分析获得最佳工艺为复合酶添加量1.85%、酶解温度52.32 ℃、酶解时间2.07 h、微波时间4.31 min,在此条件下,预测的绞股蓝皂苷得率最大理论值为7.92%。
2.5 绞股蓝皂苷提取验证实验结果
为了方便实际操作,将条件调节为复合酶添加量1.8%、酶解温度52 ℃、酶解时间2 h、微波时间4 min,并结合料液比1∶30(g/mL)、酶解pH 4.8,进行3次平行绞股蓝皂苷提取实验,绞股蓝皂苷得率(7.86%、7.90% 和7.89%)平均值为7.88%,实际值与预测值差异不显著。因此,该法优化得到的工艺条件基本准确可靠,可以作为工业化应用的依据。
2.6 与传统水提法比较结果
若不采用微波辅助酶法,而是利用传统水提法提取绞股蓝皂苷,水提条件为2 g预处理过的绞股蓝粉末、料液比1∶30(g/mL)、提取温度70 ℃、提取时间1 h,平行测定6组,绞股蓝皂苷得率的平均值为4.69%。从产品得率看,微波辅助酶法提取率相比传统水提法提高了68%,这主要是因为微波辅助酶法在微波破壁的基础上进一步复合酶解更有利于改变细胞壁的组织结构和状态,提高破壁效果,促进绞股蓝皂苷的溶出,且微波辅助酶法提取温度低,皂苷不易失活,有助于提高绞股蓝皂苷得率。
经响应面试验优化得到皂苷提取所用复合酶配比为果胶酶添加量0.4%、半纤维素酶添加量0.5%、纤维素酶添加量0.5%,即4∶5∶5。添加量影响强弱次序为:纤维素酶>半纤维素酶>果胶酶。
通过单因素试验和Box-Behnken设计优化,得到了影响绞股蓝皂 苷得率的4 个显著因素,并实现了提取条件的优化。最佳提取工艺参数为料液比1∶30(g/mL)、酶解pH 4.8、微波功率800 W、复合酶添加量1.8%、酶解温度52 ℃、酶解时间2 h、微波时间4 min,绞股蓝皂苷得率平均为7.88%,与预测值差异不显著。
微波辅助酶法提取工艺操作简单,提取温度较低,能耗大大减少[28]。成本增加主要是复合酶,但是酶的用量仅为1.8%,且3种酶的价格也较便宜,综合来看产品得率提高所带来的附加值以及产品能耗的降低可以抵消微波辅助酶法的成本增加,具有很好的工业化前景。
参考文献:
[1] 王青豪, 潘虹, 杨宇飞, 等. 从绞股蓝中联合提取皂苷、黄酮和多糖工艺优化[J]. 食品科学, 2012, 33(22): 63-66.
[2] HU Lihong, CHEN Zhongliang, XIE Yuyuan. Dammarane-type glycosides from Gynostemma pentaphyllum[J]. Journal of Natural Products, 1997, 44(4): 667-670. DOI:10.1016/S0031-9422(96)00577-8.
[3] TAKEMOTO T, ARIHARA S, YOSHIKAWA K, et al. Studies on the constituents of cucurbitaceae plants. Ⅺ. on the saponin constituents of Gynostemma pentaphyllum Makino(7)[J]. Journal of the Pharmaceutical Society of Japan, 1984, 104(9): 724-730.
[4] TAKEMOTO T, ARIHARA S, NAKAJIMA T, et al. Studies on the constituents of Gynostemma pentaphyllum Makino. Ⅱ. structures of gypenoside XV-XXI[J]. Journal of the Pharmaceutical Society of Japan, 1983, 103(12): 1015-1023.
[5] 向善荣. 中国绞股蓝研究与资源开发利用[M]. 南昌: 江西高校出版社, 1997: 2-4.
[6] QIN Reman, ZHANG Jianyu, LI Chuyuan, et al. Protective effects of gypeno sides against fatty liver disease induced by high fat and cholesterol diet and alcohol in rats[J]. Archives of Pharmacal Research, 2012, 35(7): 1241-1250. DOI:10.1007/s12272-012-0715-5.
[7] CHI Aiping, CHEN Jinping, WANG Zhezhi, et al. Morphological and structural characterization of a polysaccharide from Gynostemma pentaphyllum Makino and its anti-exercise fatigue activity[J]. Carbohydrate Polymers, 2008, 74(4): 868-874. DOI:10.1016/ j.carbpol.2008.05.010.
[8] WANG Zhaojing, LUO Dianhui. Antioxidant activities of different fractions of polysaccharide purifed from Gynostemma pentaphyllum Makino[J]. Carbohydrate Polymers, 2007, 68(1): 54-58. DOI:10.1016/ j.carbpol.2006.07.022.
[9] YEO J, KANG Y J, JEON S M, et al. Potential hypoglycemic effect of an ethanol extract of Gynostemma pentaphyllum in C57bl/ksj-Db/db mice[J]. Journal of Medicinal Food, 2009, 11(4): 709-716. DOI:10.1089/jmf.2007.0148.
[10] HUANG T H, TRAN V H, ROUFOGALIS B D, et al. Gypenoside XLIX, a naturally occurring PPAR-alpha activator, inhibits cytokineinduced vascular cell adhesion molecule-1 expression and activity in human endothelial cells[J]. European Journal of Pharmacology, 2007, 565(1): 158-165. DOI:10.1016/j.ejphar.2007.03.013.
[11] 史琳, 赵红, 张璐雅, 等. 绞股蓝药理作用的研究进展[J]. 药物评价研究, 2011, 34(2): 125-129.
[12] 张新宇, 张笛, 王琳, 等. 绞股蓝皂苷提取纯化工艺研究进展[J].食品工业科技, 2014, 35(18): 374-378; 382. DOI:10.13386/ j.issn1002-0306.2014.18.077.
[13] 仇小艳, 李向民, 苗玲, 等. 绞股蓝总皂甙提取方法的比较研究[J].现代生物医学进展, 2008, 8(10): 1936-1938.
[14] 林硕, 岳琳娜, 高学玲, 等. 超声波强化提取绞股蓝皂苷的工艺研究[J]. 食品科学, 2009, 30(14): 72-75. DOI:10.3321/ j.issn:1002-6630.2009.14.009.
[15] 黄山, 公衍玲, 金宏. 酶法提取绞股蓝总皂苷工艺条件的优化[J]. 食品工业科技, 2009, 30(4): 178-180; 273.
[16] 林硕, 岳琳娜, 高学玲, 等. 果胶酶提取绞股蓝皂苷的工艺研究[J]. 中国食物与营养, 2009, 23(4): 21-24. DOI:10.3969/ j.issn.1006-9577.2009.04.007.
[17] 李扬, 赵树法, 李婷, 等. 微波辅助萃取技术在食品工业中的研究进展[J]. 中国酿造, 2006, 25(9): 5-8. DOI:10.3969/ j.issn.0254-5071.2006.09.002.
[18] BALLARD T S, MALLIKARJUNAN P, ZHOU Kequan, et al. Microwave-assisted extraction of phenolic antioxidant compounds from peanut skins[J]. Food Chemistry, 2010, 120(4): 1185-1192. DOI:10.1016/j.foodchem.2009.11.063.
[19] BAI Yuping, ZHAO Lis ha, QU Chenling. Microwave degradation of floatation-enriched ginsenoside extract from Panax quinquefolium L. leaf[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 10252-10260. DOI:10.1021/jf902153a.
[20] KWON J H, LEE G D, KIM K G, et al. Monitoring and optimization of microwave-assisted extraction for total solid, crude saponin, and ginsenosides from ginseng roots[J]. Food Science and Biotechnology, 2004, 13(3): 309-314.
[21] 龙云飞, 王沛佩, 杨克迪, 等. 响应面法优化亚麻籽油提取工艺[J].食品科学, 2012, 33(14): 45-49.
[22] 卫生部. 保健食品检验与评价技术规范[M]. 北京: 人民卫生出版社, 2003: 306.
[23] 刘世彪, 廖海民, 胡正海. 绞股蓝营养器官各发育阶段结构与总皂甙含量相关性的 研究[J]. 植物科学学报, 2005, 23(2): 144-148. DOI:10.3969/j.issn.2095-0837.2005.02.009.
[24] 林硕, 高学玲, 岳琳娜, 等. 正交法优选绞股蓝皂苷提取工艺及稳定性研究[J]. 中国食品添加剂, 2009(2): 89-92. DOI:10.3969/ j.issn.1006-2513.2009.02.016.
[25] 郭辉力, 邓泽元. 微波干法辅助提取绞股蓝总皂苷的研究[J]. 食品与机械, 2009, 25(1): 68-71.
[26] LEE S B, KIM I H, RYU D D, et al. Structural properties of cellulose and cellulase reaction mechanism[J]. Biotechnology and Bioengineering, 1983, 25(1): 33-51. DOI:10.1002/bit.260250105.
[27] 廖红梅, 廖小军, 胡小松, 等. 影响DPCD技术杀菌效果的因素与杀菌机理分析[J]. 食品与发酵工业, 2007, 33(1): 96-99. DOI:10.3321/ j.issn:0253-990X.2007.01.026.
[28] 张力. 微波辅助提取天然产物有效成分及丹参酮ⅡA分离纯化工艺研究[D]. 天津: 天津大学, 2008. DOI:10.7666/d.y1530561.
Optimization of Microwave-Assisted Enzymatic Extraction of Gypenosides from Gynostemma pentaphyllum
ZHANG Di, ZENG Qingmei*, WANG Lin, YAN Chunming, GAO Ya
(Engineering Research Center of Bio-Process, Ministry of Education, Hefei University of Technology, Hefei 230009, China)
Abstract: This study addressed the microwave-assisted enzymatic extraction of gypenosides from the whole plants of Gynostemma pentaphyllum as an improvement over the traditional water extraction method, giving a lower extraction yield. Response surface method based on Box-Behnken design was used to optimize the ratio of pectinase to hemicellulase to cellulose for their combined use in the extraction of gypenosides as well as process parameters. The results showed that enzyme dosage, hydrolysis temperature, hydrolysis time and microwave irradiation time were identified as main variables that influence extraction efficiency. The optimum values for these 4 independent variables were 1.8%, 52 ℃, 2 h and 4 min, respectively. The yield of gypenosides was 7.88% under these conditions, which was increased by 68% compared with that obtained with the traditional water extraction method. Due to its low extraction temperature and simple operation, this method has a good prospect of industrial application.
Key words: microwave; multi-enzymatic method; response surface methodology; gypenosides
收稿日期:2015-11-15
基金项目:国家自然科学基金面上项目(31371844);国家高技术研究发展计划(863计划)项目(2011AA100801);安徽省科技攻关项目(1301032155)
作者简介:张笛(1990—),男,硕士,研究方向为食品现代加工工程化技术。E-mail:baitianwy@163.com
*通信作者:曾庆梅(1962—),男,教授,博士,研究方向为食品科学与生物化工。E-mail:zengqingmei-1@163.com
DOI:10.7506/spkx1002-6630-201612001
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)12-0001-06