张艳荣,王庆庆,刘 通,郭 中
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:采用正交试验优化碳酸钠提取木耳黑色素的工艺,并对黑色素的稳定性和结构进行分析。结果表明,单因素及正交试验确定最优工艺条件为:超声功率160 W(5 g固体物料)、料液比1∶30(g/mL)、碳酸钠浓度2.00 mol/L、提取时间50 min。在此工艺条件下获得木耳黑色素粗提物的产量为9.078 g/100 g。化学表征证明,木耳黑色素对温度、低浓度氧化剂和还原剂有较强的稳定性,但对光的稳定性较差;木耳黑色素在波长210 nm处有最大吸收峰。红外结果显示,木耳黑色素由羟基、氨基、C=O、C=C、CH、CH2以及芳环基团组成。木耳黑色素的S∶N=0.01,表明木耳黑色素为真黑色素,预示其具有乌发、抗衰老等作用。
关键词:黑木耳;黑色素;提取工艺;表征
作者介绍:张艳荣(1965—),女,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com
引文格式:
张艳荣, 王庆庆, 刘通, 等. 木耳黑色素碱法提取工艺优化及表征[J]. 食品科学, 2016, 37(12): 27-32. DOI:10.7506/ spkx1002-6630-201612005. http://www.spkx.net.cn
ZHANG Yanrong, WANG Qingqing, LIU Tong, et al. Alkaline extraction optimization and characterization of Auricularia auricula melanin[J]. Food Science, 2016, 37(12): 27-32. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612005. http://www.spkx.net.cn
黑色素是一类在生物体内广泛存在的天然物质,通常是由多酚类化合物或吲哚氧化聚合而成,其结构复杂,分子质量大[1]。通常情况下黑色素呈黑色、褐素或者棕色[2]。意大利化学家Nicolaus[3]通过研究黑色素的元素组成、聚合途径及颜色,把黑色素分为异黑色素、棕黑色素和真黑色素。天然黑色素在生物体内广泛存在,其含量在现有生物类黑色素中占第一位[4]。相关研究[5]结果表明,黑色素具有保护神经、抗氧化、清除自由基等功能,对人体健康的维护具有重要意义。随着人们对天然黑色素研究的不断深入,其越来越广泛地被应用于食品领域和化工领域[6],例如食品添加剂、防晒露、染发剂等[7]。
天然黑色素的提取多采用氢氧化钠法,其提取率高、纯化效果好。但对于木耳黑色素的提取会由于强碱的作用导致木耳萃余物无法再次利用,带来木耳食用菌资源的浪费。如果提取剂为食品级碳酸钠,则可继续利用萃余物提取木耳膳食纤维,提高木耳利用率。木耳(Auricularia auricula(L. ex Hook.)Underwood),又名树蕈,是传统的药食用菌[8]。木耳被誉为“菌中之冠”,其营养价值丰富 ,受到广大营养学家的称赞[9],富含人体不可缺少的蛋白质、多糖、脂肪、维生素[10]等。木耳子实体含有功能性黑色素,是著名的黑色健康食品[11]。有关研究[11]结果显示,食物的营养价值与天然颜色存在密切联系。食物的颜色越深,营养价值越高,其排列顺序为黑、绿、红、黄、白,在同类食物中颜色越深,营养效果越显著。天然黑色素是木耳特有的功能性成分之一[12]。本实验采用超声波辅助碳酸钠提取木耳黑色素,并通过紫外光谱扫描、红外光谱扫描和元素测定,对木耳黑色素的组成及相关性质进行检测分析,为木耳黑色素在食品、医药等方面的开发利用提供理论依据。
1.1 材料与试剂
木耳 市售干品,要求干燥洁净、无虫蛀、无霉变。
碳酸钠、氢氧化钠、盐酸、乙酸乙酯、三氯甲烷、95%乙醇(均为分析纯) 北京化工厂。
1.2 仪器与设备
RHP-600型高速多功能粉碎机 浙江荣浩工贸有限公司;水浴振荡器 哈尔滨市东联电子技术开发有限公司;101A-2E电热恒温鼓风干燥箱 上海试验仪器厂有限公司;JY92-II超声波细胞粉碎机 宁波新芝科器研究所;PHS-3C型pH计 上海仪电科学仪器股份有限公司;IR Prestige傅里叶红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 原料预处理
木耳干品用清水冲洗干净,去除杂质,置于50 ℃条件下烘干,破碎,得到可全部通过60 目孔径筛的木耳粉,干燥环境保存备用。
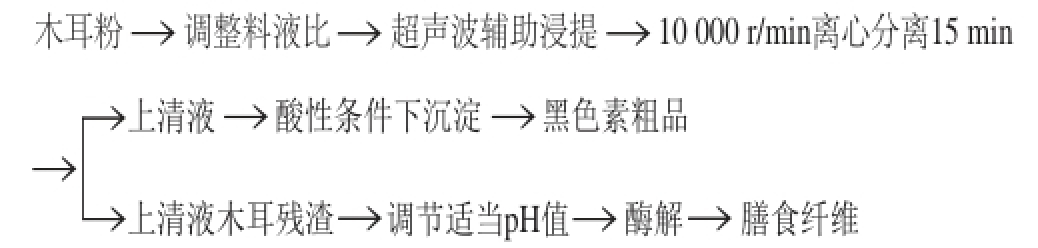
1.3.2 木耳黑色素提取工艺

1.3.3 单因素试验
单因素试验条件为:固定样品用量为5 g,料液比1∶30、碳酸钠浓度1.00 mol/L、超声功率100 W、提取时间70 min。改变其中一个条件,固定其余条件来分析料液比、碳酸钠浓度、超声功率和提取时间对木耳黑色素产量的影响[13]。每个因素设5 个水平:料液比(1∶20、1∶30、1∶40、1∶50、1∶60,g/mL)[14]、碳酸钠浓度(1.00、1.50、2.00、2.50、3.00 mol/L)、超声功率(80、100、120、140、160 W)、提取时间(30、50、70、90、110 min),为减小试验的误差,每组试验重复5 次。
将处理后的料液离心分离,获得上清液,调节上清液pH 1.5,在80 ℃的水浴锅中加热至沉淀,离心分离,用蒸馏水洗涤至中性,干燥至恒质量,获得木耳黑色素粗提物。
1.3.4 正交试验设计
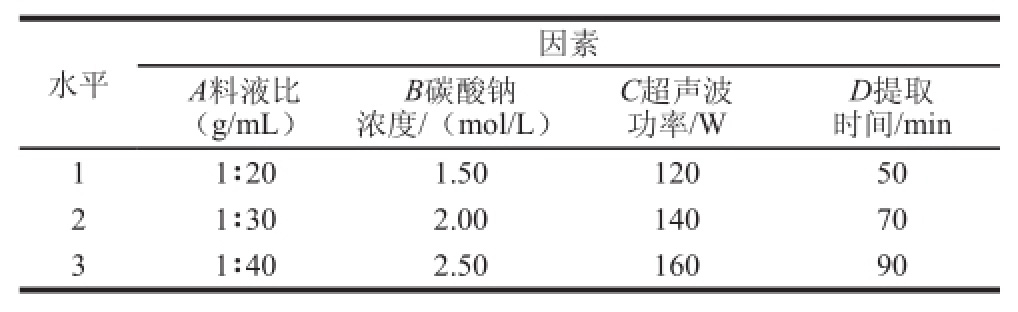
根据单因素试验结果,以木耳黑色素粗提物的产量作为考察指标,对料液比、碳酸钠浓度、超声功率和提取时间4 个因素,设计L9(34)正交试验,确定提取的最优工艺。正交试验因素与水平设计见表1。
表1 正交试验因素与水平
Table 1 Factors and levels used in orthogonal array experiments
1.3.5 木耳黑色素的纯化
将木耳黑色素粗提物置于浓度1 mol/L HCl溶液中,在90 ℃的条件下水解2 h,离心分离,取沉淀物分别用三氯甲烷、乙酸乙酯、95%乙醇溶液反复处理至不产生白色分层,处理后用盐酸调沉淀物pH 2.5静置沉淀,离心收集沉淀用蒸馏水洗涤沉淀至中性,干燥至恒质量,获得纯化的木耳黑色素[15]。
1.3.6 木耳黑色素的鉴定
1.3.6.1 温度对木耳黑色素稳定性的影响
将0.1 g木耳黑色素用1 mol/L的氢氧化钠溶液定容至1 L,分别置于0、20、40、60、80、100 ℃不同条件下,于暗处放置,每个1 h取样1 次,等温度恢复至室温条件,在波长400 nm处测定吸光度[15]。
1.3.6.2 光照对木耳黑色素稳定性的影响
将0.1 g木耳黑色素用1 mol/L的氢氧化钠溶液定容至1 L,分别置于暗处(对照)、自然光照和白炽灯下照射,每隔1 h取样一次测定吸光度。
1.3.6.3 氧化剂对木耳黑色素稳定性的影响
配制质量分数为0.03%、0.30%和3.00%的H2O2溶液,分别量取2 mL加入到8 mL木耳黑色素溶液中,于室温暗处放置,每隔1 h测定吸光度,对照组中将H2O2溶液换成蒸馏水[16]。
1.3.6.4 还原剂对木耳黑色素稳定性的影响
配制质量分数为0.02%、0.20%和2.00%的亚硫酸钠溶液,分别量取2 mL加入到8 mL木耳黑色素溶液中,于室温暗处放置,每隔1 h测定吸光度,对照组中将H2O2溶液换成蒸馏水。
1.3.6.5 紫外-可见光谱扫描
称取1.00 g木耳黑色素,加入到0.1 mol/L的氢氧化钠溶液中,60 ℃水浴加热并搅拌,维持30 min,使色素完全溶解,然后3 000 r/min离心10 min,取上清液在190~600 nm的波长范围内进行紫外光谱扫描[17]。
1.3.6.6 红外光谱扫描
采用溴化钾压片法,按1∶200的比例将烘干至恒质量的木耳黑色素和溴化钾粉末,混合均匀研成粉末,将粉末压成薄厚均匀、透明度高的薄片。在500~4 000 cm-1范围内进行红外光谱扫描[18]。
1.3.6.7 木耳黑色素各组分元素分析
采用元素分析仪检测木耳黑色素样品中C、H、N和S元素含量。
2.1 单因素试验
2.1.1 料液比对木耳黑色素提取效果的影响

图1 料液比对木耳黑色素提取效果的影响
Fig. 1 Effect of material-to-liquid ratio on the extraction yield of Auricularia auricula melanin
当料液比为1∶10时,溶液黏稠,试验操作误差大。由图1可知,随着提取溶剂用量的不断增加,黑色素粗品产量也随之上升,料液比在1∶30时,木耳黑色素粗提物产量最高;继续增加溶剂用量,黑色素产量呈下降趋势,且不利于黑色素酸沉,造成浪费。综合以上因素,选取料液比为1∶20、1∶30、1∶40为正交试验考察水平。
2.1.2 碳酸钠浓度对木耳黑色素得率的影响
由图2可知,碳酸钠溶液浓度在1.00~2.00 mol/L时,黑色素粗品产量随着浓度的提高而上升。碳酸钠度高于2.00 mol/L时,碱溶性杂质的溶出量随着碳酸钠浓度的提高而增加,影响了黑色素的溶出效率,从而使黑色素产量下降。综合以上因素,选取碳酸钠浓度为1.50、2.00、2.50 mol/L作为正交试验考察水平。

图2 碳酸钠溶液浓度对木耳黑色素提取效果的影响
Fig. 2 Effect of sodium carbonate concentration on the extraction yield of Auricularia auricula melanin
2.1.3 超声功率对木耳黑色素提取效果的影响

图3 超声功率对木耳黑色素提取效果的影响
Fig. 3 Effect of ultrasonic powers on the extraction yield of Auricularia auricula melanin
由图3可知,木耳黑色素粗提物产量随着超声功率的增加而增大。这是由于超声功率越大细胞破碎程度越大,加快了木耳黑色素的扩散释放效率[19],提高木耳黑色素的产量。随着超声功率的增大,木耳黑色素粗提物产量趋于稳定,如果继续增加超声波功率会造成不必要的损失,因此选取120、140、160 W作为正交试验考察水平。
2.1.4 超声波提取时间对木耳黑色素提取效果的影响

图4 提取时间对木耳黑色素提取效果的影响
Fig. 4 Effect of extraction duration on the extraction yield of Auricularia auricula melanin
由图4可知,提取时间在30~70 min时,木耳黑色素粗提物的产量随时间延长不断增加。当提取时间在70 min左右时产量最高。提取时间继续延长,木耳黑色素粗提物的产量开始降低。这可能是由于超声波的振荡破碎作用使黑色素分子结构发生变化而造成损失[20]。综合以上因素,选取提取时间为50、70、90 min作为正交试验考察水平。
2.2 正交试验设计及结果
根据单因素试验结果,选取料液比、碳酸钠浓度、超声功率、提取时间4 个因素,设计四因素三水平的正交试验,以木耳黑色素粗提物产量为评价标准,确定木耳黑色素提取的最优工艺。
表2 木耳黑色素提取工艺正交试验结果
Table 2 Orthogonal experimental design with experimental results of Auricularia auricula melanin

由表2和图5可知,采用碳酸钠提取木耳黑色素过程中,各因素对木耳黑色素粗提物产量的影响主次关系为C>B>A>D,即超声功率>碳酸钠浓度>料液比>提取时间。其中超声功率及碳酸钠浓度对木耳黑色素粗提物产量的影响较大;而料液比与提取时间对木耳黑色素的提取影响不显著。最优组合为A2B2C3D1,即料液比1∶30、碳酸钠浓度2.00 mol/L、超声波功率160 W、提取时间50 min,由此工艺条件下获得的木耳黑色素粗提物产量为9.078 g/100 g。
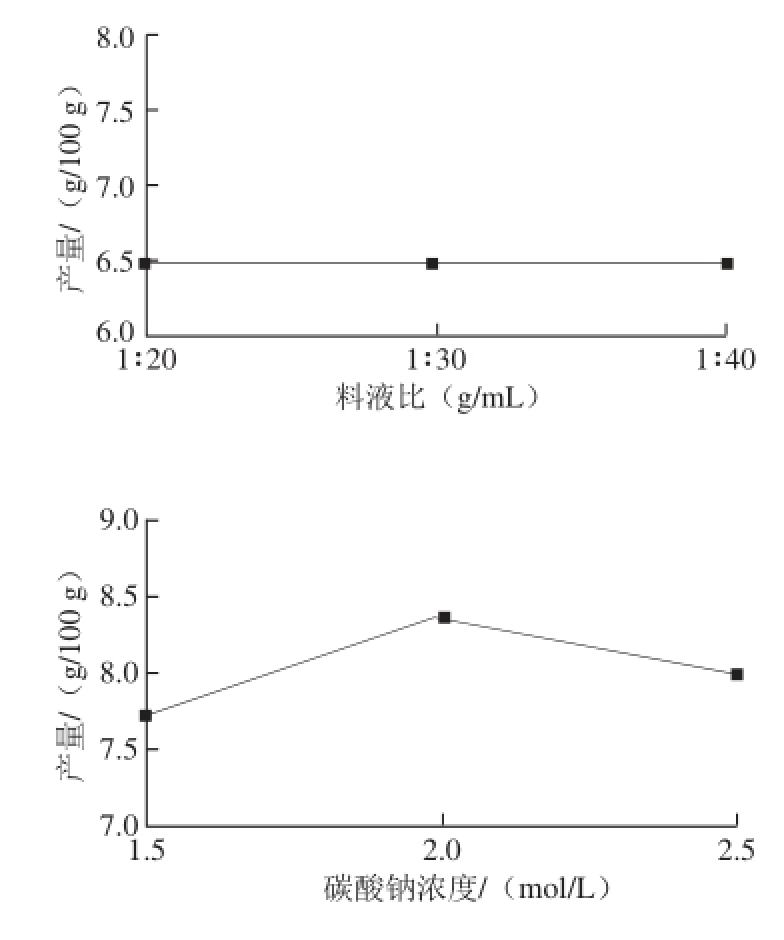
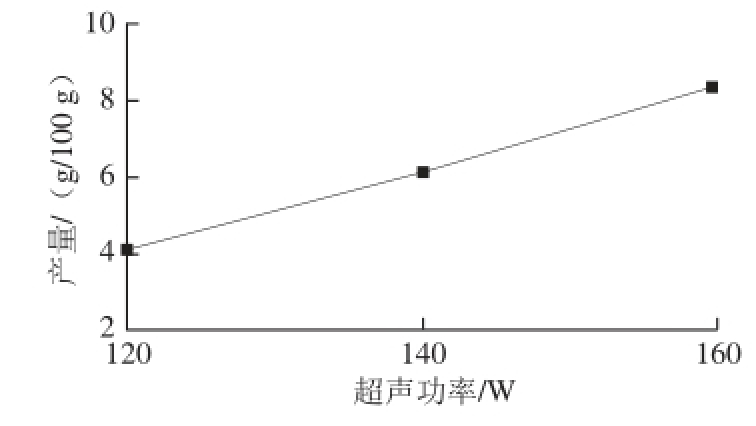

图5 正交试验直观图
Fig. 5 Range analysis of orthogonal experiment
2.3 温度对木耳黑色素稳定性的影响
表3 温度对木耳黑色素稳定性的影响
Table 3 Effect of temperature on the stability of Auricularia auricula melanin
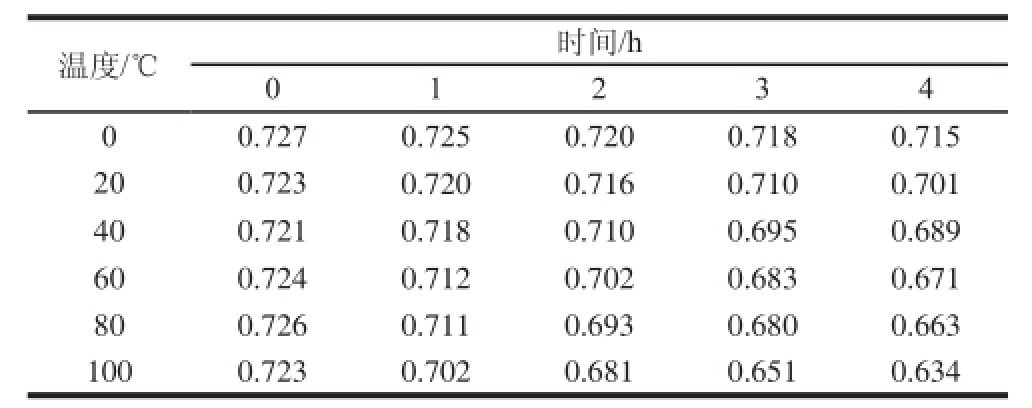
注:黑色素含量以吸光度计。下同。
由表3可知,木耳黑色素在0 ℃维持4 h仅损失1.65%,随着温度的升高和加热时间的延长,木耳黑色素的保存率有所下降,但在100 ℃加热4 h后,损失保存率仍达到87.69%,这表明木耳黑色素具有较强的热稳定性。
2.4 光照对木耳黑色素稳定性的影响
表4 光照对木耳黑色素稳定性的影响
Table 4 Effect of different light sources on the stability of Auricularia auricula melanin
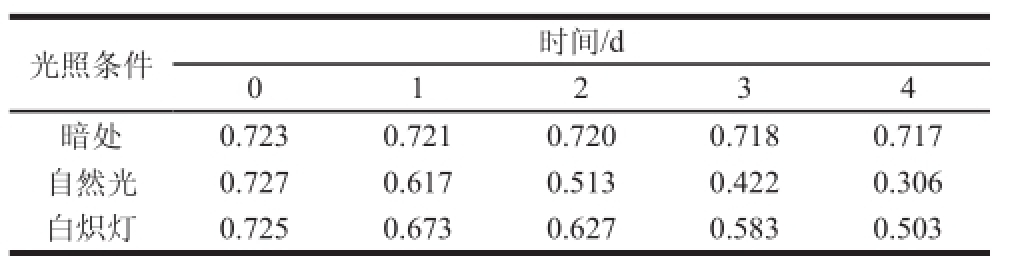
由表4可知,木耳黑色素在暗处保存4 d,其损失率仅为0.83%;但是在自然光下存放仅1 d,色素损失就达到15.13%,存放4 d时木耳黑色素的残存率为57.91%。木耳黑色素在白炽灯下照射4 d后,黑色素残存率为69.38%,这表明光照对木耳黑色素的破坏作用随着时间的延长而增加,且光照越强,破坏程度越大。这可能是因为光照改变了木耳黑色素的结构,导致稳定性下降。
2.5 氧化剂对木耳黑色素稳定性的影响
表5 氧化剂对木耳黑色素稳定性的影响
Table 5 Effect of oxidants on the stability of Auricularia auricula melanin

由表5可知,木耳黑色素溶液在H2O2质量分数为0.03%时,色素溶液的吸光度与对照相差不大,但当H2O2质量分数为0.30%时,色素溶液的吸光度与对照相差较大,当H2O2质量分数为3.00%时,色素溶液的吸光度急剧下降,这说明木耳黑色素对低质量分数的H2O2具有较强的稳定性。
2.6 还原剂对木耳黑色素稳定性的影响
表6 还原剂对木耳黑色素稳定性的影响
Table 6 Effect of reducing agents on the stability of Auricularia auricula melanin
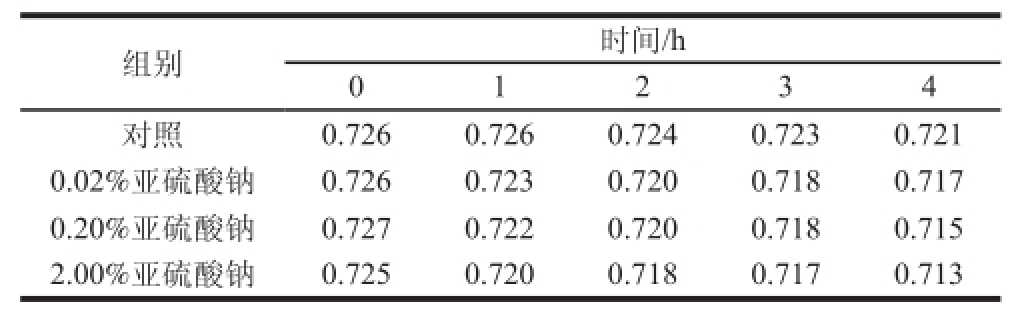
由表6可知,在不同质量分数的亚硫酸钠溶液中,木耳黑色素的吸光素几乎保持不变,表明木耳黑色素对还原剂亚硫酸钠有较强的稳定性。
2.7 木耳黑色素紫外光谱特征

图6 碳酸钠提取木耳黑色素的紫外光谱图
Fig. 6 UV absorption spectra of Auricularia auricula melanin extracted with Na2CO3
将木耳黑色素在190~600 nm内进行紫外光谱扫描,结果见图6,在210 nm波长处有最大吸收峰,与相关报道[21]中黑色素的最大吸收峰在210 nm左右一致。光谱在紫外区域吸收力最强,从210 nm处开始,随着波长的不断提高,吸光度表现出下降趋势,这是黑色素紫外吸收图像的典型特点[22]。在紫外扫描的过程中没有其他杂峰出现,说明本实验采用的提取与纯化方法收到良好效果。
2.8 木耳黑色素的傅里叶红外光谱特征
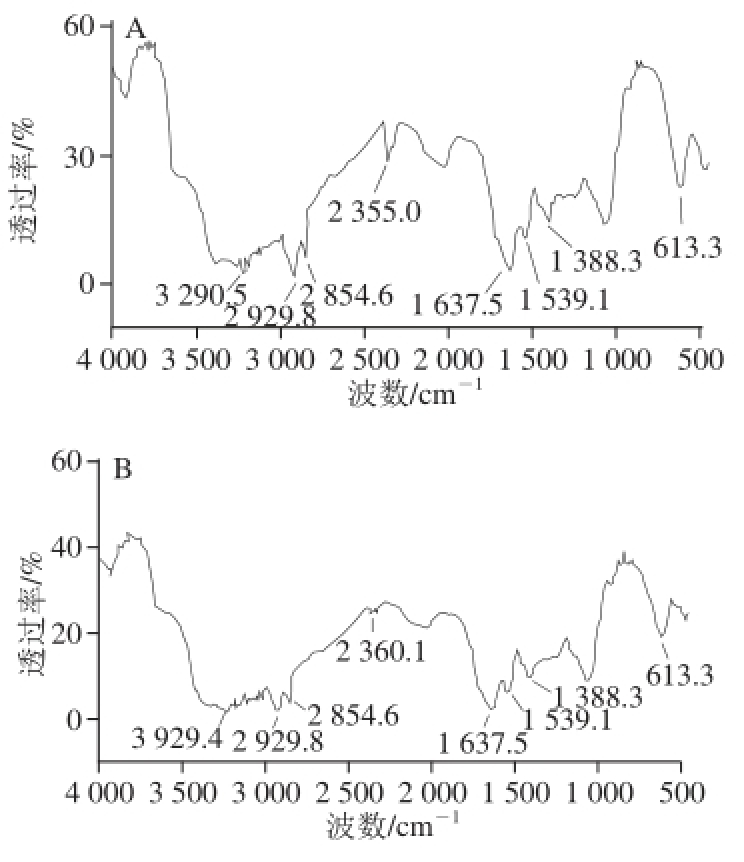
图7 氢氧化钠(A)和碳酸钠(B)提取木耳黑色素的红外光谱图
Fig. 7 Infrared spectra of Auricularia auricula melanin extracted with NaOH (A) and Na2CO3(B)
由图7可知,在3 290.5 cm-1处有较强的吸收峰,说明存在—OH和—NH结构;在2 929.8 cm-1处的吸收峰是—CH和—CH2的共振峰;在2 854.6 cm-1处的吸收峰可能是由于CH3、CH2、或者C=H基团的振动引起的;在1 637.5 cm-1处吸收峰说明可能存在—COOH;在1 388.3 cm-1处吸收峰是C—CH3的弯曲和骨架振动形成;在613.3 cm-1处存在吸收峰可能存在苯环;在2 360.1 cm-1的吸收峰产生了偏差,是由于产生了二氧化碳而引起的,对分析结果影响较小可以忽略;在3 600.0~3 800.6 cm-1的范围内存在一些较小的峰,这是由于有杂质的存在而引起的杂质峰,可以通过进一步纯化除杂削弱或除掉杂质,提高样品纯度,减小分析误差。根据分析结果可知,木耳黑色素为邻苯二酚结构,与植物源黑色素的结构一致。另外,分别采用氢氧化钠与碳酸钠提取的木耳黑色素结构极其相似,说明不同种类的碱溶液提取的木耳黑色素差异较小,因此可以考虑用食品级碳酸钠取代氢氧化钠提取木耳黑色素。
2.9 木耳黑色素的元素分析
表7 木耳黑色素的元素分析
Table 7 Elemental composition of Auricularia auricula melanin
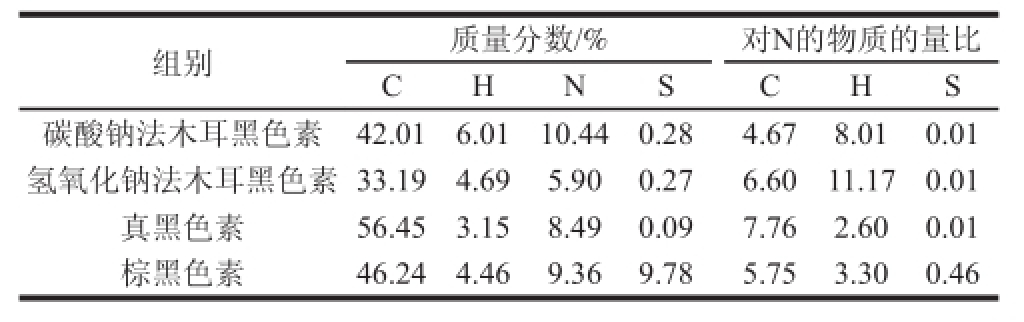
Ito等[23]提出棕黑色素和真黑色素的S∶N分别是0.46和0.01,从表7可知,2种方法提取的木耳黑色素的S∶N均是0.01,说明氢氧化钠及碳酸钠法提取的木耳色素都是真黑色素。对比氢氧化钠及碳酸钠法提取的木耳色素中C∶N,发现碳酸钠法获得的木耳黑色素中N含量明显高于氢氧化钠法,说明碳酸钠法提取的木耳黑色素中可能夹杂较多的蛋白质等含氮化合物,或者含有氨基结构[18,24-25]。
研究表明,超声波辅助碳酸钠提取木耳黑色素的最佳条件为料液比1∶30、碳酸钠浓度2.00 mol/L、超声功率160 W、提取时间50 min,此条件下木耳黑色素粗提物产量为9.078 g/100 g。
对木耳黑色素进行稳定性性实验,紫外、红外图谱扫描及元素分析,结果显示,木耳黑色素对温度、低浓度氧化剂和还原剂有较强的稳定性,但是对光的稳定性较差;木耳黑色素在波长210 nm处有最大吸收峰;红外光谱分析表明木耳黑色素由氨基、羟基、CH、C=C、C=O、CH2以及芳环基团组成,说明木耳黑色素为邻苯二酚型结构;元素分析表明木耳黑色素为真黑色素。
天然黑色素具有保护神经、抗氧化、清除自由基等营养保健作用,而且使用安全。在化学添加剂的污染、药物的滥用对人们机体健康造成的危害越来越受到关注与抵制的今天,安全、健康、功能化的天然色素的提取必将成为研究和应用的热点。氢氧化钠与碳酸钠提取的木耳黑色素的结构和性质极其相似,预示可以利用食品级碳酸钠取代强碱氢氧化钠进行木耳黑色素的提取,在获得木耳黑色素的同时萃余物可以再次利用于木耳膳食纤维、木耳食品等加工,避免原料木耳的浪费,实现木耳高值化利用。
参考文献:
[1] 邹宇, 尹冬梅, 胡文忠. 黑木耳天然黑色素理化性质及其抗氧化活性的研究[J]. 食品工业科技, 2013, 34(4): 118-120. DOI:10.13386/ j.issn1002-0306.2013.05.053.
[2] FINKEL T, HOLBROOK N J. Oxidants, oxidative stress and the biology of aging[J]. Nature, 2000, 408(9): 239-247.
[3] NICOLAUS R A. Melanins[M]. Paris: Hermann Press, 1968.
[4] SEIFRIED H E, ANDERSON D E, FISHER E I, et al. A review of the interaction among dietary antioxidants and reactive oxygen species[J]. Journal of Nutritional Biochemistry, 2007, 18(9): 567-579. DOI:10.1016/j.jnutbio.2006.10.007.
[5] PETROSYAN T R, GEVORKYAN O V, MELIKSETYAN I B, et al. Neuroprotective action of bacterial melanin in rats after corticospinal tract lesions[J]. Pathophysiology, 2012, 19(2): 71-80. DOI:10.1016/ j.pathophys.2011.12.003.
[6] 周幸知, 曹婷婷, 高艳, 等. 天然色素的研究进展概述[J]. 三农论坛, 2015, 32(9): 10-13. DOI:10.3969/j.issn.1004-8421.2015.09.004.
[7] 李琦, 侯丽华, 刘鑫, 等. 黑木耳黑色素鉴定及提取工艺优化[J]. 食品科学, 2010, 31(16): 87-92.
[8] 何杰民, 李春阳, 张拥军, 等. 不同工艺黑木耳不溶性膳食纤维的理化特性研究[J]. 营养学报, 2012, 34(4): 344-348. DOI:10.13325/ j.cnki.acta.nutr.sin.2012.04.003..
[9] 陆雯, 蔡振优, 鲜乔, 等. 黑木耳多糖提取工艺条件的研究[J]. 中国食品添加剂, 2010(6): 99-111. DOI:10.3969/ j.issn.1006-2513.2010.06.012.
[10] 吴晨霞, 陈平, 金晖, 等. 木耳黑色素的提取及其抗氧化研究[J]. 食用菌, 2013(4): 73-75. DOI:10.3969/j.issn.1000-8357.2013.04.043.
[11] 王鹏, 韩伟, 王文亮. 我国黑色食品的营养保健功能及开发前景[J]. 现代农业科技, 2010(17): 359-362. DOI:10.3969/ j.issn.1007-5739.2010.17.231.
[12] 刘雅静, 袁延强, 刘秀河, 等. 黑木耳营养保健研究进展[J]. 中国食物与营养, 2010(10): 66-69. DOI:10.3969/ j.issn.1006-9577.2010.10.018.
[13] 陈红, 樊红秀, 王大为, 等. 微波协同酶法提取玉米皮中的黄色素[J].食品科学, 2012, 33(6): 50-53.
[14] 余凡, 杨恒拓, 田光辉. 紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J]. 食品工业科技, 2013, 34(4): 322-326. DOI:10.13386/ j.issn1002-0306.2013.04.033.
[15] SAVA N, PLANCKEN V D, CLAEYS W, et al. The kinetics of heat: induced structural changes of β-lactoglobulin[J]. Dairy Science Association, 2005, 88: 1646-1653. DOI:10.3168/jds.S0022-0302(05)72836-8.
[16] 杨本宏. 辣椒红色素稳定性研究[J]. 生物学杂志, 2002(14): 20-22.
[17] 邓开野, 武国君, 王大为. 黑米中天然色素分离工艺的研究[J]. 食品科学, 2005, 26(9): 305-308. DOI:10.3321/ j.issn:1002-6630.2005.09.075.
[18] 邹宇, 尹冬梅, 杜雄伟, 等. 黑木耳黑色素组分分析及其抗氧化活性研究[J]. 食品科学, 2013, 34(23): 138-141. DOI:10.7506/spkx1002-6630-201323029.
[19] 廖建明, 张瑾, 沈子龙. 超声波法提取海带多糖的研究[J].药物生物技术, 2002, 9(3): 157-160. DOI:10.3969/ j.issn.1005-8915.2002.03.009.
[20] 欧阳琴, 陈兴才, 黄亚治. 雨生红球藻提取虾青素不同机械破壁方法的研究[J]. 福州大学学报, 2005, 33(1): 111-115. DOI:10.3969/ j.issn.1000-2243.2005.01.026.
[21] 付湘晋. 我国天然黑色素资源研究概况[J]. 粮食与油脂, 2005(12): 42-45.DOI:10.3969/j.issn.1008-9578.2005.12.014.
[22] SELVAKUMAR P, RAJASEKAR S, PERIASAMY K, et al. Isolation and characterization of melanin pigment from Pleurotiis cystidiosns (telomorph of Antromycopsis macrocarpa)[J]. World Journal of Microbiology and Biotechnology, 2008, 24(10): 2125-2131. DOI:10.1007/s11274-008-9718-2.
[23] ITO S, FUJITA K. Microanalysis of eumelanin and pheomelanin in hair and melanomas by chemicaldegradation and liquid chromatography[J]. Analytical Biochemistry, 1985, 144(2): 527-536. DOI:10.1016/0003-2697(85)90150-2.
[24] 黄宇玫, 田颖刚, 朱胜. 乌骨鸡黑色素三步法提取及结构性状研究[J].食品工业科技, 2014, 35(1): 249-253.
[25] 李瑞成, 尚永彪, 管俊峰. 乌骨鸡黑色素及其研究进展[J]. 肉类研究, 2010, 24(10): 54-59. DOI:10.3969/j.issn.1001-8123.2010.10.014.
Alkaline Extraction Optimization and Characterization of Auricularia auricula Melanin
ZHANG Yanrong, WANG Qingqing, LIU Tong, GUO Zhong
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract: The orthogonal array design method was used to optimize the extraction of Auricularia auricula melanin and the characterization of the melanin was conducted. Through single factor and orthogonal array experiments, the optimum extraction conditions were obtained as follows: ultrasonic power, 160 W; sample mass 5 g; material-to-liquid ratio, 1:30 (g/mL); sodium carbonate concentration, 2.00 mol/L; and extraction duration, 50 min. The crude extract yield under these conditions was 9.078 g/100 g. Chemical characterization proved that the melanin possessed strong stability to heat and low concentrations of oxidant and reducing agent but was sensitive to light. The melanin displayed maximum absorption peak at 210 nm. Infrared spectroscopy indicated that Auricularia auricula melanin was composed of hydroxy, amino, C=O, C=C, CH, CH2and aromatic ring groups. The S:N ratio of the melanin was 0.01, indicating that it is eumelanin and has functions such as hair blackening and anti-aging.
Key words: Auricularia auricular; melanin; extraction; characterization
收稿日期:2015-12-14
基金项目:“十二五”国家科技支撑计划项目(2013BAD16B08);国家高技术研究发展计划(863计划)项目(2011AA100805)
DOI:10.7506/spkx1002-6630-201612005
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)12-0027-06