表1 样品组、样品空白组和蒸馏水空白组的配制
Table 1 Preparation of sample group, sample blank group and distilled water blank group
李佳桥,余修亮,曾林晖,邓泽元,李红艳*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:在单因素试验的基础上,采用响应面试验研究乙醇体积分数、液料比、超声波功率和超声时间对莲房原花青素得率的影响,通过建立超声波辅助提取莲房原花青素的多元回归模型,优化莲房原花青素的提取工艺参数。结果表明,乙醇体积分数对莲房原花青素得率的影响最大,其次是液料比和超声波功率,超声时间对得率的影响相对较小。在乙醇体积分数45%、液料比21∶1(mL/g)、超声波功率700 W、超声时间15 min时,莲房原花青素得率最大,为6.81%,与模型理论预测值相近,说明该模型回归性良好,试验的拟合程度高,可以用于莲房原花青素得率的预测,为莲房原花青素作为天然抗氧化剂的应用提供一定的科学数据。
关键词:莲房;原花青素;提取工艺;超声波;响应面
引文格式:
李佳桥, 余修亮, 曾林晖, 等. 响应面试验优化超声波辅助提取莲房原花青素工艺[J]. 食品科学, 2016, 37(12): 40-45.
LI Jiaqiao, YU Xiuliang, ZENG Linhui, et al. Response surface methodology for optimization of ultrasonic-assisted extraction of proanthocyanidins from lotus seed pot[J]. Food Scien ce, 2016, 37(12): 40-45. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612007. http://www.spkx.net.cn
莲房为睡莲科植物莲的成熟花托,在我国主要产自江西、湖南、福建、江苏、浙江等省,呈倒圆锥状或漏斗状,直径5.0~8.0 cm,高4.5~6.0 cm,鲜品为石绿色,干品表面灰棕色至紫棕色,质地疏松,破碎面呈海绵样[1]。据李时珍在《百草纲目》中记载,莲房有消瘀散血之效。莲在加工时,大量莲房作为垃圾而丢弃,这不仅造成资源浪费,还会污染环境。
原花青素是一种分子结构特殊的生物类黄酮,由不同数量的儿茶素或表儿茶素缩合而成,在抗氧化方面有着无可比拟的优势,是目前发现的效果最好的自由基清除剂之一[2]。莲房原花青素不仅具有很高的体内活性和抗衰老作用[3],还有保护皮肤[4]、抗肝癌[5]、抗黑色素瘤[6]、预防口腔癌[7]、改善记忆[8-9]、保护心脑血管、增强免疫[10]、抑制糖化终产物的形成[11]等功能。同时还能提高机体抗辐射的能力[12],其机制可能与其抗氧化活性、增强细胞免疫功能、促进骨髓造血功能有关[13]。
目前,国内外开始对莲房原花青素进行研究,提取方法主要有双酶辅助法[14-15]、脉冲超声辅助丙酮提取法[16]、微波辅助丙酮提取法[17]、乙醇浸提法[18]等,但超声波辅助乙醇提取法鲜有报道。超声波辅助提取具有时间短、操作简单、原花青素得率高等优点。贾宝珠等[19]以香蕉皮为原料,分别采用溶剂提取法和超声波辅助提取法对原花色素的提取工艺进行研究,研究表明超声波辅助提取法的最佳提取时间仅为溶剂提取法的40%,得率和纯度却分别为溶剂提取法的1.5 倍和1.6 倍。本研究拟以乙醇为提取剂,采用超声波辅助提取法提取莲房原花青素,通过工艺参数的优化,以期为莲房原花青素的进一步研究开发及产业化生产提供科学依据。
1.1 材料与试剂
莲房 南昌市江大南路天虹商场;儿茶素标准品上海阿拉丁生化科技股份有限公司;无水甲醇、无水乙醇、浓硫酸、香草醛均为国产分析纯。
1.2 仪器与设备
722G可见分光光度计 上海精密科学仪器有限公司;GA92-ⅡD超声波粉碎机 无锡市上佳生物技术有限公司;TDL-5-A飞鸽牌台式离心机、FW80高速万能粉碎机 上海安亭科学仪器厂;DGG-9140A电热鼓风干燥箱 上海森信实验仪器有限公司;AR323CN电子天平 奥豪斯仪器有限公司。
1.3 方法
1.3.1 莲房粉的制备
将莲蓬中的莲子全部剥除,用蒸馏水快速冲洗莲房部分,然后撕成茎部相连的条状,在60 ℃条件下烘干(48 h以上)至质量恒定,粉碎,过40 目筛,备用。
1.3.2 莲房原花青素的制备
准确称取莲房粉末0.250 g,置于50 mL离心管中,并按一定液料比加入一定体积分数的乙醇溶液,摇匀。然后在室温条件下,用一定功率的超声波分别处理一定时间,取出后溶液立刻离心5 min(4 200 r/min),取上清液。残渣中再加入10 mL蒸馏水,充分摇匀,4 200 r/min离心5 min。上清液合并后置于25 mL容量瓶中,用蒸馏水定容至刻度线。
1.3.3 儿茶素标准曲线的绘制
用儿茶素标准品配制0.5 mg/mL的儿茶素溶液,分别稀释得到0.4、0.3、0.2、0.1 mg/mL儿茶素标准溶液。按表1分别配制标准组、标准空白组和蒸馏水空白组[20]。将配制好的溶液摇匀,在室温条件下密封避光反应20 min,取出充分摇匀后在500 nm波长条件下用1 cm的比色皿测吸光度。标准曲线方程为:y=2.404 0x-0.019 8,R2=0.998 3。
表1 样品组、样品空白组和蒸馏水空白组的配制
Table 1 Preparation of sample group, sample blank group and distilled water blank group

1.3.4 原花青素含量的测定
取少量已制备好的莲房原花青素溶液,将其稀释2 倍,并按表1分别进行样品组、样品空白组和蒸馏水空白组的配制。将配制好的溶液摇匀,在室温条件下密封避光反应20 min,取出充分摇匀后,在500 nm波长条件下用1 cm的比色皿测定其吸光度,计算出溶液中莲房原花青素的质量浓度(mg/mL),由此作为计算莲房原花青素得率的指标。每组做3 个平行样,每次实验做3 个蒸馏水空白。莲房原花青素得率按下式计算[20]:
式中:V为提取液体积/mL;ρ为待测溶液中莲房原花青素的质量浓度/(mg/mL);n为提取液 的稀释倍数;w为莲房粉的质量/g。
1.3.5 单因素试验
各因素固定值分别为提取剂乙醇体积分数40%、液料比60∶1(mL/g)、超声波功率600 W、超声时间20.0 min,保持其他3 个因素不变,每次改变1 个因素,测定莲房原花青素提取得率。
1.3.6 响应面试验设计
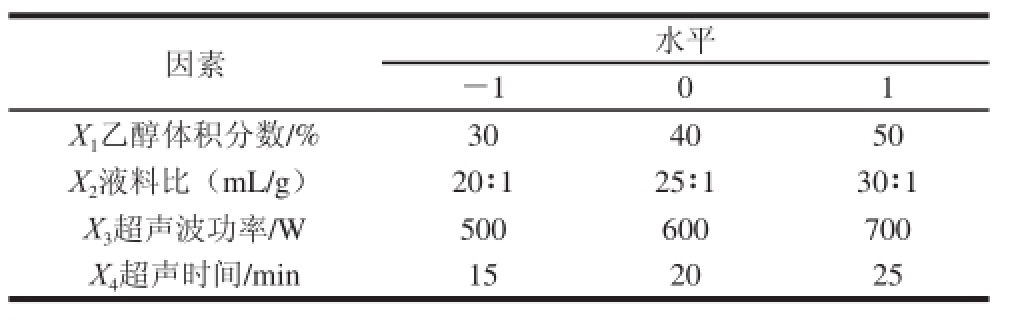
根据Box-Behnken试验设计原理,以单因素试验为基础,选取乙醇体积分数、液料比、超声波功率、超声时间4 个因素,采用四因素三水平的响应面分析方法,因素与水平设计见表2。
表2 响应面试验因素与水平设计
Table 2 Coded levels for the factors used in response surface analysis
1.4 统计分析
单因素试验每次做3个平行样,采用SPSS 19.0软件处理数据、显著性分析、制作图表,结果用 ±s表示;响应面结果用Design-Expert 8.05b软件进行参数优化及方差分析。
±s表示;响应面结果用Design-Expert 8.05b软件进行参数优化及方差分析。
2.1 单因素试验结果
2.1.1 超声时间对莲房原花青素得率的影响
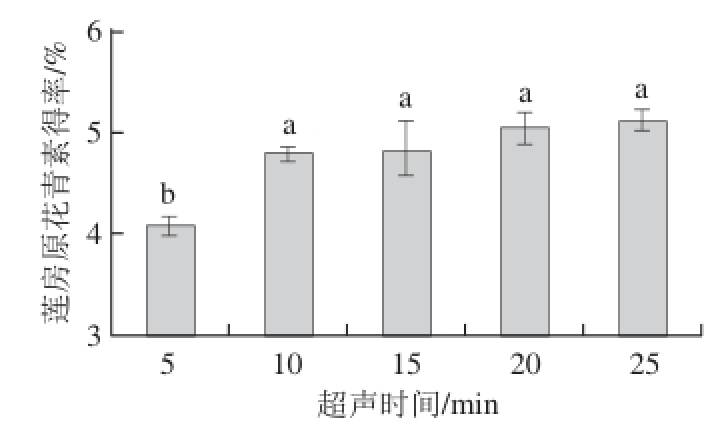
图1 超声时间对莲房原花青素得率的影响
Fig. 1 Effect of ultrasonic treatment time on the extraction yield of LSP
字母不同表示差异显著(P<0.05)。下同。
由图1可知,随着超声时间的延长,原花青素得率逐渐增大,且超声波处理5 min与处理10 min,原花青素得率差异显著(P<0.05),处理10 min后,原花青素得率虽有增加,但差异不显著(P>0.05)。20 min后趋于平缓,这是因为20 min时莲房粉中原花青素可能已被基本提取,所以延长提取时间,原花青素得率只有微小的变化。故适宜的超声时间应该为20 min。
2.1.2 超声波功率对莲房原花青素得率的影响

图2 超声波功率对莲房原花青素得率的影响
Fig. 2 Effect of ultrasonic power on the extraction yield of LSP
由图2可知,超声波功率为300~600 W时,原花青素得率逐渐增大,并在600 W时达到最大,与300 W和400 W相比差异显著(P<0.05)。功率大于600 W时得率下降,这可能是由于超声波功率较大时,有少量脂类或脂溶性蛋白从细胞中溶出,并与原花青素反应,而降低原花青素得率;此外,功率过大时,超声波热效应导致提取液温度升高,原花青素有效成分被破坏,导致得率降低[21]。故选择超声波功率为600 W。
2.1.3 乙醇体积分数对莲房原花青素得率的影响
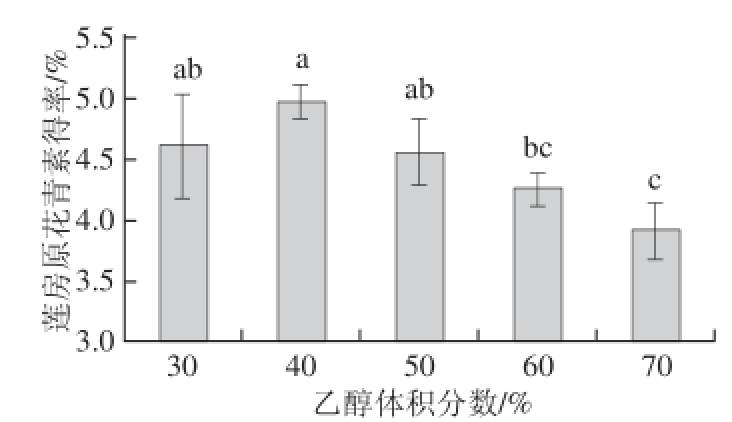
图3 乙醇体积分数对莲房原花青素得率的影响
Fig. 3 Effect of ethanol concentration on the extraction yield of LSP
由图3可知,随着乙醇体积分数的增大,原花青素得率先增大后减小,在体积分数40%时达到最大值,与60% 和70%的乙醇体积分数相比差异显著(P<0.05)。其原因可能为水相比例较大时,溶出的水溶性杂质增多,原花青素相对减少;随着乙醇体积分数的增大,脂溶性杂质的成分溶出量增加,可与乙醇-水分子结合,为原花青素的竞争性抑制剂,导致原花青素得率降低[22],故选择乙醇体积分数为40%。
2.1.4 液料比对莲房原花青素得率的影响
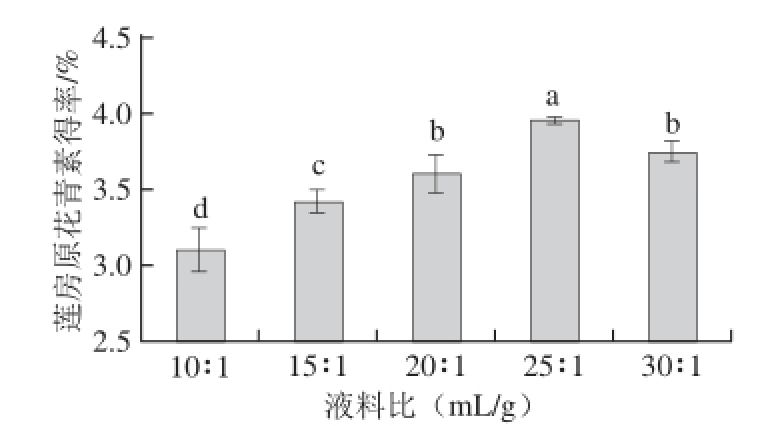
图4 液料比对莲房原花青素得率的影响
Fig. 4 Effect of liquid/solid ratio on the extraction yield of LSP
由图4可知,随着液料比的增大,原花青素得率逐渐升高,在25∶1(mL/g)时达到最大,再提高液料比时得率反而呈下降趋势,液料比改变,原花青素得率的差异显著(P<0.05)。提高液料比不但会增大不必要的溶剂成本,还会给后续浓缩提纯带来不便[23-24],因此,选择液料比为25∶1(mL/g)。
2.2 响应面试验结果
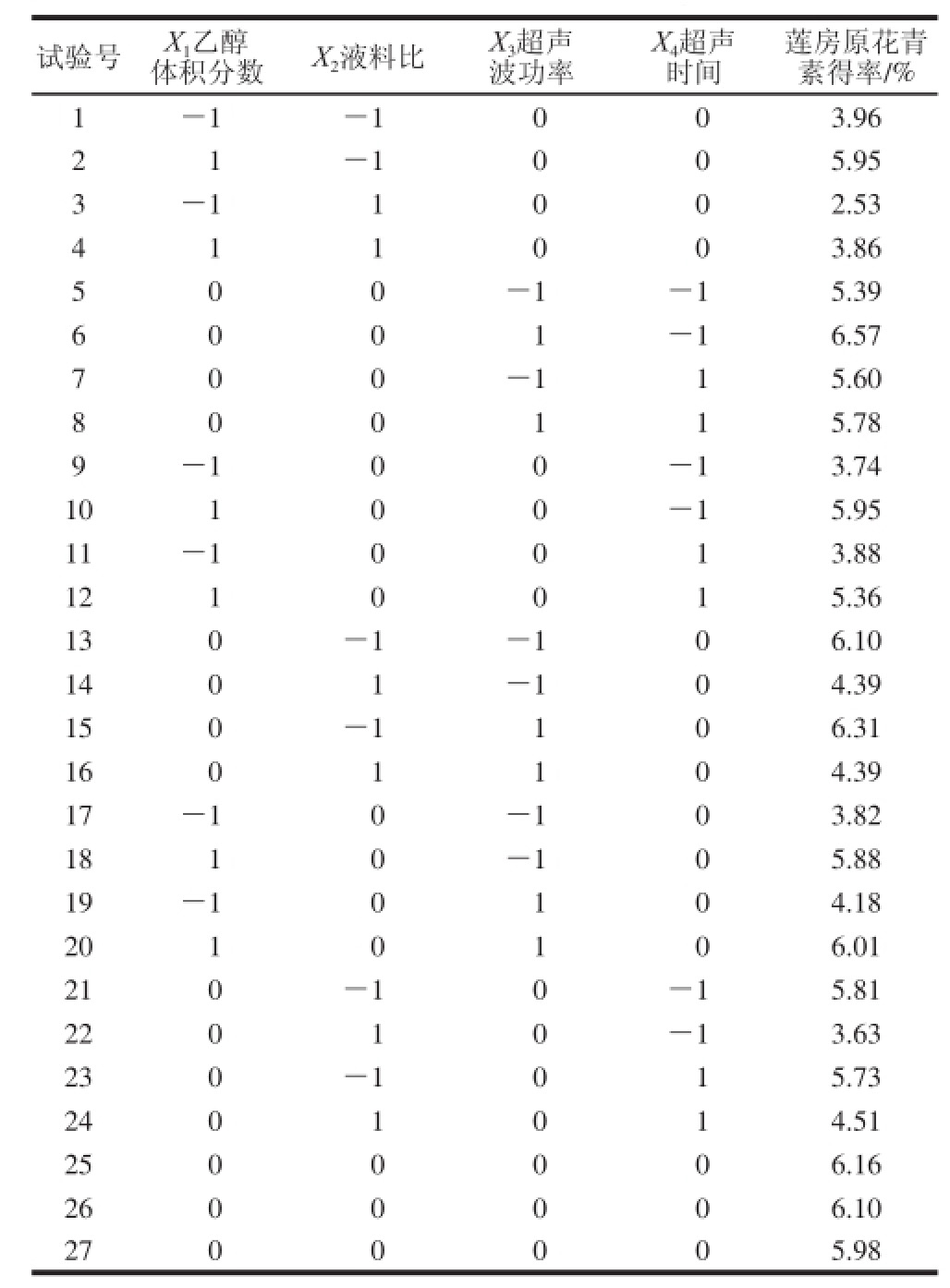
2.2.1 响应面试验设计方案及结果
以单因素试验为基础,根据Design-Expert 8.05b软件的Box-Behnken设计响应面试验方案,共有27 个试验点,其中1~24号为析因点,其变量取值在各因素构成的三维顶点;25~27号为零点,是区域的中心点,用来估计试验误差。莲房原花青素得率为响应值,响应面试验设计方案及结果见表3。
表3 超声波提取莲房原花青素响应面试验设计及结果
Table 3 The experimental design and results for response surface analysis
2.2.2 回归方程拟合和方差分析
将表3中的试验数据进行多元回归拟合,建立回归模型,得到莲房原花青素得率与乙醇体积分数、液料比、超声波功率、超声时间四因素变量的二次多元回归方程为:

由表4可知,该回归方程模型的P<0.000 1,模型极显著,而失拟项不显著(P=0.152>0.05);各因素对莲房原花青素得率的影响大小顺序为:乙醇体积分数>液料比>超声波功率>超声时间。决定系数R2值为0.982 2,预测决定系数R2值为0.899 3,考察值与模拟预测值具有紧密联系,表明该方程具有较好的模拟性,可用于优化试验设计与结果分析,以确定莲房原花青素超声波提取的最优工艺条件。一次项X1、X2均达到了极显著的水平(P<0.01),X3达到了显著水平(P<0.05),而X4不显著(P>0.05),说明乙醇体积分数和液料比对莲房原花青素得率影响较大,超声波功率次之,故要得良好的响应值,必须严格控制乙醇体积分数和液料比;而超声时间对得率影响相对不显著。
表4 回归模型方差分析
Table 4 Analysis of variance of regression model
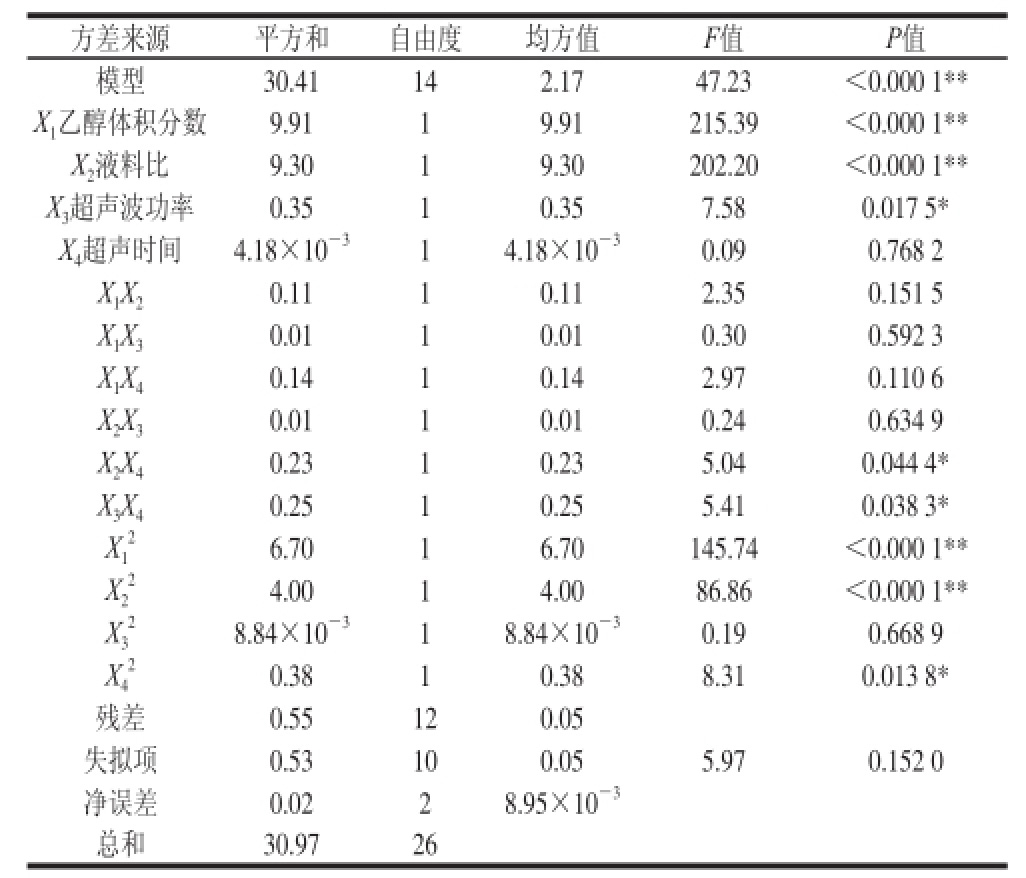
注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。
除X2X4、X3X4因素之间的交互作用显著外,其余因素之间的交互因素并不显著,其P值远大于0.05,表明交互作用对得率的影响较小。方差分析结果还显示,除因素X32外,其余各因素的二次项对响应目标值均有显著影响。
2.2.3 响应面分析

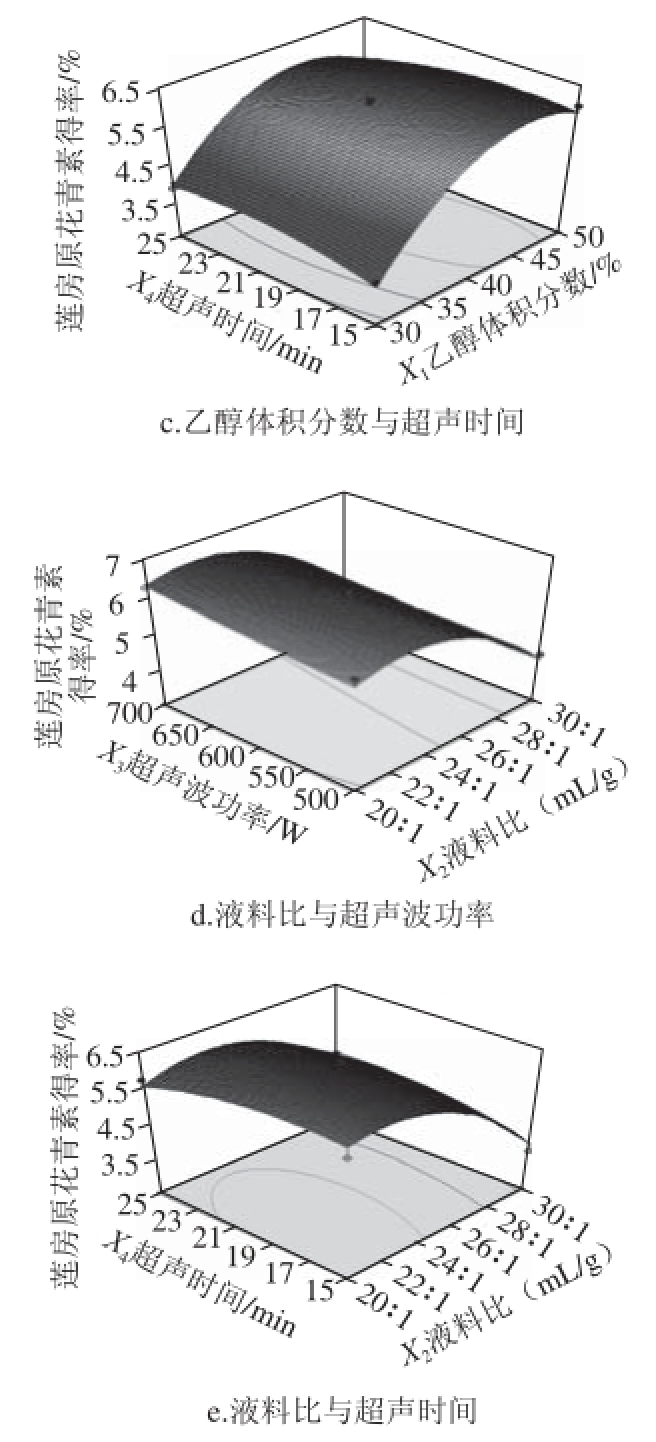
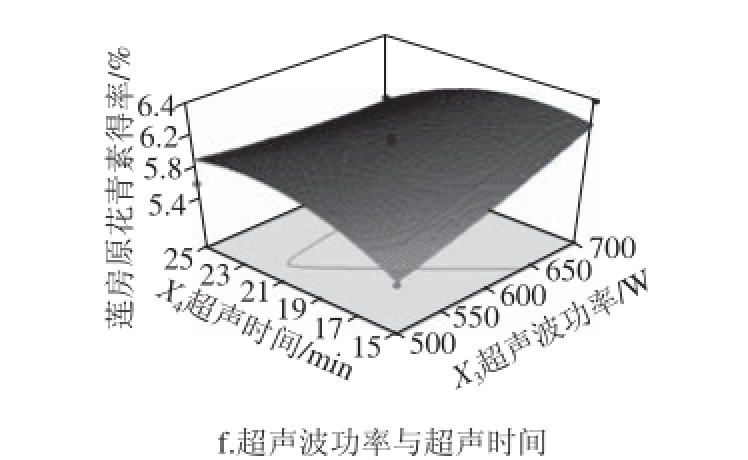
图5 各因素交互作用对莲房原花青素提取得率的影响
Fig. 5 Interactive effects of various factors on the extraction yield of LSP
由图5可知,开始时莲房原花青素得率随乙醇体积分数、液料比和超声时间水平的增大而增大,达到各因素中心值以后,得率随各因素增大而逐渐减小;得率与超声波功率呈正相关。对比各图可知,乙醇体积分数对莲房原花青素得率影响最大,表现为图5a、b、c的曲面较陡,由此可见,控制好乙醇体积分数对取得良好的提取效果至关重要;其次是液料比,再次是超声波功率。而超声时间表现为响应面相对较为平缓,说明此因素对得率影响较小。由图5还可知,除超声时间和液料比与超声时间与超声波功率的交互因素较强外,其余各因素间的交互作用不强,表现为图5e和图5f的等高线为椭圆形,其余各图的等高线椭圆形状不明显,这与回归方程的方差分析结果相一致,说明响应面优化设计可以较好地反映出乙醇体积分数、液料比、超声波功率和超声时间4个因素对莲房原花青素得率的影响。
通过Design-Expert 8.05b软件分析计算可得到最佳提取工艺条件:乙醇体积分数45.15%、液料比21.37∶1(mL/g)、超声波功率700.00 W、超声时间15.00 min,在此条件下,回归模型预测的原花青素得率的理论值可达6.98%。汪志慧等[14]采用双酶法提取莲房原花青素,在最佳工艺参数下得率为5.20%,而乙醇浸提法的得率为3.84%,都远远低于本实验超声波辅助提取法的得率,这可能是由于超声波的空化作用能增强乙醇溶液对莲房组织的渗透作用,破坏莲房的细胞壁,促使原花青素的释放,因此可在在短时低温条件下将原花青素从莲房中提取出来[24]。
2.2.4 工艺条件的优化和验证
为了检验试验结果的真实性,结合实际实验条件需要,将最佳提取工艺参数优化为:乙醇体积分数45%、液料比21∶1(mL/g)、超声波功率700 W、超声时间15 min。在此条件下,进行3次平行验证实验,测得莲房原花青素的平均得率为6.81%,与理论预测值6.98%的相对标准偏差仅为2.44%,说明采用响应面法得到的优化工艺可行性强,优化结果可靠。对比传统的乙醇浸提法,在乙醇体积分数50%、液料比25∶1(mL/g)、提取温度55 ℃和提取时间60 min条件下莲房原花青素得率为6.68%[18],进一步表明超声波辅助提取莲房原花青素,具有提取温度低、所需时间短和得率高等优势。
本研究优化了超声波辅助提取莲房原花青素的工艺参数,其中各因素对得率的影响大小顺序为:乙醇体积分数>液料比>超声波功率>超声时间。优化后的最佳工艺条件为乙醇体积分数45%、液料比21∶1(mL/g)、超声波功率700 W、超声时间15 min,在此条件下,莲房原花青素得率达到最大值(6.81%),与理论预测值基本一致。本研究可为莲房原花青素的超声波工业提取利用,以及作为天然抗氧化剂的合理开发提供科学数据。至于莲房原花青素的具体成分及抗氧化活性成分组成,有待进一步研究。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 401-1247.
[2] 高军涛, TANG Huiru, 侯京武, 等. 葡萄籽中多酚类物质对氧自由基清除作用的ESR研究[J]. 波谱学杂志, 1999, 16(5): 409-415. DOI:10.3969/j.issn.1000-4556.1999.05.006.
[3] XU Jiqu, RONG Shuang, XIE Bijun, et al. Procyanidins extracted from the lotus seedpod ameliorate age-related antioxidant deficit in aged rats[J]. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2010, 65A(3): 236-241. DOI:10.1093/ gerona/glp211.
[4] 张瑞, 段玉清, 武妍, 等. 莲房原花青素对极低频电磁场致星形胶质细胞氧化损伤的预防作用[J]. 食品工业科技, 2013, 34(5): 49-53.
[5] 梁慧敏, 时小燕, 随裕敏, 等. 莲房花青素诱导人肝癌细胞SMMC-7721凋亡的研究[J]. 中国实用药学, 2011, 6(19): 37-38. DOI:10.3969/j.issn.1673-7555.2011.19.020.
[6] DUAN Yuqing, ZHANG Haihui, XU Feifei, et al. Inhibition effect of procyanidins from lotus seedpod on mouse B16 melanoma in vivo and in vitro[J]. Food Chemistry, 2010, 122: 84-91. DOI:10.1016/ j.foodchem.2010.02.020.
[7] XU Jiqu, RONG Shuang, XIE Bijun, et al. Memory impairment in cognitively impaired aged rats associated with decreased hippocampal CREB phosphorylation: reversal by procyanidins extracted from the lotus seedpod[J]. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2010, 65A(9): 933-940. DOI:10.1093/ gerona/glq094.
[8] XU Jiqu, RONG Shuang, XIE Bijun, et al. Changes in the nitric oxide system contribute to effect of procyanidins extracted from the lotus seedpod ameliorating memory impairment in cognitively impaired aged rats[J]. Rejuvenation Research, 2011, 14(1): 33-43. DOI:10.1089/ rej.2010.1076.
[9] XU Jiqu, RONG Shuang, XIE Bijun, et al. Rejuvenation of antioxidant and cholinergic system contributes to the effect of procyanidins extracted from the lotus seedpod ameliorating memory impai rment in cognitively impaired aged rats[J]. Eur Neuropsychopharmacology, 2009, 19(12): 851-860. DOI:10.1016/j.euroneuro.2009.07.006.
[10] 段玉清, 张海晖, 邓乾春, 等. 莲房原花青素对免疫功能的影响[J]. 食品研究与开发, 2007, 28(12): 1-4. DOI:10.3969/ j.issn.1005-6521.2007.12.001.
[11] WU Qian, LI Shuyi, YANG Tang, et al. Inhibitory effect of lotus seedpod oligomeric procyanidins on advanced glycation end product formation in a lactose-lysine model system[J]. Electronic Journal of Biotechnology, 2015, 18(2): 68-76. DOI:10.1016/j.ejbt.2014.10.005.
[12] DUAN Yuqing, ZHANG Haihui, XIE Bijun, et al. Whole body radioprotective activity of an acetone-water extract from the seedpod of Nelumbo nucifera Gaertn. seedpod[J]. Food and Chemical Toxicology, 2010, 48: 3374-3384. DOI:10.1016/j.fct.2010.09.008.
[13] 段玉清. 莲房原花青素对皮肤的保护作用及其分子机制研究[D]. 武汉: 华中农业大学, 2004.
[14] 汪志慧, 孙智达, 谢笔钧, 等. 响应曲面法优化双酶法提取莲房原花青素[J]. 食品科学, 2011, 32(4): 64-68.
[15] 禹华娟, 孙智达, 谢笔钧, 等. 酶辅助提取莲房原花青素工艺及其抗氧化活性研究[J]. 天然产物研究与开发, 2010, 22(1): 154-158. DOI:10.3969/j.issn.1001-6880.2010.01.036.
[16] 段玉清, 张海晖, 李金凤, 等. 脉冲超声辅助提取莲房多酚的工艺[J].农业工程学报, 2009, 25(1): 193-197.
[17] 段玉清, 闫永胜, 张海晖, 等. 莲房多酚的微波辅助提取技术[J]. 江苏大学学报, 2009, 30(9): 437-440.
[18] 陈卫航, 谭美亭, 张婕. 响应面法优化莲房原花青素提取工艺研究[J]. 郑州大学学报, 2012, 30(2): 31-35. DOI:10.3969/ j.issn.1671-6833.2012.02.008.
[19] 贾宝珠, 鲍金勇, 郑晓仪, 等. 香蕉皮原花色素提取工艺的研究[J].食品工业科技, 2014, 35(6): 251-255.
[20] 郑俊霞, 肖付才, 李华. 香草醛-HPLC结合法测定葡萄籽超微粉中的原花青素[J]. 食品科技, 2009, 34(11): 304-308.
[21] 刘新, 陈卫中, 韩琴. 响应面优化超声波辅助提取芒果核中原花青素的研究[J]. 食品工业科技, 2012, 33(3): 227-231.
[22] 郑迎春, 曹玉芬, 李静, 等. 梨叶多酚提取的正交试验优化及其成分测定[J]. 食品科学, 2015, 36(20): 32-36. DOI:10.7506/spkx1002-6630-201520006.
[23] 陈健, 孙爱东, 高雪娟, 等. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学, 2011, 32(4): 82-86.
[24] XU Jialin, WANG Wenchao, LIANG Hui, et al. Optimization of ionic liquid based ultrasonic assisted extraction of antioxidant compounds from Curcuma longa L. using response surface methodology[J]. Industrial Crops and Products, 2015, 76(15): 487-493. DOI:10.1016/ j.indcrop.2015.07.025
[25] 汪振洋. 超声波辅助提取葡萄籽中原花青素[D]. 哈尔滨: 东北林业大学, 2002.
Response Surface Methodology for Optimization of Ultrasonic-Assisted Extraction of Proanthocyanidins from Lotus Seed Pot
LI Jiaqiao, YU Xiuliang, ZENG Linhui, DENG Zeyuan, LI Hongyan*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract: One-factor-at-a-time method (OFAT) and response surface methodology (RSM) were adopted to study the effects of ethanol concentration, liquid/solid ratio, ultrasonic power and ultrasonic treatment time on the extraction yield of proanthocyanidin from lotus seed pot (LSP). A multiple regression model was established to optimize the parameters for ultrasonic-assisted extraction of LSP. The results indicated that ethanol concentration had the most significant impact on the extraction yield of LSP, followed by liquid/solid ratio and ultrasonic power, while the impact of ultrasonic treatment time was relatively low. When the extraction was carried out using 45% ethanol as the extractant at a liquid/solid ratio of 21:1 (mL/g) with ultrasonic treatment for 15 min at 700 W, the maximum yield of LSP of 6.81% was obtained, which was close to the model-predictive value. Our results indicated that the developed model had good regression performance and fitness, and could be applied in the prediction of the extraction yield of LSP. This study could provide scientific data for the application of LSP as a natural antioxidant.
Key words: lotus seed pot; proanthocyanidins; extraction process; ultrasonic; response surface methodology
收稿日期:2015-10-31
基金项目:江西省自然青年科学基金项目(20142BAB214003)
作者简介:李佳桥(1995—),女,本科生,研究方向为食品营养与功能。E-mail:ljqncu@163.com
*通信作者:李红艳(1986—),女,副教授,博士,研究方向为抗氧化、食品营养、食品化学。E-mail:lihongyan@ncu.edu.cn
DOI:10.7506/spkx1002-6630-201612007 10.7506/spkx1002-6630-201612007. http://www.spkx.net.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)12-0040-06