张慧瑛1,罗光宏2,*,郝军元1,杨生辉2,崔 伟1,张 杰1
(1.河西学院农业与生物技术学院,甘肃 张掖 734000;2.河西学院凯源生物技术开发中心,甘肃 张掖 734000)
摘 要:为了获得较高的锁阳多糖得率,以河西锁阳为原料,采用超声波协同生物酶技术进行锁阳多糖提取工艺及活性的研究,选用单因素试验探索料液比、超声时间、超声功率及纤维素酶加酶量、酶解时间、酶解温度、pH值对锁阳多糖得率的影响,在单因素试验的基础上,采用正交试验对工艺条件进行优化,并采用四甲基噻唑蓝(methlthiazoletrazolium,MTT)法评价锁阳多糖对HeLa细胞的抗肿瘤活性。结果表明,锁阳多糖超声波-纤维素酶法提取最佳工艺为:料液比1∶10(g/mL)、超声功率300 W、酶解温度60 ℃、超声时间10 min、加酶量1.8%、酶解时间90 min、pH 5.5。最优条件下锁阳多糖得率达3.01%。MTT实验结果表明,提取多糖对HeLa细胞具有明显的抗肿瘤活性。
关键词:锁阳;多糖;提取;超声波-纤维素酶;生物活性
引文格式:
张慧瑛, 罗光宏, 郝军元, 等. 超声波-生物酶法提取锁阳多糖工艺优化及其抗肿瘤活性[J]. 食品科学, 2016, 37(12): 59-64. DOI:10.7506/spkx1002-6630-201612010. http://www.spkx.net.cn
ZHANG Huiying, LUO Guanghong, HAO Junyuan, et al. Optimization of ultrasonic-assisted enzymatic extraction of polysaccharides from Cynomorium songaricum and their antitumor activity[J]. Food Science, 2016, 37(12): 59-64. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612010. http://www.spkx.net.cn
锁阳(Cynomorium songaricum)为锁阳科锁阳属多年生肉质寄生草本植物[1]。作为中蒙药中的常用药[1-2],古代中医用锁阳的干燥茎治疗阳痿精虚,阴衰血竭,老年气弱阴虚等症[3-5]。近年研究[3-6]表明,锁阳富含多种化学成分及药用成分,包括黄酮类、甾体类、三萜类、氨基酸、熊果酸、没食子酸、儿茶素、胡萝卜苷、鞣质、多糖和无机离子等。其中锁阳多糖具有抗肿瘤、降低血糖、抗辐射、调节血脂以及促进细胞再生和新陈代谢、增强免 疫调节能力的功效[6-7];传统方法中将其用于酿酒和制作饲料[7],造成严重的资源浪费,锁阳多糖提取工艺条件的建立及有效利用是急需解决的问题。
目前,锁阳多糖的提取方法主要有大孔树脂吸附法、超声辅助提取法、微波辅助提取法和超临界提取法等[8-9]。超声破碎是利用超声波振动传递能量,改变物质组织结构、状态、功能或加速这些改变过程,从而提高多糖得率,缩短提取时间,降低提取液黏度。生物酶技术是一种新型高效绿色提取技术,具有快速、高效、反应温和、专一性强等诸多优点[10],其中纤维素酶能特异性降解纤维素[11]。超声破碎和纤维素酶酶解相结合可高效破坏细胞壁,使细胞内多糖最大限度地溶出。因此,本研究选用河西锁阳为原料,利用生物酶技术对锁阳多糖的提取活性进行了研究,旨在为锁阳资源的合理利用及其多糖提取物在抗肿瘤方面的开发和应用提供参考。
1.1 材料与试剂
锁阳 甘肃省微藻工程技术研究中心。
HeLa细胞 中国科学院上海细胞库。
葡萄糖、苯酚、浓硫酸、正丁醇、氯仿、95%乙醇溶液、无支原体的胎牛血清、青霉素、链霉素、RPMI Medium 1640、二甲基亚砜(dimethyl sulfoxide,DMSO)、N-2羟乙基哌嗪N-2-乙烷磺酸(E.M.K进口分装)、四甲基噻唑蓝(methlthiazoletrazolium,MTT)均为分析纯。
1.2 仪器与设备
722型紫外分光光度计 上海光谱仪器有限公司;800型离心机 上海手术器械厂;电热恒温水浴锅北京长远设备厂;BDS 300型倒置显微镜 重庆奥特光学仪器有限责任公司;RT-6000型酶标分析仪 美国雷社公司;5510型CO2培养箱 美国Nuaire公司;96孔细胞培养板 康宁生物有限公司;微孔滤膜 天津东康科技有限公司;SB-JS-1型超净工作台 上海医疗设备厂;3110型微量加样器 德国爱本德公司;YXQ-CS-50S11型立式压力蒸汽灭菌器 上海博讯公司;HH.GF-1型电热鼓风干燥箱 长沙医疗器械厂;AP-9925型无油真空泵天津奥特公司;AL104型电子分析天平 梅特勒-托利多仪器公司;血球计数板 上海医科大学;D7411型超纯水系统 美国BT公司。
1.3 方法
1.3.1 锁阳粗多糖提取工艺流程[12-13]
锁阳研碎→称取锁阳粉末10 g→加去离子水→纤维素酶处理→55 ℃条件下超声提取→离心取上清液→脱蛋白(Sevag法)3 次→离心取上清液→95%乙醇溶液沉淀→4 ℃静置12 h→离心收集沉淀→干燥→锁阳粗多糖
1.3.2 多糖含量测定及得率计算
采用苯酚-硫酸比色法[14]测定多糖含量。精确称取20 mg自制锁阳粗多糖,用少量50 ℃水完全溶解后,用蒸馏水定容至100 mL。吸0.5 mL多糖溶液加1.5 mL的蒸馏水,再加入5%苯酚溶液1.0 mL及浓硫酸5.0 mL;室温静置20 min后于波长490 nm处测吸光度。将所测吸光度代入回归方程,得多糖相当于葡萄糖含量[15]。多糖得率计算如式(1)所示:
式中:m为多糖液从回归方程求得的多糖相当于葡萄糖的含量/mg;D为稀释倍数;F为锁阳多糖相对葡萄糖的换算因子,2.478;M0为锁阳干粉质量/mg。
1.3.3 超声破碎单因素试验
按提取流程,固定纤维素酶处理工艺(加酶量2.0%、酶解温度45 ℃、酶解时间90 min、酶作用pH 6.0),分别考察超声功率(100、200、300、400、500 W)、超声时间(5、10、15、20、25 min)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25,g/mL)对锁阳多糖得率的影响。
1.3.4 纤维素酶酶解单因素试验
按提取流程,固定超声破碎条件,考察纤维素酶用量(1.0%、1.5%、2.0%、2.5%、3.0%)、酶解温度(25、35、45、55、65 ℃)、酶解时间(30、60、90、120、150 min)、酶解pH值(5.0、5.5、6.0、6.5、7.0)对锁阳多糖得率的影响。
1.3.5 锁阳多糖提取工艺正交试验优化
根据单因素试验结果确定锁阳多糖提取的正交试验因素和水平,采用L9(34)正交试验设计,优化多糖提取工艺,重复3 次。以多糖得率为指标,对正交试验结果进行验证及方差分析,P<0.05表示影响显著。因素与水平设计如表1所示。
表1 超声波-纤维素酶法正交试验因素和水平
Table 1 Factors and levels used in the orthogonal array design for the optimization of extraction parameters

1.3.6 锁阳多糖的制备
准确称取各种方法提取干燥的锁阳粗多糖提取物粉末,加无血清RPMI 1640培养基溶解至质量浓度为800 μg/mL,膜过滤除菌,作为高质量浓度多糖母液[13]放于4 ℃保存备用。
1.3.7 HeLa细胞的培养
从液氮中取出冻存的HeLa细胞,迅速放入40 ℃水浴中解冻并不断轻轻摇动,使冻存管中的冻存物在1 min之内融化。取出冻存管,1 000 r/min离心5 min,弃上清液,无血清RPMI 1640培养基清洗一次,1 mL RPMI 1640完全培养基将细胞重悬,吸到细胞培养瓶中,再加入4 mL RPMI 1640完全培养基,37 ℃、5% CO2条件下培养。细胞丰度达90%时进行传代,待细胞生长状态良好时进行药物实验。
1.3.8 MTT法评价锁阳多糖对HeLa细胞的抗肿瘤活性[16-17]
取对数生长期HeLa细胞,用0.25%胰蛋白酶消化制成细胞悬液,调整细胞数量浓度5×104个/mL接种于96 孔板(平底),每孔100 μL,同时设只加培养基的空白调零孔3 个,37 ℃、5% CO2培养,至细胞单层铺满孔底,加入质量浓度800 μg/mL的锁阳多糖,每个实验组分别接种3个复孔,继续培养72、96、120、144 h。采用MTT法进行细胞抑制率测定。测定过程为:终止实验前4 h每孔加入20 μL MTT溶液,继续培养4~6 h。小心吸弃孔内培养液,每孔加DMSO 100 μL,轻轻振荡10 min,用酶标仪在492 nm波长处测定吸光度,按式(2)计算多糖对HeLa细胞生长的抑制率:
1.3.9 Gimesa染色观察细胞形态
各实验组HeLa细胞分别加入800 μg/mL不同提取方法的锁阳多糖,继续培养72、96、120、144 h后,除细胞培养液,磷酸缓冲盐溶液冲洗,甲醇固定10 min,滴入Gimesa染色液1~2 滴,染色15 min,用自来水冲去玻片上多余的染料,自然干燥,二甲苯透明,光学树脂胶封固。倒置显微镜观察细胞形态,比较各种方法提取的锁阳多糖对HeLa细胞形态的影响。
2.1 超声破碎单因素试验结果
2.1.1 料液比对多糖得率的影响
由图1可知,控制超声作用时超声功率300 W、超声时间15 min,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25时,多糖得率随着溶剂用量的增大而增大,料液比在1∶5~1∶10之间呈现了明显的增大趋势,1∶10之后多糖得率趋于平缓,因溶剂用量达到一定程度时,游离态的多糖已基本全部溶出,再增加溶剂用量,得率变化不大,还会增加后续工作困难。

图1 料液比对多糖得率的影响
Fig. 1 Effect of miterial-to-liquid ratio on polysaccharides yield
2.1.2 超声功率对多糖得率的影响
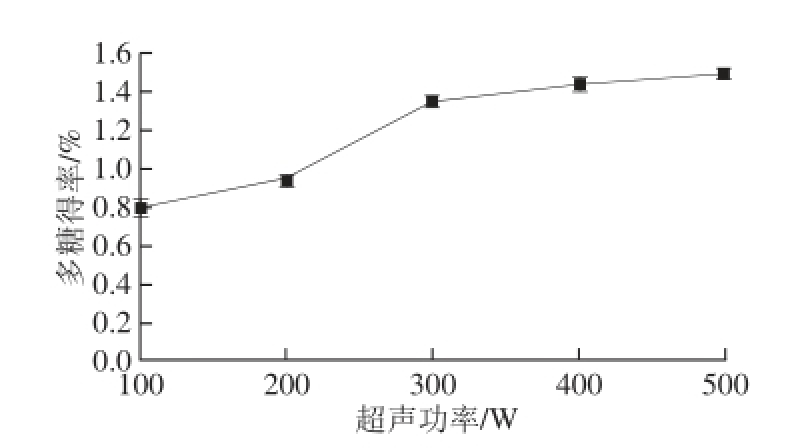
图2 超声功率对多糖得率的影响
Fig. 2 Effect of ultrasonic power on polysaccharides yield
由图2可知,控制超声作用料液比1∶10、超声时间15 min,超声功率为100、200、300、400、500 W时,多糖得率随着超声功率的增大而增大,当超声功率在100~300 W之间时呈现明显的增大趋势,大于300 W多糖得率趋于稳定,分析其原因是由于随着功率的增大,产生大的冲击波、剪切力使细胞破碎,多糖溶出率增加,当超声功率为400 W时,多糖得率曲线上升幅度趋于平缓,考虑到实际情况,功率过大需要的能耗大,同时也会使超声时的温度升高或破坏多糖结构。
2.1.3 超声时间对多糖得率的影响
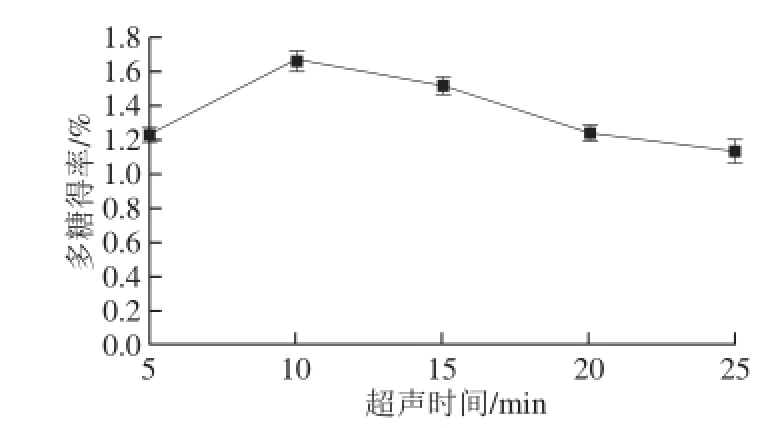
图3 超声时间对多糖得率的影响
Fig. 3 Effect of ultrasonic treatment time on polysaccharides yield
由图3可知,控制超声作用时料液比1∶10、超声功率300 W,超声时间为5、10、15、20、25 min时,随着超声时间的延长,多糖得率先增加后减小,在超声时间为10 min时有最大多糖得率,之后开始下降。这是由于过长时间的超声波剧烈振动会使多糖降解,从而使多糖提取量下降[18]。
2.2 纤维素酶酶解单因素试验结果
2.2.1 加酶量对多糖得率的影响
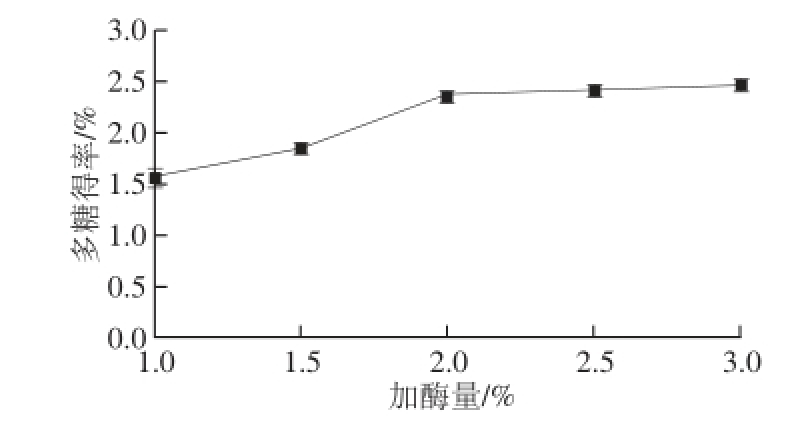
图4 加酶量对多糖得率的影响
Fig. 4 Effect of enzymatic quantities on polysaccharides yield
由图4可知,控制纤维素酶作用pH 6.0、酶解时间90 min、酶解温度45 ℃,加酶量分别为1.0%、1.5%、2.0%、2.5%、3.0%,在加酶量小于2.0%时,多糖得率随加酶量的增大迅速升高,当酶量增大至2.0%后多糖得率基本保持不变。
2.2.2 酶解温度对多糖得率的影响

图5 酶解温度对多糖得率的影响
Fig. 5 Effect of hydrolysis temperature on polysaccharides yield
由图5可知,控制纤维素酶加酶量2.0%、酶解pH 6.0、酶解时间90 min,酶解温度分别为25、35、45、55、65 ℃,当酶解温度从25 ℃升高到55 ℃时,多糖得率随着酶解温度的升高而增大,在55 ℃时达到最大值,在60 ℃时又降低。这是由于酶本身也是一种蛋白质,温度过高时会因变性而失去活性,导致多糖得率降低。
2.2.3 酶解时间对多糖得率的影响
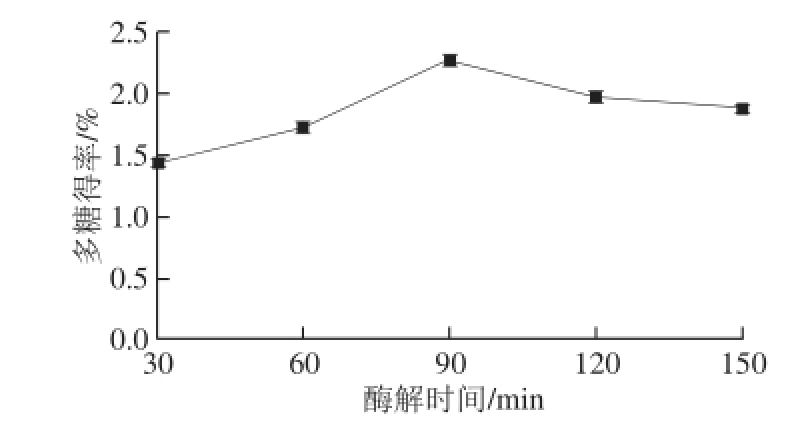
图6 酶解时间对多糖得率的影响
Fig. 6 Effect of hydrolysis time on polysaccharides yield
由图6可知,控制加酶量2.0%、酶解温度55 ℃、酶解pH 6.0,酶解时间分别为30、60、90、120、150 min,当酶解时间在30~90 min范围内时,多糖得率随着酶解时间的延长而增大,在90 min时达到最大值;当酶解时间超过90 min时,多糖得率反而减小,说明延长酶解时间可以使纤维素酶对细胞壁中的纤维素物质充分酶解,但酶解时间过长,酶的催化活性降低,进而对多糖得率影响不大。
2.2.4 酶解pH值对多糖得率的影响

图7 酶解pH值对多糖得率的影响
Fig. 7 Effect of initial pH values on polysaccharides yield
由图7可知,控制加酶量2.0%、酶解温度55 ℃、酶解时间90 min,酶解pH值分别为5.0、5.5、6.0、6.5、7.0,pH值在5.0~6.5之间时,多糖得率随着pH值的升高而升高,pH值大于6.5时出现细微的降低,这是由于pH值的变化可以改变酶的空间构象而引起酶活性的降低,酶对pH值比较敏感,而纤维素酶在弱酸条件下酶活较高,自身稳定性好,因此选择纤维素酶最适作用pH 5.5。
2.3 正交试验结果
根据单因素试验结果,以锁阳多糖得率为考察指标,进行了L9(34)正交试验,试验结果见表2。通过直观分析和极差分析得到最优组合,确定锁阳多糖的最优提取工艺条件。
表2 L9(34)正交试验设计及结果
Table 2 L9(34) orthogonal array design with experimental results
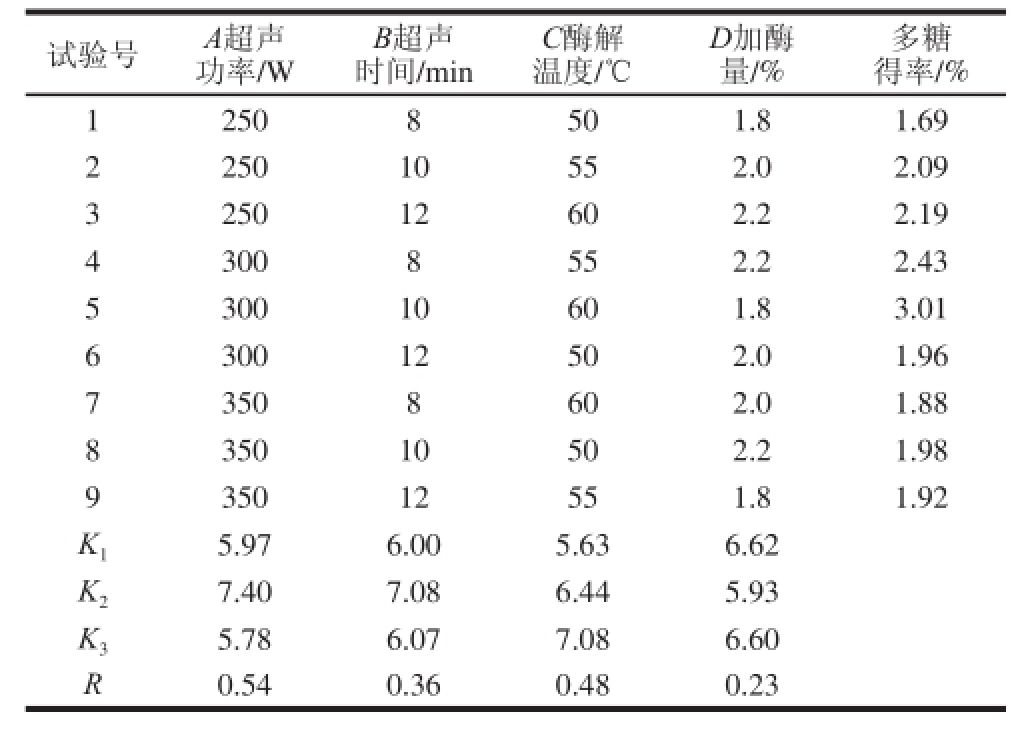
表3 正交试验方差分析
Table 3 Analysis of variance for the orthogonal array design
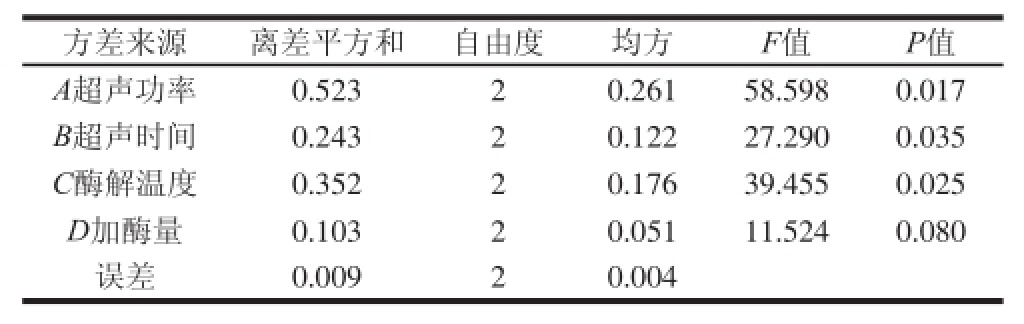
由表2、3可知,各因素对多糖得率的影响依次为,超声功率>酶解温度>超声时间>加酶量,且超声功率、超声时间、酶解温度对多糖得率的影响显著,最优工艺为A2B2C3D1,因此选择超声功率300 W、酶解温度60 ℃、超声时间10 min、加酶量1.8%,该条件下多糖得率为3.01%。
2.4 验证实验结果
为了验证正交试验结果的可靠程度,选择料液比1∶10、超声功率300 W、酶解温度60 ℃、超声时间10 min、加酶量1.8%,酶解时间90 min、酶解pH 5.5进行多糖的提取实验,重复6 次,多糖得率分别为2.96%、2.87%、3.18%、2.89%、3.16%、3.12%,结果可靠,实验重复性较好。
2.5 锁阳多糖提取方法的比较
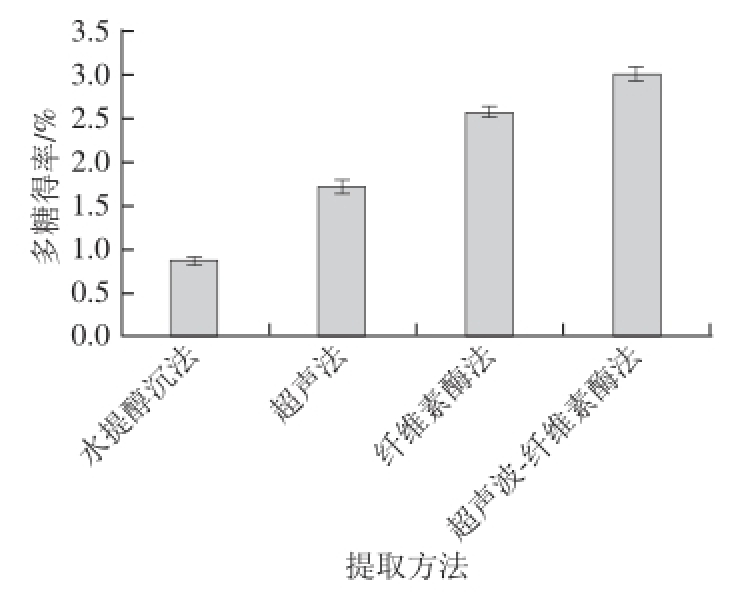
图8 锁阳多糖不同提取方法的提取效果比较
Fig. 8 Comparison of the extraction efficiencies of different extraction methods
由图8可知,传统的水提醇沉法提取锁阳多糖得率为0.87%,超声法提取锁阳多糖得率为1.72%,单一纤维素酶法提取锁阳多糖得率为2.58%,而超声波-纤维素酶法提取锁阳多糖得率为3.01%。结果表明超声波-纤维素酶法可显著提高锁阳多糖得率。
2.6 MTT法评价锁阳多糖抗肿瘤活性
锁阳多糖质量浓度为800 μg/mL,分别作用HeLa细胞72、96、120、144 h,各实验点细胞抑制率如表4所示。
由表4可知,在锁阳多糖质量浓度800 μg/mL、作用时间72 h时,各实验组中超声波-纤维素酶法提取锁阳多糖对HeLa细胞的抑制率最大为50.17%;随着作用时间的延长,各实验组细胞抑制率均升高,当作用时间延长至144 h,只有超声波-纤维素酶法实验组提取锁阳多糖对HeLa细胞的抑制率增加趋势最明显,抑制率为76.59%。结果表明水提醇沉法、超声波法、纤维素酶法和超声波-纤维素酶法提取的锁阳多糖均有肿瘤抑制性,相比之下,超声波-纤维素酶法提取的锁阳多糖的抗肿瘤活性更为明显。
表4 锁阳多糖作用时间与细胞抑制率关系(n=3)
Table 4 Inhibition of tumor growth after different times of exposure to Cynomorium songaricum polysaccharides (n=3)

2.7 细胞形态观察结果

图9 锁阳多糖作用HeLa细胞后倒置显微镜观察结果(×200)
Fig. 9 Effects of Cynomorium songaricum polysaccharides on the ultrastructure of HeLa cells visualized under inverted microscope (× 200)
A.正常HeLa细胞120 h;B.水提醇沉法提取锁阳多糖作用HeLa细胞144 h;C.超声波法提取锁阳多糖作用HeLa细胞144 h;D.正常HeLa细胞144 h;E.纤维素酶法提取锁阳多糖作用HeLa细胞144 h;F.超声波-纤维素酶法提取锁阳多糖作用HeLa细胞144 h。
由图9可以看出,通过Giemsa染色在倒置显微镜下观察,与正常细胞实验组(A、D)相比,各实验组(B、C、E、F)细胞形态均发生明显改变、细胞皱缩变形、细胞外形不规则、胞浆着色加深、细胞核固缩或碎裂、细胞与相邻细胞分离;其中F组细胞回缩变圆,少数为不规则形,细胞核染色质呈粗块状聚集于核膜下,核碎裂。对照组细胞贴壁较紧,呈梭形,充分生长且连接成片,细胞核较规则,核仁明显,核质比正常,核膜完整。由观察结果可说明超声波-纤维素酶法提取锁阳多糖实验组对人宫颈癌HeLa细胞的抑制作用强于单一提取法。
以河西锁阳为原料,前期采用传统的水提醇沉法提取多糖得率为0.87%,作用于HeLa细胞,MTT法评价抗肿瘤活性,结果表明作用时间72~144 h时,细胞抑制率由29.54%增加为37.72%,推测锁阳多糖的对HeLa细胞具有抗肿瘤活性,但作用效果欠佳,分析其原因认为传统的水提醇沉法提取多糖时由于水的极性大,容易把蛋白质、苷类等水溶性的成分浸提出来,从而使提取液存放时腐败变质,不但为后续的分离带来困难,而且该法提取比较耗时,得率也不高[19-20]。因此采用超声波-纤维素酶法提取锁阳多糖,通过单因素试验,以多糖得率作为考察指标,对超声波料液比、超声时间、超声功率及纤维素酶加酶量、酶解温度、酶解时间、pH值等因素分别进行考察,研究各因素对锁阳多糖得率的影响。然后对上述因素进行正交试验,以锁阳多糖得率作为考察指标,确定出超声波-纤维素酶法提取锁阳多糖的最优提取工艺,以优化工艺提取锁阳多糖结果显示,本研究提取锁阳多糖得率较传统提取提高了2.14%。评价锁阳多糖抗肿瘤活性实验过程中发现,与传统水提醇沉法、超声波法和单一纤维素酶法提取所得锁阳多糖相比,超声波-纤维素酶法提取所得锁阳多糖具有明显抗肿瘤活性。超声法具有操作简便、节约溶剂、得率高、对多糖结构破坏小等优点。但是由于超声波具有较强的剪切作用,长时间的作用会使大分子的多糖化学键断裂,从而在后处理的过程中使损失增大而影响多糖得率[20-23]。酶解法作用条件温和,对多糖的破坏较小,操作相对简单且能保证较高的得率。酶解法减少了化学试剂的使用,有利于资源的利用和环境的改善,但酶的价格高,限制了大规模的应用[21-23]。锁阳多糖存在于细胞壁内,由于细胞壁结构紧密,导致锁阳多糖的提取时间过长和提取不完全。超声波-纤维素酶法提取锁阳多糖,先用超声波的高频振荡及其产生的“空化效应”来破坏细胞壁间的维持力,使锁阳细胞壁的结构层发生变化,并除去一部分影响酶接触纤维的妨碍物[22],再用纤维素酶酶解,从而达到提高纤维素酶水解纤维素的水解效率,尽快最大限度地释放细胞壁多糖[24-26]。本研究提取的锁阳多糖不仅得率增加,而且活性提高,为锁阳多糖的提取分离提供了一种新思路。同时也有利于扩大锁阳多糖工业化生产,为充分利用锁阳资源及锁阳多糖在抗肿瘤方面的开发和应用提供数据参考。
参考文献:
[1] 刘晓丹, 林鹏, 钱娇玲, 等. 锁阳多糖超声提取工艺及含量测定研究[J]. 食品工业科技, 2013, 34(19): 239-240. DOI:10.13386/ j.issn1002-0306.2013.19.038.
[2] 王学喜, 张俊, 李新明, 等. 响应面法优化超声提取锁阳多糖工艺研究[J]. 北方园艺, 2011(6): 191-195.
[3] 罗光宏, 王勤, 祖廷勋, 等. 甘肃河西沙区锁阳多糖提取工艺优化及含量测定[J]. 食品科学, 2011, 32(10): 79-80.
[4] 董雪. 锁阳化学成分及质量标准研究[D]. 沈阳: 辽宁中医药大学, 2009.
[5] 李国玉, 王航宇. 锁阳化学成分研究[J]. 中国药师, 2012, 15(7): 911-914.
[6] 杨国伟, 危晴, 刘卉, 等. 超声波辅助提取锁阳多糖的工艺研究[J].食品与机械, 2013, 29(3): 141-143.
[7] YE Chunlin, HU Weilian, DAI Dehui. Extraction of polysaccharides and the antioxidant bioactivity from the seeds of Plantago asiatica L.[J]. International Journal of Biological Macromolecules, 2011, 49(4): 466-470. DOI:10.1016/j.ijbiomac.2011.05.026.
[8] ZHU Caiping, ZHAI Xichuan, LI Linqiang, et al. Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J]. Food Chemistry, 2015, 177(15): 139-146. DOI:10.1016/j.foodchem.2015.01.022.
[9] WU Zhen, LI Hong, YANG Yong, et al. Ultrasonic extraction optimization of L. macranthoides polysaccharides and its physicochemical properties[J]. International Journal of Biological Macromolecules, 2015, 74(6): 224-231. DOI:10.1016/ j.ijbiomac.2014.12.010.
[10] 苏格尔, 常艳旭. 锁阳的化学成分及药理作用研究概况[J]. 中国民族医药杂志, 2005, 11(6): 42-49. DOI:10.16041/j.cnki.cn15-1175.2005.06.040.
[11] 陈红, 崔海月, 李玉扩, 等. 超声波协同酶法提取大豆多糖工艺的研究[J]. 吉林农业大学学报, 2011, 33(5): 581-586. DOI:10.13327/ j.jjlau.2011.05.006.
[12] 魏明, 姚红, 杨超英. 超声波-纤维素酶法提取霍山石斛多糖的研究[J]. 食品工业科技, 2009, 30(3): 199-201. DOI:10.13386/ j.issn1002-0306.2009.03.011.
[13] 张立娟, 于国萍. 黑木耳多糖酶法提取条件的优化及脱蛋白工艺的研究[J]. 食品工业科技, 2005, 26(5): 109-110. DOI:10.13386/ j.issn1002-0306.2005.05.031.
[14] 张颖, 曾艳, 张丽姣, 等. 不同食用菌菌糠多糖的组分分析与抗氧化活性评价[J]. 食品科学, 2015, 36(5): 18-23. DOI:10.7506/spkx1002-6630-201505004.
[15] 陈红, 张艳荣, 王大为, 等. 微波协同酶法提取玉米须多糖工艺的优化研究[J]. 食品科学, 2010, 31(10): 42-46.
[16] 梁曾恩妮, 易有金, 郭雨桐, 等. 灵芝多糖联合对人结肠癌细胞增殖及凋亡的影响[J]. 食品科学, 2012, 33(19): 310-313.
[17] 陈枝岚, 谢守珍. 中草药体外抗白念珠菌作用研究[J]. 医药导报, 2006, 25(8): 765-766.
[18] 张庆增. 复合酶法提取当归多糖及其生物活性研究[D]. 长春: 吉林大学, 2006.
[19] 赵玉红, 赵小旭, 姜晓青. 超声波-双酶法协同提取林蛙皮多糖的工艺优化[J]. 食品工业科技, 2012, 33(11): 230-234. DOI:10.13386/ j.issn1002-0306.2012.11.015.
[20] 黄琼, 丁玲. 微波协同酶法提取金针菇多糖的研究[J]. 食品与机械, 2013, 29(1): 128-130. DOI:10.3969/j.issn.1003-5788.2013.01.031.
[21] 郭雨桐. 灵芝多糖对结肠癌细胞增值的抑制作用[D]. 长沙: 湖南农业大学, 2012.
[22] 罗光宏. 酶处理提取锁阳多糖的方法及锁阳多糖抗肿瘤制剂的制备: 中国, 201310015133[P]. 2013-06-12.
[23] 田杰, 赵烽, 高治廷, 等. 姜黄素与阿霉素联合应用抗肿瘤的协同作用[J]. 烟台大学学报, 2010, 23(4): 297-303.
[24] 张志娟, 乔明霞, 郝言芝, 等. 复合螺旋藻多糖对人肝癌7402细胞的抑制作用[J]. 陕西医学杂志, 2010, 38(3): 279-281.
[25] 张新国, 王强林, 李春雷, 等. 当归多糖的酶法提取新工艺研究[J].中医药学报, 2012, 40(2): 96-100.
[26] 舒任庚, 蒋跃平, 蔡永红, 等. 植物多糖的提取分离方法探讨[J]. 药房中国, 2011, 16(3): 222-226.
Optimization of Ultrasonic-Assisted Enzymatic Extraction of Polysaccharides from Cynomorium songaricum and Their Antitumor Activity
ZHANG Huiying1, LUO Guanghong2,*, HAO Junyuan1, YANG Shenghui2, CUI Wei1, ZHANG Jie1
(1. College of Agriculture and Biotechnology, Hexi University, Zhangye 734000, China; 2. Kaiyuan Biology Technology Development Centre, Hexi Universi ty, Zhangye 734000, China)
Abstract: The ultrasonic-assisted enzymatic extractio n of polysaccharides from the dried fleshy stem of Cynomorium songaricum grown in the Hexi Corridor region, Gansu province was optimized by one-factor-at-a-time and orthogonal array design methods for improved yield of polysa ccharides. The effects of the ratio of material to water, ultrasonic treatment time, ultrasonic po wer, cellulase dosage, hydrolysis temperature, time, and pH on the extraction yield of polysaccharides were investigated. The inhibitory effects of the extracted polysaccharides on the proliferation of human cervical cancer HeLa cells in vitro were studied. The optimal extraction conditions obtained were a s follows: material to water ratio, 1:10 (g/mL); ultrasonic treatment time, 10 min; ultrasonic power, 300 W; enzyme dosage, 1.8%; hydrolysis temperature, 60 ℃; hydrolysis time, 90 min; and initial pH, 5.5. Under these conditions, the maximum yield of polysaccharides of 3.01 % was obtained. MTT assay results showed that the polysaccharide had obvious anti-tumor activity against human cervical cancer HeLa cells.
Key words: Cynomorium songaricum; polysaccharides; extraction; ultrasonic-assisted enzymatic hydrolysis; bioactivity
收稿日期:2015-10-30
基金项目:甘肃省青年科技研究基金项目(1107RJYG012);甘肃省科技支撑计划项目(1304FKCG103)
作者简介:张慧瑛(1975—),女,讲师,硕士,研究方向为细胞工程。E-mail:zhy20001101@126.com
*通信作者:罗光宏(1965—),男,教授,硕士,研究方向为植物保护和微藻加工。E-mail:13993693452@163.com
DOI:10.7506/spkx1002-6630-201612010
中图分类号:R284.2
文献标志码:A
文章编号:1002-6630(2016)12-0059-06