黄亚芳,李罗明,李俊杰,李 珂*
(湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
摘 要:通过响应面法分析和全因子试验设计,探究单一酶和复合酶用于水酶法提取杨梅核仁油的效果,优选确定水酶法提取杨梅核仁油的酶制剂为纤维素酶。采用正交试验对酶法水解提取杨梅核仁油的工艺进行优化,获得其最佳工艺条件为纤维素酶添加量2%、酶解温度50 ℃、pH 4.8、酶解时间2.5 h、料液比1∶4(g/mL),该条件下的得油率为33.95%,提取率为50.67%。采用气相色谱法对杨梅核仁油的脂肪酸组成进行了分析,结果表明:木洞杨梅核仁油富含不饱和脂肪酸,高达87.22%,其中油酸含量达50.31%,亚油酸含量达到36.64%,亚麻酸含量为0.27%。
关键词:响应面法;水酶法;杨梅核仁油;得油率;脂肪酸
引文格式:
黄亚芳, 李罗明, 李俊杰, 等. 水酶法提取杨梅核仁油的工艺优化[J]. 食品科学, 2016, 37(12): 65-70. DOI:10.7506/ spkx1002-6630-201612011. http://www.spkx.net.cn
HUANG Yafang, LI Luoming, LI Junjie, et al. Optimization of enzyme-assisted aqueous extraction for Myrica rubra kernel oil[J]. Food Science, 2016, 37(12): 65-70. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612011. http://www.spkx.net.cn
木洞杨梅是目前湖南省种植面积最大的杨梅品种,主要产自怀化靖州[1]。杨梅核仁是取自杨梅在酿酒及果饮加工后的废弃物,富含不饱和脂肪酸,根据品种不同,杨梅核仁中油脂含量可高达58.12%~70.79%[2-3]。
水酶法[4]是一种新兴的提油方法。它以机械和酶解为手段降解植物细胞壁,使油脂得以释放,可以满足食用油生产中“安全、高效、绿色”的要求[5-6]。与传统浸提工艺相比,其最大优势是在于能安全有效回收植物原料中的蛋白质(或其水解产物)及碳水化合物。酶在植物油脂中的应用研究越来越受关注,国外众多学者对大豆[7-8]、油菜籽[9-10]、油茶[11-12]、花生[13]等油料进行了广泛、深入的研究,认为运用复合酶比使用单一酶更有利于提高出油率。Rosenthal等[14]使用蛋白水解酶和纤维素酶使花生油提取率从无酶的72%提高到78%。Dominguez等[15]进行水酶法从葵花籽中同时提取葵花籽油和葵花籽蛋白工艺的研究,结果表明油的提取率达到了30%,而且得到了颜色浅无抗营养成分的蛋白粉。
目前,也有少部分研究者将此方法应用于杨梅核仁油的提取。Zhang Yinglao等[16]采用纤维素酶和酸性蛋白酶(质量比1∶1)复合添加量3.15%、料液比1∶4.9(g/mL)、酶解温度51.6 ℃、酶解时间4 h,该条件下的东魁杨梅核仁得油率为31.15%,提取率约为49.44%;陈潇逸等[17]结合微波处理,再用纤维素酶和蛋白酶水解,复合酶用量3.5%、酶解时间90 min、酶解温度50 ℃、料液比1∶3 (g/mL),在此条件下得油率约为36%,提取率为53.79%;这两者研究均采用复合酶作为酶制剂,添加量为3%以上,得油率为30%以上,而林弈琪等[18]采用单一酶(酸性蛋白酶)添加量1.0%、料液比1∶6、酶解时间3 h,该条件下得油率为19.0%,相比之下酶用量降低了2%以上,但得油率也降低了10%以上。目前单一酶与复合酶对杨梅核仁油的提取效果鲜见报道,本研究基于此出发点对水酶法提取木洞杨梅核仁油的酶制剂进行了探讨,比较单一酶与复合酶解的效果,并对最适酶提取杨梅核仁油的工艺进行优化,旨在筛选适合木洞杨梅核仁油的生产用酶,并确定最优酶解条件,以提高对木洞杨梅核仁油的提取率;同时采用气相色谱法[19]对水酶法提取的杨梅核仁油进行脂肪酸组成分析,为高品质的杨梅核仁油的工业化生产提供理论依据。
1.1 材料与试剂
木洞杨梅核产地湖南靖州,按照GB/T 5512—2008《粮油检验:粮食中粗脂肪含量测定》[20]测定核仁含油率为67%;果胶酶、纤维素酶、酸性蛋白酶(均为食品级) 锐阳生物有限公司;其他试剂均为分析纯国药集团化学试剂有限公司。
1.2 仪器与设备
CP114电子分析天平 奥豪斯仪器(上海)有限公司;DK-BD电热恒温水槽 上海一恒科技有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;TGL-20M离心机 长沙英泰仪器有限公司;GC-2014型气相色谱仪日本Kyoto公司。
1.3 方法
1.3.1 原料处理
杨梅核经杨梅核专用破壳试验机破壳后过筛初步分离,经人工筛选获得核仁,105 ℃干燥至水分含量4.35%,粉碎至16 目以下,得杨梅核仁粉,冷藏备用。采用索氏抽提法[20]测定其含油量为67%。
1.3.2 杨梅核仁油提取工艺
量取一定体积用HCl或NaOH已调好pH值的水于50 mL离心管中,加入一定量的酶,混匀后恒温水浴活化5 min,准确称取核仁粉5.000 g,加入离心管中,混匀置于恒温水浴锅中,在设定的酶解温度及酶解时间条件下进行酶解,反应完成后90 ℃水浴10 min灭酶,8 000 r/min离心20 min;上层为杨梅核仁油。
1.3.3 杨梅核仁得油率计算
使用正己烷分离油脂,减压蒸发回收溶剂,并将其干燥(105 ℃)至质量恒定,称取油脂质量,根据式(1)、(2)计算得油率和提取率。
式中:m’为杨梅核仁油与蒸发瓶的总质量/g;m为蒸发瓶的质量/g;M为杨梅核仁的质量,5 g。
式中:67%为按照GB/T 5512—2008测定的核仁含油率。
1.3.4 酶制剂的选择
1.3.4.1 各酶最佳添加量的单因素试验
采用单因素试验考察果胶酶(10万 U/g)、纤维素酶(5万 U/g)、酸性蛋白酶(80万 U/g)添加量对杨梅核仁得油率的影响。酶解条件:果胶酶最适pH 5.5、温度55 ℃;纤维素酶最适pH 4.8、温度50 ℃;酸性蛋白酶pH 3.5、温度45 ℃;料液比1∶5(g/mL);酶添加量(基于杨梅核仁的质量百分比)梯度:0.5%、1%、1.5%、2%、2.5%、3%、3.5%,3 组平行取均值。
1.3.4.2 酶添加量选择的响应面试验
根据果胶酶、纤维素酶及酸性蛋白酶的酶解适合条件范围,将反应条件定为:pH 4.5、酶解温度45 ℃、料液比1∶5(g/mL)、酶解时间2 h。根据Box-Behnken响应面[21]设计原理,运用三因素三水平分析法选取果胶酶、纤维素酶及酸性蛋白酶3种酶添加量,试验设计见表1。
表1 响应面分析试验因素与水平
Table 1 Factors and levels used in response surface design

1.3.4.3 单一酶与复合酶对得油率的影响
根据单因素试验结果,果胶酶、纤维素酶及酸性蛋白酶3种酶在最佳pH值、温度的条件下最佳添加量分别为2.5%、2.5%及2%;根据响应面试验结果,各酶间无交互作用,试验采用二水平全因子设计方案,考察不同酶复合作用与单一酶作用对杨梅核仁得油率的影响,试验因素与水平设计见表2。
表2 全因子试验因素与水平
Table 2 Factors and levels used in full factorial design

1.3.5 酶解条件优化
1.3.5.1 酶解条件单因素试验
纤维素酶的最佳酶解温度与pH值分别为50 ℃、pH 4.8,对其酶解各条件酶添加量、酶解时间和料液比分别进行单因素试验,确定其对杨梅核仁得油率的影响;单因素试验中固定参数条件如下:酶添加量2.5%、酶解温度50 ℃、酶解pH 4.8、酶解时间2 h、料液比1∶5(g/mL)。
1.3.5.2 酶解条件正交试验
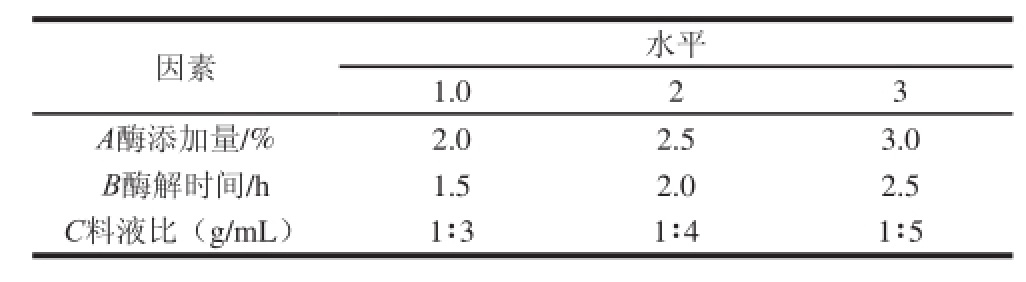
在单因素试验的基础上,对酶添加量、酶解时间与料液比做正交试验,最终得到水酶法提取杨梅核仁油的优化工艺参数。
表3 酶解条件正交试验因素与水平
Table 3 Factors and levels used in orthogonal array design for hydrolysis conditions
1.3.6 杨梅核仁油脂肪酸组成分析
参照GB/T 17376—2008《动植物油脂:脂肪酸甲酯制备》、GB/T 17377—2008《动植物油脂:脂肪酸甲酯的气相色谱分析》,采用气相色谱法对杨梅核仁油的脂肪酸组成进行分析。
气相色谱条件:氢火焰离子化检测器;脂肪酸的分离依靠SP2340石英毛细管柱来完成;氮气作载气,进样口温度250 ℃,检测器温度300 ℃,进样不分流。柱温箱的升温程序为:50 ℃进样,保持2 min;10 ℃/min升至170 ℃,保持10 min;2 ℃/min升至180 ℃,保持10 min;4 ℃ min升至 220 ℃,保持10 min。
2.1 酶制剂的确定
2.1.1 各种酶添加量对得油率的影响
果胶酶、纤维素酶及酸性蛋白酶在各自最佳条件下,不同添加量对杨梅核仁得油率的影响见图1。实验结果表明,随着酶添加量不断增加,杨梅核仁提取的得油率不断增加,这是由于酶可以破坏细胞壁及细胞中的脂蛋白等结构,使油脂溶出,有利于杨梅核仁油的释放;果胶酶与酸性蛋白酶添加量对得油率增长趋势影响较大,而纤维素酶添加量的影响较小;果胶酶、纤维素酶、酸性蛋白酶分别在添加量为2.5%、2.5%及2%时获得最高得油率,分别为32.54%、33.68%、32.03%。随着酶添加量继续增加,得油率反而不断降低,这可能是底物已饱和,过多的酶与油脂发生吸附作用,引起了无效结合[22-23]。

图1 酶添加量对杨梅核仁得油率的影响
Fig. 1 Effect of amounts of enzymes used individually on the oil yield extracted from Myrica rubra kernels
2.1.2 酶添加量确定的响应面试验结果
在单因素试验的基础上,利用响应面分析法进行水酶法提取工艺条件的优化并分析3种酶之间的交互作用。选择果胶酶、纤维素酶及酸性蛋白酶添加量进行三因素三水平响应面优化试验。具体试验设计及结果见表4。
表4 酶添加量响应面试验设计与结果
Table 4 The experimental design and corresponding results for response surface analysis

从表5可知,模型P<0.05,失拟项P>0.05,说明模型拟合程度较好,二次多项模型具有显著性。试验结果分析显示,果胶酶、纤维素酶及酸性蛋白酶添加量对杨梅核仁的得油率均有显著影响(P<0.01,P<0.05)。但三因素之间的交互作用对杨梅核仁油的得油率都不具有显著性影响(P>0.05)。该模型各酶添加量最终优化方案为果胶酶1%、纤维素酶1%、酸性蛋白酶0.67%,预测得油率为31.57%。在优化条件下,3 组平行实验得油率为(31.48±0.27)%,相比较各种单一酶最佳添加量条件下果胶酶、纤维素酶及酸性蛋白酶的得油率分别为32.54%、33.68%、32.03%,此复合方案没有优化效果。
表5 酶添加量响应面试验方差分析结果
Table 5 Analysis of variance of response surface design

注:**.差异极显著,P<0.01;*.差异显著,P<0.05。
2.1.3 不同酶复合作用对得油率的影响
响应面试验设计对3种酶的相互作用研究表明,三者之间的相互作用均不显著,试验采用23无交互作用全因子设计,各复合酶组试验的结果如表6所示。
表6 全因子试验设计与结果
Table 6 Full factorial design results

从表6可看出,6 号果胶酶与酸性蛋白酶的复合添加组的效果最好,得油率最高(29.85%),7号纤维素酶与酸性蛋白、4号果胶酶与纤维素酶及8号3种酶的组合次之,2、3、5号3种单一酶效果再次之;1号得油率为14.13%,为对照组。由此说明,在一定条件下,复合酶的提取效果比单一酶略好,加酶的提取效果较好。这是由于种仁的结构成分复杂,加入一定的酶有利于破坏其组织结构(蛋白质、纤维素、果胶等),从而使得油脂得以释放出来;另一方面,酶具有专一性,不同的酶针对不同的底物,加入不同种类的酶可以将不同结构同时破坏,使得种仁破坏的更彻底,油脂释放出更多。
果胶酶与酸性蛋白酶的复合添加组总酶添加量为5%,得油率为29.85%;单一酶组的添加量为2%~2.5%,得油率为21.40%~27.08%,单一酶在各自最佳条件下得油率则可达到32.02%~33.68%,相比较下,单一酶的成本只有复合酶的一半,得油率仍较高;3种单一酶对杨梅核仁的酶解效果中,纤维素酶的作用效果最强,因此后期将采取纤维素酶对杨梅核仁进行提取条件优化试验。
2.2 酶解条件的优化
2.2.1 酶解条件单因素试验结果
2.2.1.1 酶添加量对杨梅核仁浸提得油率的影响
纤维素酶添加量对杨梅核仁浸提得油率的影响如2.1.1节所示,最佳添加量为2.5%,此时得油率为33.68%。
2.2.1.2 料液比对杨梅核仁浸提得油率的影响
当酶添加量2.5%、酶解温度50 ℃、酶解pH 4.8、酶解时间2 h时,料液比对杨梅核仁浸提得油率的影响如图2所示。
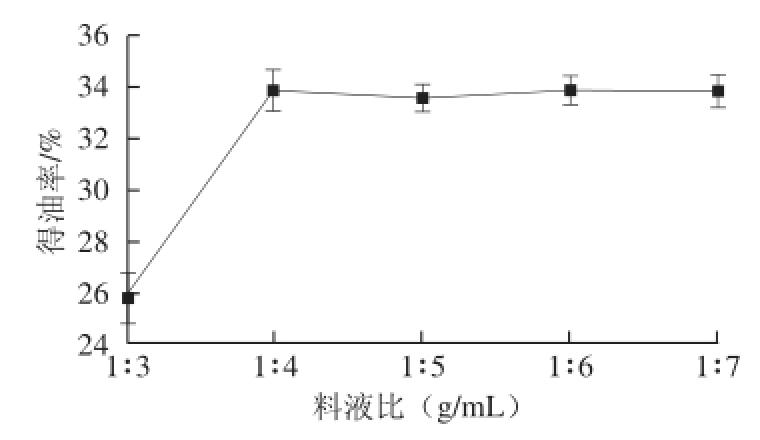
图2 料液比对杨梅核仁得油率的影响
Fig. 2 Effect of solid/liquid ratio on the oil yield extracted from Myrica rubra kernels
试验采用50 mL的离心管,取5 g样品,考虑到料液比为1∶1、1∶2(g/mL)时,液体不足与物料充分接触,为此省略。由图2可知,当溶剂用量不断增大时,得油率不断增加,当达到1∶4(g/mL)时,就几乎达到饱和状态,再增大溶剂用量,得油率也没有明显增加。考虑到酶解液不能回收利用,纤维素酶的成本,选择1∶3、1∶4、1∶5(g/mL)作为正交试验3 个水平。
2.2.1.3 酶解时间对得油率的影响
当酶添加量2.5%、酶解温度50 ℃、酶解pH 4.8、料液比1∶5(g/mL)时,酶解时间对杨梅核仁浸提得油率的影响如图3所示。

图3 酶解时间对杨梅核仁得油率的影响
Fig. 3 Effect of hydrolysis time on the oil yield extracted from Myrica rubra kernels
由图3可知,随着酶解时间的延长,杨梅核仁的得油率也不断增大,当达到2 h后,酶解时间的延长变化对得油率没有显著影响;这可能是因为纤维素酶的酶解能力是一定的,或是原料中的底物是一定的,当酶解时间达到一定时期后,纤维素酶所能酶解的底物已经充分降解,继续酶解也无明显作用效果。
2.2.2 酶解条件正交试验结果
表7 酶解条件正交试验设计与结果
Table 7 Orthogonal array design with experimental values of oil yield

由表7可知,酶解时间(B)对杨梅核仁得油率的影响最大,其次是纤维素酶添加量(A),最后是料液比(C)。通过K值的比较发现,优化的最佳组合为A1B3C2,即纤维素酶添加量2%、酶解时间2.5 h、料液比1∶4(g/mL)。
在最佳提取工艺条件下,进行水酶法提油验证实验,其得油率为(33.95±0.23)%,比正交试验3号(A1B3C3)得油率33.72%高出0.2%。因此最佳提取工艺为:纤维素酶最佳酶解温度50 ℃、pH 4.8、酶添加量2%、酶解时间2.5 h和料液比1∶4(g/mL)。该条件下得油率为33.95%,提取率为50.67%。
2.3 脂肪酸组成分析
采用气相色谱法对杨梅核仁油的脂肪酸组成进行了分析,杨梅核仁油中各脂肪酸的相对含量如表8所示,木洞杨梅核仁油富含不饱和脂肪酸,高达87.22%,其中油酸的质量分数达50.31%,亚油酸含量达到36.64%,亚麻酸含量为0.27%。亚油酸是人体必需的脂肪酸[24],具有降低血清总胆固醇功效[25];亚麻酸[26]是构成人体组织细胞的主要成分,在体内能合成、代谢,转化为机体必需的生命活性因子二十二碳六烯酸和二十碳五烯酸[27],是一种具有较高潜在营养价值的植物油脂。
表8 杨梅核仁油脂肪酸组成分析
Table 8 Fatty acids composition of Myrica rubra kernel oil

通过单因素试验对果胶酶、纤维素酶及酸性蛋白酶3种单一酶的酶解效果做了初步研究,然后通过响应面法分析、全因子试验设计,探究了单一酶和复合酶用于水酶法提取杨梅核仁油的效果,结果证明复合酶作用效果不理想,得油率最高组合仅为29.85%,而且酶添加量也随着叠加作用而成倍增加,单一酶添加量为2%~2.5%,2种酶复合添加量为4.5%~5%,3种酶添加量则可达到7%,成本也随之大大增加;优选确定了水酶法提取杨梅核仁油的酶制剂为纤维素酶。在酶制剂确定的基础上,采用正交试验对酶法水解提取杨梅核仁油的工艺进行了优化,获得其最佳工艺条件为纤维素酶添加量2%、酶解温度50 ℃、pH 4.8、酶解时间2.5 h、料液比1∶4(g/mL),该条件下的得油率为33.95%。文献[17]报道采用微波进行前处理后再采用复合酶提取,提取率比本研究略高,但前一种方法操作工艺较复杂,复合酶添加量较大,成本较高,相比较而言,本研究中的单一酶提取法成本较低,工艺也更简便。
同时,采用气相色谱法对木洞杨梅核仁油进行了脂肪酸组成分析,结果表明:水酶法提取的杨梅核仁油主要含棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸5种脂肪酸,相应所占百分比分别为9.78%、3.00%、50.31%、36.64%、0.27%;不饱和脂肪酸高达87.22%,可与茶油橄榄油媲美,是一种具有较高潜在营养价值的植物油脂。
参考文献:
[1] 中国农业信息网[EB/OL]. [2013-08-01]. http://www.agri.cn/DFV20/ hunan/ttc/201308/t20130801_3545709.htm.
[2] 成纪予. 杨梅核的综合利用研究[D]. 杭州: 浙江大学, 2008.
[3] 倪亮. 杨梅生产废弃物资源化利用研究[D]. 杭州: 浙江大学, 2007.
[4] 王文侠, 任健. 植物油水酶法浸提工艺研究进展[J]. 现代食品科技, 2005, 21(2): 182-185. DOI:10.13982/j.mfst.1673-9078.2005.02.065.
[5] 孙红, 费学谦, 方学智. 茶油水酶法提取工艺初步研究[J]. 江西农业大学学报, 2011, 33(3): 597-601. DOI:10.13836/j.jjau.2011107.
[6] 王超, 方柔, 仲山民, 等. 水酶法提取山茶油的工艺研究[J].食品工业科技, 2010, 31(5): 267-269. DOI:10.13386/ j.issn1002-0306.2010.05.035.
[7] 江连洲, 李杨, 王妍, 等. 水酶法提取大豆油的研究进展[J]. 食品科学, 2013, 34(9): 346-350.
[8] 钱俊青. 水酶法提取大豆油工艺研究[D]. 杭州: 浙江大学, 2001.
[9] 贾照宝, 王瑛瑶, 刘建学, 等. 水酶法提取菜籽油预处理工艺及酶复配研究[J]. 食品工业科技, 2008, 29(10): 153-155. DOI:10.13386/ j.issn1002-0306.2008.10.034.
[10] 章绍兵. 水酶法从油菜籽中提取油和生物活性肽的研究[D]. 无锡:江南大学, 2008.
[11] 刘瑞兴, 张智敏, 吴苏喜, 等. 水酶法提取油茶籽油的工艺优化及其营养成分分析[J]. 中国粮油学报, 2013, 27(12): 54-61.
[12] 陈泽君, 胡伟. 水酶法提取油茶籽油的研究进展综述[J]. 湖南林业科技, 2012, 39(5): 101-104.
[13] 江利华, 华娣, 王璋, 等. 水酶法从花生中提取油与水解蛋白的中试研究[J]. 食品与发酵工业, 2009, 35(9): 147-150. DOI:10.13995/ j.cnki.11-1802/ts.2009.09.032.
[14] ROSENTHAL A, PYLE D L, NIRANJAN K. Aqueous and enzymatic processes for edible oil extraction[J]. Enzyme and Microbial Technology, 1996, 19(6): 402-420. DOI:10.1016/S0141-0229(96)80004-F.
[15] DOMINGUEZ H, NÚNẼZ M J, LEMA J M. Aqueous processing of sunflower kernels with enzymatic technology[J]. Food Chemistry, 1995, 53(4): 427-434. DOI:10.1016/0308-8146(95)99838-Q.
[16] ZHANG Yinglao, LI Shuai, YIN Caiping, et al. Response surface optimisation of aqueous enzymatic oil extraction from bayberry (Myrica rubra) kernels[J]. Food Chemistry, 2012, 135(1): 304-308. DOI:10.1016/j.foodchem.2012.04.111.
[17] 陈潇逸, 王超, 张帆, 等. 微波预处理水酶法提取杨梅核仁油的研究[J].中国粮油学报, 2013, 28(11): 37-40.
[18] 林弈琪, 陆艇, 王超, 等. 水酶法提取杨梅核仁油条件研究[J]. 中国油脂, 2014, 39(5): 9-12.
[19] 杨春英, 刘学铭, 陈智毅. 15种食用植物油脂肪酸的气相色谱-质谱分析[J]. 食品科学, 2013, 34(6): 211-214.
[20] 国家粮食局科学研究院. GB/T 5512—2008 粮油检验: 粮食中粗脂肪含量测定[S]. 北京: 中国标准出版社, 2008.
[21] 易军鹏, 朱文学, 马海乐, 等. 响应面法优化微波提取牡丹籽油的工艺研究[J]. 食品科学, 2009, 30(14): 99-104.
[22] 赵巧玲, 刘文玉, 胡汇泉, 等. 超声波辅助水酶法提取胡麻油工艺条件的研究[J]. 粮食与食品工业, 2015, 22(2): 35-39.
[23] 朱振宝, 刘旷, 易建华, 等. 大扁杏仁油水酶法提取工艺优化[J]. 中国油脂, 2014, 39(1): 10-14.
[24] 王筱菁, 李万根, 苏杭, 等. 棕榈酸及亚油酸对人成骨肉瘤细胞MG63作用的研究[J]. 中国骨质疏松杂志, 2007, 13(8): 542-546.
[25] 张春娥, 张惠, 刘楚怡, 等. 亚油酸的研究进展[J]. 粮油加工, 2010(5): 18-21.
[26] 陶国琴, 李晨. α-亚麻酸的保健功效及应用[J]. 食品科学, 2000, 21(12): 140-143.
[27] 范文洵. α-亚麻酸及其代谢产物EPA和DHA[J]. 生理科学进展, 1988, 19(2): 110-113.
Optimization of Enzyme-Assisted Aqueous Extraction for Myrica rubra Kernel Oil
HUANG Yafang, LI Luoming, LI Junjie, LI Ke*
(Hunan Province Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract: In this study, the response surface methodology and full factorial design were employed to evaluate the extraction efficiencies of Myrica rubra kernel oil by aqueous enzymatic extraction with three individual enzymes and their combinations, and it turned out that cellulase was the best enzyme for the extraction of Myrica rubra kernel oil. Then, using an orthogonal array design, the optimum hydrolysis conditions for oil extraction were determined as follows: cellulase dose, 2%; temperature, 50 ℃; pH value, 4.8; time, 2.5 h; and solid/liquid ratio, 1:4 (g/mL). Under these conditions, the oil yield was 33.95%, which was 50.67% as compared to the oil content of Myrica rubra kernels measured according to the Chinese national standard GB/T 5512—2008. Gas chromatography analysis revealed that the kernel oil contained 87.22% unsaturated fatty acids, including 50.31% oleic acid, 36.64% linoleic acid and 0.27% linolenic acid.
Key words: response surface methodology; aqueous enzymatic extraction; Myrica rubra kernel oil; oil yield; fatty acid
收稿日期:2015-10-14
基金项目:粮油深加工与品质控制湖南省协同创新中心项目(湘教通[2013]448号)
作者简介:黄亚芳(1989—),女,硕士研究生,研究方向为食品加工与安全。E-mail:279272649@qq.com
*通信作者:李珂(1982—),男,实验师,博士研究生,研究方向为食品科学、微生物学。E-mail:leeke14@163.com
DOI:10.7506/spkx1002-6630-201612011
中图分类号:TS224.4
文献标志码:A
文章编号:1002-6630(2016)12-0065-06