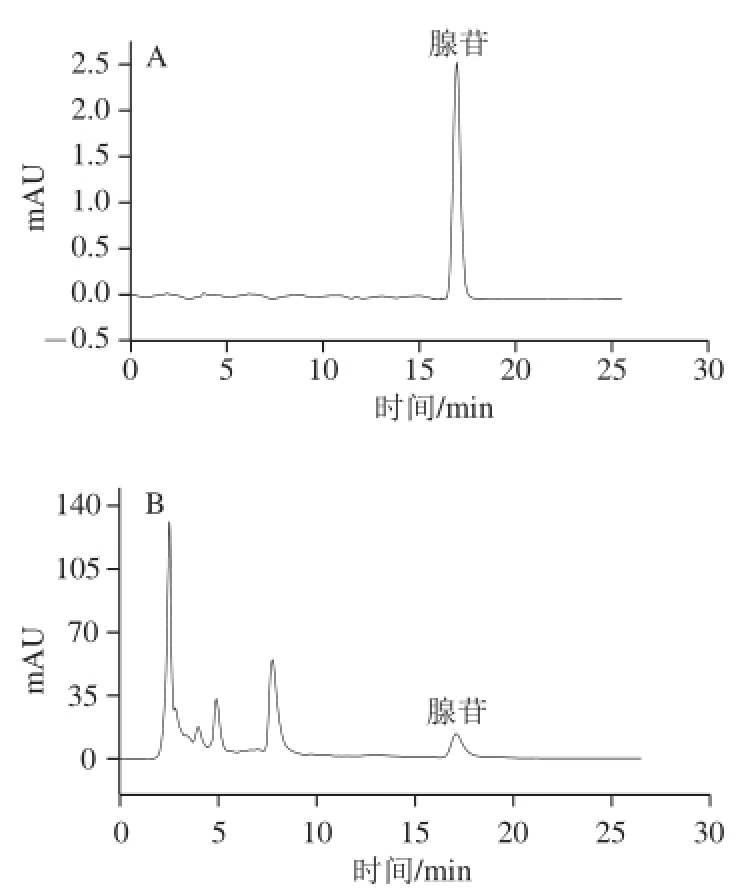
图1 腺苷标准品(A)与玛咖提取物中腺苷(B)的HPLC图谱
Fig. 1 HPLC of adenosine standard (A) and maca sample (B)
金文闻1,2,陈雪敏1,2,杨 飘3,汪 巨1,陈 慧1,张之会4,余龙江1,2,*
(1.华中科技大学生命科学与技术学院,资源生物学与生物技术研究所,湖北 武汉 430074;2.武汉生物技术研究院,湖北 武汉 430075;3.武昌首义学院,湖北 武汉 430064;4.丽江百岁坊生物科技开发有限公司,云南 丽江 674100)
摘 要:目的:建立一种玛咖中腺苷的高效液相色谱(high performanc e liquid chromatography,HPLC)检测技术,并根据 海拔、组织部位、干燥处理方法及表皮颜色差异对国产玛咖中腺苷含量进行分析。方法:用10%的 甲醇溶液为提取溶剂提取玛咖中的腺苷,采用Waters SunfireTMC18(4.6 mm×250 mm,5 μm)色谱柱,以甲醇-水(10∶90,V/V)为流动相,流速1.00 mL/min,紫外检测波长260 nm,柱温2 6 ℃为条件进行腺苷的HPLC含量测定,并用该方法对多个玛咖样本进行了腺苷含量分析;结果:该方法显示腺苷含量在2.81~90 μg/mL范围内与峰面积呈良好的线性关系(R2为0.999 4),精密度较高(相对标准偏差(relative standard deviation,RSD)为0.728 3%)、重复性较好(RSD为1.745%),样品溶液24 h内的稳定性好(RSD为1.069%),平均加样回收率为99.76%(RSD为0.48%)。根据不同玛咖样品检测结果发现,腺苷含量受玛咖颜色和海拔的影响较大,而且干燥处理方法和组织部位影响更大。结论:HPLC法适合玛咖中腺苷成分的含量测定,可用于玛咖原料的质量控制。
关键词:玛咖;腺苷;高效液相色谱;质量控制
金文闻, 陈雪敏, 杨飘, 等. 国产玛咖中腺苷含量的高效液相色谱分析[J]. 食品科学, 2016, 37(12): 148-151. DOI:10.7506/spkx1002-6630-201612026. http://www.spkx.net.cn
JIN Wenwen, CHEN Xuemin, YANG Piao, et al. Determination of adenosine in domestic maca by high performance liquid chromatography[J]. Food Science, 2016, 37(12): 148-151. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612026. http://www.spkx.net.cn
玛咖是十字花科(Brassicaceae)独行菜属(Lepidium)一年生或两年生草本植物Lepidium meyenii Walpers的中文音译名,其英文简称“Maca”,原产于南美秘鲁海拔3 500 m以上的安第斯山区[1],十多年前在我国引种成功,在我国西部高原省份如云南、西藏、新疆、四川等有大面积种植。长期以来,药食两用植物玛咖被认为能增强精力和耐力、抗压力、提高生育力[2],同时可用于缓解女性更年期综合征和预防骨质疏松[3-4]。玛咖富含多种营养成分,如蛋白质、氨基酸、膳食纤维、多糖、矿物质、多种维生素等[5-6]。此外,玛咖还含有玛咖酰胺、玛咖烯、芥子油苷、甾醇、多酚、黄酮、咪唑生物碱、异硫氰酸苄酯等活性成分[2,7],这些活性成分大多可以采用先进手段实现精确定性和含量检测[8-13],为揭示玛咖功效物质基础提供了重要手段。因此,发掘更多的玛咖化学成分和检测手段对玛咖功效研究和玛咖保健食品开发意义重大。
最近几年玛咖获批我国新资源食品,以玛咖为原料的保健食品申报也逐渐增多,其中缓解体力疲劳是玛咖重要的功能之一,而具有相同功能的冬虫夏草[14-15]、人参[16]、灵芝[17]等均含有腺苷,并常将其作为重要功效成分宣称,市场上也常把玛咖与这些保健食品进行类比,所以对于玛咖中腺苷成分分析很有必要。郑茜等[18]从吉林产玛咖根茎中分离纯化出腺苷,并通过理化性质和波谱数据对其进行了结构鉴定。但目前专门针对玛咖尤其是国产玛咖中腺苷的检测研究鲜见报道。高效液相色谱(high performance liquid chromatography,HPLC)技术是目前检测食品中腺苷最为普遍的方法[19-25],本实验以国产玛咖的代表云南丽江产玛咖为研究对象,建立玛咖中腺苷的提取分离及其HPLC检测技术,并根据海拔、组织部位、干燥处理方法及表皮颜色的差异对玛咖样本中腺苷含量进行分析,初步考察国产玛咖中腺苷含量及部分影响因素,以期能为玛咖功效研究、加工应用及质量控制提供参考和检测手段。
1.1 材料与试剂
玛咖产自云南丽江,2014年12月在丽江百岁坊生物科技开发有限公司-华中科技大学玛咖联合种植基地采收,经黄冈师范学院项俊教授鉴定为Lepidium meyenii;采集玛咖样本包括不同海拔(黄色玛咖根,海拔分别为3 200、2 800、2 400 m,整根晒干),不同组织部位(海拔2 800 m的紫色玛咖全株,采收后剪切收获须根和叶,然后刀削获取2 mm左右厚度的皮部,去皮肉质切成约3 mm厚度的片,全部组织样本采用真空冷冻干燥),不同干燥处理方式(海拔2 800 m的黄色玛咖根,采后分别用切片冻干、切片晒干、整根晒干),不同表皮颜色(海拔2 800 m,采收不同颜色玛咖根,切片冻干),所有玛咖样品需粉碎过100 目筛,于干燥器内常温保存备用。
腺苷对照品A9251-1G(纯度≥99%) 美国Sigma公司;提取用甲醇为分析纯,HPLC检测用甲醇为色谱纯,水为超纯水。
1.2 仪器与设备
1525-F型高效液相色谱仪 美国Waters公司;Mettler A E100型分析天平 武汉永盛科技有限公司;恒温磁力搅拌水浴锅、SHB-IIIA循环水式真空泵 巩义市予华仪器有限责任公司;RE-2000B旋转蒸发仪 上海亚荣生化仪器厂;GL-21M高速冷冻离心机 湖南湘仪离心机仪器有限公司;超声波提取仪 宁波新芝生物科技股份有限公司;恒温鼓风干燥箱 杭州蓝天化验仪器厂;超纯水仪 四川卓越水处理设备有限公司。
1.3 方法
1.3.1 玛咖样品中腺苷的提取过程
用分析天平称取玛咖干粉1.000 g至250 mL圆底烧瓶中,按照1∶50的料液比加入10%的甲醇溶液,设定提取温度55 ℃,恒温水浴,搅拌回流30 min[26-31];然后以8 000 r/min的转速离心10 min,倒出上清液,将残渣按上述方法,重复操作2 次。合并3 次的上清液,用旋转蒸发仪于55 ℃条件下减压浓缩得浸膏,即为玛咖腺苷提取物。
1.3.2 对照品溶液的制备
用分析天平精密称取腺苷对照品适量,用少量超纯水溶解后,转移至10 mL容量瓶中,加超纯水定容至刻度,配制成质量浓度为90 μg/mL的对照品溶液,备用。
1.3.3 供试品溶液的制备
向1.3.1节得到的玛咖腺苷提取物中加入少许10%的甲醇溶液,超声溶解后,以5 000 r/min的转速离心,取上清液转移至10 mL容量瓶中定容至刻度,备用。
1.3.4 色谱条件
色谱柱:Waters Sunfire C18柱(4.6 mm× 250 mm,5 μm);流动相:甲醇-水(10∶90,V/V);流速:1.0 mL/min;检测波长:260 nm;柱温:26 ℃;进样量:20 μL;理论塔板数按腺苷峰计算不少于3 000。
1.3.5 不同玛咖样品中腺苷含量分析
按照1.1节选取不同海拔、不同组织部位、不同干燥处理方法以及不同表皮颜色的玛咖样品,每个样品平行取样3 份,按以上提取及检测条件测定腺苷含量。
2.1 专属性考察
分别精密吸取对照品溶液和供试品溶液各20 μL,按照1.3.4节中的色谱条件,进行HPLC检测。结果可见腺苷对照品与供试品中腺苷的保留时间分别为17.04 min和17.11 min,且供试品中腺苷与其他组分的色谱峰可达到良好分离,结果见图1。

图1 腺苷标准品(A)与玛咖提取物中腺苷(B)的HPLC图谱
Fig. 1 HPLC of adenosine standard (A) and maca sample (B)
2.2 线性关系考察
精密吸取1.3.2节中制备的对照品溶液用流动相逐级稀释,制成质量浓度分别为90、45、22.5、11.25、5.62 μg/mL与2.81 μg/mL的对照品溶液,进样量为20 μL,按上述色谱条件进行分析,以对照品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得回归方程为Y=87.144X+95.327(R2=0.999 4),结果表明腺苷在2.81~90 μg/mL范围内线性关系良好。
2.3 精密度实验结果
按1.3.4节色谱条件,分别精密吸取腺苷对照品溶液(90 μg/mL)20 μL,连续进样5 次,测定腺苷的峰面积,相对标准偏差(relative standard deviation,RSD)为0.728 3%,表明仪器精密度良好。
2.4 重复性实验结果
取同一批海拔2 800 m的黄色晒干玛咖干粉5 份,按1.3.1节中腺苷的提取方法,将制备好的供试品溶液用0.45 μm微孔滤膜过滤,进样量为20 μL,按照上述色谱条件测定,每个样品重复进样2 次,取其峰面积的平均值,代入标准曲线方程,得5 份样品中腺苷的平均含量为63.84 μg/g,RSD为1.745%,表明方法重复性较好。
2.5 稳定性实验结果
任意取1.3.3节中制备的供试品溶液一份,分别在9、12、15、18、24 h时进样测定其峰面积,RSD为1.069%,表明样品溶液24 h内较稳定。
2.6 加样回收率实验结果
精密称取海拔2 800 m的黄色晒干玛咖干粉9 份,每份1.000 g,分别精密加入1.3.2节下制备的腺苷对照品标准溶液(90 μg/mL):低、中、高质量浓度每一份平行实验2 次,按照1.3.1节中供试品溶液制备方法制备,然后按上述色谱条件,进样量20 μL,测定各个峰面积,计算加样回收率,结果见表1。本实验建立的玛咖中腺苷的提取与检测方法准确度较好。
表1 样品含量测定及加样回收率实验(n=9)
Table 1 Adenosine contents of real samples and its spiked recovery (n=9)

2.7 不同玛咖样品中腺苷检测结果
表2 不同海拔的玛咖样品中腺苷含量
Table 2 Adenosine contents in maca samples grown at different altitudes
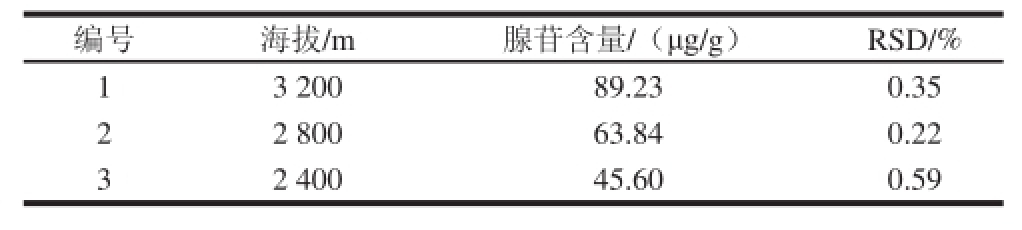
表3 不同部位的玛咖样品中腺苷含量
Table 3 Adenosine contents in different maca tissues

表4 不同干燥处理方法的玛咖样品中腺苷含量
Table 4 Adenosine contents in maca samples dried by different methods

表5 不同品种的玛咖样品中腺苷含量
Table 5 Adenosine contents in maca varieties with different skin colors
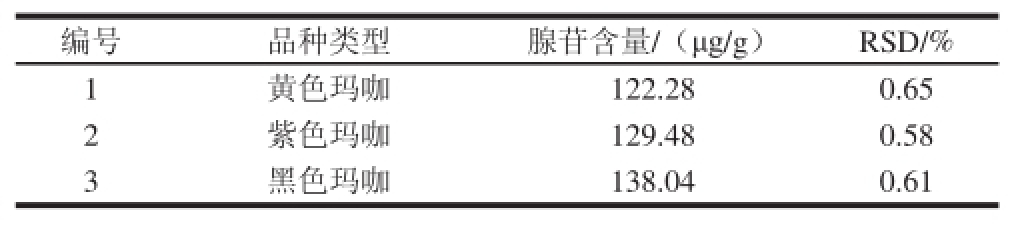
由表2~5可见,通过对不同玛咖样品中腺苷的检测可以发现,玛咖中腺苷含量受到很多因素的影响。在确保种苗品种、种植管理、采收加工等相同的情况下,从不同海拔玛咖基地采收的玛咖中腺苷含量有一定差异,其中随着海拔提高,腺苷含量逐渐提高;腺苷在玛咖不同组织部位中积累有差异,而且靠近外层或皮质较多的组织中含量低,含量最高的是玛咖去皮肉质(147.35 μg/g),最低的则是玛咖叶(38.23 μg/g);由于腺苷的热稳定性较差,本实验也考察了几种干燥处理方式对玛咖腺苷含量的影响,其中真空冷冻干燥所得玛咖腺苷含量最高,整根晒干其次,损失最大的是切片干燥,因此玛咖加工中要从温度和控制氧化等方面入手,尽量保持腺苷含量;另外,市面上不同颜色玛咖的价格差异很大,因此本实验也对同一基地几种不同颜色玛咖中腺苷含量进行了分析,可见黑色玛咖腺苷含量最高,其次是紫色玛咖,含量最低的是黄色玛咖,但相对组织部位和干燥加工对腺苷含量的影响来说,不同颜色玛咖的腺苷差异不大。以上检测结果虽然还有待更大样本量的分析,但也足够提示在利用腺苷作为活性成分开发玛咖抗疲劳产品时,要密切关注玛咖原料的选择及其采后加工工艺。
腺苷是人参、灵芝、冬虫夏草等多种重要生物资源的活性成分,具有重要的生理活性,如舒张血管、降低血压、减慢心率、抑制血小板凝集和改善心脑血液循环等作用。腺苷含量的测定已成为许多药材或滋补品质量监控的指标。本实验成功地建立了一种玛咖干粉中腺苷的HPLC检测技术,对国产玛咖进行腺苷成分的分析和报道。通过实验结果发现,该方法重复性较好、稳定性良好,可以用于玛咖中腺苷的含量测定。此外,通过对云南丽江多种玛咖样品中腺苷含量的检测发现,腺苷含量与玛咖种植地海拔、表皮颜色,尤其是组织部位和干燥处理方法密切相关,且多数样品腺苷含量较为丰富,结合腺苷具有的活性作用,暗示腺苷很可能是玛咖提高精力、抗疲劳的潜在功效成分之一,通过进一步研究,腺苷有望成为继支链氨基酸、锌、牛磺酸等玛咖抗疲劳活性成分之后,又一种用于评价玛咖抗疲劳功能的重要指标性成分。
参考文献:
[1] QUIROS C F, CARDENAS R A. Maca[C]//HERMANN M, HELLER J. Andean roots and tubers: ahipa, arracacha, maca and yacón. Promoting the conservation and use of underutilized and neglected crops. 21. Institute of Plant Genetics and Crop Plant Research, Gatersleben/International Plant Genetic Resources Institute, Rome, Italy, 1997: 175-195.
[2] WANG Yali, WANG Yuchun, MCNEIL B, et al. Maca: an andean crop with multi-pharmacological functions[J]. Food Research International, 2007, 40(7): 783-792. DOI:10.1016/ j.foodres.2007.02.005.
[3] BROOKS N, WILCOX G, WALKER K, et al. The use of Lepidium meyenii (Maca) on hormone profile and symptoms in postmenopausal women[J]. Menopause, 2007, 14(6): 1083-1083.
[4] ZHANG Yongzhong, YU Longjiang, AO Mingzhang, et al. Effect of ethanol extract of Lepidium meyenii Walp. on osteoporosis in ovariectomize d ra t[J]. Journal of Ethnopharmacology, 2006, 106(1/2): 422-428. DOI:10.1016/j.jep.2005.12.013.
[5] DINI A, MIGLIUOLO G, RASTRELLI L, et al. Chemical composition of Lepidium meyenii[J]. Food Chemistry, 1994, 49(4): 347-349. DOI:10.1016/0308-8146(94)90003-5.
[6] 余龙江, 金文闻. 玛咖(Lepidium meyenii.)干粉的营养成分及抗疲劳作用研究[J]. 食品科学, 2004, 25(2): 164-166. DO I:10.3321/ j.issn:1002-6630.2004.02.038.
[7] 余龙江, 金文闻. 玛咖的种植加工与营养保健[M]. 北京: 化学工业出版社, 2014: 95-115.
[8] CHAIN F E, GRAU A, MARTINS J C, et al. Macamides from wild ‘Maca’, Lepidium meyenii Walpers (Brassicaceae)[J]. Phytochemistry Le tters, 2014, 8: 145-148. DOI:10.1016/j.phytol.2014.03.005.
[9] 艾中, 程爱芳, 孟际勇, 等. 国产玛咖芥子油苷的组分分析和含量测定[J]. 食品科技, 2012, 37(4): 182-186. DOI:1 0.13684/j.cnki. spkj.2012.04.011.
[10] 金文闻, 王晴芳, 李硕, 等. 新疆产玛咖的挥发油成分研究[J]. 食品科学, 2009, 30(12): 241-245. DOI:10.3321/j.issn:1002-6630.2009.12.055.
[11] 甘瑾, 冯颖, 张弘 等. 三种色型玛咖甾醇组分及含量分析[J]. 林业科学研究, 2013, 26(1): 129-132. DOI:10.3969/ j.issn.100 1-1498.2013.01.022.
[12] CUI Baoliang, Z HENG Bolin, HE Kan, et al. Imidazole alkaloids from Lepidium meyenii[J]. Journal of Natural Product, 2003, 66(8): 1101-1103. DOI:10.1021/np030031i.
[13] CLÉMENT C, GRADOS D A D, AVULA B, et al. Influence of colour type and previous cultivation on secondary metabolites in hypocotyls and leaves of maca (Lepidium meyenii Walpers)[J]. Journal of the Science of Food and Agriculture, 2010, 90(5): 861-869. DOI:10.1002/ jsfa.3896.
[14] 张倩, 唐永范, 徐三妹. 人工培育北冬虫夏草主要有效成分分布特点的研究[J]. 中医药学报, 2011, 39(4): 72-74. DOI:10.3969/ j.issn.1002-2392.2011.04.029.
[15] YAN Xiaofeng, ZHANG Zhongmiao, YAO Hongyi, et al. Cardiovascular protection and antioxidant activity of the extracts from the mycelia of cordyceps sinensis act partially via adenosine receptors[J]. Phytotherapy Research, 2013, 27(11): 1597-1604. DOI:10.1002/ptr.4899.
[16] 张伟云. 人参与秘鲁参中腺苷的分离及人参中单体人参皂苷的定量分析[D]. 长春: 吉林农业大学, 2006.
[17] 邱文炜, 翁雪萍. 灵芝胶囊质量标准研究及质量评价[J]. 中药材, 2005, 28(9): 827-828. DOI:10.3321/j.issn:1001-4454.200 5.09.037.
[18] 郑茜, 张庆贺, 卢丹, 等. 吉林产玛咖的化学成分 研究[J]. 中草药, 2014, 45(17): 2457-2460. DOI:10.7501/j.issn.0253-2670.2014.17.007.
[19] 周爽, 荫硕炎, 王丹, 等. 虫草类保健食品中腺苷含量测定HPLC方法的改进[J]. 中国卫生检测杂志, 2013, 23(6): 1424-1426.
[20] KU MAR M H, SPANDANA M. Simultaneous extraction, determination and analysis of adenosine, cordycepin and other derivatives of Cordyceps sinensis of nepal by new validated HPLC method[J]. Journal of Pharmacognosy and Phytochemistry, 2013, 2(4): 43-45.
[21] 陈婷, 刘群, 莫灼康, 等. HPLC同时测定冬虫夏草中腺苷、虫草素和麦角甾醇[J]. 中国实验方剂学杂志, 2013, 19(6): 161-163. DOI:10.13422/j.cnki.syfjx.2013.06.062.
[22] 马东升, 高飞飞, 李伟, 等. 鲜人参及其加工品中腺苷和L-焦谷氨酸含量比较研究[J]. 吉林农业大学学报, 2013, 35(1): 36-39; 45. DOI:10.13327/j.jjlau.2013.01.007.
[23] 席桂同. 高效液相色谱法测定灵芝提取物中尿苷和腺苷含量[J]. 世界中医药, 2014, 9(7): 934-936; 940. DOI:10.3969/ j.issn.1673-7202.2014.07.030.
[24] 岳显可, 曹岗, 吴瑶, 等. HPLC法测定猴头菇核苷类成分腺苷的含量[J]. 实用药物与临床, 2015, 18(4): 432-436. DOI:10.14053/j.cnki. ppcr.201504016.
[25] 郑瑜倩, 程巧鸳, 祝明, 等. HPLC同时测定百令胶囊中5种核苷类成分的含量[J]. 中国实验方剂学杂志, 2015, 21(5): 61-64. DOI:10.13422/j.cnki.syfjx.2015050061.
[26] 肖慧, 刘清飞, 王义明, 等. 高效液相法测定板蓝根药材中三种核苷的含量[J]. 中成药, 2008, 30(11): 1654-1657. DOI:10.3969/ j.issn.1001-1528.2008.11.029.
[27] 周成惠, 李春雪, 张镓小, 等. HPLC测定不同产地掌叶半夏中腺苷的含量[J]. 中国实验方剂学杂志, 2011, 17(3): 77-79. DOI:10.3969/ j.issn.1005-9903.2011.03.025.
[28] 谭莉 萍, 谭小勇. HPLC测定海麻雀中腺苷的含量[J]. 中国实验方剂学杂志, 2011, 17(5): 107-109. DOI:10.3969/ j. issn.1005-9903.2011.05.033.
[29] 吴柳春, 蒋秋香, 齐兆林. HPLC法测定板蓝根片中尿苷和腺苷的含量[J]. 中国药品标准, 2011, 12(4): 291-294. DOI:10.3969/ j.issn.1009-3656.2011.04.017.
[30] 周伟平, 高晓霞, 代安国, 等. HPLC法测定西藏主产区冬虫夏草中尿苷和腺苷的含量[J]. 广东药学院学报, 2011, 27(6): 591-595. DOI:10.3969/j.issn.1006-8783.2011.06.010.
[31] 黄丽俊, 李利东, 宓晓黎. 高效液相色谱法同时检测虫草制品中腺苷和虫草素含量的研究[J]. 农学学报, 2015, 5(5): 25-28.
Determination of Adenosine in Domestic Maca by High Performance Liquid Chromatography
JIN Wenwen1,2, CHEN Xuemin1,2, YANG Piao3, WANG Ju1, CHEN Hui1, ZHANG Zhihui4, YU Longjiang1,2,*
(1. Institute of Resource Biology and Biotechnology, College of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, China; 2. Wuhan Institute of Biotechnology, Wuhan 430075, China; 3. Wuchang Shouyi University, Wuhan 430064, China; 4. Lijiang Baisuifang Biot echnology Development Co. Ltd., Lijiang 67 4100, China)
Abstract: Objective: To establish a high performance liquid chromatography (HPLC) method for detecting the adenosine content of Lepidium meyenii (maca) and utilize it to detect and the adenosine contents of domestic maca grown at different altitudes, its different tissues, dried samples obtained using drying methods and maca varieties with different skin colors. Methods: A 10% aqueous methanol solution was used as the extraction solvent to extract the adenosine in maca. The HPLC analysis was performed using a Waters SunfireTMC18column (4.6 mm × 250 mm, 5 μm). The mobile phase was CH3OH-H2O (10:90, V/V) at a flow rate of 1.00 mL/min. The detection wavelength was 260 nm, and the column temperature was 26 ℃. Multiple samples were analyzed under these chromatographic conditions. Results: The method had good linearity in the concentration range of 2.81–90 μg/mL (R2=0.999 4), high precision and good reproducibility with relative standard deviation (RSD) values of 0.728 3% and 1.745%, respectively. The sample solution was stable within 24 h (RSD = 1.069%), and the average recovery of was 99.76% with a RSD value of 0.48% (n = 9). The analytical results of different maca samples showed that different altitudes and differently colored maca varieties had great influences on the content of adenosine while different drying methods and different tissues had more significant impacts. Conclusions: The HPLC method is suitable for detecting the content of adenosine in maca for the quality control of maca materials.
Key words: maca; adenosine; HPLC; quality control
收稿日期:2015-08-31
基金项目:华中科技大学校企重大合作项目(20130901);华中科技大学自主创新研究基金前沿探索项目(2015TS091);国家基础科学人才培养基金项目(J1103514)
作者简介:金文闻(1976—),男,讲师,博士,研究方向为天然产物化学。E-mail:jww@hust.edu.cn
*通信作者:余龙江(1966—),男,教授,博士,研究方向为资源生物学与生物技术。E-mail:yulongjiang@hust.edu.cn
DOI:10.7506/spkx1002-6630-201612026
中图分类号:O657.72;TS255.7
文献标志码:A
文章编号:1002-6630(2016)12-0148-04引文格式: