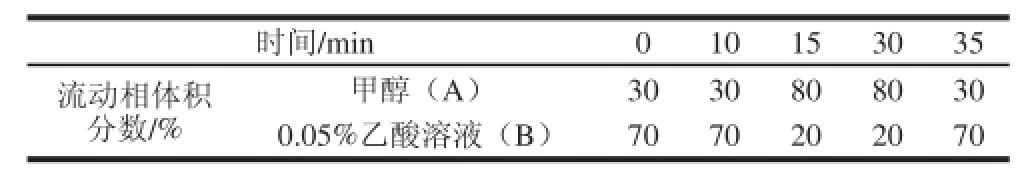
表1 梯度洗脱条件
Table 1 Gradient elution conditions
艾散江·艾海提,王 瑾,关 明*
(新疆师范大学化学化工学院,新疆 乌鲁木齐 830054)
摘 要:目的:建立高效液相色谱法测定药食同源红花中羟基红花黄色素A含量的方法。方法:采用微波辅助萃取法提取药食同源红花中的有效成分,高效液相色谱梯度洗脱法分离分析其中羟基红花黄色素A;色谱柱为Sino Chrom ODS-BP(4.6 mm×200 mm,5 μm),流动相为甲醇-0.5%的乙酸溶液,检测波长为403 nm,流速为1.0 mL/min。结果:羟基红花黄色素A在5.25~80.32 μg/mL质量浓度范围内与峰面积呈良好线性关系(r=0.999 9),加标回收率为101.0%~103.6%,相对标准偏差不大于2.27%。结论:建立的方法简便准确、重复性好,可用于食品、保健品及其复方制剂中羟基红花黄色素A的含量测定。
关键词:红花;羟基红花黄色素A;高效液相色谱法;梯度洗脱
引文格式:
艾散江·艾海提, 王瑾, 关明. 高效液相色谱法分离分析药食同源红花中羟基红花黄色素A[J]. 食品科学, 2016, 37(12): 152-155. DOI:10.7506/spkx1002-6630-201612027. http://www.spkx.net.cn
AISANJIANG·Aihaiti, WANG Jin, GUAN Ming. Separation and analysis of hydroxysafflor yellow a in edible and medical petals of safflower flowers by high performance liquid chromatography[J]. Food Science, 2016, 37(12): 152-155. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612027. http://www.spkx.net.cn
红花(Carthamus tinctorius L.)属菊科植物[1],是一种药食同源作物,原产于埃及,文字记载已有4 000多年历史[2]。我国始载于《开宝本草》[3],已有2 100多年的栽培、食用及药用历史,主产于新疆,并于我国多地广泛栽培[4]。红花所含成分主要为色素、黄酮类、挥发油、脂肪酸等[5],被广泛应用于食品、保健品领域[6-7]。红花黄色素是从红花的花瓣中提取的天然食用色素,具有良好的保健功能[8],被广泛应用于食品工业中[9]。其中,羟基红花黄色素A是红花的主要有效成分[10-11],具有扩张冠状动脉、抗氧化、保护心肌、降血压、免疫抑制和脑保护等功效[12-14],其含量与抗氧化能力有相关性,因此被广泛应用于食品与保健品行业[15]。
1993年,Meselhy等[16]首次分离得到羟基红花黄色素A,国内外对其提取、分离及测定开展了广泛研究。目前,提取红花中的羟基红花黄色素A主要采用热浸法、超声法、渗滤法、回流提取、微波辅助萃取等方法,其中,微波辅助萃取技术因具有穿透力强、选择性高、反应速度快、溶剂消耗低、污染小,以及设备简单、提取收率高等多种优点[17],成为样品前处理技术的热点[18]。关于红花中羟基红花黄色素A的含量测定,主要采用紫外分光光度法[19]、高效液相色谱法[20-22]等,其中,高效液相色谱法因其分离效率高、选择性好、分析速度快、灵敏度高等特点,应用日益广泛,但大多涉及食品或保健品中羟基红花黄色素A的含量测定,此外,文献[22]报道,采用高效液相色谱法测定红花有效成分存在色谱峰拖尾、峰形不对称、保留时间长、分离度不理想等缺陷。
本研究采用微波辅助萃取法对药食同源的红花植物原料进行了有效成分提取,并借鉴相关报道[10],采用梯度洗脱高效液相色谱法对红花植物原料中的羟基红花黄色素A进行了有效地分离分析,希望为药食同源红花的质量评价提供参考依据。
1.1 材料
红花花瓣,采自新疆喀什岳普湖县。
羟基红花黄色素A标准品(纯度≥98%) 天津马克生物技术有限公司;甲醇(色谱纯) 美国Sigma-Aldrich公司;高纯水;乙酸(分析纯)。
1.2 仪器与设备
1200LC高效液相色谱仪 安捷伦科技有限公司;E1817525 Sino chrom ODS-BP色谱柱(4.6 mm×200 mm,5 μm);XH300B型超声波微波组合合成/萃取仪 北京祥鹄科技发展有限公司。
1.3 方法
1.3.1 色谱条件
流动相:甲醇(A)-0.5%乙酸溶液(B),梯度洗脱(表1),每次运行后平衡柱子5 min;流速:1.0 mL/min;检测波长:403 nm;柱温:30 ℃;进样体积20 μL。
表1 梯度洗脱条件
Table 1 Gradient elution conditions

1.3.2 标准品溶液的制备
1.3.2.1 储备液的制备
准确称取羟基红花黄色素A标准品2.6 mg,置于25 mL的容量瓶中,加水溶解并稀释至刻度。经0.45 μm微孔滤膜过滤,配制0.104 mg/mL的储备液,混匀。
1.3.2.2 标准品溶液的制备
从0.104 mg/mL的标准品储备液中,分别精密吸取0.5、1、2、8 mL到10 mL的容量瓶中,混匀,配制成质量浓度分别为0.005 2、0.010 4、0.020 8、0.041 6、0.083 2、0.104 mg/mL的标准品溶液。
1.3.3 标准曲线的绘制
精密吸取1.3.2.2节系列标准品溶液各20 μL,进样,按照1.3.1节下色谱条件进行测定。以羟基红花黄色素A对照品的质量浓度为横坐标X,羟基红花黄色素A峰面积为纵坐标Y,绘制标准曲线。
1.3.4 供试品溶液的制备
取红花粉末(过40目筛)1 g,在功率300 W、温度70 ℃条件下,微波提取5 min,过滤,稀释,得到1 mg/mL的供试品溶液,再用0.45 μm微孔滤膜过滤,即得供试品溶液。
1.3.5 样品测定
吸取供试品溶液各20 μL,注入高效液相色谱仪,按1.3.1节条件进行色谱分析,测定羟基红花黄色素A的峰面积,按外标法计算其含量。
2.1 提取条件的确定
对提取时间、微波功率、提取温度、提取次数等影响微波辅助萃取效果的主要因素进行了考察,确定微波功率 300 W、提取温度 70 ℃、提取时间5 min、提取1 次时,红花植物原料中羟基红花黄色素A的提取率最高。
2.2 色谱条件的优化
2.2.1 流动相的选择
考察了乙腈-水[21]、甲醇-乙腈-0.7%磷酸溶液、乙腈-甲醇、甲醇-水及甲醇-0.05%乙酸溶液[10]等几种流动相系统,结果发现,使用前几种流动相系统,羟基红花黄色素A与其他成分分离度不高,峰形不对称;最终,选择甲醇-0.05%乙酸溶液为流动相,并进行梯度洗脱,羟基红花黄色素A的分离效果得到明显改善,羟基红花黄色素A标准品溶液与供试品溶液色谱图见图1。

图1 羟基红花黄色素A标准品溶液(A)与供试品溶液(B)色谱图
Fig. 1 HPLC chromatograms of HSYA standard solution and sample solution
1.羟基红花黄色素A。
2.2.2 流速的选择
考察0.8、1.0、1.2、1.5 mL/min条件下流速对分离效果的影响。结果表明,流速越大,样品的分离时间越短,但是分离效果不佳,当流速为1.0 mL/min时,分离效果最佳,分离时间较短,故确定1.0 mL/min为最佳流速。
2.2.3 检测波长与柱温的选择
配制羟基红花黄色素A标准品溶液,以超纯水为空白,用紫外-可见分光光度计在200~800 nm扫描范围内进行扫描,发现在403 nm波长处有最大吸收,故确定403 nm为检测波长。改变柱温,考察分离度改善情况,结果发现,柱温为30 ℃时,分离情况最佳,故确定柱温为30 ℃。
2.3 标准曲线线性关系考察结果
在5.25~80.32 mg/mL质量浓度范围内,羟基红花黄色素A的质量浓度与其峰面积呈良好的线性关系,回归方程为Y=49.745X-2.487 5,r=0.999 9。
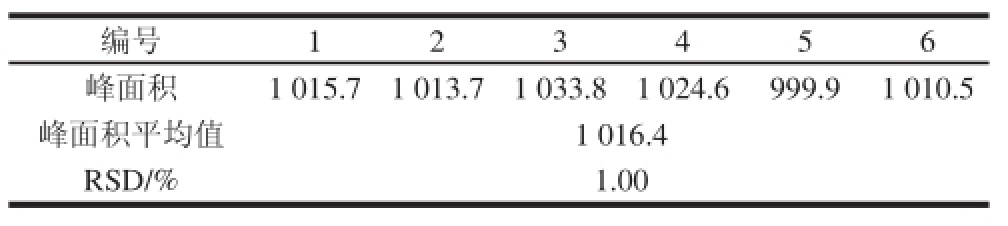
2.4 精密度实验结果
按1.3.4节方法制备供试品溶液6 份,按1.3.1节条件进行羟基红花黄色素A峰面积的测定,结果见表2,相对标准偏差(relative standard deviation,RSD)为1.00%,表明该方法精密度满足分析要求。
表2 精密度实验结果
Table 2 Results of precision test
2.5 稳定性实验结果
按1.3.4节方法制备供试品溶液6 份,按1.3.1节条件,分别在0、12、18、24 h进行羟基红花黄色素A峰面积的测定,结果见表3,其RSD为1.95%,表明供试品溶液,在24 h内稳定。
表3 稳定性实验结果
Table 3 Results of stability test

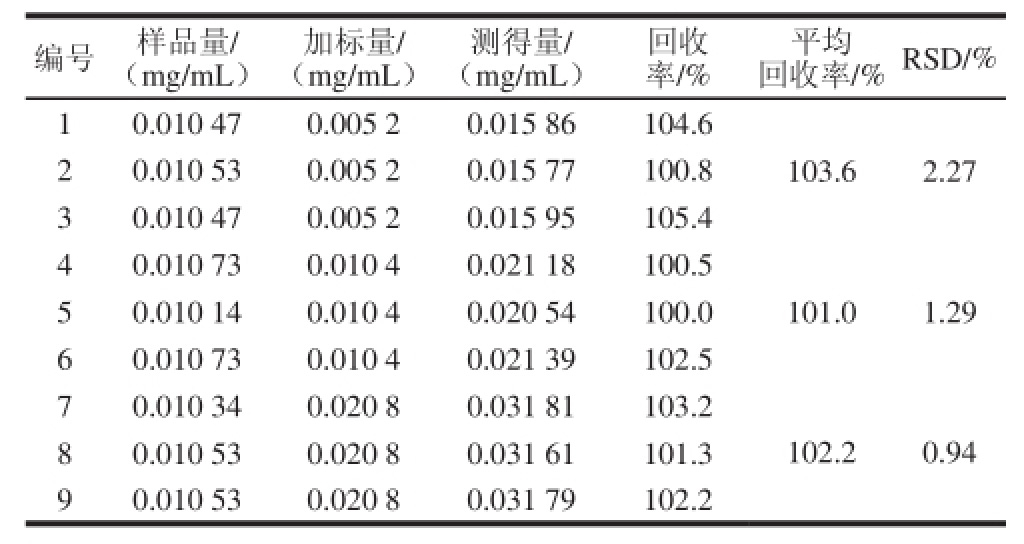
2.6 加标回收率实验结果
准确称取红花植物原料样品,分别加入不同质量的羟基红花黄色素A标准品,按1.3.4节方法制备供试品溶液,测定羟基红花黄色素A含量,计算回收率,结果见表4,加标回收率为101.0%~103.6%,相对标准偏差不大于2.27%,表明该方法准确度高,满足分析要求。
表4 回收率实验结果
Table 4 Results of recovery test
2.7 样品的含量测定结果
准确称取红花植物原料样品1 g,按1.3.4节方法制备供试品溶液,按1.3.1节条件进行羟基红花黄色素A含量的测定,计算得到红花植物原料样品中羟基黄色素A的含量为16.2 mg/g(1.62%)。文献[23]对新疆不同产地的红花植物原料质量进行了比较,得出了32 批新疆不同产地红花中羟基红花黄色素A含量为0.93%~2.25%,与文献比较结果表明,本研究所采集的红花植物原料样品质量属于中等水平。
本研究采用微波辅助萃取法提取红花植物原料样品中有效成分,提取溶剂为纯水,具有易得、绿色、环保、提取效果优异等优点,大大降低了提取溶剂的成本,并减少了环境污染。
本研究采用甲醇-0.05%乙酸溶液为流动相,对药食同源红花植物原料样品中的羟基红花黄色素A进行了梯度洗脱,具有峰形对称、分离时间短、分离效果好等优点,方法学考察结果表明,各项实验达到分析要求,方法简便准确、重复性好,可用于食品、保健品及其复方制剂中羟基红花黄色素A的含量测定。
参考文献:
[1] FAN Lijiao, GUO Meili. Progress of safflower (Carthamus tinctorius L.) regeneration through tissue culture[J]. Journal of Medical Colleges of PLA, 2013, 28: 289-301. DOI:10.1016/S1000-1948(13)60045-3.
[2] 黎大爵. 红花研究的历史、现状与展望[C]//全国红花药用学术会议论文集. 1996: 1-10.
[3] 洪菁. 市售中药材红花的质量探讨[J]. 海峡药学, 2006, 18(5): 106-107. DOI:10.3969/j.issn.1006-3765.2006.05.057.
[4] 曾春萍, 宫晓平, 韩慧琴, 等. 红花药材质量现状分析[J]. 现代中药研究与实践, 2014, 28(4): 67-69.
[5] 郭宇飞, 申丹, 杨洪军. 含红花中药组方规律分析[J]. 中国中医杂志, 2014, 39(11): 2144-2148. DOI:10.4268/cjcmm20141140.
[6] 国家药典委员会. 中华人民共和国药典: 一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 141-142.
[7] 赵明波, 邓秀兰, 王亚玲, 等. 高效液相色谱法测定红花中的羟基红花黄色素A[J]. 色谱, 2013, 21(6): 593-595. DOI:10.3321/ j.issn:1000-8713.2003.06.015.
[8] XIE Mingyong, WANG Huiqin, NIE Shaoping. Study on antioxidant activities of extract of safflower florets (Carthamus tinctorius L.)[J]. 食品科学, 2006, 27(9): 36-40. DOI:10.3321/ j.issn:1002-6630.2006.09.003.
[9] 张娟, 卿德刚, 倪慧, 等. 红花黄色素HPLC指纹图谱研究[J]. 食品科学, 2008, 29(1): 257-259. DOI:10.3321/j.issn:1002-6630.2008.01.054.
[10] 刘红, 郁晓艺, 李炳奇, 等. RP-HPLC法测定保健饮料中羟基红花黄色素A的含量[J]. 食品科学, 2006, 27(2): 232-234. DOI:10.3321/ j.issn:1002-6630.2006.02.053.
[11] ZHOU Mingxue, FU Jianhua, ZHANG Qiong, et al. The effect of hydroxy safflower yellow A on inflammatory reaction in myocardium of the rats after acute myocardial infarction[J]. African Journal of Pharmacy and Pharmacology, 2013, 7(12): 643-649.
[12] KONG Dezhao, XIA Wei, ZHANG Zhe, et al. Safflower yellow injection combined with conventional therapy in Ireating unstable angina pectoris: a meta-analysis[J]. Traditional Chinese Medicine, 2013, 33(5): 553-561.
[13] 王若菁, 杨滨. 红花的化学成分及质量标准研究进展[J].中国实验方剂学杂志, 2007, 13(5): 65-69. DOI:10.3969/ j.issn.1005-9903.2007.05.023.
[14] HARRELKAS F, AZIZI A, YAAEOUBI A, et a1. Treatment of textile dye effluents using coagulation- floceulation coupled with membrane processes or adsorption on powdered activated carbon[J]. Desalination, 2009, 235(1/2/3): 330-339. DOI:10.1016/j.desal.2008.02.012.
[15] 侯世斌, 吕芳, 苏幼红, 等. 抗羟基红花黄色素A抗血清的制备[J]. 食品科学, 2009, 30(3): 150-154. DOI:10.3321/ j.issn:1002-6630.2009.03.033.
[16] ZHANG Liang, LIN Pengcheng, LI Huye. Study on purification of hydroxy safflower yellow A from Carthamus tinctorius L. by macroporus resins[J]. Medicinal Plant, 2010, 1(6): 57-58; 63.
[17] LIAZID A, GUERRERO R F, CANTOS E, et al. Microwave assisted extraction of anthocyanins from grape skins[J]. Food Chemistry, 2011, 124(3): 1238-1243. DOI:10.1016/j.foodchem.2010.07.053.
[18] UPADHYAY R, RAMALAKSHMI K, JAGAN M R L. Microwaveassisted extraction of chlorogenic acids from green coffee beans[J]. Food Chemistry, 2012, 130(1): 184-188. DOI:10.1016/ j.foodchem.2011.06.057.
[19] 李书静, 李可, 姚新建, 等. 微波辅助提取红花黄色素工艺优化[J]. 湖北农业科学, 2013, 52(12): 2891-2893. DOI:10.3969/ j.issn.0439-8114.2013.12.043.
[20] 王秀梅, 韩晓静, 白梅荣, 等. HPLC法测定红花地上部分羟基红花黄色素A和木犀草素的含量[J]. 中国民族民间医药, 2014(8): 29-30.
[21] 兰艺凤, 周璐, 张立伟. HPLC法同时测定红花中5种黄酮成分[J]. 食品科学, 2011, 32(12): 283-286.
[22] 刘建枝, 王栋, 周雪梅. HPLC法测定蒙成药咽炎灵中羟基红花黄色素A的含量[J]. 中国民族医药杂志, 2015, 1(1): 48-49. DOI:10.3969/ j.issn.1006-6810.2015.01.033.
[23] 刘雅新, 刘珊珊, 谭勇, 等. 新疆不同产地红花质量评价[J]. 中成药, 2014, 36(1): 141-144. DOI:10.3969/j.issn.1001-1528.2014.01.034.
Separation and Analysis of Hydroxysafflor Yellow A in Edible and Medical Petals of Safflower Flowers by High Performance Liquid Chromatography
AISANJIANG·Aihaiti, WANG Jin, GUAN Ming*
(College of Chemistry and Chemical Engineering, Xinjiang Normal University, Ürümqi 830054, China)
Abstract: Objective: To e stablish a method for the determination of hydroxysafflor yellow A (HSYA) in medical and edible petals of safflower flowers by high performance liquid chromatography (HPLC). Methods: The HSYA in the safflower flowers was extracted by microwave-assisted extraction, chromatographically separated using gradient elution and analyzed by HPLC. The separation was performed on Sino Chrom ODS-BP column (4.6 mm × 200 mm, 5 μm) using methanol-0.5% acetic acid as the mobile phase at a flow rate of 1.0 mL/min. The analyte was detected at 403 nm. Results: The calibration curve had good linear relationship in the range of 5.25–80.32 μg/mL for safflower yellow A (r = 0.999 9). The spiked recoveries were 101.0%–103.6%, with relative standard deviation (RSD) not exceeding 2.27%. Conclusions: The method was simple and accurate with good repeatability and could be used for the determination of hydroxysafflor yellow A in foods, health products, and compound medicinal preparations.
Key words: safflower (Carthamus tinctorius); hydroxysafflor yellow A; high performance liquid chromatography (HPLC); gradient elution
收稿日期:2015-09-14
基金项目:新疆维吾尔自治区自然科学基金项目(2015211A033);新疆维吾尔自治区研究生科技创新项目(XJGRI2014119)
作者简介:艾散江·艾海提(1989—),男,硕士研究生,主要从事仪器分析新方法研究。E-mail:326821579@qq.com
*通信作者:关明(1974—),男,教授,博士,主要从事仪器分析新方法研究。E-mail:guanm@xjnu.edu.cn
DOI:10.7506/spkx1002-6630-201612027
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)12-0152-04