毛 雪,刘玉梅*
(新疆大学化学化工学院,新疆 乌鲁木齐 830046)
摘 要:采用铁盐催化比色法、硫酸-香草醛法、盐酸-香草醛法和直接紫外分光光度法对13 个品种葡萄枝蔓中原花色素含量进行分析,直接紫外分光光度法选取不同原花色素对照品对测定结果进行比较。通过方法学考察和统计分析,比较不同品种葡萄枝蔓中原花色素分析方法的优缺点。结果发现铁盐催化比色法和香草醛法专一性强,但铁盐催化比色法反应时间长,香草醛法不稳定,而直接紫外分光光度法稳定性好、精密度高、操作简便,适合葡萄枝蔓中原花色素含量的快速测定。采用直接紫外分光光度法比较分析,分别以原花色素对照品、原花色素B1和原花色素B2为标准,发现所得各种葡萄枝蔓中原花色素的含量计算结果差别接近2 倍,说明原花色素对照品的纯度及组成对原花色素含量的分析结果影响明显。
关键词:葡萄枝蔓;原花色素;铁盐催化比色法;香草醛法;直接紫外分光光度法
引文格式:
毛雪, 刘玉梅. 葡萄枝蔓中原花色素的不同分析方法比较及含量分析[J]. 食品科学, 2016, 37(12): 169-175. DOI:10.7506/spkx1002-6630-201612030. http://www.spkx.net.cn
MAO Xue, LIU Yumei. Comparison of analytical methods for the determination of proanthocyanidin in grape vines proanthocyanidin contents of different grape varieties[J]. Food Science, 2016, 37(12): 169-175. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612030. http://www.spkx.net.cn
原花色素是黄烷-3-醇类化合物[1-2],由不同数量的儿茶素、表儿茶素或没食子酸经C4—C6或C4—C8键缩合而成[3-5]。该类化合物具有极强的抗氧化性,其抗氧化活性和清除自由基能力是VC的20 倍、VE的50 倍[6],此外,原花色素具有保护心血管[7]、抗肿瘤、抗辐射、抗炎、改善视觉疲劳及其并发症等药理活性[8],以及抗衰老、抗紫外线、增白、收敛保湿等美容效果[9],因而被广泛用于食品、化妆品、医药等领域,是一种极具开发潜力的天然活性物质[10-11]。已有文献[12]研究了葡萄皮籽中的原花色素,而对葡萄枝蔓中的原花色素鲜有报道。葡萄是多年生藤本植物,为了便于栽培和管理,提高产量和品质,每年都要对枝蔓进行修剪,会产生大量的葡萄枝蔓,这些枝蔓除极少部分留作繁殖苗木外,大部分都被废弃,这样既污染环境又会造成巨大的资源浪费。葡萄是新疆的特产之一,在新疆广泛种植,每年都有大量的葡萄枝蔓产生。因此,分析废弃葡萄枝蔓中原花色素含量对其开发应用具有重要的意义。
关于原花色素的测定在国际上还未有统一的标准方法,常用的有铁盐催化比色法[13]、紫外分光光度法[14]、香草醛法[15-16]、福林肖卡-高效液相色谱(high performance liquid chromatography,HPLC)结合法[17]、钼酸铵分光光度法[18]、硫酸高铈铵分光光度法[19]等。福林肖卡-HPLC结合法需要使用HPLC,过程较复杂,且对样品前处理要求高。钼酸铵分光光度法是基于邻苯二酚和钼酸铵可以生成黄色钼酸酯,此物质在弱酸性条件下能稳定存在,并在波长333 nm处有最大吸收,而原花色素是儿茶素和表儿茶素的单体和低聚体组合而成,其结构中含有邻苯二酚的基团。硫酸高铈铵分光光度法是基于原花青素与Ce4+在强酸性介质中反应生成无色的Ce3+,通过测定黄色高铈盐的吸光度,间接测定原花色素。而铁盐催化比色法、香草醛法、紫外分光光度法均是测定原花色素单体及多聚体的总量。本实验采用铁盐催化比色法、硫酸-香草醛法、盐酸-香草醛法和直接紫外分光光度法(分别选用原花色素对照品、原花色素B1、原花色素B2为标准对照物)对13 个品种葡萄枝蔓中原花色素的含量进行分析,比较上述原花色素分析方法的异同,拟为葡萄枝蔓中原花色素的开发利用提供理论参考。
1.1 材料与试剂
葡萄枝蔓为秋季修剪葡萄植株后的废弃枝蔓,经低温烘干后保存,用时粉碎过筛。品种分别为新疆吐鲁番产区的无核白、马奶子、赤霞珠,新疆玛纳斯产区的佳美、烟73、美乐、贵人香、雷司令、晚红蜜、霞多丽、红提、白诗南、赤霞珠。
原花色素对照品(U V≥9 5%,批号ZD1200LA10)、原花色素B1(HPLC≥97.5%,批号PA0819RC13)、原花色素B2(HPLC≥98%,批号P17J6F1) 上海源叶生物科技有限公司;硫酸铁铵北京化工厂;香草醛 天津市光复精细化工研究所;浓硫酸、浓盐酸 天津化工厂;甲醇 天津永晟精细化工有限公司。以上试剂均为分析纯。
1.2 仪器与设备
RHP-1000A快速开盖型万能高速粉碎机 永康市荣浩工贸有限公司;BS210S型电子天平(读数精度0.1 mg,称量范围0~210 g) 德国赛多利斯公司;UV-5300PC型紫外-可见分光光度计 上海元析仪器有限公司;HH-S4型数显恒温水浴锅 金坛市医疗仪器厂生产;KQ-100VDE型三频数控超声波清洗器 昆山市超声仪器有限公司;B-Ⅲ型循环水式真空泵 郑州长城科工贸有限公司;其他实验室常用玻璃仪器。
1.3 方法
1.3.1 样品处理
经对提取工艺优化,样品提取过程如下:准确称取1 g粉碎的葡萄枝蔓样品,精确到0.000 1 g,加30 mL体积分数50%乙醇溶液,于温度65 ℃条件下超声20 min,再65 ℃水浴保温70 min,过滤,将滤液定容于50 mL容量瓶中。
1.3.2 标准曲线的绘制
1.3.2.1 铁盐催化比色法
准确称取原花色素对照品20.0 mg,用甲醇溶解、定容至10 mL,以此为储备液。取其储备液用甲醇稀释,制成质量浓度为0.047 5~0.475 0 mg/mL的系列标准溶液。分别吸取不同质量浓度标准溶液1.0 mL于10 mL刻度试管中,加入9.0 mL反应混合液,塞紧塞子,摇匀,置于沸水浴中加热40 min后,立即取出用流水冷却4~5 min,取出,恢复至室温后(15 min)测定吸光度A550 nm,绘制吸光度-原花色素质量浓度的标准曲线。
1.3.2.2 硫酸-香草醛法
取1.3.2.1节中储备液用甲醇稀释成质量浓度0.047 5~0.475 0 mg/mL的原花色素系列标准溶液,于试管中依次加入0.5 mL不同质量浓度标准溶液、2.5 mL 30 g/L香草醛-甲醇溶液及2.5 mL体积分数30%硫酸-甲醇(以浓硫酸为基准)溶液,混匀后于30 ℃水浴保温20 min后测定吸光度A500 nm,绘制标准曲线。
1.3.2.3 盐酸-香草醛法
取1.3.2.1节中储备液用甲醇稀释成质量浓度0.047 5~0.475 0 mg/mL的原花色素系列标准溶液,于试管中依次加入0.5 mL不同质量浓度标准溶液、3 mL 30 g/L香草醛-甲醇溶液及1.5 mL浓盐酸溶液,混匀后于20 ℃避光反应15 min后测定吸光度A500 nm,绘制标准曲线。
1.3.2.4 直接紫外分光光度法
准确称取原花色素对照品、原花色素B1、原花色素B2各5.0 mg,用甲醇溶解分别配制成1 mg/mL的标准储备液。分别取其储备液用甲醇稀释,制成质量浓度为0.004 8~0.076 0、0.008 3~0.083 3、0.005 6~0.166 7 mg/mL的系列标准溶液。用甲醇做参比,在波长280 nm处用紫外-可见分光光度计分别测定该系列标准溶液的吸光度,绘制原花色素对照品、原花色素B1、原花色素B2的标准曲线。
1.3.3 样品含量的测定
将1.3.1节中处理后的样品分别按照上述相应标准曲线的方法在规定的波长处测定吸光度,根据对应的标准曲线计算提取液中原花色素的质量浓度C,再换算原花色素的含量。
式中:n为提取液稀释倍数;C为稀释后提取液中原花色素的质量浓度/(mg/mL);V为提取液体积/mL;m为葡萄枝蔓的质量/g。
1.3.4 方法学考察
1.3.4.1 精密度实验
吸取一定量的提取液,分别参考1.3.2节方法重复测定6 次,对精密度进行考察。
1.3.4.2 重复性实验
吸取一定量的提取液,分别参考1.3.2节方法重复测定6 次,对重复性进行考察。
1.3.4.3 回收率实验
精密移取样品提取液3 份,测得其中原花色素含量,加入不同质量浓度的原花色素标准液,分别参考1.3.2节方法对回收率进行考察。
1.3.4.4 稳定性实验
精密移取一定量提取液,分别参考1.3.2节方法每隔一段时间测定一次,对稳定性进行考察。
1.4 数据处理
实验数据的统计分析结果均是采用Microsoft Excel或OriginPro 86专业软件来处理的,实验数据以 ±s表示。
2.1 不同方法的标准曲线
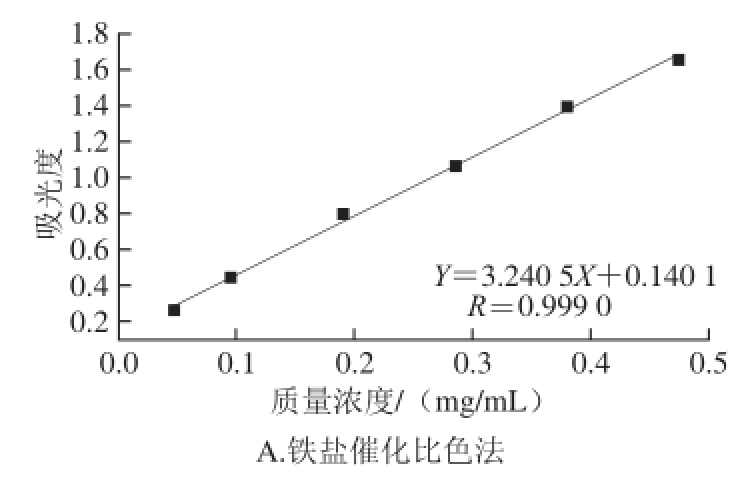
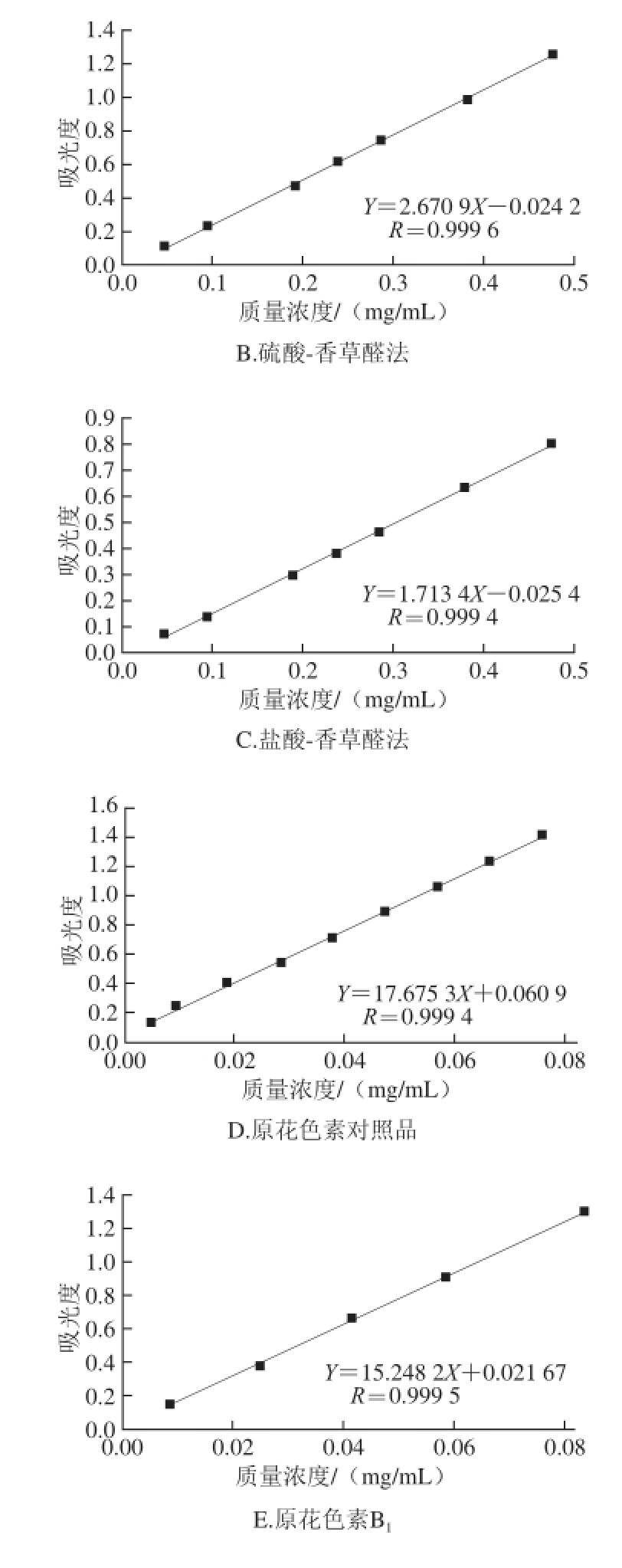
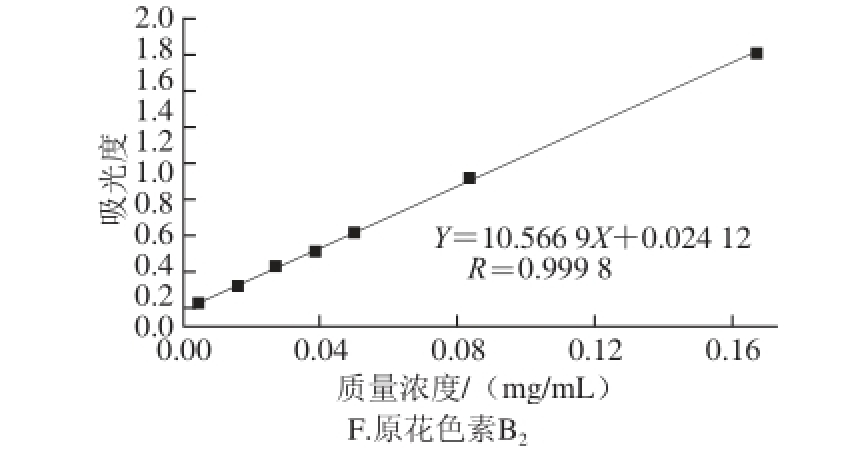
图1 原花色素标准曲线
Fig. 1 Standard curves for the determination of proanthocyanidins using different methods
如图1所示,不同方法原花色素在相应质量浓度范围内吸光度与质量浓度有较好的线性关系。
2.2 方法学考察
2.2.1 精密度实验结果
表1 精密度实验结果
Table 1 Results of precision test
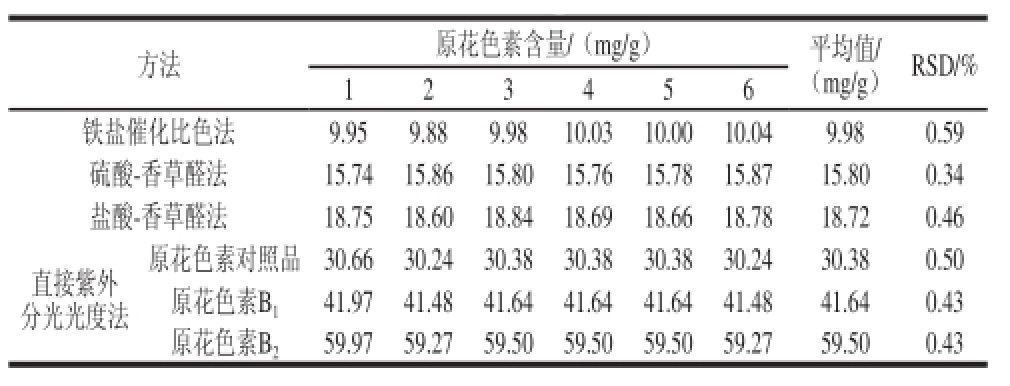
精密度是表示实验的重复性与再现性,高的精密度可保证实验获得良好的准确度。按1.3.4.1节方法,对不同方法的精密度进行考察,如表1所示。不同方法的精密度良好,相对标准偏差(relative standard deviation,RSD)分别为0.59%、0.34%、0.46%、0.50%、0.43%、0.43%,可以满足实验要求。
2.2.2 重复性实验结果
表2 重复性实验结果
Table 2 Results of repeatability test

按1.3.4.2节方法,对方法重复性进行考察,如表2所示。经计算可得,不同方法的RSD分别为0.34%、0.19%、0.17%、0.29%、0.21%、0.21%,结果表明不同方法的重复性良好。
2.2.3 回收率实验结果
表3 回收率实验结果
Table 3 Results of recovery test
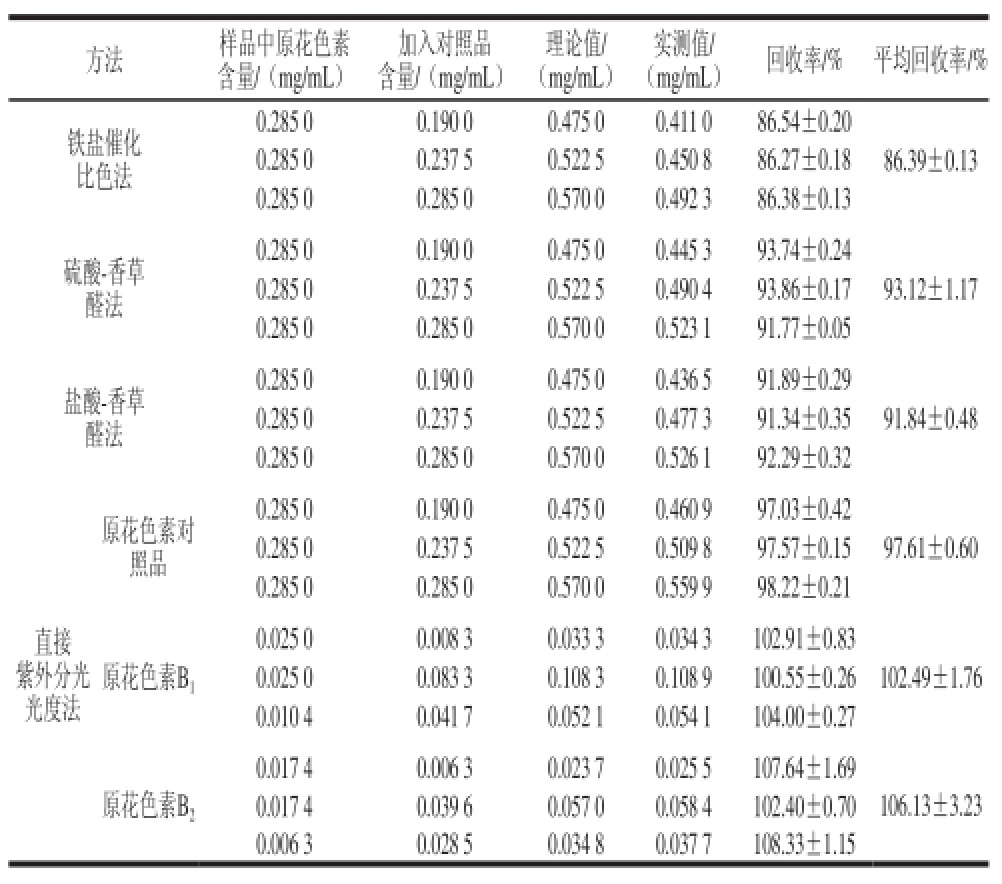
按1.3.4.3节方法对不同方法的回收率进行考察,如表3所示。铁盐催化比色法的回收率为86.27%~86.54%,相对较低,硫酸-香草醛法的回收率为91.77%~93.86%,盐酸-香草醛法的回收率为91.34%~92.29%,直接紫外分光光度法的回收率相对较高,其中原花色素对照品的回收率为97.03%~98.22%,原花色素B1的回收率为100.55%~104.00%,原花色素B2的回收率为102.40%~108.33%,不同方法的回收率均可满足实验要求,作为测定原花色素含量的方法是可行的。
2.2.4 稳定性实验结果

图2 稳定性实验结果
Fig. 2 Results of stability test
按1.3.3.4节方法,对方法稳定性进行考察,计算原花色素含量的变化,如图2所示。直接紫外分光光度法分别选用原花色素对照品、原花色素B1、原花色素B2作为对照品时均比较稳定,在24 h内原花色素的含量几乎保持不变,铁盐催化比色法也相对较稳定,24 h内含量变化不大,而香草醛法稳定性不好,在反应完成2 h之后,含量就有所下降。因此,2种香草醛法对分析要求高,为了保证所有样品的均一性,在要求的反应时间完成后应立即测定,减小误差。
2.3 不同方法测定样品中的原花色素含量
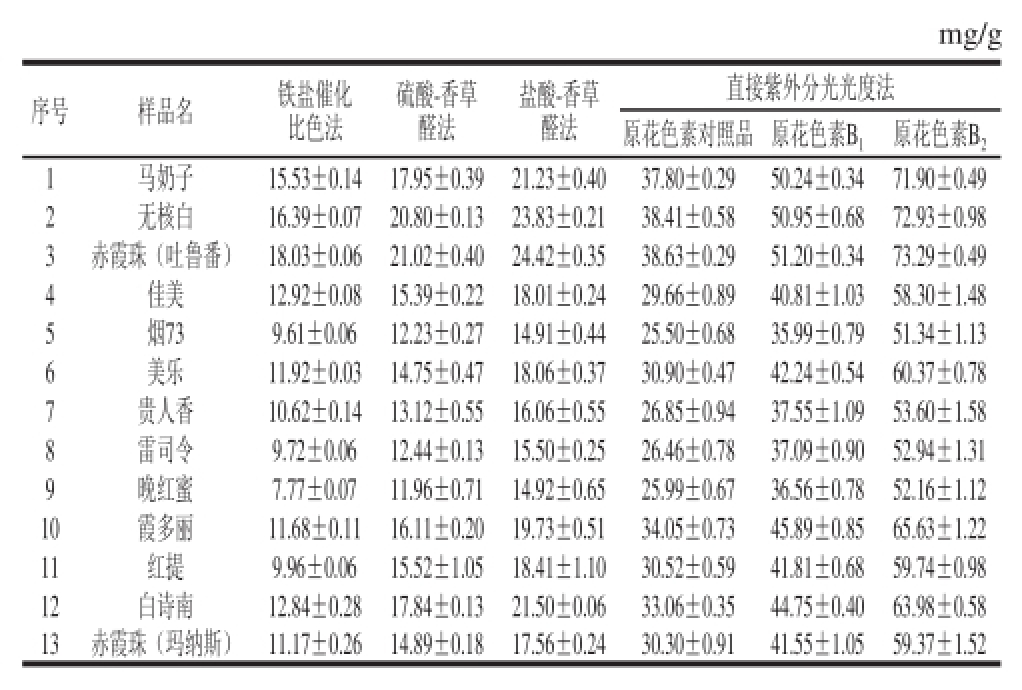
对提取的不同品种葡萄枝蔓的原花色素分别用铁盐催化比色法、硫酸-香草醛法、盐酸-香草醛法及直接紫外分光光度法进行测定,由于原花色素是由不同的单体及聚合体形成的多酚化合物,不同的对照品对应的测定结果有差异。为考察测定结果,本实验还分别比较了常见的原花色素对照品、原花色素B1、原花色素B23个不同的对照品来计算样品中原花色素的含量。不同品种葡萄枝蔓中提取的原花色素含量的检测结果如表4所示。所有测试样品直接紫外分光光度法的测定结果均显著高于其他3种方法,而直接紫外分光光度法中原花色素总量以原花色素B2计算所得含量最高,接近原花色素对照品计算值的2 倍,原花色素B1计算值居于这两者之间,说明采用直接紫外分光光度法测定总原花色素含量时,对照品的纯度和组成与测定结果的高低有非常直接的关系。铁盐催化比色法测定的结果相对较低,但与硫酸-香草醛法和盐酸-香草醛法的测定结果相对比较接近。直接紫外分光光度法测定时,由于干扰物质较多,因此测定结果会偏高。
表4 不同品种葡萄枝蔓中原花色素含量测定结果
Table 4 Determination of proanthocyandin contents in grape vines from different varieties
2.4 方差分析法评价不同方法对不同品种葡萄枝蔓中原花色素含量的测定结果准确性的影响
表5 不同方法对原花色素含量的测定结果
Table 5 Analytical results for the determination of proanthocyandins in grape vines from different varieties with different methods
续表5 mg/g
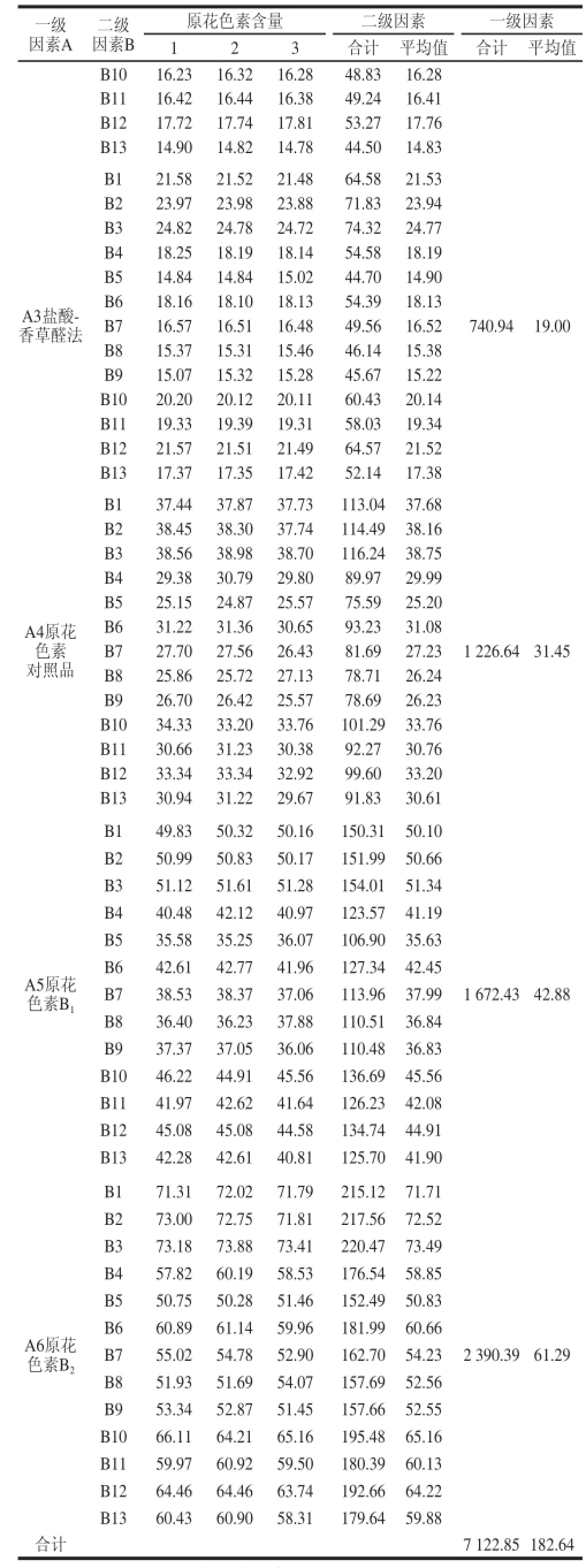
注:二级因素为葡萄枝蔓品种,序号见表4。
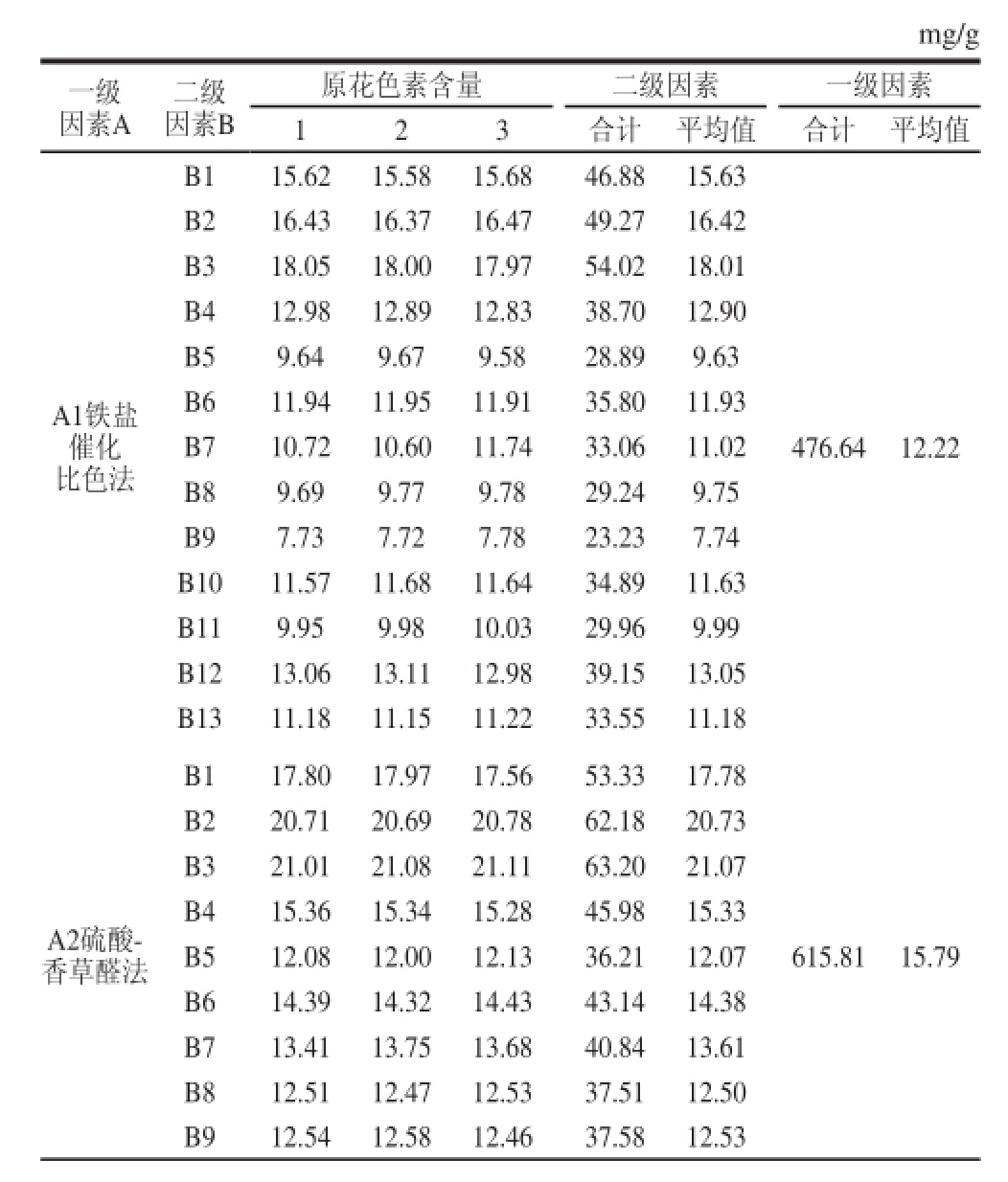
对不同品种葡萄枝蔓中原花色素含量测定所得到的实验数据,采用两因素系统分组的实验数据模式进行方差分析,以比较各方法所得测定结果的差异显著性[20-21],如表5所示。
表6 不同测定方法所得原花色素含量的方差分析
Table 6 Analysis of variance of proanthocyandin contents with assays and grape varieties

注:**.差异极显著。
如表6所示,同一方法对不同样品所得的测定结果的F值大于响应的临界值,表明同一测定方法测定不同的样品的差异极显著,说明不同葡萄品种其枝蔓中原花色素的含量多少是不同的。而不同测定方法对同一样品的分析结果也表明方法间的差异极显著。为进一步考察各方法间的差异影响,有必要对几种方法之间测定结果进行多重比较。采用最短显著极差值(shortest significant ranges,SSR)又称新复极差检验。
因为对一级因素(测定方法)进行F检验时是以对不同品种样品均方作为分母,样品的重复测定总数为39,计算可得测定结果的标准误为1.337 1。以自由度DFB(A)= 72,查表得的秩次k=2、3、4、5、6时所对应的SSR0.05和SSR0.01,与标准误相乘,求出相应的最小显著极差值(the least significant ranges,LSR),LSR0.05和LSR0.01,结果见表7。
表7 SSR值与LSSRR值
Table 7 Shortest significant ranges and least significant ranges
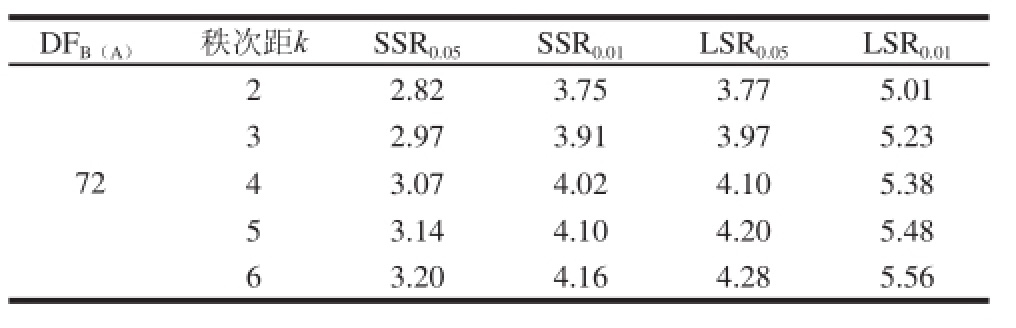
表8 测定方法对不同样品测定结果的多重比较表(新复极差法)
Table 8 Multiple comparisons of determination results (new multiple range method)

注:**.差异极显著(P<0.01)。
SSR法所得的几种测定方法间的多重比较结果见表8。原花色素B2、原花色素B1、原花色素对照品与铁盐催化比色法、硫酸-香草醛法、盐酸-香草醛法所得的测定结果有极显著差异,原花色素B2、原花色素B1与原花色素对照品所得的测定结果也有极显著差异。盐酸-香草醛法与硫酸-香草醛法、硫酸-香草醛法与铁盐催化比色法所得的测定结果之间差异不显著,而盐酸-香草醛法与铁盐催化比色法所得的测定结果也有极显著差异。
铁盐催化比色法通常选择正丁醇和盐酸为反应介质,以Fe3+为催化剂,原花色素在热酸作用下使单体与单体之间的C—C键断裂能产生红色物质,并用分光光度法进行测定以确定其含量。香草醛法是基于原花色素在酸性条件下,A环的化学活性较高,其上的间苯二酚或间苯三酚可与香草醛发生缩合,产物在浓酸作用下会形成有色的正碳离子,测定吸光度从而计算含量的,盐酸和硫酸都可作为反应过程的催化剂[22]。但是硫酸-香草醛法中硫酸加入时会产生很高的热量,从而使原花色素氧化分解,造成测定结果偏低。直接紫外分光光度法是因为原花色素中含有苯环及共轭双键结构,而可见光、紫外光照射具有这些结构的有机化合物时,由于物质分子中价电子跃迁对辐射的吸收,从而产生了化合物的可见-紫外吸收光谱,因此采用直接紫外分光光度法测定其含量[23]。
比较不同方法测定不同品种葡萄枝蔓中原花色素的含量,结果显示,直接紫外分光光度法测定的结果高于其他3种方法,均在25.50 mg/g以上。一般对照品含量的确定是有相应的测定方法,依据同样的测定方法检测之后确定其纯度的,不同的对照品也许确定其纯度时所选的测定方法不同,因此直接紫外分光光度法中选择不同的对照品时测定的含量也有所不同。铁盐催化比色法测定结果相对较低,在7.77~18.03 mg/g之间,与硫酸-香草醛法的测定结果相差不明显,却明显小于盐酸-香草醛法的测定结果;而盐酸-香草醛法的测定结果则与硫酸-香草醛法的测定结果无显著差异;而直接紫外分光光度法的测定结果远高于上述3种方法。原因可能是在波长280 nm处,直接紫外分光光度法干扰物质多,样品中的其他物质影响较大,造成测定结果偏高;而香草醛法和铁盐催化比色法反应要求高,专一性强,在反应的过程中可能会有一定的损失,使得测定结果低于直接紫外分光光度法。上述几种方法均有良好的精密度和重复性,其中香草醛法稳定性不好,铁盐催化比色法反应时间较长,相对而言,直接紫外分光光度法稳定性好,操作简单,更适合葡萄枝蔓中原花色素含量的快速测定。
参考文献:
[1] PRIEUR C, RIGAUD J, CHEYNIER V, et al. Oligomeric and polymeric procyanidins from grape seeds[J]. Phytochemistry, 1994, 36(3): 781-784. DOI:10.1016/S0031-9422(00)89817-9.
[2] 苏越, 贺明睿, 史铁嘉. 葡萄籽中原花青素的检测[J]. 品牌与标准化, 2011(10): 60-61. DOI:10.3969/j.issn.1674-4977.2011.10.049.
[3] LELONO R A, TACHIBANA S. Bioassay-guided isolation and identification of antioxidative compounds from the bark of Eugenia polyantha[J]. Pakistan Journal of Biological Sciences, 2013, 16(16): 812-818.
[4] 高德艳, 胡文效, 魏彦锋, 等. 葡萄籽中原花青素的提取与分离[J]. 中外葡萄与葡萄酒, 2013(1): 6-11. DOI:10.3969/ j.issn.1004-7360.2013.05.001.
[5] SARNOSKI P J, JOHNSON J V, REED K A, et al. Separation and characterization of proanthocyanidin in Virginia type peanut skins by LC-MSn[J]. Food Chemistry, 2012, 131(3): 927-939. DOI:10.1016/ j.foodchem.2011.09.081.
[6] FRACASSETTI D, COSTA C, MOULAY L, et al. Ellagic acid derivatives, ellagitannins, proanthocyanidins and other phenolics, vitamin C and antioxidant capacity of two powder products from camu-camu fruit (Myrciaria dubia)[J]. Food Chemistry, 2013, 139(1/2/3/4): 578-583. DOI:10.1016/j.foodchem.2013.01.121.
[7] NISHIZUKA T, FUJITA Y, SATO Y, et al. Procyanidins are potent i nhibitors of LOX-1: a new player in the French Paradox[J]. Proceedings of the Japan Academy Series B, Physical and Biological Sciences, 2011, 87(3): 104-108. DOI:10.2183/pjab.87.104.
[8] 暴悦梅, 佟永薇, 章勤学. 葡萄籽中原花青素的研究[J].食品研究与开发, 2010, 31(1): 185-186. DOI:10.3969/ j.issn.1005-6521.2010.01.057.
[9] 刘荣丽. 保健食品中原花青素的分析及缓解视疲劳功效研究[D]. 福州: 福建中医药大学, 2014.
[10] ZHANG Huiwen, YANG Yumei, MA Chaomei, et al. Structures and antioxidant and intestinal disaccharidase inhibitory activities of A-type proanthocyanidins from peanut skin[J]. Journal of Agricultural and Food Chemistry, 2013, 61(37): 8814-8820. DOI:10.1021/jf402518k.
[11] 张华, 曾桥. 原花青素功能及应用进展[J]. 安徽农业科技, 2011, 39(9): 5349-5350. DOI:10.3969/j.issn.0517-6611.2011.09.115.
[12] 王卫东, 李超, 凌莉. 葡萄籽原花青素的提取与分离[J]. 中国食品添加剂, 2010(3): 84-89. DOI:10.3969/j.issn.1006-2513.2010.03.014.
[13] 傅武胜, 蔡一新, 林丽玉. 铁盐催化比色法测定葡萄籽提取物中原花青素的研究[J]. 食品与发酵工业杂志, 2001, 27(10): 57-61.
[14] 傅武胜, 赵道辉, 黄剑锋. 紫外分光光度法测定葡萄籽提取物中的原花青素含量[J]. 食品研究与开发, 2002, 23(12): 90-92. DOI:10.3969/j.issn.1005-6521.2002.06.043.
[15] BROADHURST R B, JONES W T. Analysis of condensed tannins using acidified vanillin[J]. Journal of the Science of Food and Agriculture, 1978, 29(9): 788-794. DOI:10.1002/jsfa.2740290908.
[16] 孙芸, 谷文英. 硫酸-香草醛法测定葡萄籽原花青素含量[J]. 食品与发酵工业, 2003, 29(9): 43-46. DOI:10.3321/j.issn:0253-990X.2003.09.011.
[17] 邵云东, 高文远, 苏艳芳, 等. 葡萄籽提取物的质量标准[J].中国中药杂志, 2005, 30(18): 1406-1408. DOI:10.3321/ j.issn:1001-5302.2005.18.003.
[18] 马亚军, 杨秉勤, 郎惠云. 钼酸铵分光光度法测定葡萄籽提取物中的原花青素[J]. 食品科学, 2003, 24(5): 135-137. DOI:10.3321/ j.issn:1003-7969.2003.03.020.
[19] 马亚军, 郎惠云, 贾婴琦. 硫酸高铈铵分光光度法测定葡萄籽提取物中原花青素[J]. 分析试验室, 2004, 23(4): 42-44. DOI:10.3969/ j.issn.1000-0720.2004.04.013.
[20] 李春喜, 姜丽娜, 邵云, 等. 生物统计学[M]. 3版. 北京: 科学出版社, 2005.
[21] 刘玉梅. 紫草中羟基萘醌总色素的分光光度定量方法研究[J]. 药物分析杂志, 2011, 31(6): 1140-1145.
[22] 姚开, 何强, 吕远平, 等. 葡萄籽中原花青素含量不同测定方法比较[J].化学研究与应用, 2002, 14(2): 230-232.
[23] 温普红, 王晓玲. 紫外法测定葡萄籽中花青素的含量[J].西北药学杂志, 2000, 15(4): 155-158. DOI:10.3969/ j.issn.1004-2407.2000.04.008.
Comparison of Analytical Methods for the Determination of Proanthocyanidin in Grape Vines Proanthocyanidin Contents of Different Grape Varieties
MAO Xue, LIU Yumei*
(College of Chemistry and Chemical Engineering, Xinjiang University, Ürmüqi 830046, China)
Abstract: The contents of proanthocyanidins in grape vines from 13 different varieties were analyzed by four different methods, namely ferric ion catalysis-colorim etry, H2SO4-vanillin assay, HCl-vanillin assay and UV spectrophotometry. The quantitative determination by UV spectrophotometry was carried out using 3 different proanthocyanidin reference substances. The methodological evaluation and statistical analysis showed that ferric ion catalysis-colorimetry was timeconsuming and vanillin assays had poor stability, though both methods had a high specificity. On the other hand, the UV spectrophotometric method was more stable, precise and convenient. For all 13 grape varieties tested, there was an approximately 2-fold difference in proanthocyanidin contents in grape vines assayed by UV spectrophotometry using 3 different reference substances. As a result, the purity and composition of reference substances had a significant influence on the results of proanthocyanidins determination.
Key words: grape vine; proanthocyanidins; ferric ion catalysis-colorimetry; vanillin assay; UV spectrophotometry
收稿日期:2015-10-03
作者简介:毛雪(1989—),女,硕士研究生,研究方向为分析化学。E-mail:gsjcmx@163.com
*通信作者:刘玉梅(1965—),女,教授级高级工程师,博士,研究方向为食品功能因子。E-mail:xjdxlym@163.com
DOI:10.7506/spkx1002-6630-201612030
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)12-0169-07