朱文冉,王 欣*,陈利华
(上海理工大学食品质量与安全研究所,上海 200093)
摘 要:研究掺杂不同比例猪油对花生油脂肪酸组成及低场核磁弛豫特性的影响,并分析了二者的相关性。结果表明:随猪油比例的增加,掺杂样品中饱和脂肪酸含量显著增加,掺杂参数(adulteration parameter,AP)减小;单组分弛豫时间(T2W)线性减小;掺杂比例大于30%时,T21显著下降后一直保持不变,T22变化不显著;S21、S22分别呈线性增加和减小趋势,且在掺杂比例大于50%后变化显著。掺杂猪油的样品在主成分分布图上呈从右上角到左下角的分布趋势,当掺杂比例大于20%,掺杂油样与花生油样品可明显区分。样品的低场核磁特性主成分综合得分(F值)与AP值间具有较好的相关性(R2=0.969),研究表明可通过样品的低场核磁弛豫特性预测脂肪酸组成的变化情况,从而快速判别其品质。
关键词:猪油;花生油;掺杂;脂肪酸组成;弛豫特性
朱文冉, 王欣, 陈利华. 掺杂猪油比例对花生油脂肪酸组成及LF-NMR弛豫特性的影响[J]. 食品科学, 2016, 37(12): 176-181. DOI:10.7506/spkx1002-6630-201612031. http://www.spkx.net.cn
ZHU Wenran, WANG Xin, CHEN Lihua. Effect of lard adulteration proportion on the fatty acid composition and LFNMR relaxation characteristics of peanut oil[J]. Food Science, 2016, 37(12): 176-181. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612031. http://www.spkx.net.cn
油脂掺伪、掺杂现象依然是当前油脂品质安全中一个亟待解决的问题[1-3]。如国外文献中关于橄榄油中掺杂低价植物或动物油的检测有较多的研究[4]。而在国内,花生油是一种深受消费者喜爱的,脂肪酸组成合理的优质食用植物油[5]。前期发现,在利益的驱使下,部分不法商贩会向一些价格较高的植物油中掺杂价格相对较低的油脂,甚至利用花生油在较低温度条件下易凝结的特性向其中掺入猪油。这不但存在一定的价格欺诈,也对消费者的身心健康存在一定的负面影响。因此,如何快速有效地鉴别花生油的品质及掺杂程度对于保障消费者的食品安全具有重要的意义。
为了应对当今市场上复杂的油脂的掺伪、掺杂问题,在传统的理化指标检测的基础上,众多研究者也从不同的角度进行了有益探索。如潘磊庆等[6]研究了应用电子鼻检测芝麻油的掺假情况,发现该技术能实现对掺杂50%以上的大豆油、玉米油及70%葵花籽油的芝麻油样品进行有效区分。Peng Dan等[7]发现应用气相色谱-质谱结合多元统计分析可区分掺杂5%低价植物油的芝麻油样品。Rohman等[8]则发现应用傅里叶转换红外光谱可实现对橄榄油掺杂1%以上棕榈油的区分。总体而言,国内外相关研究主要集中于橄榄油[9-12]、芝麻油[13-14]等油的掺伪检测研究。而对于花生油的掺伪检测研究还相对较少,需要开展进一步的探索研究。
近年来,基于被测样品中氢质子的核磁共振特性,且检测过程简便、快速的氢谱低场核磁共振(1H low field nuclear magnetic resonance,1H LF-NMR)技术在油脂的品质监控领域崭露头角[15]。如Zhang Qing等[16]的研究发现食用植物油的弛豫时间主要与其脂肪酸组成有关,煎炸废油掺杂比例的增加,其对应的弛豫峰的峰面积线性增大。赵婷婷等[17]应用LF-NMR研究了煎炸猪油掺杂比例对猪油脂肪酸含量的影响,发现弛豫特性与脂肪酸之间存在较好的相关性。王永巍[18]、周凝[19]等应用LF-NMR分别对煎炸油和米糠毛油掺杂食用植物油进行研究,发现S21峰面积与劣质油脂掺杂量的增加呈线性增加趋势。但是对于掺杂猪油的花生油的低场核磁弛豫特性还没有研究。
基于以上分析,在前期研究的基础上,本实验拟着重就掺入不同比例猪油的花生油样品的脂肪酸组成及其低场核磁弛豫特性的变化规律进行研究,并分析二者的相关性,以期为应用LF-NMR技术快速定性定量检测花生油掺杂猪油程度提供可靠依据。
1.1 材料与试剂
花生油 山东鲁花集团有限公司;大8纯香系列猪油 益海嘉里食品工业有限公司。
脂肪酸甲酯标准品(37种脂肪酸甲酯混标)美国O2SI公司;甲醇、异辛烷、硫酸氢钠、氢氧化钾(均为分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
NMI-20型核磁共振分析仪(氢谱、磁体强度(0.5±0.08)T、共振频率23 MHz、磁体温度32 ℃、配套T-invfit反演拟合软件和Φ15 mm核磁试管) 上海纽迈电子科技有限公司;HH.S21型恒温水浴锅 上海博讯实业有限公司;7890N-5975C气相色谱-质谱联用仪美国安捷伦公司。
1.3 方法
1.3.1 样品的制备
将实验中的花生油定义为0%掺杂的对照1,猪油定义为100%掺杂的对照2,按照体积百分比在花生油中加入一定量的猪油(50 ℃水浴至融为液态),制备猪油掺杂比例为10%~90%的掺杂油样,充分振荡使其混合均匀后,在4 ℃冰箱内存放备。
1.3.2 低场核磁弛豫特性的检测
准确移取2.6 mL待测样品于核磁试管中,50 ℃水浴30 min至油样完全液化,振荡1 min使油样均质,立即置于核磁探头中,选择CPMG脉冲序列,在如下检测参数条件下采集信号:重复采样时间2 000 ms、半回波时间250 μs、回波个数6 000 个、重复扫描次数4 次、谱宽250 kHz。
1.3.3 气相色谱-质谱联用检测
油脂脂肪酸甲酯化方法:参照GB/T 17376—2008《动植物油脂脂肪酸甲酯制备》[20]。
气相色谱检测条件:毛细管色谱柱 D B-5 (50 mm×0.25 mm,0.25 μm),柱温采用程序升温:初始温度60 ℃,以10 ℃/min 程序升温至180 ℃,保持10 min,再以5 ℃/min程序升温至270 ℃,保持5 min,载气为高纯氦气,流速3.0 mL/min,进样口温度260 ℃,进样量1 μL,不分流。
质谱检测条件:电子电离源,离子源温度230 ℃,电子电离能70 eV,四极杆温度150 ℃,定性分析为全扫描方式,质量数扫描范围50~650 u。
对对照1、2进行气相色谱-质谱分析,利用脂肪酸甲酯标准品内脂肪酸甲酯的峰保留时间,同时结合质谱离子扫描对样品内脂肪酸种类进行定性判断,并采用峰面积归一化法计算各脂肪酸的含量。
考虑到油脂掺杂过程中无化学反应产生,掺杂油样各脂肪酸的相对含量可通过计算得到[21-22],继而为了更加准确地反映掺杂样品中主要脂肪酸的变化,参考Xie Jia等[23]提出的油脂掺杂参数(adulteration parameter,AP)值的思想建立本研究中AP值计算公式。并根据公式计算出各掺杂花生油样品的AP值。
1.4 数据分析
利用T-invfit反演软件对低场核磁共振仪测量得到的自由诱导指数衰减曲线进行反演拟合,可得到到油样的多组分弛豫图谱(T2),获知如弛豫时间(按出峰时间从小到大命名为T21、T22……T2i)、峰比例面积(S21、S22……S2i)等多组分弛豫特征参数数据,把样品看作一个整体组分分析时,可得到样品的单组分弛豫时间(T2W)。
应用SPSS 18.0软件对数据进行统计分析,并应用Origin 8.0软件进行图形绘制及线性拟合。
1.4.1 显著性分析和主成分分析
利用SPSS对低场核磁数据进行显著性分析。以对照1的低场核磁数据(图中用a表示)为标准,各掺杂油样与之比较,具有显著性变化的用*标注。
利用SPSS 18.0和Origin 8.0软件对低场核磁数据进行主成分分析,并根据主成分的得分系数计算出主成分得分(Z值)以及综合得分(F值)。
1.4.2 相关性分析
为了分析含有一定比例猪油的掺杂油样LF-NMR弛豫特性与其脂肪酸变化间的相关性,应用Origin 8.0对样品LF-NMR弛豫特性的F值与掺杂花生油样品的AP值进行相关性分析。
1.4.3 相关性模型的验证
配制猪油掺杂比例为15%、35%、55%、75%、95%的样品进行LF-NMR横向弛豫时间(T2)的检测并进一步获知其F值,应用1.4.2节得到的相关性模型获得其预测AP值,并与参照1.3.3节方法获得的真实AP值相比较,以验证模型的可靠性。
2.1 掺杂油样的脂肪酸组成分析
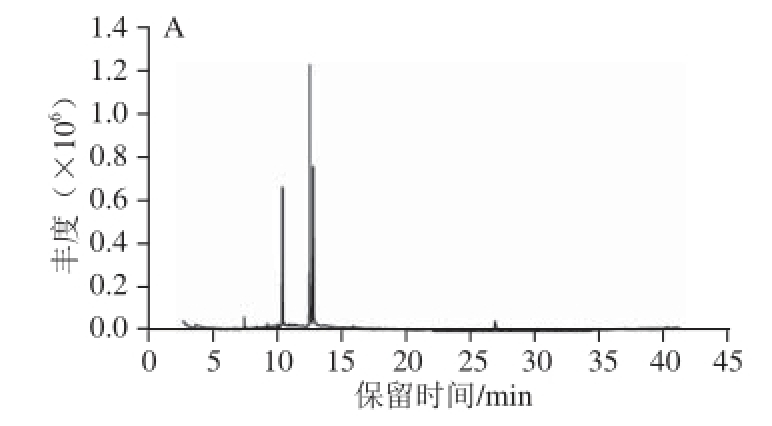
油脂的主要成分是三油酸甘油酯[24],了解油脂中各脂肪酸的含量变化对于研究油脂的掺杂程度具有重要的意义。花生油和猪油主要的脂肪酸甲酯色谱图如图1所示。


图1 花生油(A)和猪油(B)的脂肪酸甲酯色谱图
Fig. 1 Chromatogram of fatty acid methyl esters (FAME) of peanut oil (A) and lard (B)
如图1所示,花生油和猪油的脂肪酸甲酯色谱图上特征峰的出峰时间和个数基本一致,说明二者的主要脂肪酸种类相似,但峰的丰度不同,说明各脂肪酸的含量不同。
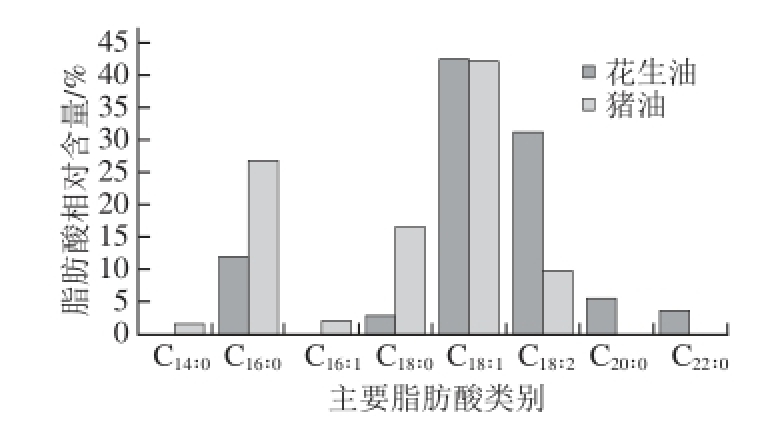
图2 花生油和猪油的主要脂肪酸组成比较
Fig. 2 Main fatty acid compositions of peanut oil and lard
由图2可知,花生油主要的脂肪酸有油酸(C18∶1,42.52%)、亚油酸(C18∶2,31.24%)、棕榈酸(C16∶0,11.94%)、花生四烯酸(C20∶0,5.35%)、山嵛酸(C22∶0,3.61%)、硬脂酸(C18∶0,2.74%);而猪油中的主要脂肪酸为油酸(C18∶1,42.12%)、棕榈酸(C16∶0,26.93%)、硬脂酸(C18∶0,16.45%)、亚油酸(C18∶2,9.66%)、棕榈油酸(C16∶1,2.02%)、肉豆蔻酸(C14∶0,1.46%)。比较后可以发现,花生油和猪油中的油酸相对含量相近,且所占比例均最多为42.00%左右。花生油中的亚油酸相对含量(31.24%)远远高于猪油中亚油酸的相对含量(9.66%),而猪油中棕榈酸(26.93%)、硬脂酸(16.45%)相对含量则远远高于花生油(11.94%,2.74%),综合考虑,可以尝试利用亚油酸、棕榈酸和硬脂酸来反映掺杂样品中主要脂肪酸的变化情况,得到猪油掺杂的花生油样品的掺杂参数AP值,计算公式(1)如下所示:
公式中的脂肪酸(如棕榈酸)指其相对含量;根据公式计算出掺杂样品的各主要脂肪酸的相对含量和AP值,结果如表1所示。
表1 掺杂样品的主要脂肪酸相对含量及AP值
Table 1 Fatty acid composition and AP values of peanut oils adulterated with lard

由表1可知,随着猪油掺杂比例的增加,掺杂油样的肉豆蔻酸(C14∶0)、棕榈酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)呈增加趋势,油酸(C18∶1),亚油酸(C18∶2)、花生酸(C20∶0)、山嵛酸(C22∶0)呈减小趋势,整体而言,饱和脂肪酸含量相对增加,而不饱和脂肪酸含量相对减少,掺杂参数AP值呈减小趋势。
2.2 掺杂油样的低场核磁弛豫特性
2.2.1 T2多组分图谱

图3 掺杂猪油比例对花生油T2多组分弛豫图谱的影响
Fig. 3 Effects of lard concentration on the multi-component relaxation of peanut oil samples
如图3所示,对照1(花生油)和对照2(猪油)均出现了2 个弛豫峰,但是猪油的多组分弛豫峰起时间相对要稍晚,且其峰顶点的信号幅值相对较小。随猪油掺杂比例的增加,两个弛豫峰顶点的信号幅值均逐渐减小。掺杂样品的弛豫时间和信号幅值反映了样品中氢质子的运动速度和强弱,随猪油掺杂比例的增加,样品体系中饱和脂肪酸含量增加,即受双键影响的氢质子数量减少,氢质子运动频率加快,加之黏度相对变大,导致弛豫时间相对缩短。
2.2.2 掺杂油样的LF-NMR弛豫特性参数变化
进一步分析掺杂油样的单组分弛豫时间(T2W)、多组分弛豫时间(T21、T22)以及峰面积(S21、S22),随猪油掺杂比例的变化,结果如图4所示。

图4 掺杂样品的T2W(A)、T21(B)、T22(C)、S21(D)、S22(E)变化规律
Fig. 4 Evolution of the peak area T2W(A), T21(B), T22(C), S21(D) and S22(E) of peanut oils adulterated with lard
a.对照;*.与对照相比,差异显著。
由图4A可知,随猪油掺杂比例的增加,单组份弛豫时间(T2W)呈线性减小趋势(R2=0.961)。在掺杂比例低于20%时,多组分弛豫时间T21变化不明显(图4B),但当掺杂比例大于30%时,则T21显著下降至49.77 ms后一直保持不变。这是因为,猪油掺杂比例的增加使体系中的饱和脂肪酸含量相对升高,即体系中不受双键影响的氢质子含量相对增加,其弛豫相对较快,主要体现在T21峰中,表现为弛豫时间缩短[25]。而T22则在掺杂过程中保持不变(图4C)。这可能与其所表征的脂肪酸分子上不饱和双键及相邻位置上的氢质子的核磁响应有关,从表3可以发现,油酸在此部分中所占比例较大,且掺杂过程中整体变化较小,故弛豫时间整体变化亦不大。
从各弛豫峰的峰面积比例来看,随猪油掺杂比例的增加,S21(图4D)由63.68%线性增加至69.10% (R2=0.936),而S22(图4E)则从36.72%线性减少至30.37%(R2=0.972),且当掺杂比例大于50%时都变化显著,这也进一步说明了T21峰与饱和脂肪酸的变化密切相关,随着猪油掺杂比例的增加,饱和脂肪酸如棕榈酸、硬脂酸等的含量增加,其相关氢质子的核磁响应亦增强,峰面积比例增大;而不饱和脂肪酸,如亚油酸含量的降低,则使反映不饱和脂肪酸的T22峰对应的S22相应减小。
2.2.3 掺杂油样LF-NMR数据的主成分分析
对掺杂油样LF-NMR弛豫特性(T2W、T21、S21、S22)标准化后,进行主成分分析,获得的各主成分贡献率如表2所示。
表2 主成分贡献率
Table 2 Contribution ratios of the principal components

由表1可知,主成分1的特征值大于1,且其贡献率高达85.462%,说明主成分1能够反映原始变量(低场核磁弛豫特性)85.462%的信息,因此可选取主成分1进一步分析,获得各LF-NMR弛豫参数在主成分1的得分系数,并得到主成分1的Z值表达如式(2)所示:
Z=0.52T2W+0.45T21-0.51S21+0.52S22 (2)
进而计算得到各掺杂油样的Z值,并绘制图,如图5所示。

图5 掺杂油样的主成分得分图
Fig. 5 Principal component score plot for peanut oils adulterated with lard
由图5可知,花生油(对照1,0%)位于第1象限,而猪油(对照2,100%)则位于第3象限,随着猪油掺杂比例的增加,样品在主成分1上的得分逐渐减小,其在图上呈从右上角到左下角的分布趋势,掺杂油样介于花生油和猪油之间。当掺杂比例小于20%时,掺杂油样与花生油难以清晰区分,掺杂比例大于20%后,掺杂油样与对照1可明显的区分。
将Z值乘以相应的方差贡献率(85.462%)即可得到样品基于LF-NMR弛豫特性的F值,可以综合反映掺杂油样的LF-NMR弛豫特性变化规律,简化分析步骤。
2.3 F值与AP值的相关性

图6 掺杂油样的F值与AP值的相关性
Fig. 6 Correlation between F values and AP values of peanut oils adulterated with lard
由图6可知,随样品F值的增大,其AP值亦线性升高,二者间存在良好的相关性(R2=0.969),说明可以通过样品的低场核磁弛豫特性有效表征掺杂油样的脂肪酸变化情况,从而反映花生油中是否掺杂猪油及其掺杂程度。
2.4 相关性模型的验证
为了验证2.3节方法中掺杂油样品的F值与掺杂参数(AP值)相关性模型的可靠性,按照1.4.3节对模型进行实验验证,结果如图7所示。
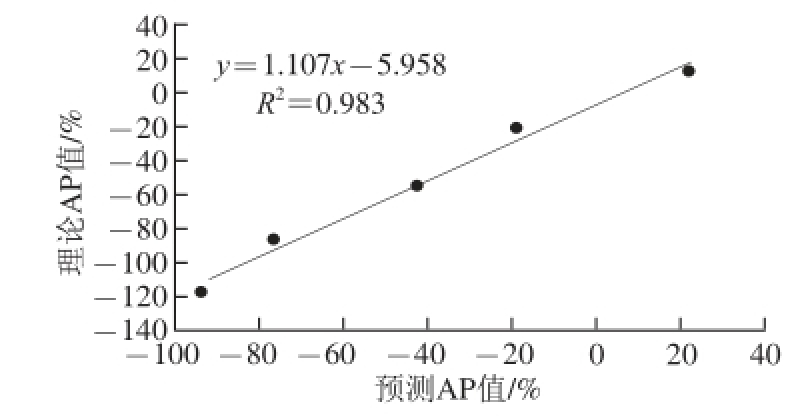
图7 AP值预测值与理论值的关系
Fig. 7 Relationship between theoretical and predicted AP values
由图7可知,验证样品的AP预测值和理论值之间具有较好的相关性(R2=0.983)。说明所建立的相关性模型具有良好的预测效果,这为后期应用样品的低场核磁弛豫特性反映其掺杂猪油情况提供了一条新的途径,且可以将其思路进一步研究后拓展至对其他油品掺杂程度的快速分析中,从而为保障食用油品质提供可靠的快速分析方法。
本实验主要研究了猪油掺杂比例对花生油脂肪酸组成及低场核磁弛豫特性的影响,并进一步建立了二者的相关性,得到的主要结论如下:随着猪油掺杂比例的增加,样品中饱和脂肪酸含量显著增加,不饱和脂肪酸含量显著下降,掺杂参数AP值呈减小趋势。LF-NMR单组分弛豫时间(T2W)线性减小(R2=0.961);掺杂比例大于30%时,T21显著下降后一直保持不变,T22变化不显著,S21、S22分别呈线性增加(R2=0.936)和减小(R2=0.972)趋势,且在掺杂比例大于50%时变化显著。
掺杂油样低场核磁弛豫特性的主成分分析表明,随着猪油掺杂比例的增加,样品在主成分分布图上呈从右上角到左下角的分布趋势,当掺杂比例大于20%,掺杂油样与花生油样品可明显区分。样品的低场核磁特性F值与AP值间具有较好的相关性(R2=0.969),说明可以通过样品的低场核磁弛豫特性预测其脂肪酸组成的变化情况,从而快速判别其品质。
参考文献:
[1] DAHIMI O, RAHIM A A, ABDULKARIM S M, et al. Multivariate statistical analysis treatment of DSC thermal properties for animal fat adulteration[J]. Food Chemistry, 2014, 158(5): 132-138. DOI:10.1016/ j.foodchem.2014.02.087.
[2] ZHANG Q, LIU C, SUN Z, et al. Authentication of edible vegetable oils adulterated with used frying oil by Fourier transform infrared spectroscopy[J]. Food Chemistry, 2012, 132(3): 1607-1613. DOI:10.1016/j.foodchem.2011.11.129.
[3] POPESCU R, COSTINEL D, DINCA O R, et al. Discrimination of vegetable oils using NMR spectroscopy and chemometrics[J]. Food Control, 2015, 48: 84-90. DOI:10.1016/j.foodcont.2014.04.046.
[4] FANG G, JING Y G, TAY M, et al. Characterization of oils and fats by1H NMR and GC/MS fingerprinting: classification, prediction and detection of adulteration[J]. Food Chemistry, 2013, 138(2/3): 1461-1469. DOI:10.1016/j.foodchem.2012.09.136.
[5] 杨晨, 于修烛, 王昕, 等. 基于紫外光谱的花生油掺伪检测[J]. 食品科学, 2012, 33(6): 186-189.
[6] 潘磊庆, 唐琳, 詹歌, 等. 电子鼻对芝麻油掺假的检测[J]. 食品科学, 2010, 31(20): 318-321.
[7] PENG D, BI Y, REN X, et al. Detection and quantification of adulteration of sesame oils with vegetable oils using gas chromatography and multivariate data analysis[J]. Food Chemistry, 2015, 188: 415-421. DOI:10.1016/j.foodchem.2015.05.001.
[8] ROHMAN A, MAN Y B C. Fourier transform infrared (FTIR) spectroscopy for analysis of extra virgin olive oil adulterated with palm oil[J]. Food Research International, 2010, 43(3): 886-892. DOI:10.1016/j.foodres.2009.12.006.
[9] SEMMAR N, ARTAUD J. A new simplex-based approach predicting olive oil blend compositions from fatty acid data[J]. Journal of Food Composition and Analysis, 2015, 43: 149-159. DOI:10.1016/ j.jfca.2015.05.009.
[10] APETREI I M, APETREI C. Detection of virgin olive oil adulteration using a voltammetric e-tongue[J]. Computers and Electronics in Agriculture, 2014, 108: 148-154. DOI:10.1016/j.compag.2014.08.002.
[11] LERMA-GARCÍA M J, RAMIS-RAMOS G, HERREROMARTÍNEZ J M, et al. Authentication of extra virgin olive oils by Fourier-transform infrared spectroscopy[J]. Food Chemistry, 2010, 118(1): 78-83. DOI:10.1016/j.foodchem.2009.04.092.
[12] MONFREDA M, GOBBI L, GRIPPA A. Blends of olive oil and seeds oils: characterisation and olive oil quantification using fatty acids composition and chemometric tools. Part Ⅱ.[J]. Food Chemistry, 2014, 145(4): 584-592. DOI:10.1016/j.foodchem.2013.07.141.
[13] LEE D S, LEE E S, KIM H J, et al. Reversed phase liquid chromatographic determination of triacylglycerol composition in sesame oils and the chemometric detection of adulteration[J]. Analytica Chimica Acta, 2001, 429(2): 321-330. DOI:10.1016/S0003-2670(00)01289-7.
[14] SEO H Y, HA J, SHIN D B, et al. Detection of corn oil in adulterated sesame oil by chromatography and carbon isotope analysis[J]. Journal of the American Oil Chemists Society, 2010, 87(6): 621-626. DOI:10.1007/s11746-010-1545-6.
[15] BLÜMICH B, PERLO J, CASANOVA F. Mobile single-sided NMR[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2008, 52(4): 197-269. DOI:10.1016/j.pnmrs.2007.10.002.
[16] ZHANG Q, SALEH A S M, SHEN Q. Discrimination of edible vegetable oil adulteration with used frying oil by low field nuclear magnetic resonance[J]. Food and Bioprocess Technology, 2013, 6(9): 2562-2570. DOI:10.1007/s11947-012-0826-5.
[17] 赵婷婷, 王欣, 刘宝林, 等. 煎炸猪油掺杂比例对猪油低场核磁共振弛豫特性及脂肪酸组成的影响[J]. 食品科学, 2015, 36(1): 6-12. DOI:10.7506/spkx1002-6630-201501002.
[18] 王永巍, 王欣, 刘宝林, 等. 低场核磁共振技术检测煎炸油品质[J].食品科学, 2012, 33(6): 171-175.
[19] 周凝, 刘宝林, 王欣, 等. 米糠毛油掺伪食用植物油的低场核磁共振检测[J]. 食品与发酵工业, 2011, 37(3): 177-181.
[20] GB/T 17376—2008 动植物油脂脂肪酸甲酯制备[S]. 2008.
[21] ZHANG L, LI P, SUN X, et al. Classification and adulteration detection of vegetable oils based on fatty acid profiles[J]. Journal of Agricultural and Food Chemistry, 2014, 62(34): 8745-8751. DOI:10.1021/jf501097c.
[22] SUN X, ZHANG L, LI P, et al. Fatty acid profiles based adulteration detection for flaxseed oil by gas chromatography mass spectrometry[J]. Lebensmittel-Wissenschaft und-Technologie, 2015, 63: 430-436. DOI:10.1016/j.lwt.2015.02.023.
[23] XIE J, LIU T, YU Y, et al. Rapid detection and quantification by GCMS of camellia seed oil adulterated with soybean oil[J]. Journal of the American Oil Chemists Society, 2013, 90(5): 641-646. DOI:10.1007/ s11746-013-2209-0.
[24] POPESCU R, COSTINEL D, DINCA O R, et al. Discrimination of vegetable oils using NMR spectroscopy and chemometrics[J]. Food Control, 2015, 48: 84-90. DOI:10.1016/j.foodcont.2014.04.046.
[25] 高汉宾, 张振芳. 核磁共振原理与实验方法[M]. 武汉: 武汉大学出版社, 2008: 118-136.
Effect of Lard Adulteration Proportion on the Fatty Acid Composition and LF-NMR Relaxation Characteristics of Peanut Oil
ZHU Wenran, WANG Xin*, CHEN Lihua
(Institute of Food Safety and Quality, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract: Fatty acid composition and LF-NMR relaxation characteristics of peanut oil adulterated with lard at different ratios were studied and the corresponding correlations were also analyzed. The results showed that as the adulteration ratio of lard increased, the content of saturated fatty acid increased significantly while the adulteration parameter (AP) value decreased, and the single component relaxation time T2Wdecreased linearly. When the adulteration ratio was above 30%, T21decreased significantly and then remained stable. However, there was no obvious change in T22. S21and S22linearly increased (R2= 0.936) and decreased (R2= 0.972), respectively. Adulterated oil samples were all located from the top-right corner to the lower-left corner in the principal component analysis (PCA) map and PCA could clearly discriminate oil samples with an adulterated ratio above 20%. Besides, good correlation was found between the F value (PCA overall score) and AP value (R2= 0.969). Therefore LF-NMR characteristics can be used to predict the changes in fatty acid composition and thus rapidly detect the quality of peanut oil.
Key words: lard; peanut oil; adulteration; fatty acid composition; relaxation characteristics
收稿日期:2015-09-11
基金项目:国家自然科学基金青年科学基金项目(NSFC31201365);上海市科委重点攻关项目(11142200403);上海市教委科研创新项目(11YZ109)
作者简介:朱文冉(1989—),女,硕士研究生,研究方向为食品安全快速检测。E-mail:zhuwenran2014@126.com
*通信作者:王欣(1975—),女,副教授,博士,研究方向为食品安全控制与检测。E-mail:18918629281@126.com
DOI:10.7506/spkx1002-6630-201612031
中图分类号:TS227
文献标志码:A
文章编号:1002-6630(2016)12-0176-06引文格式: