单利君1,林勤保1,*,韩善辉1,吴宇梅1,田海娇2,李 波1
(1.暨南大学包装工程研究所,产品包装与物流广东普通高校重点实验室,广东 珠海 519070;2.山西省分析科学研究院,山西 太原 030006)
摘 要:探究纳米银-聚乙烯复合包装中纳米银成分的存在对2种抗氧化剂(Irganox1076和Irgafos168)向食品模拟物迁移规律的影响。将含有抗氧化剂的聚乙烯包装膜和同时含有抗氧化剂与纳米银的复合包装膜裁成正方形若干,分别 浸泡于正己烷和体积分数95%乙醇溶液2种食品模拟物中,密封后在20、40 ℃以及70 ℃条件下进行迁移实验。食品模拟物中2种抗氧化剂的加标回收率在79.3%~108.0%之间,相对标准偏差在0.7%~5.3%之间。2种抗氧化剂的迁移会随着迁移温度的升高以及迁移时间的延长而增加直至达到迁移平衡,且其在正己烷模拟物中的迁移量大于在体积分数95%乙醇模拟物中的迁移量;含纳米银聚乙烯塑料比不含纳米银聚乙烯塑料中的抗氧化剂向食品模拟物中的迁移量小,表明纳米银成分的存在可以抑制包装中的抗氧化剂向食品模拟物中的迁移。
关键词:纳米银;抗氧化剂;食品模拟物;迁移;高效液相色谱
引文格式:
单利君, 林勤保, 韩善辉, 等. 纳米银-聚乙烯复合包装中银对2种抗氧化剂向食品模拟物迁移的影响[J]. 食品科学, 2016, 37(12): 182-186. DOI:10.7506/spkx1002-6630-201612032. http://www.spkx.net.cn
SHAN Lijun, LIN Qinbao, HAN Shanhui, et al. Impact of nanosilver on migration of two antioxidants from nanosilverplastic food packaging to food simulants[J]. Food Science, 2016, 37(12): 182-186. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612032. http://www.spkx.net.cn
通过纳米技术将特征尺寸为1~100 nm的纳米数量级颗粒或者晶体与塑料材料通过纳米合成、纳米添加、纳米改性等方式加工而成的新型材料,与传统普通塑料包装材料对比,其物理、化学等性能(如稳定性、阻隔性、抗菌性、保鲜性等)显著增强,因而在各行各业得到了广泛的应用并具有极大的前景[1-2]。近年来,已有多种聚合物基纳米复合材料(如纳米Ag/聚乙烯类、纳米TiO2/聚丙烯类、纳米蒙脱石粉/聚酰胺类等)在啤酒、饮料、果蔬、肉类、奶制品等食品的包装应用方面得到了快速发展,而纳米银因其显著的抗菌性,被广泛应用于纳米塑料复合食品包装中[2-4]。塑料材料在使用的过程中容易遭到氧化而造成褪色、硬化、失去光泽或者变得透明,为了控制和延缓塑料包装材料的氧化过程、改善塑料一些物理化学性质,在生产过程中常常会加入一些抗氧化剂。Irganox1076和Irgafos168因与塑料相溶性、抗氧化效果好而分别在主抗氧化剂、辅助抗氧化剂中最具代表性[5]。
纳米塑料复合包装材料在与食品直接接触的过程中纳米成分和各种添加剂会通过吸收、溶解和扩散等过程迁移到食品中,并随着食品进入人体而对人们的身体健康造成一定的威胁[6-8]。基于此,国内外众多学者已对包装材料中各种添加剂[9-15]以及纳米成分[16-21]的含量、检测方法以及迁移过程中时间和温度等影响因素进行大量研究,但是纳米成分与各种塑料添加剂之间的相互影响研究甚少。本课题组已对纳米银-聚乙烯复合包装中助剂对银向食品模拟物迁移的影响进行研究[22],本实验将探讨纳米银的存在对2种抗氧化剂迁移的影响。
本实验选取2种(含纳米银和不含纳米银)聚乙烯塑料(2种塑料都含助剂Irganox1076、Irgafos168),分别测定这2种塑料中2种抗氧化剂的初始含量,进行不同条件下2种抗氧化剂的迁移实验,通过比较2种塑料中2种抗氧化剂的迁移量来研究纳米银对抗氧化剂的迁移影响,为进一步的迁移实验以及迁移模型的完善提供参考依据。
1.1 材料、试剂与仪器
复合膜材料:纳米银粉末(20 nm) 上海超威纳米科技有限公司;抗氧化剂SONOX900(Irganox1076、Irgafos168复配物) 三丰化工有限公司;纳米银-聚乙烯塑料母粒 金耀塑料颜料有限公司;空白聚乙烯塑料、含有0.3%抗氧化剂SONOX900的聚乙烯复合塑料、含有0.3%抗氧化剂SONOX900的纳米银聚乙烯复合塑料广州金中机械有限公司。
Irganox1076标准品(纯度>99%) 德国BASF公司;Irgafos168标准品(纯度>98%) 日本BASF公司;二氯甲烷(分析纯) 天津大茂化学试剂厂;无水乙醇(分析纯) 台山市粤桥试剂塑料有限公司;正己烷(分析纯) 天津市广成化学试剂有限公司;乙醇(分析纯) 国药集团化学试剂有限公司;甲醇(色谱纯)美国Tedia公司;超纯水(18.25 MΩ/cm)由易普易达实验室超纯水器制得。
2695 高效液相色谱仪(配有UV二极管阵列检测器2996) 美国Waters公司;LABUY-10LHT超声波清洗器 杭州莱博仪器设备有限公司;AL204电子分析天平 梅特勒-托利多仪器(上海)有限公司;R205B旋转蒸发器 上海申生科技有限公司;DHG-9140A电热恒温鼓风干燥箱 上海培因实验仪器有限公司;Turbo VAP Ⅱ样品自动浓缩工作站 美国Caliper公司。
1.2 方法
1.2.1 标准溶液的配制
分别准确称取Irgafos168和Irganox1076的化学标准品10.0 mg(精确至0.1 mg)。其中,Irgafos168用少量二氯甲烷完全溶解后用甲醇定容于10 mL容量瓶中,Irganox1076直接用甲醇溶解定容于10 mL容量瓶中,配制成1 000 mg/L的标准储备溶液,置于冰箱4 ℃冷藏保存。根据需要用甲醇将其稀释成不同质量浓度的标准工作液使用。
1.2.2 初始含量检测
用蒸馏水将塑料样品冲洗,晾干,用剪刀剪成1 cm×1 cm小块若干混匀。准确称取0.100 g(精确至0.001 g)样品于含20 mL二氯甲烷的玻璃瓶中密封,在30 ℃条件下超声萃取1 h,超声频率为40 kHz,超声功率为300 W;然后将萃取液转移至100 mL圆底烧瓶中,并用5 mL二氯甲烷重复提取3 次后与萃取液合并,在50 ℃水浴中旋转蒸发至近干,用甲醇定容至2 mL,振荡均匀后过0.45 μm微孔滤膜,待高效液相色谱仪分析测定。
1.2.3 迁移实验
根据文献[23]可以用异辛烷和体积分数95%乙醇溶液作为替代测试介质来模拟脂肪类食品;在国家标准中,选取正己烷作为脂肪类食品模拟物用于食品包装材料内有机物的迁移研究[24]。故本实验选用体积分数95%乙醇溶液和正己烷作为脂肪类食品模拟物进行对比实验。每0.6 dm2的塑料应与100 g或者100 mL的食品或者食品模拟物接触[14]。将塑料样品剪成12 cm×12 cm大小的正方形膜若干,取一片浸泡于含200 mL食品模拟物的广口瓶中并用橡胶塞密封后,转移到恒温箱中进行不同时间和不同温度条件下的迁移实验。分别选取20、40 ℃以及70 ℃代表室温、常见接触温度和正己烷最高使用温度。每隔一定的时间取浸泡液样品0.5 mL进行上机前的预处理:体积分数95%乙醇溶液浸泡液直接过0.45 μm微孔滤膜;正己烷浸泡液于35 ℃水浴中氮吹至近干后,准确加入2.0 mL无水乙醇再超声5 min使其完全溶解,再过0.45 μm微孔滤膜。经过处理后的液体进高效液相色谱仪进行测定。
1.2.4 迁移量计算
2种抗氧化剂的迁移量用模拟物中测得的抗氧化剂的质量与食品模拟物质量的比值表示:
式中:Mmigration为抗氧化剂的迁移量/(mg/kg);M1为浸泡后抗氧化剂在食品模拟物中的质量/mg;M2为食品模拟物的质量/kg;C检测值为实验测定得到的抗氧化剂的质量浓度/(μg/L);V浸泡液为食品模拟物的体积/mL;N为稀释倍数(若直接取食品模拟液上机,则N=1)。
1.2.5 高效液相色谱条件
Waters Symmetry®C18色谱柱(4.6 mm×150 mm,5 μm);柱温为30 ℃;流动相为100%甲醇;流速为1.0 mL/min;进样量为10 μL;检测波长为276 nm;运行时间为16 min。
2.1 线性方程、检出限(limit of detection,LOD)与定量限(limit of quantitation,LOQ)
采用外标法定量,准确配制2种抗氧化剂的质量浓度为50、100、200、500、1 000、2 000、5 000 μg/L的系列标准工作液,以质量浓度作为横坐标x,峰面积作为纵坐标y建立标准曲线,得到两者之间的线性关系和线性方程。根据RSN=3和RSN=10得到各物质仪器的LOD和LOQ。2种抗氧化剂的保留时间、线性方程、相关系数R、LOD以及LOQ见表1。
表1 2种抗氧化剂的保留时间、线性方程、相关系数、LOQ与LOD(n=6)
Table 1 Retention time, linearity equation, correlation coefficient, LOD, and LOQ for 2 antioxidants (n=6)

注:保留时间以 ±s表示。
±s表示。
2.2 方法的回收率和精密度
2.2.1 超声旋蒸法测定塑料样品中抗氧化剂含量的回收率和精密度
准确称取0.100 g(精确到0.001 g)空白聚乙烯塑料样品于含20 mL二氯甲烷的玻璃瓶中,向其中添加标准工作液使添加水平分别为100、250、500 μg/L,按含量测定时的处理方法处理后在高效液相色谱仪上机测定,计算相对标准偏差(relative standard deviation,RSD),如表2所示。方法的回收率在95.1%~106.1%之间,RSD在0.7%~4.3%之间。
表2 旋转蒸发高效液相色谱法检测塑料中抗氧化剂含量的方法回收率与精密度(n=6)
Table 2 Precision and recoveries for spiked plastic with additives detected by rotary evaporation-HPLC (n=6)

2.2.2 食品模拟物中2种抗氧化剂的回收率和精密度
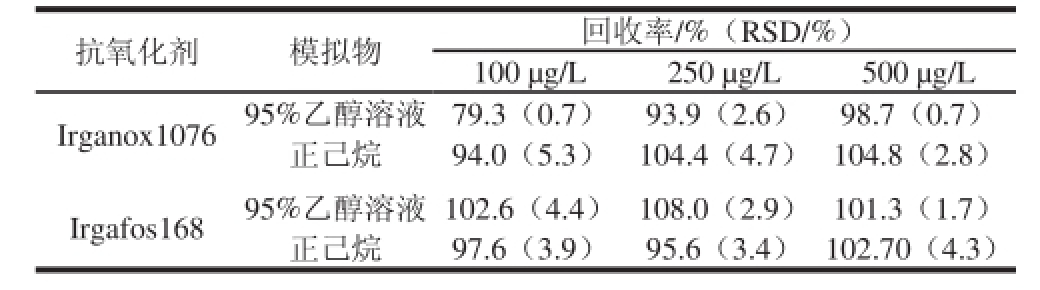
分别量取10 mL体积分数95%乙醇溶液和正己烷于玻璃瓶中,向其中添加标准工作液使Irganox1076和Irgafos168的3 个添加水平分别为100、250、500 μg/L,经浸泡液预处理方法处理后上机测定,如表3所示。食品模拟物中2种抗氧化剂的加标回收率在79.3%~108.0%之间,RSD在0.7%~5.3%之间。
表3 高效液相色谱测定2种食品模拟物中2种抗氧化剂的回收率与精密度(n=6)
Table 3 Precision and recovery for spiked food simulants with 2 antioxidants detected by HPLC (n=6)
2.3 包装中2种抗氧化剂的初始含量
按照1.2.2节检测含纳米银的聚乙烯复合塑料包装与不含纳米银的聚乙烯复合塑料中Irganox1076的含量分别为(631.54±6.09)mg/kg和(635.66±6.87)mg/kg;Irgafos168的含量分别为(299.38±2.62)mg/kg和(302.83±3.20)mg/kg。利用SPSS软件进行统计分析,在置信水平为95%时,Irganox1076在2种塑料中的含量无显著性差异(P=0.219>0.05),Irgafos168在2种塑料中的含量无显著性差异(P=0.385>0.05),因而可以看作Irganox1076和Irgafos168在这2种塑料中的初始含量是近似相等的。
2.4 迁移结果
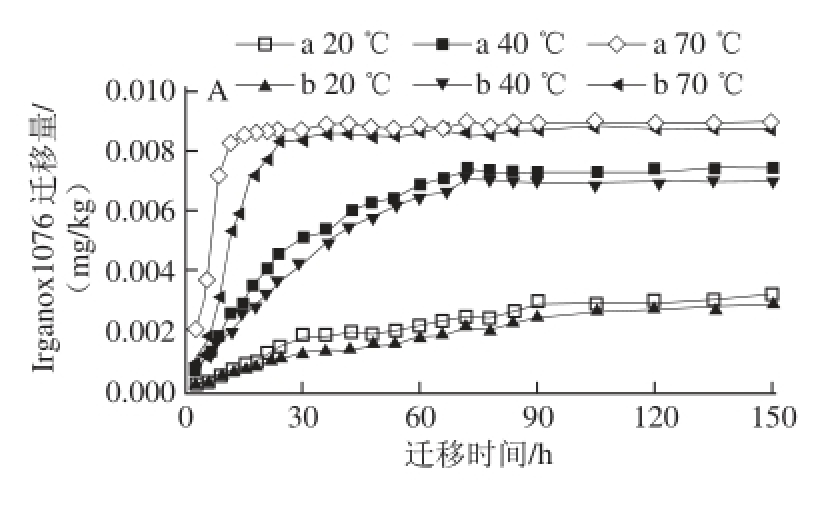

图1 聚乙烯复合食品包装中的Irganox1076(A、B)、Irgafos116688 (C、D)向食品模拟物的迁移
Fig. 1 Migration of Irganox1076 (A and B) and Irgafos168 (C and D) from films into food simulants
A、C.体积分数95%乙醇溶液;B、D.正己烷;a.不含纳米银;b.含纳米银。
2种(含纳米银和不含纳米银)的聚乙烯复合塑料中的Irganox1076、Irgafos168在不同时间、不同温度条件下向2种食品模拟物的迁移情况如图1所示。
在同一温度条件下,随着迁移实验时间的延长,抗氧化剂向食品模拟物中的迁移量增加,直到达到平衡;随着迁移温度的升高,同一种塑料中的抗氧化剂向食品模拟物中的迁移量也增加。这是因为迁移时间越长,塑料中越多的抗氧化剂能够与食品模拟物溶液接触从而溶入其中,但是当其达到溶解度后,抗氧化剂不再向食品模拟物溶液迁移至达到迁移平衡。
在同样的迁移条件下,塑料材料中的同一种抗氧化剂向不同食品模拟物中的迁移量也不同。由图1可知,Irganox1076和Irgafos168在正己烷中的最大迁移量大于同温度条件下在体积分数95%乙醇溶液中的最大迁移量。这可能是因为Irganox1076和Irgafos168分别为受阻酚类和亚磷酸酯类抗氧化剂,其在正己烷中的溶解度比在体积分数9 5%乙醇溶液中大,故在正己烷中的迁移量较大。
在同样的实验条件下,含纳米银聚乙烯塑料比不含有纳米银聚乙烯塑料中的抗氧化剂向食品模拟物中的迁移量小。利用SPSS软件进行统计分析,在置信水平为95%时,2种塑料(含纳米银与不含纳米银)中2种抗氧化剂Irganox1076和Irgafos168在20、40 ℃以及70 ℃条件下的迁移结果有显著差异(6 组数据P<0.05),这说明,纳米银成分能够抑制塑料中的抗氧化剂向食品模拟物中的迁移。此现象存在两方面原因。首先,由于纳米银颗粒之间存在小分子效应和表面效应,其在塑料内部会产生一定的团聚现象,会以分散状或者团聚状态镶嵌或者黏合在塑料材料上面[25],而抗氧化剂的迁移是一种分子扩散过程,纳米银的团聚现象可能会阻碍抗氧化剂的扩散行为,进而抑制了抗氧化剂向食品模拟物的迁移;其次,纳米银在大多数环境中很容易被氧化而在短时间内大量释放出银离子[11],抗氧化剂可能与银离子结合以抑制纳米银的氧化,经过反应以后的抗氧化剂可能变成另一种物质,从而使得抗氧化剂的迁移量减少。2种抗氧化剂Irganox1076和Irgafos168之间存在协同作用,故纳米银与抗氧化剂在塑料中的作用机理较为复杂,关于这一部分的探讨研究有待于进一步深入。
本实验探究纳米银-聚乙烯复合包装中纳米银成分的存在对2种抗氧化剂(Irganox1076和Irgafos168)向2种食品模拟物(体积分数95%乙醇溶液和正己烷)中迁移规律的影响,分析迁移温度、迁移时间、食品模拟物种类以及纳米银的存在对这2种抗氧化剂的迁移量的影响。
2种抗氧化剂的迁移会随着迁移温度的升高以及迁移时间的延长而增加,直至达到迁移平衡,且其在正己烷模拟物中的迁移量大于在体积分数95%乙醇溶液模拟物中的迁移量;含纳米银聚乙烯塑料比不含纳米 银聚乙烯塑料中的抗氧化剂向食品模拟物中的迁移量小,表明纳米银成分的存在抑制了包装中的抗氧化剂向食品模拟物中的迁移。本实验为进一步的迁移实验和实际生活中纳米银-聚乙烯复合塑料膜的生产应用以及迁移模型的完善提供了参考依据。
参考文献:
[1] CHAUDHRY Q, SCOTTER M, BLACKBURN J, et al. Applications and implications of nanotechnologies for the food sector[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure and Risk Assessment, 2008, 25(3): 241-258. DOI:10.1080/02652030701744538.
[2] LAGARON J M, LOPEZ R A. Nanotechnology for bioplastics: opportunities, challenges and strategies[J]. Trends in Food Science and Technology, 2011, 22(11): 611-617. DOI:10.1016/j.tifs.2011.01.007.
[3] de AZEREDO H M C. Nanocomposites for food packaging applications[J]. Food Research International, 2009, 42(9): 1240-1253. DOI:10.1016/j.foodres.2009.03.019.
[4] CUSHEN M, KERRY J, MORRIS M, et al. Nanotechnologies in the food industry-recent developments, risks and regulation[J]. Trends in Food Science and Technology, 2012, 24(1): 30-46. DOI:10.1016/ j.tifs.2011.10.006.
[5] 马少波, 郑亚兰, 吴晓妮, 等. 塑料抗氧剂的研究和发展趋势[J].塑料科技, 2015, 43(1): 100-103. DOI:10.15925/j.cnki.issn1005-3360.2015.01.017.
[6] CHAUDHRY Q, CASTLE L. Food applications of nanotechnologies: an overview of opportunities and challenges for developing countries[J]. Trends in Food Science and Technology, 2011, 22(11): 595-603. DOI:10.1016/j.tifs.2011.01.001.
[7] 朱玲风, 杜晶, 任佳丽, 等. 食品药品包装材料中抗氧化剂毒理学研究[J]. 食品与机械, 2013, 29(2): 68-72. DOI:10.3969/ j.issn.1003-5788.2013.02.015.
[8] CUSHEN M, KERRY J, MORR IS M, et al. Migration and exposure assessment of silver from a PVC nanocomposite[J]. Food Chemistry, 2013, 139(1/2/3/4): 389-397. DOI:10.1016/j.foodchem.2013.01.045.
[9] 林勤保, 李小梅, 宋欢, 等. 聚乙烯塑料包装材料中4种抗氧化剂向脂肪食品模拟物迁移的研究[J]. 分析科学学报, 2010, 26(6): 631-635.
[10] 郝倩, 苏荣欣, 齐崴, 等. 食品包装材料中有害物质迁移行为的研究进展[J]. 食品科学, 2014, 35(21): 279-286. DOI:10.7506/spkx1002-6630-201421055.
[11] LIN Q B, LI B, SONG H, et al. Determination of 7 antioxidants, 8 ultraviolet absorbents, and 2 fir e retardants in plastic food package by ultrasonic extraction and ultra performance liquid chromatography[J]. Journal of Liquid Chromatography and Related Techno logies, 2011, 34(9): 730-743. DOI:10.1080/10826076.2011.563889.
[12] DOPICO-GARCÍA M S, LPEZVILARIO J M, GONZLEZRODRÍ GUEZ M V. Determination of antioxidant migration levels from low-density polyethylene films into food simulants[J]. Journal of Chromatography A, 2003, 1018: 53-62. DOI:10.1016/j.chroma.2003.08.025.
[13] GREEN S, BAI S, CHEATHAM M, et al. Determination of antioxidants in polyolefins using total dissolution methodology followed by RPLC[J]. Journal of Separation Science, 2010, 33(22): 3455-3462. DOI:10.1002/jssc.201000491.
[14] GALOTTO M J, TORRES A, GUARDA A, et al. E xperimental and theoretical study of LDPE versus different concentrations of Irganox 1076 and different thickness[J]. Food Research International, 2011, 44(2): 566-574. DOI:10.1016/j.foodres.2010.12.009.
[15] SCHWARZINGER C, GABRIEL S, BEISSMANN S, et al. Quantitative analysis of polymer additives with MALDI-TOF MS using an internal stand ard approach[J]. Journal of the American Society for Mass Spectrometry, 2012, 23(6): 1120-1125. DOI:10.1007/ s13361-012-0367-1.
[16] ARTIAGA G, RAMOS K, RAMOS L, et al. Migration and characterisation of nanosilver from food containers by AF(4)-ICP-MS[J]. Food Chemistry, 2015, 166: 76-85. DOI:10.1016/ j.foodchem.2014.05.139.
[17] HUANG Y, CHEN S, BING X, et al. Nanosilver migrated into food-simulating solutions from commercially available food fresh containers[J]. Packaging Technology and Science, 2011, 24(5): 291-297. DOI:10.1002/pts.938.
[18] LIN Q B, LI B, SONG H, et al. Determination of silver in nano-plastic food packaging by microwave digestion coupled with inductively coupled plasma atomic emission spectrometry or inductively coupled plasma mass spectrometry[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure and Ri sk Assessment, 2011, 28(8): 1123-1128. DOI:10.1080/19440049.2011.580013.
[19] SONG H, LI B, LIN Q B, et al. Migration of silver from nanosilverpolyethylene composite packaging into food simulants[J]. Food Additives and Contam inants Part A-Chemistry Analysis Control Exposure and Risk Assessment, 2011, 28(12): 1758-1762. DOI:10.108 0/19440049.2011.603705.
[20] ECHEGOYEN Y, NERIN C. Nanoparticle release from nano-silver antimicrobial food containers[J]. Food and Chemical Tox icology. 2013, 62: 16-22. DOI:10.1016/j.fct.2013.08.014.
[21] LIN Q B, LI H, ZHONG H N, et al. Determination of titanium in nanotitanium (Ⅳ) oxide composite food packaging by microwave digestion and inductively coupled plasma atomic emission spectrometry and in ductively coupled plasma mass spectrometry[J]. Analytical Letters, 2014, 47(12): 2095-2103. DOI:10.1080/00032719.2014.895907.
[22] 田海娇, 林勤保, 郭捷, 等. 纳米银-聚乙烯复合包装中助剂对银向食品模拟物迁移的影响[J]. 食品科学, 2014, 35(5): 8-12. DOI:10.7506/ spkx1002-6630-201405002.
[23] BS EN 13130-1:2004-Materials and articles in contact with foodstuffsplastics substances subject to limitation-part 1: guide to test methods for the specific migration o f substances from plastics to foods and food simulants and the determination of substances in plastics and the selection of conditions of exposure to food simulants[S].
[24] GB/T 23296.1—2009 食品接触材料: 塑料中受限物质: 塑料中物质向食品及食品模拟物特定迁移试验和含量测定方法以及食品模拟物暴露条件选择的指南[S].
[25] 艾茜, 胡长鹰, 林勤保, 等. 纳米银/低密度聚乙烯复合食品包装薄膜的表征及性能[J]. 食品工业科技, 2014, 35(22): 294-298. DOI:10.13386/j.issn1002-0306.2014.22.056.
Impact of Nanosilver on Migration of Two Antioxidants from Nanosilver-Plastic Food Packa ging to Food Simulants
SHAN Lijun1, LIN Qinbao1,*, HAN Shanhui1, WU Yumei1, TIAN Haijiao2, LI Bo1
(1. Key Laboratory of Product Packaging and Logistics of Guangdong Higher Education Institutes, Institute of Packaging Engineering, Jinan University, Zhuhai 519070, China 2. Shanxi Academy of Analytical Sciences, Taiyuan 030006, China)
Abstract: This study aimed to evaluate the effect of nanosilver on the migration of two antioxidants (Irganox1076 and Irgafos168) from nanosilver-polyethylene plastic packaging into food simulants. Two polyethylene films containing two antioxidants (Irganox1076 and Irgafos168) with or without nanosilver were soaked in the food simulants, hexane or 95% aqueous ethanol (V/V), a t 20, 40 or 70 ℃ for migration. The spiked recoveries of two antioxidants from the food simulants ranged from 79.3% to 108.0% with relative standard deviations (RSDs) varying from 0.7% to 5.3%. In addition, the migration of two antioxidants increased gradually with the increases in temperature and time in both food simulants till the migration balance. The migration was greater in hexane than in 95% (V/V) ethanol. The migration of the polyethylene film with nanosilver was lower than that without nanosilver. Thus, the addition of nanosilver plastic hindered the migration of antioxidants into food simulants.
Key words: nanosilver; antioxidants; food simulant; migration; high performance liquid chromatography (HPLC)
收稿日期:2015-09-22
基金项目:国家自然科学基金面上项目(21277085;21277061)
作者简介:单利君(1992—),女,硕士研究生,研究方向为食品与药品包装。E-mail:shan-lijun@foxmail.com
*通信作者:林勤保(1968—),男,研究员,博士,研究方向为食品包装安全。E-mail:tlinqb@jnu.edu.cn
DOI:10.7506/spkx1002-6630-201612032
中图分类号:TB487
文献标志码:A
文章编号:1002-6630(2016)12-0182-05