表1 糙米样品建模集和验证集中AFB1含量统计结果
Table 1 Descriptive statistics of AFB1concentrations for calibrationn and validation sets of brown rice samples

沈 飞1,吴启芳1,唐培安1,邵小龙1,姜大峰2
(1.南京财经大学食品科学与工程学院,江苏省现代粮 食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.山东省疾病预防控制中心,山东 济南 250014)
摘 要:拟建立基于衰减全反射-傅里叶变换红外光谱(attenuated total reflectance-Fourier transform infrared spectroscopy,ATR-FTIR)的糙米中微量黄曲霉毒素B1(aflatoxin B1,AFB1)的快速检测方法。首先将16 份糙米样品经辐射灭菌后接种产毒菌株并在适宜条件下(28 ℃、相对湿度85%)贮藏30 d,测定其AFB1含量。其次将受AFB1污染样品磨粉后与空白糙米样品按质量比例进行精确混合,获得AFB1含量在0~890.20 μg/kg内的糙米样品共计128 份。ATR-FTIR建模分析结果显示,依据AFB1含量高低将样品划分为4 类,临近算法判别分析模型的预测整体正确率达到83.3%。运用偏最小二乘回归分析建立的定量模型精度最优,预测相关系数、均方根误差和相对分析误差值分别为0.970、70.8 μg/kg和4.0。结果表明,ATR-FTIR技术用于糙米黄曲霉毒素污染程度的快速分析与筛选具有一定可行性,但需进一步研究来提升对低AFB1含量样品的预测精度。
关键词:衰减全反射-傅里叶变换红外光谱;糙米;黄曲霉毒素B1(AFB1);快速检测
引文格式:
沈飞, 吴启芳, 唐培安, 等. 糙米中黄曲霉毒素B1的ATR-FTIR快速测定[J]. 食品科学, 2016, 37(12): 187-191. DOI:10.7506/spkx1002-6630-201612033. http://www.spkx.net.cn
SHEN Fei, WU Qifang, TANG Peian, et al. Attenuated total reflectance-Fourier transform infrared spectroscopy (ATR-FTIR) for rapid detection of aflatoxin B1in brown rice[J]. Food Science, 2016, 37(12): 187-191. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612033. http://www.spkx.net.cn
黄曲霉毒素(aflatoxin,AF)是主要由黄曲霉(Asperillus flavus)和寄生曲霉(Aspergillus parasiticus)等真菌产生的一类次级代谢产物,广泛存在于各类粮食产品中,具有强致畸、致癌和致突变等作用[1-2]。粮食中常见的黄曲霉毒素主要有B1、B2、G1和G2四种形式,尤以AFB1的毒性和致癌性最强,1993年被国际癌症研究机构确定为Ⅰ类致癌物[3]。因此,快速准确地测定粮食受黄曲霉毒素污染情况具有十分重要的意义。目前黄曲霉毒素测定方法主要有高效液相色谱法[4]、液相色谱-质谱联用法[5]、酶联免疫吸附法[6]等,但这些技术均存在过程繁琐、时效性差或成本高等缺点[7-8],难以满足现场大批量样品快速在线检测需求,发展一种快速、准确且经济的检测分析方法变得十分迫切。
红外和拉曼光谱分析技术,具有分析速度快、多组分同时检测、无需样品预处理等诸多优点而受到广泛关注,已被用于粮食多种品质指标的分析预测,并在真菌毒素污染的快速鉴定方面展现出一定的应用潜力[9-12]。Berardo等[13]利用近红外光谱成功区分了受串珠镰刀菌污染的小麦样品,并对伏马毒素B1进行了定量预测,预测均方根误差(root mean-square error of prediction,RMSEP)达到1.33 mg/kg。Kos等[14]运用衰减全反射-傅里叶变换红外光谱(attenuated total reflectance-Fourier transform infrared spectroscopy,ATR-FTIR)检测了玉米样品受脱氧雪腐镰刀菌烯醇污染的情况,建立的模型对脱氧雪腐镰刀菌烯醇含量的预测误差为600 μg/kg。Lee 等[15]系统比较了近红外、中红外和拉曼光谱用于玉米中AFB1(0~1 206 μg/kg)检测的模型精度,发现基于拉曼和中红外光谱的检测结果略优于近红外,拉曼光谱模型的RESEP达到104~124 μg/kg。
然而,从目前的报道中可以得出,光谱技术用于真菌毒素的检测仍处于探索阶段,研究对象多集中在玉米、小麦和花生等更易受真菌毒素污染的样品,对稻米的研究则较少[16-18]。虽然有一些定量检测研究,但主要用于定性分析。因此,本实验拟利用ATR-FTIR分析技术,建立糙米中AFB1的定性定量检测方法,为最终实现真菌毒素的在线监测提供技术参考。
1.1 材料、试剂与仪器
2014年黑龙江产糙米样品,初始水分含量18.7%,真空包装4 ℃冷藏待用。
产黄曲霉毒素标准菌株:黄曲霉3.17和寄生曲霉3.395,购于中国北京北纳创联研究院,置于-18 ℃冷藏待用。AFB1标准品 美国Sigma公司。
Tensor 27型FTIR仪 德国Bruker公司;ZnSe衰减全反射附件 美国Pike公司。
1.2 方法
1.2.1 霉菌培养与接种
首先,将黄曲霉3.17和寄生曲霉3.395标准菌株置于高盐察氏培养基上培养7 d,采用无菌水冲洗培养基斜面,分别调整2种霉菌孢子悬浮液浓度至约6.03×106CFU/mL。然后,将初始糙米样品用60Co辐照灭菌,剂量为12 kGy。取4 kg灭菌糙米样品,以250 g/份分装为16 份。其中8 份喷洒接种黄曲霉3.17,另8份接种寄生曲霉3.395,经平板计数法确定接种量约为1.02×105CFU/g。接种后所有样品置于28 ℃、85%相对湿度环境条件下进行贮藏,30 d后取样分析。
1.2.2 样品AFB1含量测定
参照GB/T 5009.23—2006《食品中黄曲霉毒素B1、B2、G1、G2的测定》,采用高效液相色谱法测定样品中AFB1含量。步骤简叙如下:称取50 g样品加入200 mL乙腈-水(84∶16,V/V)提取液,振荡提取30 min。移取8 mL提取液至MycoSepTM228多功能柱净化,再移取2 mL净化液在50 ℃条件下氮气流吹干。剩余含黄曲霉毒素残渣加入200 μL正己烷和100 μL三氟乙酸,40 ℃条件下衍生反应15 min。室温条件下干燥后,以1 mL乙腈-水(15∶85,V/V)复溶,过0.45 μm滤膜,装入样品瓶,采用高效液相色谱仪进行测定。激发和发射波长分别为360 nm和440 nm。进样体积为10 μL,流速为1.0 mL/min。每份样品重复测定3 次,外标法定量。
1.2.3 不同AFB1含量样品配制
高效液相色谱检测结果显示空白样品中未检出AFB1,而16 份接种霉菌样品中AFB1含量均较高。因此,为得到AFB1含量范围分布较广的样品,首先将空白和含AFB1样品分别经粉碎机粉碎,过40 目筛。再从每份含AFB1样品中精确称量10 g,按照1∶2、1∶4、1∶6、1∶8、1∶10、1∶12、1∶14共7 个质量比例,掺入空白样品,从而将AFB1在样品中的含量调整为7.33~890.20 μg/kg。每个水平梯度配制16 个样品,共计获得糙米样本128 份(16 份空白+16×7 份AFB1污染样品)。
1.2.4 ATR-FTIR光谱采集
采用Tensor 27型FTIR仪和45 ℃ ZnSe衰减全反射附件采集糙米样品的光谱信息。将约1 g样品置于ATR附件的ZnSe晶体上,以空气为背景进行检测,样品测定前先扫描空气背景光谱。光谱区域为4 000~600 cm-1,扫描64 次,分辨率为4 cm-1。每份样品重复测量3 次,取平均光谱建模。
1.3 数据分析
采用TQ analyst 6.0(美国Thermo Electron公司)和Matlab 8.0(美国Mathworks公司)软件对糙米样品的ATR-FTIR光谱信息进行处理和建模,通过临近算法(K-Nearest Neighbor,KNN)、偏最小二乘回归分析(partial least squares regression,PLSR)、逐步多元性回归分析(stepwise multiple linear regression,SMLR)和主成分回归分析(principle component regression,PCR)建立糙米AFB1含量的定性判别及定量预测模型。运用相关系数(r)、建模集均方根误差(root mean-square error of calibration,RMSEC)、交互验证均方根误差(root mean-square error of cross-validation,RMSECV)、RMSEP和相对分析误差(residual predictive deviation,RPD)对模型预测性能进行综合评价。
2.1 AFB1测定结果
表1 糙米样品建模集和验证集中AFB1含量统计结果
Table 1 Descriptive statistics of AFB1concentrations for calibrationn and validation sets of brown rice samples

由表1可知,AFB1含量范围分布较广,具有良好的代表性,适用于分析模型的建立。在模型建立前,运用Kennard-Stone算法从128 个样品中选取86 个样品作为建模集,剩余42 个样品作为预测集[19]。
2.2 ATR-FTIR光谱特征分析

图1 不同类别糙米样品的ATR-FTIR平均光谱
Fig. 1 Average ATR-FTIR spectra of brown rice samples from different groups
第1类≤5 μg/kg;5 μg/kg<第2类≤50 μg/kg;50 μg/kg<第3类≤300 μg/kg;第4类>300 μg/kg。
依据样品中AFB1含量的高低,将糙米样品划分为4类:第1类(≤5 μg/kg)、第2类(>5 μg/kg,≤50 μg/kg)、第3类(>50 μg/kg,≤300 μg/kg)和第4类(>300 μg/kg)。图1为4类糙米样品的ATR-FTIR原始平均光谱。观察可知,其光谱形状基本一致,不同类别差异不显著。其中,3 600~3 030 cm-1范围内强吸收峰与水中O—H的伸缩振动有关。样品在1 780~800 cm-1波段内吸收变化较为明显,可作为定性和定量分析的特征图谱区。如1 764~1 724 cm-1处的吸收峰与酯类和酸类C=O的伸缩振动相关,1 700~1 500 cm-1处对应于酰胺中N—H、C—O的弯曲振动,且与黄曲霉毒素中C=C的伸缩振动有关。1 475~1 390 cm-1处与C—C及C—H基团的弯曲振动有关;1 390~1 310 cm-1处对应于甲基中—C—H的弯曲振动;1 180~950 cm-1处可能来源于—CH2—伸缩振动[20-22]。虽然不同类别样品的光谱差异微小,仔细观察可知,在特定波段,如1 760~1 730 cm-1范围内,吸收峰值随着AFB1含量的上升而逐步降低,表明光谱变化趋势与AFB1含量存在一定内在联系。
2.3 判别分析模型建立
表2 不同AFB1水平糙米样品KNNN分类结果
Table 2 KNN classification results for AFB1contaminated brown ricee samples from different groups

利用主成分分析法提取糙米样品在1 780~800 cm-1波段内的前10 个主成分得分,建立KNN判别分析模型,判别结果如表2所示。由表2可知,建模集中所有样品均判别正确,而在验证集42 个样品中,共有5个样品被错判,总体正确率为83.3%。其中,第3类样品被误判为第2类几率最高,表明部分样品间AFB1绝对含量差别较小,而第4类高含量AFB1正确率最高。图2为不同类别样品判别函数第1、第2主成分得分图。观察可知,不同类别样品有大致分离趋势。第1类和第4类区分效果较好,而第2、3类样品存在部分重叠,与判别分析结果一致。结果表明,利用ATR-FTIR区分样品受AFB1具有一定可行性,但仍需要进一步研究,增加样品数量来提高模型的精度和适用性。

图2 4 类糙米样品的第1、2判别函数得分图
Fig. 2 Scatter plot of the first and second discriminant functions for four brown rice groups
第1类≤5 μg/kg;5 μg/kg<第2类≤50 μg/kg;50 μg/kg<第3类≤300 μg/kg;第4类>300 μg/kg。
2.4 定量分析模型建立
为消除基线噪音和散射的影响,采用多元散射校正MSC和SG平滑对糙米样品光谱进行预处理,并比较了一阶和二阶微分处理对模型精度的影响,建模结果如表3所示。总体而言,基于PLSR、SMLR和PCR三种方法所建立的模型性能均较佳,预测相关系数rv均高于或接近0.900,RPD值大于2.0。比较而言,PLSR所建模型精度和稳健性最佳,SMLR模型次之,PCR模型最低。在PLSR所建模型中,RPD值均大于3.0,尤以一阶微分模型稳健性最高,RPD值达到4.0,具有实 际应用潜力。一阶微分结合SMLR所得模型复杂度低,RMSEP达到91.2 μg/kg。PCR结合二阶微分性能最佳,但因子数为13,模型复杂,预测精度也不高。图3为基于一阶微分光谱建立的PLSR分析模型的实际值与预测值相关关系图。虽然模型预测精度最优(70.8 μg/kg),但对于部分低含量样品的预测结果误差较大,同他人研究类似,可能与黄曲霉毒素在样品中的分布不均及毒素在红外光谱波段的响应太低有关[23]。因此,后续研究可通过优化样品粉碎等预处理方法,采用更高效建模算法以及改进光谱采集技术,或者结合其他分析手段来进一步来降低分析误差,提升检测精度。
表3 糙米中AFB1含量的PLSR、SMLR和PCR模型建模集与预测集结果
Descriptive statistics of the multivariate calibration models built by PLSR, SMLR and PCR for the prediction of AFB1concentration in brown rice
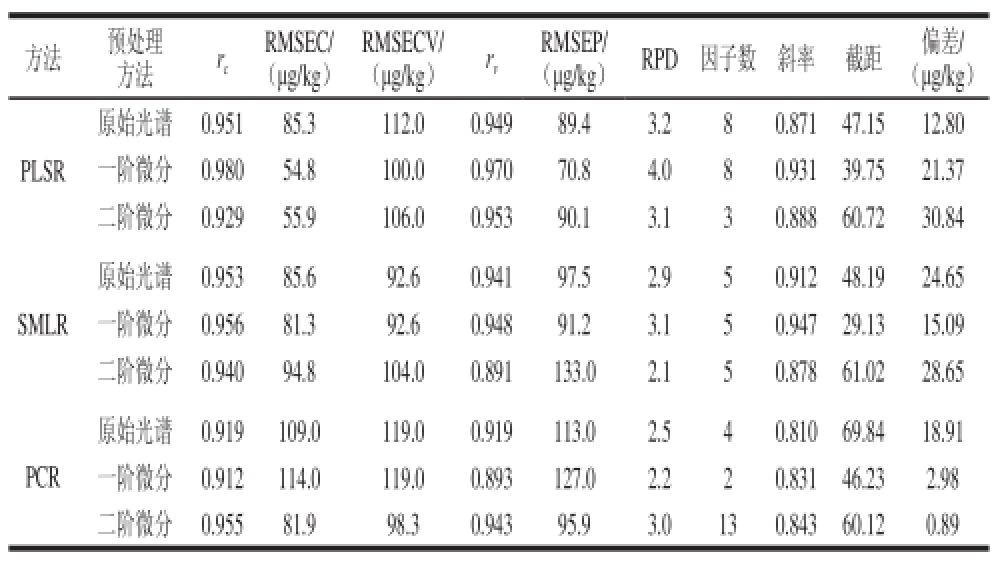

图3 糙米中AFB1实际值和ATR-FTIR预测值相关关系图
Fig. 3 Correlation statistics between reference values and ATR-FTIR predictions for AFB1in brown rice
本研究利用ATR-FTIR技术结合化学计量学方法,建立了糙米中AFB1的定性定量分析模型。结果表明,不同AFB1含量糙米样品光谱存在一定差异,基于ATR-FTIR光谱建立的KNN模型的判别正确率达到80%以上。运用PLSR方法建立的AFB1定量预测模型的 预测相关系数rv、RMSEP和RPD值分别为0.970、70.8 μg/kg和4.0,模型精度和稳健性均较优,表明利用ATR-FTIR光谱分析技术对粮食的米黄曲霉毒素污染程度的快速分析具有一定可行性。研究同时发现,部分低质量浓度或空白样品的预测误差过大,容易引起误报警,还需要进一步加大样品量和样品种类,改善样品预处理方法来建立更稳健的数学模型,如采用自然侵染AF的样品,减小样品颗粒尺寸及确保样品检测状态的一致性等,以提升模型预测性能。
参考文献:
[1] LEE J, HER J Y, LEE K G. Reduction of aflatoxins (B1, B2, G1, and G2) in soybean-base d model systems[J]. Food Chemistry, 2015, 189: 45-51.
[2] 王妍入, 李培武, 张奇, 等. 噬菌体展示纳米抗体模拟黄曲霉毒素抗原的活性表征[J]. 中国农业科学, 2014, 47(4): 685-692.
[3] 赖先文, 张荷, 刘承兰. 稻米中黄曲霉毒素和赭曲霉毒素A的研究进展[J]. 食品工业科技, 2014, 35(22): 386-391.
[4] 杨琳, 张宇昊, 马良. 高效液相色谱法同时检测粮谷中的黄曲霉毒素和赭曲霉毒素[J]. 食品科学, 2010, 31(24): 250-254.
[5] 徐飞, 刘峰, 高贵桃, 等. 超快速液相色谱-串联质谱法测定粮食及食用油中的黄曲霉毒素[J]. 粮食与油脂, 2015, 28(3): 66-68. DOI:10.3969/j.issn.1008-9578.2015.03.018.
[6] 韩春卉, 江涛, 李燕俊, 等. 黄曲霉毒素B1酶联免疫试剂盒稳定性研究[J]. 食品科学, 2013, 34(14): 315-318. DOI:10.7506/spkx1002-6630-201314066.
[7] ZHANG Xian, LI Chaorui, WANG Weicheng, et al. A novel electrochemical immunosensor for highly sensitive detection of aflatoxin B1in corn using single-walled carbon nanotubes/chitosan[J]. Food Chemistry, 2016, 192: 197-202.
[8] WANG Wei, NI Xinzhi, LAWRENCE K C, et al. Feasibility of detecting aflatoxin B1in single maize kernels using hyperspectral imaging[J]. Journal of Food Engineering, 2015, 166: 182-192.
[9] 王笑, 刘汉平, 曾常春, 等. 蒜氨酸和甲基蒜氨酸的红外及拉曼光谱研究[J]. 光谱学与光谱分析, 2013, 33(6): 1570-1574.
[10] MA C Y, PHILLIPS D L. FT-Raman spectroscopy and its applications in cereal science[J]. Cereal Chemistry, 2002, 79: 171-177.
[11] SOHN M, HIMMELSBACB D S, FEII B. A comparative study of fourier transform raman and NIR spectroscopic methods for assessment of protein and apparent amylose in rice[J]. Cereal Chemistry, 2004, 81(4): 429-433.
[12] 刘焱, 蔡静平. 储粮中黄曲霉毒素检测和预警方法研究进展[J]. 粮食与油脂, 2015, 28(3): 1-5.
[13] BERARDO N, PISACANE V, BATTILANI P, et al. Rapid detection of kernel rots and mycotoxins in maize by near-infrared reflectance spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2005, 53(21): 8128-8134.
[14] KOS G, KRSKA R, LOHNINGER H, et al. A comparative study of midinfrared diffuse reflection (DR) and attenuated total reflection (ATR) spectroscopy for the detection of fungal infection on RWA2-corn[J]. Analytical and Bioanalytical Chemistry, 2004, 378(1): 159-166.
[15] LEE K M, DAVIS J, HERRMAN T J, et al. An empirical evaluation of three vibrational spectroscopic methods for detection of aflatoxins in maize[J]. Food Chemistry, 2015, 173: 629-639.
[16] 易永艳, 李德荣, 张蕴薇, 等. 近红外技术在真菌生物量和真菌毒素检测中的研究与应用[J]. 光谱学与光谱分析, 2009, 29(7): 1826-1829.
[17] 王叶群, 姚刚, 张绍英. 污染黄曲霉毒素花生的检测及分选技术研究进展[J]. 农业工程, 2014, 4(6): 59-63.
[18] KAYA-CELIKER H, MALLIKARJUNAN P K, KAAYA A. Mid-infrared spectroscopy for discrimination and classification of Aspergillus spp. contamination in peanuts[J]. Food Contorl, 2015, 52: 103-111.
[19] RAMIREZ-LOPEZ L, SCHM IDT K, BEHRENS T, et al. Sampling optimal calibration sets in soil infrared spectroscopy[J]. Geoderma, 2014, 226/227: 140-150.
[20] WU Zhengzong, XU Enbo, LONG Jie, et al. Monitoring of fermentation process parameters of Chinese rice wine using attenuated total reflectance mid-infrared spectroscopy[J]. Food Control, 2015, 50: 405-412.
[21] ABRAMOBIĆ B, JAJIĆ I, ABRAMOVIĆ B, et al. Detection of deoxynivalenol in wheat by fourier transform infrared spectroscopy[J]. Acta Chimica Sinica, 2007, 54: 859-867.
[22] KAYA-CELIKER H, MALLIKARJUNAN P K, LII D S, et al. Discrimination of moldy peanuts with reference to aflatoxin using FTIR-ATR system[J]. Food Control, 2014, 44: 64-71.
[23] LEE K M, HERRMAN T J, YUN U. Application of Raman spectroscopy for qualitative and quantitative analysis of aflatoxins in ground maize samples[J]. Journal of Cereal Science, 2014, 59: 70-78.
Attenuated Total Reflectance-Fourier Transform Infrared Spectroscopy (ATR-FTIR) for Rapid Detection of Aflatoxin B1in Brown Rice
SHEN Fei1, WU Qifang1, TANG Pei’an1, SHAO Xiaolong1, JIANG Dafeng2
(1. Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China; 2. Shandong Center for Disease Control and Prevention, Jinan 250014, China)
Abstract: The objective of this work was to establish a rapid method for aflatoxin B1detection in brown rice by attenuated total reflectance-Fourier transform infrared spectroscopy (ATR-FTIR). A set of 16 brown rice samples were sterilized with radiation, incubated after inoculation with toxigenic strains and stored under appropriate conditions (28 ℃ and 85% RH) for 30 days, and the concentrations of AFB1were determined. Then the samples contaminated by AFB1were blended with blank samples in various weight proportions. A total of 128 samples with concentrations ranging from 0 to 890.20 μg/kg were obtained. The ATR-FTIR calibration results indicated that a classification accuracy of 83.3% was obtained by K nearest neighbors (KNN) when the samples were divided into four groups according to AFB1concentration. Quantitative analysis model was built by partial least square regression (PLSR), which showed the best performance in predication, and the regression coefficient of validation (rv), root mean square error of prediction (RMSEP) as well as RPD value, which were 0.970, 70.8 μg/kg and 4.0, respectively. Overall, ATR-FTIR offers a feasible method for rapid screening of brown rice samples contaminated by AFB1. However, further study is needed to improve the prediction power for samples with low AFB1concentrations.
Key words: attenuated total reflectance-Fourier transform infrared spectroscopy (ATR-FTIR); brown rice; aflatoxin B1(AFB1); rapid detection
收稿日期:2015-09-15
基金项目:国家自然科学基金青年科学基金项目(31301482);江苏省青年自然科学基金项目(BK20131007);江苏省高校自然科学研究项目(13KJB550009);江苏高校优势学科建设工程资助项目
作者简介:沈飞(1984—),男,讲师,博士,主要从事粮食储藏和检测技术研究。E-mail:shenfei0808@163.com
DOI:10.7506/spkx1002-6630-201612033
中图分类号:TS272.7;O657.3
文献标志码:A
文章编号:1002-6630(2016)12-0187-05