QuEChERS-超高效液相色谱-串联质谱法快速测定饮料中13种饱和内酯类合成香料
王玉健1,纪少凡1,陈文慧1,黄惠玲1,董存柱2,*
(1.海南出入境检验检疫局检验检疫技术中心,海南 海口 570311;2.海南大学环境与植物保护学院,海南 海口 570228)
摘 要:建立超高效液相色谱-串联质谱法快速测定饮料中13种饱和内酯类合成香料的方法。采用QuEChERS前处理法,以乙腈提取,N-丙基乙二胺填料吸附剂直接净化,电喷雾离子源、多反应监测正离子模式扫描,外标法定量。13种饱和内酯在0.025~0.50 μg/mL范围内质量浓度与峰面积呈良好的线性关系,仪器检出限为0.025 μg/mL,方法的检出限为0.10 mg/kg,定量限为0.40 mg/kg,添加量为0.10、0.20、0.40 mg/kg时13种饱和内酯的平均回收率范围分别为88.5%~103%,相对标准偏差为3.8%~11%(n=10)。本方法可用于饮料中饱和内酯类化合物的快速定性、定量检测。
关键词:饱和内酯类香料;饮料;QuEChERS;超高效液相色谱-串联质谱
王玉健, 纪少凡, 陈文慧, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定饮料中13种饱和内酯类合成香料[J].食品科学, 2016, 37(12): 197-202. DOI:10.7506/spkx1002-6630-201612035. http://www.spkx.net.cn
WANG Yujian, JI Shaofan, CHEN Wenhui, et al. Rapid determination of 13 synthetic saturated lactones added as flavors in beverage by QuEChERS method coupled with ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(12): 197-202. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612035. http://www.spkx.net.cn
饱和内酯类化合物是一类非常重要的食用香料,天然存在于各种水果中,现已广泛用于各种饮料焙烤食品等食用香精的配方中[1]。γ-内酯和δ-内酯类香料,是其中需求量较大的香料产品[2],γ-与δ-内酯类香料的分子结构参见文献[3]。γ-内酯是γ-羟基羧酸分子内酯化得到的一类内酯类化合物,它们富含奶香、果香,具有留香时间长、香气圆润等特点,δ-内酯是δ-羟基羧酸分子内酯化得到的一类内酯类化合物,它们具有奶香、椰香、果香[4]。GB 2760—2014《食品添加剂使用标准》附表3中列出了食品中13种常用饱和内酯类香料化合物,即γ-丁内酯、γ-戊内酯、γ-己内酯、γ-庚内酯、γ-辛内酯、γ-壬内酯、δ-壬内酯、γ-癸内酯、δ-癸内酯、γ-十一内酯、δ-十一内酯、γ-十二内酯和δ-十二内酯[5]。虽然它们被认为是一种“自我限量”的添加物,它的添加量往往受到消费者的接受程度的控制[6-7],一般情况下不会出现超量使用的问题,但是随着食品工业的日益发展,香精香料使用的逐渐普遍,消费者的味蕾对于香味的识别阈值也在逐年提高,可能造成食用香精香料在使用过程中逐渐增量[8-9],加之合成工业的发展以及香料功能的扩展[10],为消费者健康带来隐患。因此,建立γ-、δ-饱和内酯类合成香料含量的检测方法很有必要。
国内外关于食品中香精香料类物质检测的前处理方法主要采用蒸馏法[11]、顶空固相萃取法[12]、加速溶剂萃取法[13]、固相萃取法[14]、搅拌棒吸附萃取法[15]、微波辅助萃取法[16]等。目前文献报道的γ-、δ-饱和内酯类化合物检测主要为食品中致香成分的检测,均采用气相色谱或气相色谱-质谱法。于铁妹等[17]利用气相色谱-质谱联用技术对两种天然奶味香精中的致香成分进行了分析鉴定,发现了δ-癸内酯、γ-十一烷内酯(桃醛)、δ-壬内酯、γ-十二内酯、γ-壬内酯、γ-癸内酯等7种内酯类致香成分。侯园园等[18]使用气相色谱-嗅闻和气相色谱-质谱结合,测定了天然乳脂中的风味化合物,发现了己内酯、辛内酯、癸内酯、十二内酯等内酯类致香物质。Ferreira 等[19]选用Bond Elut-ENV填料固相萃取柱、以二氯甲烷洗脱的方法,结合气相色谱-离子阱质谱,分析了葡萄酒中的8种γ-、δ-内酯类化合物(C8~C12)致香成分,包括γ-辛内酯、十一内酯和十二内酯。Wong等[20]采用自填充萃取柱法,结合气相色谱技术,检测了切达奶酪中的致香成分,包括γ-十二内酯、δ-癸内酯、δ-十二内酯和δ-十四内酯。方法前处理使用固相萃取柱或自填充萃取柱,过程繁琐,且均使用致香物质检测常用的气相色谱或气相色谱-质谱技术,未见使用液相色谱-串联质谱检测食品中饱和内酯类香料成分的文献报道。液相色谱-串联质谱可在一级质谱条件下获得很强的待测物准分子离子峰,并且可借助二级质谱对准分子离子进行裂解,从而准确地进行在线定性定量[21]。高效液相色谱的高分离度和串联质谱的高选择性、高灵敏度相结合,能够实时分析复杂的样品,在高效液相色谱难以分离的条件下,使用串联质谱的多反应监测模式(multi reaction monitor,MRM),可以克服复杂样品背景的干扰,提高化合物分子离子的信噪比和灵敏度[22]。因此,本实验采用QuEChERS(quick easy cheap effective rugged safe)前处理方法,结合超高效液相色谱-串联质谱技术,建立了同时定性、定量测定饮料中γ-丁内酯、γ-戊内酯、γ-己内酯、γ-庚内酯、γ-辛内酯、γ-壬内酯、δ-壬内酯、γ-癸内酯、δ-癸内酯、γ-十一内酯、δ-十一内酯、γ-十二内酯、δ-十二内酯13种饱和内酯类合成香料含量的方法,将固相分散萃取填料直接加入乙腈提取液中离心净化,前处理简单、快速,适用性强。
1 材料与方法
1.1 材料、试剂与仪器
饮料 市购。
乙腈、甲酸(均为色谱纯) 美国Tedia公司;其余试剂均为分析纯;γ-丁内酯、γ-戊内酯、γ-己内酯、γ-庚内酯、γ-辛内酯、γ-壬内酯、δ-壬内酯、γ-癸内酯、δ-癸内酯、γ-十一内酯、δ-十一内酯、γ-十二内酯、δ-十二内酯13种内酯(纯度均≥95%) 日本TCI公司;混合标准溶液:用乙腈配制成100 mg/L标准储备液,0~4 ℃避光保存。
1200超高效液相色谱仪 美国安捷伦公司;API 4000Q四极杆质谱仪(配有电喷雾离子源) 美国ABI公司;Harvard II针泵 美国Varian公司;MS3 Basic旋涡混匀器 广州IKA公司;Centrifuge 5810R离心机德国Eppendorf公司;G-285电子天平 梅特勒-托利多(上海)有限公司;氮吹仪 美国Caliper公司。
1.2 方法
1.2.1 样品处理
称取待测样品5 g(精确至0.01 g)于50 mL具塞离心管中,加入10 mL乙腈,涡旋振荡2 min,加入4 g无水硫酸镁和10 g氯化钠,涡旋混合1 min,以4 000 r/min离心5min,加入50 mg N-丙基乙二胺吸附剂,混合30 s后离心5 min,取上清液0.5 mL,加入0.5 mL水,涡旋混匀后过0.2 μm有机滤膜,待测。
1.2.2 色谱条件
色谱柱为Shiseido Capacell Pak ADME(100 mm× 2.1 mm,3 μm);流动相:A为乙腈,B为0.1%甲酸溶液。梯度洗脱程序:0~8.0 min,10%~90% A;8.0~10.0 min,保持90% A;10.0~10.1 min,90%~10% A;10.1~15.0 min,保持10% A。流速0.50 mL/min,进样量10 μL。
1.2.3 质谱条件
电喷雾离子源;正离子扫描;模式MRM;离子源温度500 ℃;离子源电压5 000 V;雾化气、气帘气、辅助气和碰撞气均为高纯氮气。MRM监测离子对、去簇电压及碰撞电压见表1。
2 结果与分析
2.1 提取条件的选择
QuEChERS法是2003年由美国农业部Anastassiades教授等[23]共同开发、后经过多方面的验证和改进,正式提出的,后经证实有超过200种化合物可用该方法进行检测[24]。QuEChERS法采用乙腈作为提取溶剂,表明乙腈可萃取宽范围极性化合物。γ-丁内酯、γ-戊内酯、γ-己内酯、γ-庚内酯、γ-辛内酯、δ-壬内酯、γ-壬内酯、δ-癸内酯、γ-癸内酯、δ-十一内酯、γ-十一内酯、δ-十二内酯、γ-十二内酯13种饱和内酯在乙腈中的溶解性均较好,且对糖、蛋白质类化合物较难提取[25-26],本方法采用乙腈作为提取试剂,以取得良好的提取效率,且共萃物较少。
2.2 仪器分析条件的选择
分别考察了甲醇-水、乙腈-水体系作为流动相时目标化合物的响应,结果发现以甲醇-水为流动相时,目标化合物的峰形较好,且响应均优于乙腈-水流动相体系。同时比较了在流动相中分别加入0.1%甲酸溶液和5 mmol/L乙酸铵溶液的效果,结果表明峰形和分离度无明显差别,而甲醇-0.1%甲酸溶液作为流动相时,目标化合物的响应较高,因此本实验选择以甲醇-0.1%甲酸溶液为流动相。
2.3 质谱条件的选择
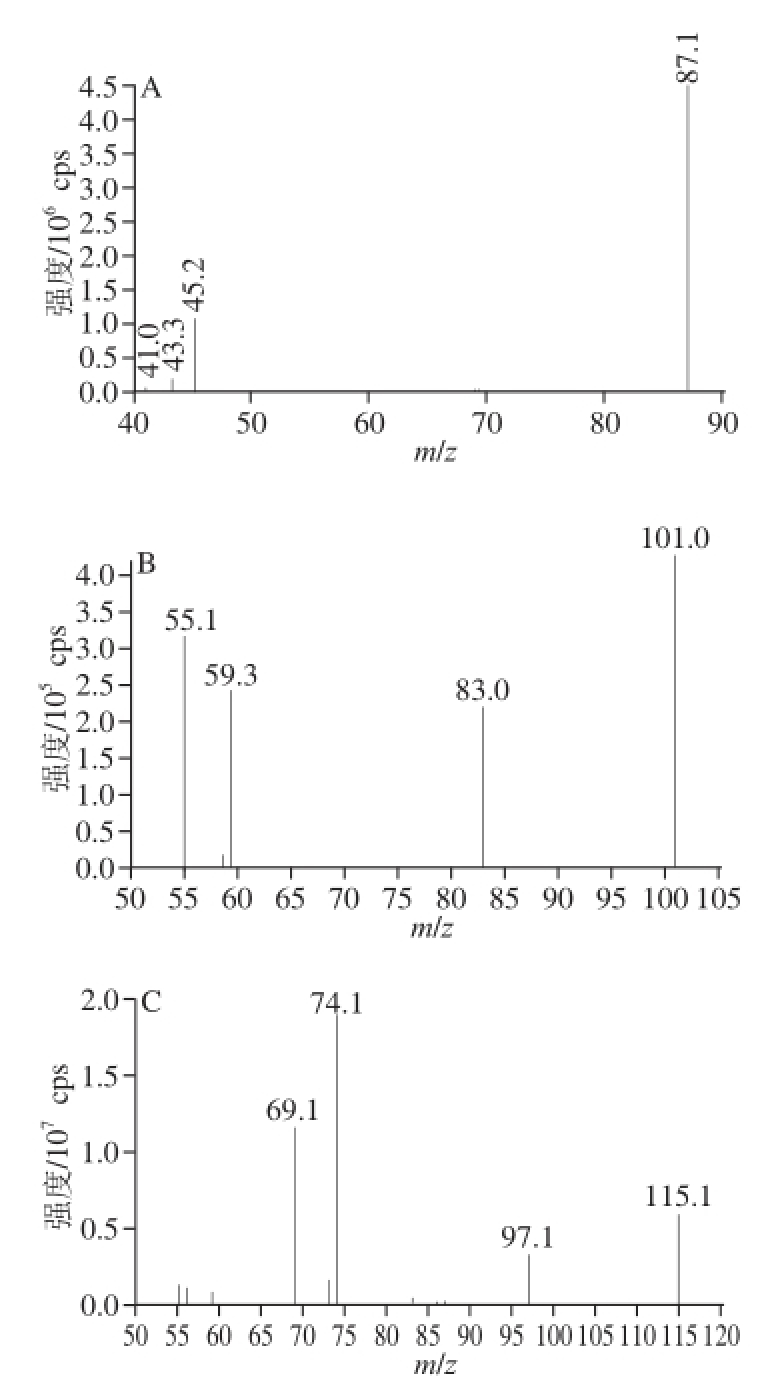
将13种内酯标准品溶液采用流动注射直接进样,通过全扫描确定化合物母离子,再对母离子进行二级质谱扫描,得到碎片离子,通过优化条件,得到二级质谱图。通过MRM选择相对丰度较高的离子对,确定为定性定量离子对,并优化去簇电压、碰撞电压等参数,综合考量离子丰度、背景干扰等因素,确定质谱条件见表1。图1为13种内酯子离子全扫描质谱图。
图1 13种饱和内酯子离子全扫描质谱
Fig. 1 Full scan mass spectra of 13 saturated lactones
A. γ-丁内酯;B. γ-戊内酯;C. γ-己内酯;D. γ-庚内酯;E. γ-辛内酯;F.壬内酯;G.癸内酯;H.十一内酯;I.十二内酯。
2.4 线性关系及检出限实验结果
以空白样品基质配制一系列不同质量浓度的混合标准工作溶液(0.025、0.050、0.075、0.10、0.20、0.40、0.50、0.80、1.0 μg/mL),并依次进样,分别以目标化合物的峰面积Y为纵坐标,以相应的质量浓度X为横坐标,作标准曲线。结果表明,13种饱和内酯在0.025~0.50 μg/mL范围内质量浓度与峰面积均呈良好的线性关系。为检验方法的稳定性和重复性,对0.025 μg/mL的标准溶液进行同日内不同时间段10 次重复进样,13种内酯峰面积的变异系数为1.44%~4.69%,表明本方法的重复性和稳定性良好。线性方程及同日内10 次进样峰面积变异系数见表2。
表2 13种饱和内酯化合物的线性方程及相关系数
Table 2 Linear equations and correlation coefficients for 13 targete comp ounds
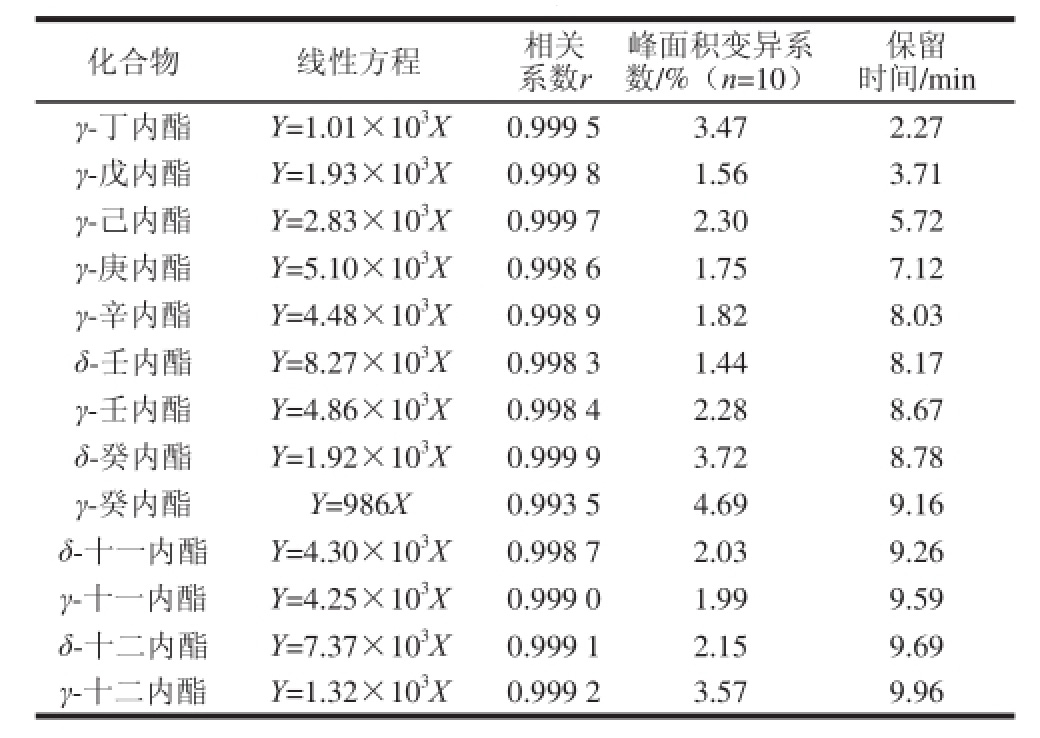
化合物 线性方程 相关系数r峰面积变异系数/%(n=10)保留时间/min γ-丁内酯 Y=1.01×103X 0.999 5 3.47 2.27 γ-戊内酯 Y=1.93×103X 0.999 8 1.56 3.71 γ-己内酯 Y=2.83×103X 0.999 7 2.30 5.72 γ-庚内酯 Y=5.10×103X 0.998 6 1.75 7.12 γ-辛内酯 Y=4.48×103X 0.998 9 1.82 8.03 δ-壬内酯 Y=8.27×103X 0.998 3 1.44 8.17 γ-壬内酯 Y=4.86×103X 0.998 4 2.28 8.67 δ-癸内酯 Y=1.92×103X 0.999 9 3.72 8.78 γ-癸内酯 Y=986X 0.993 5 4.69 9.16 δ-十一内酯 Y=4.30×103X 0.998 7 2.03 9.26 γ-十一内酯 Y=4.25×103X 0.999 0 1.99 9.59 δ-十二内酯 Y=7.37×103X 0.999 1 2.15 9.69 γ-十二内酯 Y=1.32×103X 0.999 2 3.57 9.96
以实际检测时的信噪比(RSN)为3作为检出限,仪器检出限为0.025 μg/mL,方法的检出限为0.10 mg/kg,定量限为0.40 mg/kg。13种内酯的MRM色谱图见图2。
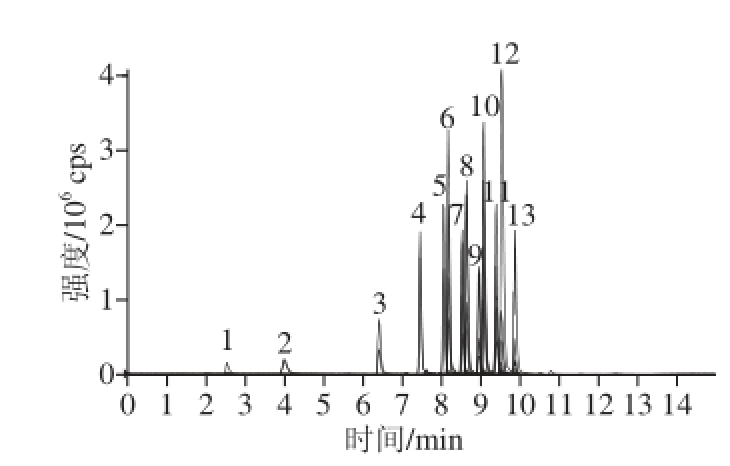
图2 13种饱和内酯标样的MRM色谱图
Fig. 2 MRM chromatogram of 13 saturated lactone standards
1. γ-丁内酯;2. γ-戊内酯;3. γ-己内酯;4. γ-庚内酯;5. γ-辛内酯;6. δ-壬内酯;7. γ-壬内酯;8. δ-癸内酯;9. γ-癸内酯;10. δ-十一内酯;11. γ-十一内酯;12. δ-十二内酯;13. γ-十二内酯。图3、4同。
2.5 回收率与精密度实验结果
采用标准添加法,在5 g(精确至0.01 g)阴性橙汁、椰汁样品中进行3 个水平(0.10、0.20、0.40 mg/kg)、10 个平行的添加回收实验,测定后得到13种内酯化合物的平均回收率和相对标准偏差(relative standard deviation,RSD)。在实验条件下,3 个添加水平下目标化合物的平均回收率范围为88.5%~103%,RSD为3.8%~11%,满足残留分析要求(表3)。
表3 3 个添加水平下目标化合物的平均回收率和RSD(n=10)
Table 3 Spiked recoveries and RSDs of saturated lactones (n=10)
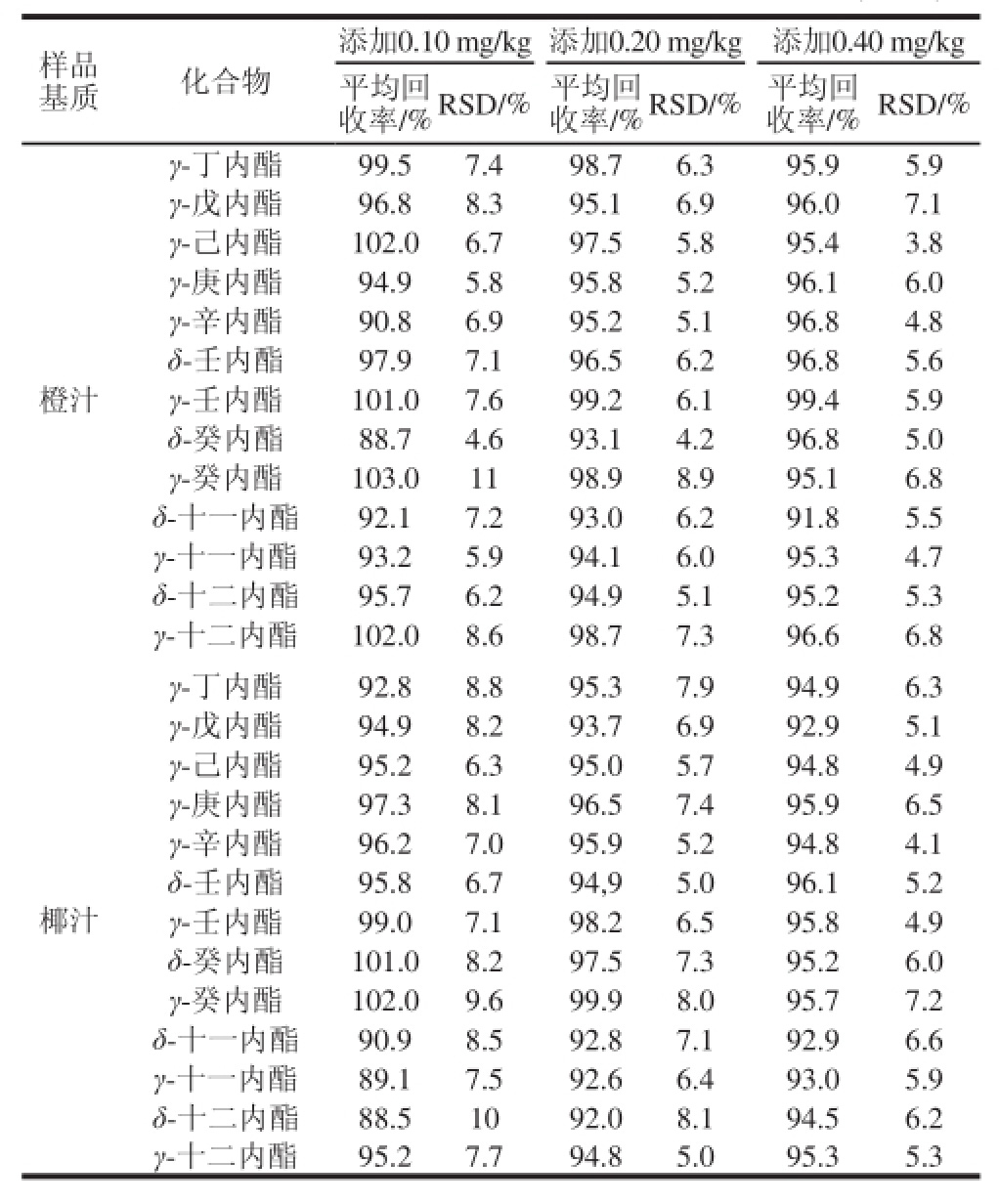
样品基质 化合物添加0.10 mg/kg添加0.20 mg/kg 添加0.40 mg/kg平均回收率/%RSD/%平均回收率/%RSD/% 平均回收率/%RSD/%橙汁γ-丁内酯 99.5 7.4 98.7 6.3 95.9 5.9 γ-戊内酯 96.8 8.3 95.1 6.9 96.0 7.1 γ-己内酯 102.0 6.7 97.5 5.8 95.4 3.8 γ-庚内酯 94.9 5.8 95.8 5.2 96.1 6.0 γ-辛内酯 90.8 6.9 95.2 5.1 96.8 4.8 δ-壬内酯 97.9 7.1 96.5 6.2 96.8 5.6 γ-壬内酯 101.0 7.6 99.2 6.1 99.4 5.9 δ-癸内酯 88.7 4.6 93.1 4.2 96.8 5.0 γ-癸内酯 103.0 11 98.9 8.9 95.1 6.8 δ-十一内酯 92.1 7.2 93.0 6.2 91.8 5.5 γ-十一内酯 93.2 5.9 94.1 6.0 95.3 4.7 δ-十二内酯 95.7 6.2 94.9 5.1 95.2 5.3 γ-十二内酯 102.0 8.6 98.7 7.3 96.6 6.8椰汁γ-丁内酯 92.8 8.8 95.3 7.9 94.9 6.3 γ-戊内酯 94.9 8.2 93.7 6.9 92.9 5.1 γ-己内酯 95.2 6.3 95.0 5.7 94.8 4.9 γ-庚内酯 97.3 8.1 96.5 7.4 95.9 6.5 γ-辛内酯 96.2 7.0 95.9 5.2 94.8 4.1 δ-壬内酯 95.8 6.7 94,9 5.0 96.1 5.2 γ-壬内酯 99.0 7.1 98.2 6.5 95.8 4.9 δ-癸内酯 101.0 8.2 97.5 7.3 95.2 6.0 γ-癸内酯 102.0 9.6 99.9 8.0 95.7 7.2 δ-十一内酯 90.9 8.5 92.8 7.1 92.9 6.6 γ-十一内酯 89.1 7.5 92.6 6.4 93.0 5.9 δ-十二内酯 88.5 10 92.0 8.1 94.5 6.2 γ-十二内酯 95.2 7.7 94.8 5.0 95.3 5.3
橙汁、椰汁阴性样品和标准添加样品的MRM色谱图见图3、4。
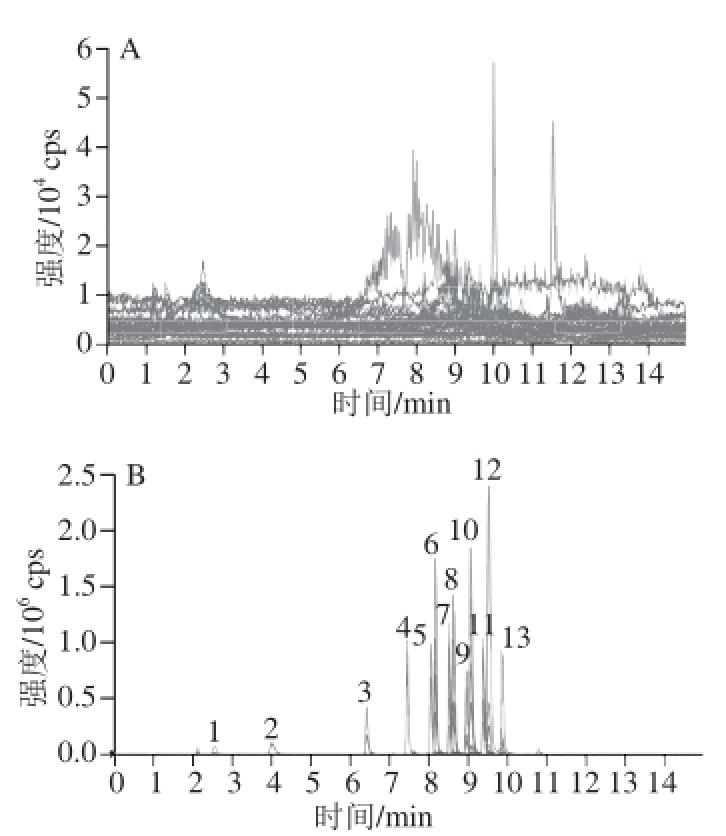
图3 橙汁阴性样品(A)和橙汁加标样品(B)中13种饱和内酯化合物残留的MRRMM色谱图
Fig. 3 MRM chromatogram of 13 saturated lactones in orange juice
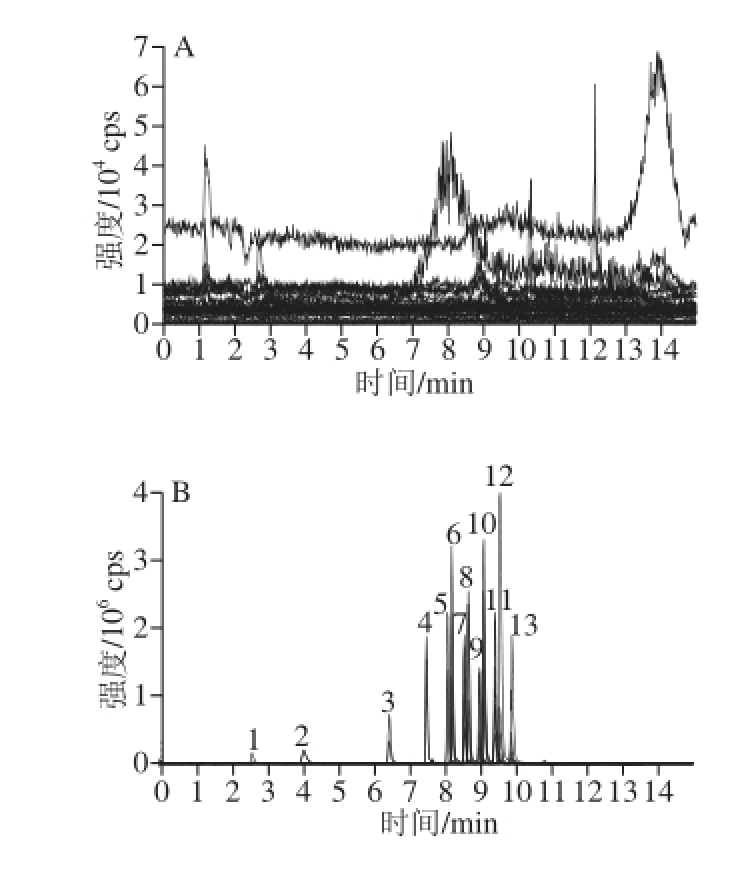
图4 椰汁阴性样品(A)和椰汁加标样品(B)中13种饱和内酯化合物残留的MRRMM色谱图
Fig. 4 MRM chromatogram of 13 saturated lactones in blank and spiked samples of coconut milk
2.6 实际样品的检测结果
将本方法应用于1 个市售橙汁和2 个市售椰子汁的检测,其中1 个椰子汁同时检出γ-辛内酯、δ-癸内酯和δ-十二内酯,含量分别为2.29、0.590 mg/kg和0.336 mg/kg。
3 结 论
本实验采用QuEChERS前处理,结合分散固相萃取法和超高效液相色谱-串联质谱法,建立了饮料中13种饱和内酯类物质含量的测定方法,方法前处理简单、快速,操作简便易行,且准确、灵敏度高、重复性好、检出限低,具有较强的实用性。
参考文献:
[1] 孙宝国, 何坚. 香料化学与工艺学[M]. 2版. 北京: 化学工业出版社, 2004: 373-391.
[2] 王勇志, 赵征, 曹小红. γ-癸内酯的生物法制取[J]. 食品与发酵工业, 2000, 26(4): 82-85. DOI:10.3321/j.issn:0253-990X.2000.04.018.
[3] 程劼. γ-与δ-内酯香料超临界流体色谱手性拆分方法研究[D]. 北京:北京工商大学, 2009.
[4] 孙宝国. 食用调香术[M]. 北京: 化学工业出版社, 2003.
[5] GB 2760—2014 食品添加剂使用标准[S]. 2014.
[6] TIMOTHY B A, ROBERT L S. Issues and challenges in the safety evaluation of food flavors[J]. Toxicology Letters, 2004, 149(1/2/3): 209-213. DOI:10.1016/j.toxlet.2003.12.032.
[7] MUNRO I C, KENNEPOHL E, KROES R. A procedure for the safety evaluation of flavoring substances[J]. Food and Chemical Toxicology, 1999, 37(2/3): 207-232. DOI:10.1016/S0278-6915(98)00112-4.
[8] 程雷, 孙宝国, 宋焕禄, 等. 食用香精香料的安全性评价现状及发展趋势[J]. 食品科学, 2010, 31(21): 409-412.
[9] 汤晨, 张蕾, 仇智宁. 试论食用香精香料安全性[J]. 粮食与油脂, 2012(7): 50-51. DOI:10.3969/j.issn.1008-9578.2012.07.015.
[10] GALLORI S, FLAMINI G, BILIA A R, et al. Chemical composition of some traditional herbal drug preparations: essential oil and aromatic water of costmary (Balsamita suaveolens Pers.)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5907-5910. DOI:10.1021/jf0107656.
[11] EDUARDO I, CHIETERA G, BASSI D, et al. Identification of key odor volatile compounds in the essential oil of nine peach accessions[J]. Society of Chemical Industry, 2010, 90(7): 1146-1154. DOI:10.1002/jsfa.3932.
[12] CHARRY-PARRA G, DEJESUS-ECHEVARRIA M, PEREZ F J. Beer volatile analysis: optimization of HS/SPME coupled to GC/MS/ FID[J]. Journal of Food Science, 2011, 76(2): 205-209. DOI:10.1111/ j.1750-3841.2010.01979.x.
[13] CICCHETTI E, CHAINTREAU A. Comparison of extraction techniques and modeling of accelerated solvent extraction for the authentication of natural vanilla flavors[J]. Journal of Separation Science, 2009, 32(11): 1957-1964. DOI:10.1002/jssc.200800650.
[14] JESIONOWSKI T, DZIADAS M, NOWACKA M. Comparison of silica gel modified with three different functionalgroups with C-18 and styrene-divinylbenzene adsorbents for the analysis of selected volatile flavor compounds[J]. Analytica Chimica Acta, 2011, 699(1): 66-72. DOI:10.1016/j.aca.2011.05.011.
[15] KARHY R, SAM P D L, ROGER M S, et al. An alternative method for analysis of food taints using stir bar sorptive extraction[J]. Analytica Chimica Acta, 2010, 677(1): 29-36. DOI:10.1016/j.aca.2010.01.049.
[16] DAI J M, ORSAT V, RAGHAVAN V G S, et al. Investigation of various factors for the extraction of peppermint leaves[J]. Journal of Food Engineering, 2010, 96(4): 540-543. DOI:10.1016/ j.jfoodeng.2009.08.037.
[17] 于铁妹, 王卫飞, 杨博, 等. GC-MS分析天然奶味香精的致香成分[J]. 现代食品科技, 2008, 24(1): 80-82. DOI:10.3969/ j.issn.1673-9078.2008.01.02.
[18] 侯园园, 王兴国, 刘元法. GC-O与GC-MS结合鉴定天然乳脂风味中的特征致香成分[J]. 食品工业科技, 2008, 29(3): 143-145.
[19] FERREIRA V, JARAUTA I, ORTEGA L, et al. Simple strategy for the optimization of solid-phase extraction procedures through the use of solid-liquid distribution coefficients: application to the determination of aliphatic lactones in wine[J]. Journal of Chromatography A, 2004, 1025(2): 147-156. DOI:10.1016/j.chroma.2003.10.086.
[20] WONG N P, ELLIS R, LACROIX D E. Quantitative determination of lactones in Cheddar Cheese[J]. Journal of Dairy Science, 1975, 58(10): 1437-1441. DOI:10.3168/jds.S0022-0302(75)84734-5.
[21] 徐远金, 李永库. 液相色谱-电喷雾质谱联用法测定蔬菜中7种有机磷农药残留量[J]. 分析测试学报, 2006, 25(4): 36-40. DOI:10.3969/ j.issn.1004-4957.2006.04.009.
[22] 罗亚男. 高效液相色谱串联质谱技术在药物分析中的应用[D]. 合肥: 中国科学技术大学, 2011. DOI:10.7666/d.d141695.
[23] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
[24] LEHOTAY S J, KOK A, HIEMSTRA M, et al. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J]. Journal of AOAC International, 2005, 88(2): 595-614.
[25] MAŠTOVSKÁ K, LEHOTAY S J. Evaluation of common organic solvents for gas chromatographic analysis and stability of multiclass pesticide residues[J]. Journal of Chromatography A, 2004, 1040: 259-272. DOI:10.1016/j.chroma.2004.04.017.
[26] GONZÁLEZ-RODRÍGUEZ R M, RIAL-OTERO R, CANCHOGRANDE B, et al. Determination of 23 pesticide residues in leafy vegetables using gas chromatography-ion trap mass spectrometry and analyte protecants[J]. Journal of Chromatography A, 2008, 1196/1197: 100-109. DOI:10.1016/j.chroma.2008.02.087.
Rapid Determination of 13 Synthetic Saturated Lactones Added as Flavors in Beverage by QuEChERS Method Coupled with Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
WANG Yujian1, JI Shaofan1, CHEN Wenhui1, HUANG Huiling1, DONG Cunzhu2,*
(1. Inspection and Quarantine Technology Center, Hainan Entry-Exit Inspection and Quarantine Bureau, Haikou 570311, China; 2. College of Environment and Plant Protection, Hainan University, Haikou 570228, China)
Abstract: A method for determining 13 synthetic saturated lactones added as flavors in beverage by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) was established. The target compounds were extracted with acetonitrile and determined by quick easy cheap effective rugged and safe (QuEChERS) pretreatment coupled with UPLC-MS/MS (under MRM mode) with an external standard method. The limits of detection (LODs) were 0.025 μg/mL for the instrument and 0.10 mg/kg for the method, respectively. The limit of quantitation (LOQ) was 0.40 mg/kg for the method. The average recoveries of 13 lactones were between 88.5% and 103% at spiked levels of 0.10, 0.20 and 0.40 mg/kg with relative standard derivation (RSDs) of 3.8%–11% (n=10). The method was reliable and allowed simultaneous quantitative determination of saturated lactones in beverage.
Key words: saturated lactones; beverage; QuEChERS; ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS)
收稿日期:2015-09-07
基金项目:国家质检总局科技计划项目(2013IK153);海南省重点科技计划项目(ZDXM2014083);国家自然科学基金青年科学基金项目(31360447);海南省自然科学基金项目(212018;313105)
作者简介:王玉健(1979—),女,高级工程师,博士,研究方向为食品中有毒有害物残留检测。E-mail:wyj_success@sohu.com
*通信作者:董存柱(1978—),男,副教授,博士,研究方向为有毒有害物检测。E-mail:czd@hainu.edu.cn
DOI:10.7506/spkx1002-6630-201612035
中图分类号:TS262.6;O657.63
文献标志码:A
文章编号:1002-6630(2016)12-0197-06引文格式:

 O 86.09 87.1 45.1、43.1 63、63 21.5、22.0 γ-戊内酯O
O 86.09 87.1 45.1、43.1 63、63 21.5、22.0 γ-戊内酯O O?
O? 100.12 101.0 55.2、83.1 60、60 18、13 γ-己内酯O
100.12 101.0 55.2、83.1 60、60 18、13 γ-己内酯O O?
O? 114.14 115.1 69.2、97.0 21、21 18、12 γ-庚内酯O
114.14 115.1 69.2、97.0 21、21 18、12 γ-庚内酯O O?
O? 128.17 129.1 83.1、111.1 42、42 11.3、18.0 γ-辛内酯O
128.17 129.1 83.1、111.1 42、42 11.3、18.0 γ-辛内酯O O
O 142.20 143.1 125.1、97.1 31.5、31.5 10.5、14.2 δ-壬内酯O
142.20 143.1 125.1、97.1 31.5、31.5 10.5、14.2 δ-壬内酯O
 O?156.22 157.1 139.1、97.1 57、57 14、18.4 γ-壬内酯O
O?156.22 157.1 139.1、97.1 57、57 14、18.4 γ-壬内酯O O
O 156.22 157.1 139.1、121.1 64、64 11、13 δ-癸内酯O
156.22 157.1 139.1、121.1 64、64 11、13 δ-癸内酯O O 170.25 171.1 111.1、135.2 40、40 18、12 γ-癸内酯O
O 170.25 171.1 111.1、135.2 40、40 18、12 γ-癸内酯O O
O
 170.25 171.2 111.2、135.1 40、40 18、11.6 δ-十一内酯O
170.25 171.2 111.2、135.1 40、40 18、11.6 δ-十一内酯O
 O 184.28 185.1 167.2、149.2 72.5、72.5 12.9、14.0 γ-十一内酯O
O 184.28 185.1 167.2、149.2 72.5、72.5 12.9、14.0 γ-十一内酯O O
O
 184.28 185.2 167.1、149.1 63、63 10、14 δ-十二内酯O
184.28 185.2 167.1、149.1 63、63 10、14 δ-十二内酯O O
O 198.30 199.1 181.0、111.1 34.9、34.9 10.8、13.7 γ-十二内酯O
198.30 199.1 181.0、111.1 34.9、34.9 10.8、13.7 γ-十二内酯O


 O 198.30 199.2 181.1、163.2 85、85 11.6、14.0
O 198.30 199.2 181.1、163.2 85、85 11.6、14.0