表1 梯度洗脱程序
Table 1 Gradient elution program
蔡鲁峰1,2,李 娜1,2,杜 莎1,谭 雅1,李 珂1,王远亮1,*
(1.湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.湖南省商业技师学院烹饪系,湖南 株洲 412000)
摘 要:建立采用固相萃取-高效液相色谱法同时测定肉制品中9种N-亚硝基化合物的方法。以甲醇为提取剂,60 ℃条件下超声提取,经CNWBOND HC-C18固相萃取柱净化后,采用AQ-C18色谱柱分析。甲醇和超纯水为流动相实现了待测物的良好分离,紫外检测器检测,结合保留时间和光谱图定性,外标法定量。结果表明:9种N-亚硝基化合物线性关系良好,相关系数均大于0.99;方法定量限(RSN= 10)为0.047~0.097 μg/g;回收率为72.6%~97.6%;相对标准偏差(n=6)为3.1%~7.9%。此方法前处理简单、回收率高、精密度好,适用于肉制品中9种N-亚硝基化合物的同时测定。
关键词:N-亚硝基化合物;固相萃取;高效液相色谱;肉制品
引文格式:
蔡鲁峰, 李娜, 杜莎, 等. 固相萃取净化-高效液相色谱法测定肉制品中的9种N-亚硝基化合物[J]. 食品科学, 2016, 37(12): 217-221. DOI:10.7506/spkx1002-6630-201612039. http://www.spkx.net.cn
CAI Lufeng, LI Na, DU Sha, et al. Determination of nine N-nitroso compounds in meat products by solid phase extraction purification and high performance liquid chromatography[J]. Food Science, 2016, 37(12): 217-221. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612039. http://www. spkx.net.cn
在已知的N-亚硝基化合物(N-nitroso compounds,NOCs)中超过300种具有致癌性,并且90%以上的已经 证实具有致癌活性[1]。目前关于NOCs检测方法的研究报道主要涉及食品样品如罐头食品[2]、肉制品[3-4],环境样品如废水[5]等,日化样品如化妆品[6],胶制品如橡胶[7]、乳胶[8]以及烟草[9]等。在肉制品中已鉴定报道的NOCs至少有15 个[10],这些物质存在于培根、香肠、烟熏羊肉、下水肉制品、火腿等肉制品中。不同种类的加工肉制品所含的NOCs的种类和含量也不同,Sannino 等[11]对干腌火腿、意大利香肠、法兰克福香肠、肉罐头、熏火腿、摩泰台拉香肠、金华火腿、意大利风干牛肉、杯形香肠、熏猪肉香肠共10种加工肉制品进行了分析,结果表明在所有样品中都检测到了N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA),含量在0.3~1.1 μg/kg之间,只有在法兰克福香肠中检测到N-亚硝基二丙胺(N-nitroso-di-iso-propylamine,NDPA)(0.6 μg/kg);在烟熏火腿中检测N-亚硝基吡咯烷(N-nitrosopyrrolidin,NPYP)(0.5 μg/kg) 。
由于肉制品中形成的NOCs是痕量的,一般的化学检测法无法定量检测,必须使用精密仪器和痕量物质检测法定量测定使。肉制品中NOCs的测定方法主要有分光光度法[12]、离子色谱法[13]、毛细管电泳法[14]、气相色谱-四极杆质谱法[15]、液相色谱-质谱法[16]、气相色谱-氮磷检测器法[17]、超高效液相色谱-串联质谱检测法[18]、气相色谱耦合热能分析法[19]、高效液相色谱法[20]、气相色谱-热能分析法等。其中液相 色谱除了具有气相色谱的高效、灵敏、选择性强等优点外,它还可以测定非挥发性亚硝胺;热能分析仪分析具有很好的重现性,但是仪器昂贵,应用范围较窄,一般实验室很少配备[21]。
由于肉制品中化合物众多,上机检测前必须进行前处理既提取净化,而固相萃取是利用固体吸附剂将液体样品中的目标化合物吸附,与样品的基体和干扰化合物分离,然后再用洗脱液洗脱或加热解吸附,该技术可以高效、快速并大批量处理样品,不仅提高了分析质量和效率,减少有机溶剂使用量,节约成本,而且可以降低环境污染。本研究采用固相萃取-高效液相色谱法对发酵肉制品中9种NOCs含量进行了分析,建立了快速、简便、准确、灵敏和高效的方法。
1.1 材料、试剂与仪器
发酵猪肉,原材料为猪里脊肉,自然发酵而成。
标准品:N-亚硝基二乙胺(N-nitrosodiethylamine, NDEA)、N-亚硝基哌啶(N-nitrosopiperidine,N P I P)、N D P A、N-亚硝基二丁胺(N-nitrosodibutylamine,NDBA)、N-亚硝基二苯胺(N-nitrosodiphenylamine,NDPhA)、N-亚硝基二苯胺(N-nitrosodiphenylamine,NMEA)、NDMA、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)、NPYP;常规试剂:HCl、NaOH、NaHCO3、NaCl、K2CO3、NaNO2、NaH2PO4、冰醋酸、正戊烷、正己烷、二氯甲烷(均为分析纯) 美国Sigma-Aldrich公司;乙腈、甲醇、甲酸(均为色谱纯) 美国Tedia公司。
L C-2 0 AT高效液相色谱仪(配备S P D-2 0 A紫外检测器) 日本岛津公司;AQ-C18色谱柱(250 mm×4.6 mm,5 μm) 美国Welch公司;HCC18SPE小柱(500 mg,6 mL) 美国Cnwbond公司;BG-12C 超声波清洗机 广州邦洁电子产品有限公司;13 mm 0.20 μm希波氏(Xiboshi)针式过滤器 美国Dionex公司;Milli-Q Integral超纯水机 美国Millipore公司;RE-52型旋转蒸发仪 上海亚荣生化仪器厂;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 方法
1.2.1 标准溶液的配制
根据各标准液质量浓度,用甲醇稀释,定容至100 mL棕色容量瓶中,超声混匀,配制成质量浓度为100 μg/mL的标准储备液,临用时用空白样品溶液稀释到系列标准溶液0.01、0.05、0.1、0.2、2、6、10、20 μg/mL的标准液。
1.2.2 样品预处理
将待测样品粉碎,称取1.0 g于10 mL具塞萃取瓶中,加入5 mL甲醇并浸泡样品5~10 min,于60 ℃条件下超声提取30 min,将提取液转移至洁净的圆底烧瓶中;再用5 mL甲醇重复提取一次,合并两次提取液,在旋转蒸发仪上于35 ℃负压条件下浓缩至1.0 mL左右,待净化。
将上述浓缩后的提取液转移至预先用甲醇5 mL进行活化处理,5 mL超纯水平衡后的C18固相萃取小柱中,先用5 mL的30%甲醇溶液淋洗,再用甲醇洗脱3 次,每次用量为3 mL,收集洗脱液并用氮气缓慢吹扫至0.5 mL,最后用甲醇定容至1.0 mL,过0.20 μm滤膜后供高效液相色谱测定。
1.2.3 色谱条件
AQ-C18色谱柱(250 mm×4.6 μm,5 μm);柱温35 ℃;进样体积20 μL;流动相:A,甲醇;B,超纯水;流速:0.5 mL/min;检测波长:240 nm;运行时间:40 min;梯度洗脱,洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution program

2.1 高效液相色谱条件优化
2.1.1 流动相的选择

图1 不同流动相条件下的标准物质出峰情况
Fig. 1 Chromatographic peaks of mixed NOC standards separated with different mobile phases
a.乙腈-乙酸盐缓冲液(pH 4.0);b.甲醇-1.0%甲酸溶液;c.乙腈-水;d.甲醇-水。
考察甲醇-水[22]、乙腈-水[23]、甲醇-1.0%甲酸溶液[24]、乙腈-乙酸盐缓冲液(pH 4.0)[25]体系对9种NOCs的分离效果,结果见图1。乙腈-乙酸盐缓冲液(pH 4.0)体系基线漂移,无法定量;甲醇-1.0%甲酸溶液分离效果较好,但同样存在基线漂移现象,这说明流动相中添加酸不会对峰形具有明显的改善,同时还会引起基线的漂移,影响分析结果的准确性,故实验采用不加酸流动相,这一结果与杨宁等[26]的研究结果一致。乙腈-水(含1%冰乙酸)体系洗脱能力很强,NDMA及NDEA被洗脱无法解析且基线漂移,甲醇-水体系洗脱效果较好,基线稳定,但NDBA和NDPhA未完全分开,通过调节在不同分析时间里流动相的配比,在总流速为0.5 mL/min,甲醇梯度洗脱,色谱图分离效果及峰形较好。
2.1.2 流速的确定
实验发现流速可以很大程度地影响待测组分的分离效果。本实验研究了0.3、0.5、0.8、1.0、1.2 mL/min 5 个梯度对色谱分离的影响,发现在流速为0.5 mL/min时,9种NOCs达到了最大程度的基线分离,当流速为0.8 mL/min,8号峰和9号峰不能分离,信号发生重叠,当流速为1.0 mL/min和1.2 mL/min时,3、8、9号物质不能定量洗脱,出现无峰现象;而当流速为0.3 mL/min,分析时间过长,且出现杂峰,影响分离效果,故液相色谱最佳流速为0.5 mL/min。各待测物混合标准溶液的液相色谱图见图2。

图2 各待测物混合标准溶液的液相色谱图
Fig. 2 Chromatogram of a mixed standard solution of the analytes
1. NDMA;2. NMOR;3. NPYR;4. NDEA;5. NMEA;6. NPIP;7. NDPA;8. NDBA;9. NDPhA。图6同。
2.2 固相萃取条件的优化
2.2.1 淋洗剂的选择
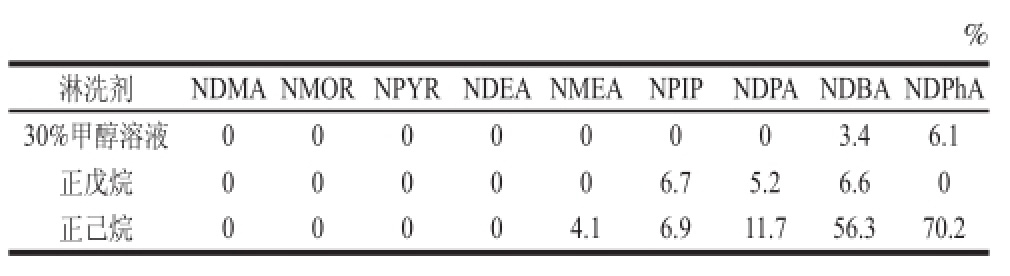
将浓缩后的提取液转移至预先用甲醇5 mL进行活化处理,5 mL超纯水平衡后的C18固相萃取小柱中,分别用30%甲醇溶液、正戊烷和正己烷各5 mL淋洗,收集洗脱液测定9种NOCs的回收率,结果见表2。正戊烷仅对NPIP、NDPA和NDBA 3种物质有微弱的解吸附能力,同时对其他6种NOCs的保留无影响;正己烷对NDBA 和NDPhA的解吸附能力较强,对NMEA、NPIP和NDPA也有微弱的解吸附能力,对其他4种NOCs的保留无影响;30%甲醇除了对NDBA和NDPhA有微弱的解吸附能力外,对其他7种NOCs的保留无影响,考虑到9种NOCs的溶解及稀释剂和有机流动相均为甲醇,故30%甲醇溶液为最佳淋洗剂。
表2 3种淋洗剂对9种NOCs的回收率
Table 2 Desorption efficiency of 9 -nitroso compounds with 3 different washing solvents
2.2.2 洗脱剂的选择
通过考察二氯甲烷、乙醇-正己烷、甲醇洗脱剂对测定9种NOCs回收率的影响。结果表明,二氯甲烷在3种洗脱剂中的回收效果最差,乙醇-正己烷次之,甲醇回收9种NOCs的效果最好。3种洗脱剂对NDBA,NDPhA的回收率都较好,而二氯甲烷、乙醇-正己烷对其他几种NOCs的回收率在31%~55%之间;甲醇对9种NOCs的回收率在76%~112%之间,因此选择甲醇作为固相萃取的洗脱剂。3种溶剂洗脱对NOCs回收率见图3。
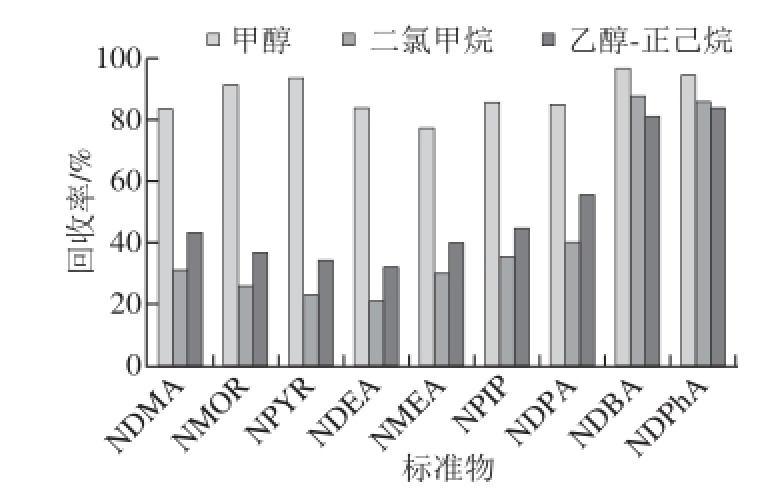
图3 不同洗脱剂对9种NOCs的回收率
Fig. 3 Recoveries of 9 nitrosamines with 3 different eluants
2.2.3 洗脱次数的选择
甲醇的用量为2 mL,考察洗脱次数对加标回收率的影响,一般来讲回收率会随着洗脱次数的增加而升高,但并不呈现线性关系。如图3所示,当洗脱1 次时9种NOCs的回收率都较低,当洗脱次数为3 次和4 次时9种标准物的回收率基本不变,曲线平缓。考虑到洗脱效果和经济及环保效益,最终选择洗脱次数为3。

图4 不同洗脱次数对9种NOCs的回收率
Fig. 4 Recoveries of 9 nitrosamines at different elution cycles
2.2.4 洗脱剂用量的选择
洗脱次数为3,考察每次甲醇的用量对9种NOCs的回收率。如图5所示,随着洗脱剂用量的不断增加,9种 NOCs的回收率逐渐升高,当洗脱剂用量为1 mL时回收率范围在42%~67%之间,洗脱效果差;当洗脱剂量为3 mL和4 mL时回收率基本不变,曲线平缓。考虑到洗脱效果和经济及环保效益,最终选择洗脱剂用量为3 mL。

图5 不同洗脱剂用量对9种NOCs的回收率
Fig. 5 Recoveries of 9 nitrosamines with different volumes of the eluant
2.3 标准曲线的建立及检出限
以高效液相色谱分离9种NOCs,在前述最优色谱分离与检测条件下,考察NOCs的峰面积与质量浓度的关系以建立标准曲线,在0.1~20 μg/mL之间线性关系良好,根据3 倍信噪比和10 倍信噪比得出9种NOCs的仪器检出限与定量限,见表3。
表3 高效液相色谱测定9种NOCs的标准曲线方程及检出限、定量限
Table 3 Standard curve equations, limit of detection and limit of quantitation for 9 nitrosamines by HPLC

2.4 方法回收率和精密度
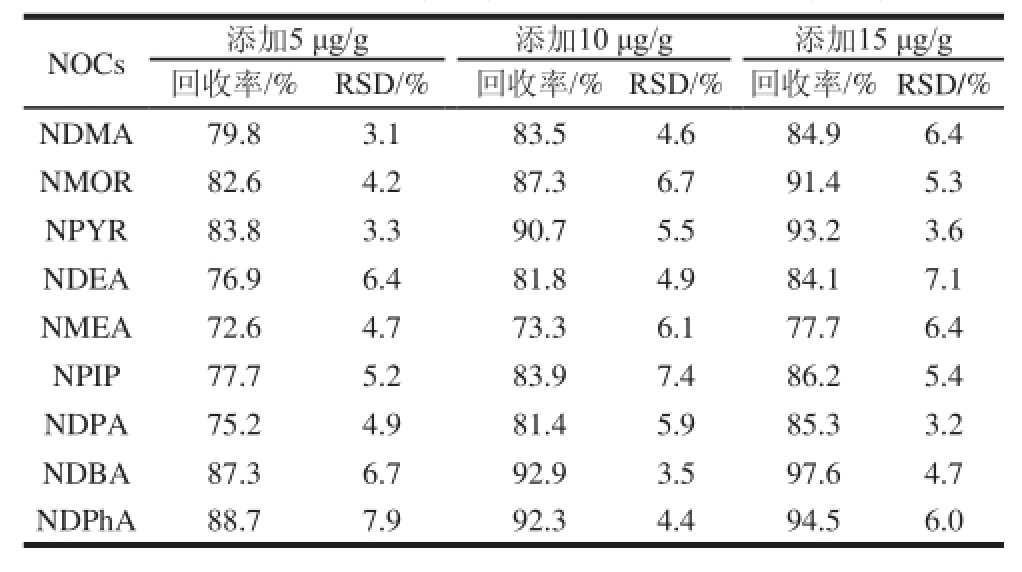
在空白样品中分别添加混合NOCs标准溶液使其添加量分别为5、10、15 μg/g,在仪器工作条件下,进行加标回收实验,结果见表4。
表4 方法回收率和精密度(n=6)
Table 4 Precision (RSD) and spiked recoveries (n= 6)
2.5 实际样品测定结果

图6 实际样品测定色谱图
Fig. 6 Chromatogram of 9 NOCs in real meat samples
利用本研究建立的方法分析测定了4 个品种的肉制品样品中9种NOCs的含量,实际样品定图谱见图6,实验结果见表5。在4种受检样品中均未检测到NMOR、NMEA、NPIP、NDPA、NDPhA;NDMA以及NDEA在4种样品中都有检测出,其含量分别在0.13~0.31 μg/kg之间和0.18~0.36 μg/kg之间;在1号和3号样品中检测到了NPYR,1、3号和4号样品中检测到了NDBA;这种结果可能是肉品原料、发酵工艺以及实验误差所导致的。
表5 实际样品中检测到9种NOCs的含量
Table 5 Contents of 9 NOCs in real meat samples

注:ND.未检出。
本研究建立了超声提取-固相萃取净化结合高效液相色谱-紫外检测器检测法测定9种NOCs含量的分析方法,在检测肉制品时能有效提取并净化其中的NOCs,降低其他物质的干扰,方法精密度和回收率均符合分析的要求,且仪器通用、前处理方便、操作简便。该方法对于NOCs的分析研究具有良好的应用前景。
参考文献:
[1] PREUSSMANN R. Carcinogenic N-nitrosocompounds and their environmental significance[J]. Naturwissenschaften, 1984, 71(1): 25-30. DOI:10.1007/BF00365976.
[2] DOMAŃSKA-BLICHARZ K, RACHUBIK J, KOWALSKI B. Occurrence of volatile N-nitrosamines in Polish tinned foods[J]. Bull Vet Inst Pulawy, 2005, 49: 319-322. DOI:10.1016/0308-8146(91)90073-W.
[3] BYUN M W, AHN H J, KIM J H, et al. Determination of volatile N-nitrosamines in irradiated fermented sausage by gas chromatography coupled to a thermal energy analyzer[J]. Journal of Chromatography A, 2004, 1054(1): 403-407. DOI:10.1016/j.chroma.2004.07.096.
[4] HUANG M, CHEN H, FU S, et al. Determination of volatile N-nitrosamines in meat products by microwave-assisted extraction coupled with dispersive micro solid-phase extraction and gas chromatography-chemical ionisation mass spectrometry[J]. Food Chemistry, 2013, 138(1): 227-233. DOI:10.1016/ j.foodchem.2012.09.119.
[5] YOON S, NAKADA N, TANAKA H. A new method for quantifying N-nitrosamines in wastewater samples by gas chromatographytriple quadrupole mass spectrometry[J]. Talanta, 2012, 97: 256-261. DOI:10.1016/j.talanta.2012.04.027.
[6] QIANG M A, HAI-WEI X I, CHAO W, et al. Determination of ten volatile nitrosamines in cosmetics by gas chromatography tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(8): 1201-1207. DOI:10.1016/S1872-2040(10)60466-5.
[7] 李琼, 李金玲, 黄理纳, 等. 高效液相色谱串联质谱法检测橡胶玩具中N-亚硝胺及其前体物[J]. 分析试验室, 2014(2): 212-216.
[8] 陈婷, 温裕云, 欧延, 等. 固相萃取净化及超高效液相色谱-串联质谱法测定橡胶制品中的13种N-亚硝胺[J]. 色谱, 2014, 32(1): 89-94. DOI:10.3724%2fSP.J.1123.2013.08003.
[9] 邓其馨, 黄朝章, 张建平, 等. 液相色谱串联质谱法测定烟用香精香料中的亚硝胺[J]. 现代食品科技, 2014(1):195-199.
[10] TRICKER A R, PREUSSMANN R. Carcinogenic N-nitrosamines in the diet: occurrence, formation, mechanisms and carcinogenic potential[J]. Mutation Research/Genetic Toxicology, 1991, 259(3): 277-289. DOI:10.1016/0165-1218(91)90123-4.
[11] SANNINO A, BOLZONI L. GC/CI-MS/MS method for the identification and quantification of volatile N-nitrosamines in meat products[J]. Food Chemistry, 2013, 141(4): 3925-3930. DOI:10.1016/ j.foodchem.2013.06.070.
[12] NAGARAJA P, HEMANTHA KUMAR M S. Spectrophotometric determination of nitrate in polluted water using a new coupling reagent[J]. Analytical Sciences, 2002, 18(3): 355-357. DOI:10.1081/ AL-120024647.
[13] MCMULLEN S E, SCHENCK F J, GROSS L K, et al. Ion chromatographic determination of nitrate and nitrite in vegetable and fruit baby foods[J]. Journal of AOAC International, 2005, 88(6): 1793-1796. DOI:10.1016/S0021-9673(97)01245-4.
[14] ÖZTEKIN N, NUTKU M S, ERIM F B. Simultaneous determination of nitrite and nitrate in meat products and vegetables by capillary electrophoresis[J]. Food Chemistry, 2002, 76(1): 103-106. DOI:10.1016/S0308-8146(01)00287-4.
[15] YOON S, NAKADA N, TANAKA H. A new method for quantifying N-nitrosamines in wastewater samples by gas chromatographytriple quadrupole mass spectrometry[J]. Talanta, 2012, 97: 256-261. DOI:10.1016/j.talanta.2012.04.027.
[16] SUNG J H, KWAK I S, PARK S K, et al. Liquid chromatographytandem mass spectrometry determination of N-nitrosamines released from rubber or elastomer teats and soothers[J]. Food Additives and Contaminants: Part A, 2010, 27(12): 1745-1754. DOI:10.1016/ j.chroma.2013.03.035.
[17] YURCHENKO S, MÖLDER U. Volatile N -Nitrosamines in various fish products[J]. Food Chemistry, 2006, 96(2): 325-333. DOI:10.1016/ j.foodchem.2005.04.009.
[18] ASAMI M, OYA M, KOSAKA K. A nationwide survey of NDMA in raw and drinking water in Japan[J]. Science of the Total Environment, 2009, 407(11): 3540-3545. DOI:10.1016/j.scitotenv.2009.02.014.
[19] BYUN M W, AHN H J, KIM J H, et al. Determination of volatile N-nitrosamines in irradiated fermented sausage by gas chromatography coupled to a thermal energy analyzer[J]. Journal of Chromatography A, 2004, 1054(1): 403-407. DOI:10.1016/j.chroma.2004.07.096.
[20] CÁDENES L, AYALA J H, GONZÁLEZ V, et al. Determination of N-nitrosodimethylamine by HPLC, with fluorescence detection. A survey of N-nitrosodimethylamine in commercial beers[J]. Journal of Liquid Chromatography and Related Technologies, 2002, 25(6): 977-984. DOI:10.1081/JLC-120003274.
[21] DRABIK-MARKIEWICZ G, van den MAAGDENBERG K, de MEY E, et al. Role of proline and hydroxyproline in N-nitrosamine formation during heating in cured meat[J]. Meat Science, 2009, 81(3): 479-486. DOI:10.1016/j.meatsci.2008.10.002.
[22] 朱翔, 李伟, 刘玉灿, 等. 超高效液相色谱-三重四极杆质谱联用仪同时检测水中9种亚硝胺[J]. 分析测试学报, 2014, 33(8): 866-872. DOI:10.3969%2fj.issn.1004-4957.2014.08.002.
[23] 陈婷, 温裕云, 欧延, 等. 固相萃取净化及超高效液相色谱-串联质谱法测定橡胶制品中的13种N-亚硝胺[J]. 色谱, 2014, 32(1): 89-94. DOI:10.3724%2fSP.J.1123.2013.08003.
[24] 罗茜, 王东红, 王炳一, 等. 超高效液相色谱串联质谱快速测定饮用水中9种N-亚硝胺的新方法[J]. 中国科学: 化学(中文版), 2011, 41(1): 82-90.
[25] 张秋菊, 崔世勇, 曹林波, 等. 固相萃取-高效液相色谱法同时测定酱腌菜中N-亚硝基二甲胺(NDMA) 和N-亚硝基二乙胺(NDEA)[J]. 中国卫生检验杂志, 2010(11): 2687-2689.
[26] 杨宁, 陈颖慧, 邓莉, 等. 双填料固相萃取-高效液相色谱/质谱法同时检测腌菜中9种N-亚硝胺[J]. 分析化学, 2013, 41(7): 1044-1049.
Determination of Nine N-Nitroso Compounds in Meat Products by Solid Phase Extraction Purification and High Performance Liquid Chromatography
CAI Lufeng1,2, LI Na1,2, DU Sha1, TAN Ya1, LI Ke1, WANG Yuanliang1,*
(1. Hunan Province Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Department of Cooking, Hunan Commercial Techincian Institute, Zhunzhou 412000, China)
Abstract: A solid-phase extraction (SPE)-high performance liquid chromatography (HPLC) method has been developed for simultaneous determination of 9 N-nitroso compounds (NOCs) in meat products. The analytes were extracted with methanol at 60 ℃ ultrasonically, purified by a CNWBOND HC-C18SPE column, and analyzed by HPLC on a Phenomenex AQ-C18column (250 mm × 4.6 mm, 5 μm) employing methanol and ultrapure water as the mobile phase in a gradient elution mode. The 9 N-nitroso compounds were qualitatively determined by retention time, and confirmed by ultraviolet spectroscopy. The results indicated that the calibration curves of the target analytes displayed good linearity with correlation coefficients (r) greater than 0.99. The method limits of quantification (MLOQ) for the target analytes ranged from 0.047 to 0.097 μg/g (RSN=10). The recoveries were in the range between 72.6% and 97.6%, and the precision (relative standard deviation, RSD) ranged from 3.1% to 7.9% (n = 6).
Key words: N-nitroso compounds; solid phase extraction (SPE); high performance liquid chromatography (HPLC); meat products
收稿日期:2015-09-20
基金项目:湖南省战略性新兴产业项目(2014GK1034);湖南省自然科学基金项目(11JJ4019);湖南省科技计划项目(2015WK3015);湖南农业产业技术体系加工岗位专家项目;公益性行业(农业)科研专项(201303082)
作者简介:蔡鲁峰(1989—),男,硕士研究生,研究方向为食品生物技术。E-mail:xslhdb@163.com
*通信作者:王远亮(1977—),男,教授,博士,研究方向为食品生物技术。E-mail:Wang@hunau.net
DOI:10.7506/spkx1002-6630-201612039
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)12-0217-05