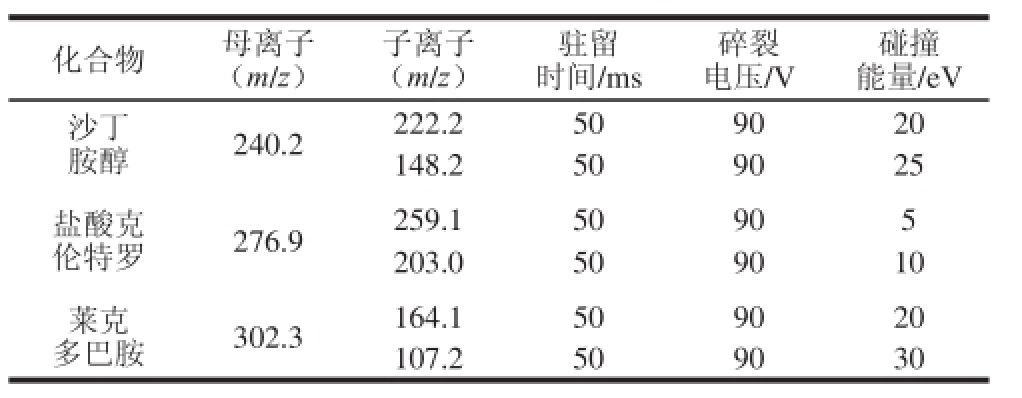
表1 HPLC-MS/MS采集参数条件
Table l Mass spectral parameters of salbutamol, clenbuterol hydrochloride and ractompaine
宁 霄,张伟清,梁瑞强,曹 进*,张庆生
(中国食品药品检定研究院,北京 100050)
摘 要:选取3种市售β-兴奋剂化学发光酶免疫分析检测试剂盒,从线性关系、灵敏度、选择性、检出限、准确度、重复性及变异性等方面进行实验,并经农业部1025号公告—18—2008中高效液相色谱-串联质谱法验证比较,初步建立了一套化学发光酶免疫分析检测试剂盒质量评价方法。结果表明:沙丁胺醇、盐酸克伦特罗、莱克多巴胺3种试剂盒在测定范围内线性关系良好,灵敏度分别为0.7、1.8、1.0 ng/mL,检出限分别为0.2、0.1、0.2 ng/mL,猪肝、猪肉和牛肉的回收率在81.9%~115.2%之间,重复性变异系数为3.3%~9.7%,批间变异系数为9.9%~16.5%,交叉反应率均符合产品说明书要求,可以用于猪肝、猪肉、牛肉样品中沙丁胺醇、盐酸克伦特罗、莱克多巴胺的残留检测。
关键词:沙丁胺醇;盐酸克伦特罗;莱克多巴胺;化学发光酶免疫分析;试剂盒;评价方法
NING Xiao, ZHANG Weiqing, LIANG Ruiqiang, CAO Jin*, ZHANG Qingsheng
(National Institutes for Food and Drug Control, Beijing 100050, China)
引文格式:
宁霄, 张伟清, 梁瑞强, 等. 3种β-兴奋剂化学发光酶免疫试剂盒分析检测方法的评价[J]. 食品科学, 2016, 37(12): 238-242. DOI:10.7506/spkx1002-6630-201612043. http://www.spkx.net.cn
NING Xiao, ZHANG Weiqing, LIANG Ruiqiang, et al. Evaluation of three β-adrenergic agonist chemiluminescence enzyme immunoassay detection kits[J]. Food Science, 2016, 37(12): 238-242. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201612043. http://www.spkx.net.cn
β-兴奋剂是一类合成化学兴奋剂。此类物质有较强的蛋白质同化作用,可提高蛋白质沉积,如果将其加入动物饲料中,能有效地促进肌肉的生长,降低脂肪比率[1-2]。然而,现在医学实验已证明其残留会严重影响到人类的健康,如出现心慌、头痛、恶心等症状,甚至还会增加致癌、致畸的风险[3-4]。鉴于此,人们开始越来越关注动物源性食品中存在的β-兴奋剂给人们身体健康所带来的影响,全世界所有国家均已禁止畜牧生产中应用此类药物[5-7],但目前非法使用并造成严重食物中毒事件的报道仍然屡见不鲜[8-11],对人体健康构成巨大威胁。所以选择一种快速、灵敏的检测方法具有很强的现实意义。
目前商品化的β-兴奋剂检测试剂盒以其方便快捷的特点得到了广泛的应用,尤其是化学发光酶免疫分析(chemiluminescence enzyme immunoassay,CLEIA)试剂盒,因其灵敏度、选择性、准确率高、无污染、操作简便等优点而在近年来备受推崇[12]。但产品质量尚没有相应的行业及国家标准,存在评价体系混乱的情况。鉴于我国试剂盒使用者、生产者和监管者的迫切需求,本研究选择沙丁胺醇、盐酸克伦特罗和莱克多巴胺3种市场上常见的β-兴奋剂CLEIA试剂盒,开展评价技术研究[13-15],依托美国分析化学家协会方法验证指南,参考食品法典委员会关于残留分析法评价指标,从线性关系、灵敏度、选择性、检出限、准确度、重复性及变异性等方面进行实验[16-22],初步建立评价方法,为规范试剂盒质量提供解决思路。
1.1 材料与试剂
猪肝、猪肉、牛肉样品 市售。
沙丁胺醇(纯度为99.5%)、盐酸克伦特罗(纯度为98.5%)、莱克多巴胺(纯度为98.0%)对照品德国Dr. Ehrenstorfer GmbH公司;β-盐酸葡萄糖醛苷酶德国Merck公司;甲醇、乙腈为色谱纯;甲酸、乙酸、异丙醇、乙酸铵、高氯酸、氢氧化钠、乙酸乙酯、叔丁基甲醚均为分析纯。
试剂盒组成:预包被抗体96 孔板、酶结合物、抗体、提取液、样品稀释液、底物液A、底物液B、浓缩洗涤液(1∶20稀释后使用)、6种质量浓度的系列标准溶液。
1.2 仪器与设备
SPY-D-Ⅱ型单光子检测仪 沙屏研公司;高速离心机 日本Hitachi公司;涡旋振荡器 中科公司;恒温水浴振荡箱 上海森信科技有限公司;1290-6460型高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/ MS)仪 美国Agilent公司;氮吹仪 北京合众日盛科技公司;pH计 瑞士Mettler Toledo公司;Oasis MCX固相萃取柱(60 mg) 美国Waters公司。
1.3 方法
1.3.1 样品前处理
取新鲜或冷冻的阴性或供试样品,绞碎并使均质,称取样品0.5 g于10 mL离心管中,加入5 mL提取液,超声时间10 min。80 ℃水浴加热10 min,6 000 r/min离心10 min。移取上清液1 mL,至培养皿中,晾干。再加入1 mL样品稀释液复溶,混匀待测。
1.3.2 检测步骤
分别加标准溶液和样品溶液50 mL到对应的微孔中,加入酶结合物及抗体各50 mL/孔,混匀,于室温条件下反应30 min,加250 mL/孔洗涤液洗涤4 次,加入底物液A、B各50 mL/孔,混匀,反应10 min后,用单光子检测仪测定各孔发光值。
1.3.3 阴性样品制备
对市售猪肝、猪肉和牛肉样品根据农业部1025号公告—18—2008规定用HPLC-MS/MS方法验证样品为阴性。
1.3.4 标准曲线和灵敏度的测定
取试剂盒中质量浓度分别为0.1、0.5、1、5、10、20 ng/mL的6种系列标准溶液,按步骤1.3.2节进行测定,每种质量浓度做2 个平行,重复3 次,分3 d进行,对照组为不加任何药物的样品稀释液。
1.3.5 选择性的测定
1.3.5.1 同类药物的选择性
分别在0.5 ng/mL的待测物溶液中加入1 000 ng/mL的同类药物以及同类药物混合物,按1.3.2节方法做3 个平行,测定质量浓度。计算各个交叉反应因子的交叉反应率。
1.3.5.2 基体的选择性
分别取猪肝、猪肉和牛肉的阴性样品按前处理方法进行操作,用所得溶液配制0.5 ng/mL的待测物试液,按1.3.2节方法测定其质量浓度,并与用样品稀释液配制的相同质量浓度试液实测质量浓度进行比较,计算不同基体的交叉反应率,每种基体做3 个平行。
1.3.6 检出限和定量限的测定
取猪肝、猪肉和牛肉3种阴性样品,分别重复测定20 次,分别得出样品溶液发光值(B)与对照组溶液发光值(B0)的比值,根据其平均值(M)和标准差(s)计算出M-2s的值,带入标准曲线方程中,求出对应的质量浓度,即为相应基体的检出限。
取猪肝、猪肉和牛肉3种阴性样品,分别重复测定20 次,得出测定结果的B/B0值,根据其平均值(M)和标准偏差(s)计算出M-6s的值,带入标准曲线方程中,求出对应的质量浓度值,即为相应基体的定量限。
1.3.7 准确度与重复性的测定
采用猪肝、猪肉和牛肉3种基体加标进行回收率实验,基体按照1.3.1节步骤进行处理,分别对1、5、10 ng/mL三个质量浓度水平进行实验,每种基体、每种质量浓度做10 个平行,按1.3.2节步骤检测。
1.3.8 批间差异稳定性的测定
每种试剂盒取3 个批次的产品,分别对3种基体进行测试,β-兴奋剂添加质量浓度为0.5 ng/mL,基体按照1.3.1节步骤进行处理,每个批次进行10 个平行,按1.3.2节步骤检测。
1.3.9 HPLC-MS/MS验证
1.3.9.1 样品前处理
采用农业部1025号公告—18—2008中HPLC-MS/MS方法。
1.3.9.2 HPLC条件
色谱柱:Agilent Eclipse XDB-C18(4.6 mm× 150 mm,3.5 μm);流动相:A相:甲醇;B相:0.1%甲酸溶液;梯度洗脱:0~2 min,维持80% A;2~12 min,80% A线性变化至40% A;12~12.1 min,40% A线性变至4% A;12.1~18 min,维持4% A;18~18.1 min,线性变至80% A;流速0.2 mL/min;柱温30 ℃;进样量2 μL。
1.3.9.3 MS条件
离子源:电喷雾离子化正离子模式;气流温度:330 ℃;气流速率:8 L/min;喷雾气压力:30 psi;毛细管电压:3 500 V;多反应监测扫描采集参数见表1。
表1 HPLC-MS/MS采集参数条件
Table l Mass spectral parameters of salbutamol, clenbuterol hydrochloride and ractompaine

2.1 标准曲线和灵敏度
表2 CLEIA试剂盒与HPLC-MS/MS方法测定结果的比较
Table 2 Results of CLEIA and HPLC-MS/MS

注:A.沙丁胺醇试剂盒;B.盐酸克伦特罗试剂盒;C.莱克多巴胺试剂盒。/.无数据,下同。
根据标准溶液发光值(B)与对照溶液发光值(B0)之比计算抑制率,以标准溶液质量浓度的对数(lgC)值为横坐标,对应的抑制率为纵坐标绘制标准曲线,以50%抑制浓度(IC50)值衡量检测方法的灵敏度,结果见表2。IC50越低说明灵敏度越高,由此可见,3种试剂盒检测方法均具有较高的灵敏度,且符合产品说明书要求。
2.2 选择性
2.2.1 同类药物的选择性
表3 同类药物的交叉反应率(n=3)
Table 3 Cross-reactivity of kits with related compounds (n= 3)

同类药物选择性实验结果见表3,因为沙丁胺醇和盐酸克伦特罗结构最相近,都含有苯环和叔胺结构,具有类似的免疫活性基团,所以体现出了3.0%~2.4%的交叉反应,其他物质之间交叉反应率均小于0.1%,符合产品说明书要求。可见3种试剂盒均具有较好的选择性,检测时受结构类似物影响小。
2.2.2 基体的选择性
表4 猪肝、猪肉、牛肉的交叉反应率(n=3)
Table 4 Cross-reactivity of kits with pork liver, pork and beef (n= 3)
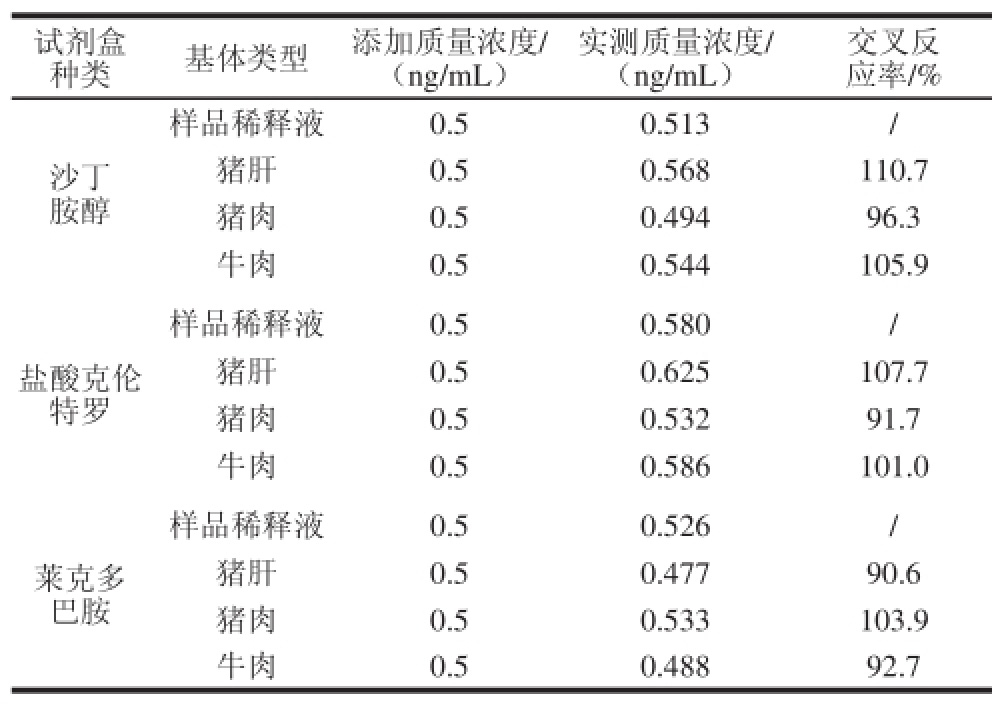
如表4所示,沙丁胺醇试剂盒中猪肝基体交叉反应率为110.7%,猪肉为96.3%,牛肉为105.9%;盐酸克伦特罗试剂盒中猪肝基体交叉反应率为107.7%,猪肉为91.7%,牛肉为101.0%;莱克多巴胺试剂盒中猪肝基体交叉反应率为90.6%,猪肉为103.9%,牛肉为92.7%;说明基体对3种试剂盒的干扰均很小。
2.3 检出限和定量限测定结果
对不同基体阴性样品进行测定,经计算得,沙丁胺醇试剂盒检测猪肝、猪肉和牛肉的检出限分别为0.17、0.20、0.18 ng/mL,定量限分别为0.54、0.49、0.51 ng/mL;盐酸克伦特罗试剂盒检测猪肝、猪肉和牛肉的检出限分别为0.15、0.15、0.14 ng/mL,定量限分别为0.48、0.54、0.46 ng/mL;莱克多巴胺试剂盒检测猪肝、猪肉和牛肉的检出限分别为0.16、0.19、0.16 ng/mL,定量限分别为0.41、0.45、0.37 ng/mL。
2.4 准确度与重复性实验结果
表5 试剂盒检测法准确度与重复性测定结果(n=10)
Table 5 Mean recovery rates of 10 replicates for -adrenergic agonists in negative pork liver, pork and beef samples spiked at three levels (n= 10)

如表2、5所示,在猪肝、猪肉和牛肉中分别添加3种β-兴奋剂,其中沙丁胺醇的回收率为81.9%~115.2%,平均回收率为100.3%,变异系数(coefficient of variation,CV)为4.3%~9.9%,平均CV 为6.8%;盐酸克伦特罗的回收率为88.7%~111.4%,平均回收率为98.6%,CV为3.8%~9.7%,平均CV为5.9%;莱克多巴胺的回收率为85.8%~110.2%,平均回收率为97.7%,CV为3.3%~9.3%,平均CV为5.4%。在各样品的添加回收率实验中,CV均在试剂盒说明书所允许的范围内,证明试剂盒有较好的准确性和重复性,可以用于猪肝、猪肉和牛肉的检测。
2.5 批间差异稳定性实验结果
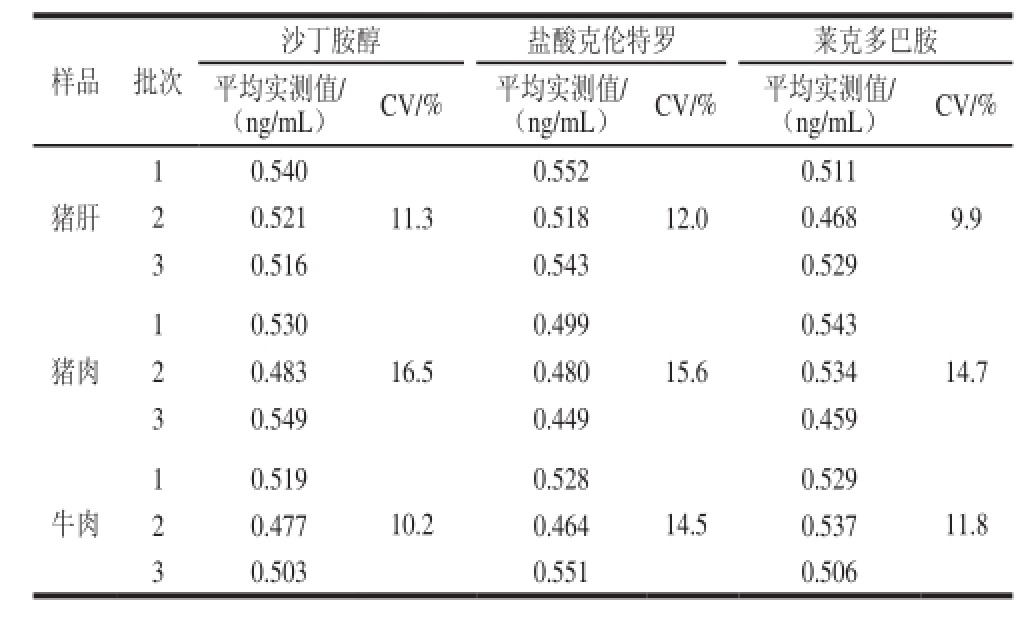
计算不同批次产品的测定平均值和CV,结果如表6所示,沙丁胺醇试剂盒3 个批次产品中添加在猪肝、猪肉和牛肉中的CV分别为11.3%、16.5%和10.2%;盐酸克伦特罗试剂盒3 个批次产品中添加在猪肝、猪肉和牛肉中的CV分别为12.0%、15.6%和14.5%;莱克多巴胺试剂盒3 个批次产品中添加在猪肝、猪肉和牛肉中的CV分别为9.9%、14.7%和11.8%。数据表明试剂盒批次间稳定性良好。
表6 试剂盒检测法批间差异稳定性测定结果(n=10)
Table 6 Inter-assay variance of the three kits (n= 10)
2.6 HPLC-MS/MS验证结果
2.6.1 标准曲线的测定结果
用甲醇逐级稀释的3种β-兴奋剂混合标准工作液(1、5、10、20、50 ng/mL)分别进样,以样品的峰面积对质量浓度进行线性回归。结果表明,在1~50 ng/mL范围内,沙丁胺醇线性相关系数R2为0.999 6;盐酸克伦特罗线性相关系数R2为0.999 7;莱克多巴胺线性相关系数R2为0.999 7。
2.6.2 检出限和定量限的测定结果
选用猪肝、猪肉和牛肉3种阴性样品,分别用绞肉机绞匀,称取6 份,每份10 g,在其中加入一定量的β-兴奋剂标准混合液,而后按照前述样品处理方法和所定条件进行分析,以3 倍和10 倍信噪比分别计算出本方法的检出限为0.2 ng/mL,定量限为1.0 ng/mL。
2.6.3 准确度和重复性的测定结果
表7 HPLC-MS/MS检测法准确度与重复性测定结果(n=6)
Table 7 Mean recovery rates of 6 replicates for -adrenergic agonists in negative pork liver, pork and beef samples spiked at three levels (n= 6)

实验选用3种基体阴性试样中添加不同量的β-兴奋剂混合标准液,进行加标回收实验,每种基体,每个化合物做3 个水平的添加,每个添加水平均做6 个平行样,从表7可以看出,该方法具有良好的精密度和较高的准确性。以此方法为标准,对CLEIA试剂盒分析法的准确性进行验证。对2.4节和2.6.3节测定结果进行线性回归分析,以相关性表示两种方法的一致性。所得沙丁胺醇线性方程为y = 0.785 5 x+0.460 4,R2=0.987 8;盐酸克伦特罗线性方程为y = 0.904 5x+0.293 5,R2=0.971 9;莱克多巴胺线性方程为y = 0.887 6x+0.314 4,R2=0.973 4,说明3种CLEIA试剂盒检测猪肝、猪肉、牛肉中的沙丁胺醇、盐酸克伦特罗和莱克多巴胺结果准确可靠。
本实验针对试剂盒质量评价体系混乱的问题,综合CLEIA方法自身特点,以3种经农业备案且年销售量占据市场上同类产品1/3以上的β-兴奋剂CLEIA试剂盒作为检测对象,设计了一套质量评价方法,并与农业部1025号公告—18—2008中的HPLC-MS/MS方法进行了比较验证。为企业在生产过程中的质量控制及监管部门日常监督检验工作提供了参考依据。
实验结果表明,选择的3种试剂盒线性关系良好、灵敏度和准确度高,在检出限、选择性、重复性和变异性等方面符合产品说明书要求。对猪肝、猪肉和牛肉中沙丁胺醇、盐酸克伦特罗、莱克多巴胺的测定方便快捷,更具有针对性。
参考文献:
[1] STOLKER A A M, ZOONTJES P W, van GINKELL L A. The use of super critical fluid extraction for the determination of steroids in animal tissues[J]. The Analyst, 1998, 123: 2671-2676.
[2] DAESELEIRE E, VANDEPUTTE R, van PETEGHEM C. Validation of multiresidue methods for the detection of anabolic steroids by GCMS in muscle tissues and urine samples from cattle[J]. The Analyst, 1998, 123: 2595-2598.
[3] 邱阳生, 杨根海, 何方洋. β-兴奋剂沙丁胺醇及其检测技术研究进展[J]. 动物医学进展, 2002, 23(4): 50-52. DOI:10.3969/ j.issn.1007-5038.2002.04.013.
[4] 翟福丽, 赖克强, 张衍亮, 等. 动物性食品中β-兴奋剂残留概述[J]. 食品科学, 2011, 32(5): 351-356.
[5] 农业部. 禁止在饲料和动物饮用水中使用的药物品种录[B]. 2002-02-09.
[6] 农业部. 兽药管理条例实施细则[B]. 1988-06-30.
[7] 农业部. 关于严禁非法使用兽药的通知[B]. 1997-03-25.
[8] 张改平, 王选年, 肖肖. 瘦肉精的毒害作用及其试纸快速检测技术[J]. 中国动物检疫, 2011, 28(5): 1-6. DOI:10.3969/j.issn.1005-944X.2011.05.001.
[9] MITCHELL G A, DUNNAVAN G. Illegal use of beta-adrenergic agonists in the United States[J]. Journal of Animal Science, 1998, 76(1): 208-211.
[10] 赵思俊, 郑增忍, 曲志娜, 等. 瘦肉精的危害及监管检测技术[J].中国动物检疫, 2011, 28(4): 1-4. DOI:10.3969/j.issn.1005-944X.2011.04.001.
[11] 路平, 肖肖, 张衍海, 等. 我国“瘦肉精”监管现状分析及对策建议[J]. 中国动物检疫, 2011, 28(4): 4-6. DOI:10.3969/j.issn.1005-944X.2011.04.002
[12] 朱龙佼, 刘萍, 周子莹, 等. 全自动化学发光免疫分析仪及配套研发试剂盒质量的评价[J]. 农业生物技术学报, 2014, 22(5): 651-660. DOI:10.3969/j.issn.1674-7968.2014.05.014.
[13] ZHANG S, ZHANG Z, SHI W, et al. Development of a chemiluminescent ELISA for determining chloramphenicol in chicken muscle[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5718-5722.
[14] ZHANG C, WANG S, FANG G, et al. Competitive immunoassay by capillary electrophoresis with laser-induced fluorescence for the trace detection of chloramphenicol in animal-derived foods[J]. Electrophoresis, 2008, 29(16): 3422-3428.
[15] 农业部. 关于加强兽药残留检测试剂(盒)管理的通知[B]. 2005-01-21.
[16] 国家食品药品监督管理总局. YY/T 1183—2010 酶联免疫吸附法检测试剂(盒)[S]. 北京: 中国标准出版社, 2010.
[17] 伏慧明, 郭展旗, 王翠英, 等. 兽药残留检测中试剂盒的验证评判方法研究[J]. 中国农业科技导报, 2008, 10(增刊2): 109-111. DOI:10.3969/j.issn.1008-0864.2008.z2.024.
[18] 何田田, 薛强, 段潜, 等. 氯霉素ELISA检测试剂盒评价技术[J]. 食品科技, 2013, 38(2): 311-314.
[19] 蒋文晓. 动物性食品中喹恶林类药物代谢物和磺胺类-喹诺酮类药物多残留免疫分析方法研究[D]. 北京: 中国农业大学, 2014.
[20] 尹伟伟. 莱克多巴胺、氯霉素、三聚氰胺药物残留的酶联免疫检测法的建立[D]. 济南: 山东大学, 2010.
[21] 金茂俊. 农药残留检测的荧光和化学发光免疫分析方法研究[D]. 杭州: 浙江大学, 2009.
[22] 李霜, 薛强, 李莉, 等. 三聚氰胺ELISA检测试剂盒评价研究[J]. 食品科技, 2014, 39(1): 317-321.
[23] 姚焱, 吴海珍, 陈键. 化学发光酶免疫分析(CLEIA)法测定猪肌肉组织中的氯霉素含量[J]. 农业灾害研究, 2012, 2(2): 42-44.
[24] 何方洋, 方华林, 罗晓琴, 等. 克仑特罗CLEIA试剂盒与ELISA试剂盒的比较分析[J]. 浙江农业学报, 2013, 25(6): 1360-1363. DOI:10.3969/j.issn.1004-1524.2013.06.34.
[25] 高彬文, 张素霞, 梁永红, 等. 化学发光免疫分析法检测猪尿中莱克多巴胺残留[J]. 中国畜牧兽医, 2009, 36(8): 27-29.
Evaluation of Three β-Adrenergic Agonist Chemiluminescence Enzyme Immunoassay Detection Kits
Key words: salbutamol; clenbuterol hydrochloride; ractompaine; chemiluminescence enzyme immunoassay (CLEIA); kit; evaluation method
Abstract: In this study, three commercially available β-adrenergic agonist chemiluminescence enzyme immunoassay (CLEIA) detection kits were evaluated in term of regression curve, sensitivity, specificity, detection limit, accuracy, reproducibility and inter-assay coefficients of variation. The validated test between CLEIA and high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) was done. This work established a methodology for the quality evaluation of CLEIA test kits. The results showed that three detection kits all had good linearity. Their sensitivities for three β-adrenergic agonists, salbutamol, clenbuterol hydrochloride and ractompaine, were 0.7, 1.8, and 1.0 ng/mL, and the corresponding limits of detection (LODs) were 0.2, 0.1, and 0.2 ng/mL, respectively. The recovery rates from spiked pork liver, pork and beef were between 81.9% and 115.2%. The reproducibility and inter-assay coefficients of variation were 3.3%–9.7% and 9.9%–16.5%, respectively. Cross-reactivity rate was in compliance with the product specification requirements. The three kits can be used in detection of salbutamol, clenbuterol hydrochloride and ractompaine residues in pork liver, pork and beef.
收稿日期:2015-08-13
作者简介:宁霄(1985—),女,助理研究员,硕士,研究方向为食品及化妆品质量控制。E-mail:xiao200730079@hotmail.com
*通信作者:曹进(1970—),男,研究员,博士,研究方向为食品及化妆品质量控制。E-mail:caojin@tsinghua.org.cn
DOI:10.7506/spkx1002-6630-201612043
中图分类号:TS207
文献标志码:A
文章编号:1002-6630(2016)12-0238-05