李灿婴1,葛永红1,*,吕静祎1,成白苗2,吴永升2
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
摘 要:研究不同浓度核黄素处理时厚皮甜瓜果实损伤接种粉红单端孢(Trichothecium roseum)和互隔交链孢(Alternaria alternata)的病斑直径,以及离体培养条件下核黄素处理对两种病原物孢子萌发和菌丝生长的影响。同时研究核黄素处理对厚皮甜瓜果实苯丙烷代谢的影响。结果表明:核黄素浓度为1.0 mmol/L时对甜瓜粉霉病和黑斑病病斑直径的抑制效果最佳。离体培养情况下核黄素处理对T. roseum和A. alternata的孢子萌发率和菌丝生长有抑制效果,其中以浓度为1.0 mmol/L效果最佳。核黄素处理显著提高了厚皮甜瓜果实过氧化物酶和苯丙氨酸解氨酶的活性,还显著提高了总酚、类黄酮、木质素的含量。由此表明,采后核黄素处理可活化苯丙烷代谢,增加相关酶活性及抗性物质的积累,从而强化果实细胞壁结构,抑制果实采后病害的发生。
关键词:厚皮甜瓜;核黄素;苯丙烷代谢;采后病害
李灿婴, 葛永红, 吕静祎, 等. 核黄素对厚皮甜瓜果实粉霉病和黑斑病的影响[J]. 食品科学, 2016, 37(12): 243-247. DOI:10.7506/spkx1002-6630-201612044. http://www.spkx.net.cn
LI Canying, GE Yonghong, LÜ Jingyi, et al. Effect of riboflavin on pink mold and black spot of muskmelon fruits[J]. Food Science, 2016, 37(12): 243-247. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612044. http://www.spkx.net.cn
甜瓜(Cucumis melo L.)是一年生草本植物,是西北地区效益较好的一种经济作物[1]。但甜瓜在贮运过程中极易受到病原物的侵染而腐烂,其中由Trichothecium roseum引起的粉霉病和Alternaria alternata引起的黑斑病是造成甜瓜采后腐烂的主要病害[2]。虽然使用化学杀菌剂可有效控制这两种病害,但存在杀菌剂残留、病原物产生抗药性、造成环境污染等问题,现已成为甜瓜产业快速发展的主要限制因素之一。因此,寻求安全、有效、广谱的采后防腐技术是当前生产中亟待解决的问题[3-4]。
诱导抗病性是近年来发展起来的采后病害控制措施之一[5]。研究发现,在寄主和病原物互作过程中维生素能够诱导寄主产生抗病性,如硫胺素、VK3、核黄素(VB2)等能够诱导多种植物和果实的抗病性[6-12]。核黄素是一种水溶性维生素,具有热稳定性,在碱性溶液中容易溶解,在强酸溶液中稳定。核黄素具有促进生长、提高作物产量、增强植物抗逆能力的功效,并且能够诱导植物对多种病害的抗性[13]。由核黄素和蛋氨酸组成的复合物可控制瓜类、豌豆和草莓等的白粉病菌,有效性均超过或等于商业化学试剂[14]。但鲜见核黄素在甜瓜采后病害控制中的研究,并且有关核黄素诱导果实产生抗病性机理研究很少。
本实验以厚皮甜瓜为试材,采后用不同浓度核黄素溶液浸泡,研究其对果实损伤接种粉霉病和黑斑病的病斑直径的影响,从而筛选最佳浓度。同时探讨离体条件下不同浓度核黄素对菌丝生长和孢子萌发率影响,进一步探讨核黄素对采后厚皮甜瓜果实苯丙烷代谢的影响,为核黄素在采后病害控制中的进一步应用及其作用机理提供理论依据。
1.1 材料与试剂
供试厚皮甜瓜采自甘肃省民勤县露地栽培大田,单果套发泡网袋纸箱包装后运抵实验室常温贮藏((25±2)℃,相对湿度45%)待用。A. alternata和T. roseum分离自自然发病的甜瓜果实,纯化后用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基保存。使用前于PDA培养基25℃条件下活化培养7 d。
核黄素(分析纯) 西安制药厂。
1.2 仪器与设备
H-1850R型离心机 长沙湘仪离心机仪器有限公司;UV-2450型分光光度计 日本岛津公司。
1.3 方法
1.3.1 菌丝生长实验
分别称取一定量的核黄素于P D A培养基(50~60 ℃)中,充分混合使其浓度为0.5、1.0、 2.0 mmol/L。将混合好的培养基均匀倒入培养皿(直径为75 mm)内。待培养基冷却后,用消毒的镊子将制备好的菌饼(直径为5 mm)反面移植到带核黄素的培养基上,每个培养皿中央接一个菌饼。待空白对照菌落接近培养皿边缘时观察结果,采用十字交叉法测出菌落直径。
1.3.2 孢子萌发实验
将培养7 d的A. alternata和T. roseum用接种环挑取少许,加入到经灭菌的含有不同浓度核黄素的马铃薯葡萄糖培养液中,在25 ℃条件下培养,统计孢子萌发数。每处理各重复随机观察3 个以上视野,每个视野数100 个孢子。孢子萌发率计算如下式所示:
1.3.3 样品处理
选择大小一致、无机械损伤和病虫害的果实表面清洗后用0.5、1.0、2.0 mmol/L核黄素溶液(含0.05%的吐温80)浸泡处理10 min,用清水处理作对照,晾干并在阴暗处贮藏,每处理30 个果实,重复3 次。
1.3.4 孢子悬浮液的配制
取25 ℃条件下培养7 d的带菌PDA平皿一个,加入10 mL含0.05%吐温80的无菌水,用玻璃棒刮下PDA平板上的病原菌孢子后转入50 mL三角瓶中,在WYX-A微型旋涡混合器上振荡20 s,双层纱布过滤后用血球计数板算出孢子悬浮液的数量浓度,最后稀释至所需数量浓度(1×106个/mL)。
1.3.5 损伤接种
各处理果实先经75%乙醇溶液表面消毒,然后用灭菌铁钉在果实表面赤道区域均匀刺孔4个(深3 mm,直径4 mm),待晾干后分别取20 μL数量浓度为1×106个/mL的A. alternata和T. roseum孢子悬浮液接种于孔内,待晾干后装箱用聚乙烯塑料薄膜密封,室温贮藏定期观察发病率并用十字交叉法测量病斑直径,筛选出核黄素的最佳浓度。
1.3.6 取样
分别于处理后0、2、4、6、8 d取核黄素处理和对照果实皮下1~3 mm处果肉组织3 g,铝箔纸包裹,液氮冷冻后在-80 ℃保存待用。每个处理每次取样用果实15 个。
1.3.7 过氧化物酶(peroxidase,POD)活性的测定
参照葛永红等[15]方法。以每分钟吸光度变化0.01为1 U,POD活性表示为U/g。
1.3.8 苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活性的测定
参照邓惠文等[16]方法。在290 nm波长条件下测定,以每分钟吸光度变化0.01为1 个PAL活力单位(U),酶活性表示为U/g。
1.3.9 总酚和类黄酮含量的测定
参照邓惠文等[16]方法并修改。3 g冷冻果肉组织用预冷的1% HCl-甲醇溶液3 mL在冰浴条件下研成匀浆,再用2 mL HCl-甲醇溶液冲洗研钵。合并两次的匀浆液于离心管内置于暗处4 ℃条件下放置20 min。然后在4℃、12 000×g条件下离心15 min,上清液分别在280 nm和325 nm波长条件下测定其吸光度,总酚含量用A280 nm/g表示;类黄酮含量用A325 nm/g表示。
1.3.10 木质素含量的测定
参照Zhang等[17]方法,木质素含量以A280 nm/g表示。
1.4 数据处理
实验数据用Microsoft Excel 2003以及SPSS 16.0软件进行数据统计处理。并计算标准偏差或进行Duncan’s多重差异显著性分析。
2.1 离体条件下核黄素处理对T. roseum和A. alternata菌丝生长的影响

图1 不同浓度核黄素处理对T. rosseeuumm(A) 和A. alternnaattaa(B)菌落直径的影响
Fig. 1 Effects of different concentrations of riboflavin on mycelia growth of T. roseum (A) and A. alternata (B)
小写字母不同表示差异显著(P<0.05),下同。
培养基中添加不同浓度的核黄素均降低了T. roseum(图1A)和A. alternata(图1B)的菌落直径,其中1.0 mmol/L和2.0 mmol/L核黄素均显著抑制了T. roseum的菌丝生长,但1.0 mmol/L核黄素处理效果更佳。由图1B可以看出,只有1.0 mmol/L核黄素显著抑制了A. alternata的菌丝生长。
2.2 核黄素处理对T. roseum和A. alternata孢子萌发的影响
由图2A可知,不同浓度的核黄素处理均显著抑制了T. roseum的孢子萌发,其中1.0 mmol/L核黄素处理萌发率最低。不同浓度的核黄素处理均显著抑制了A. alternata孢子萌发(图2B),其中以1.0 mmol/L核黄素处理的抑制效果最好。
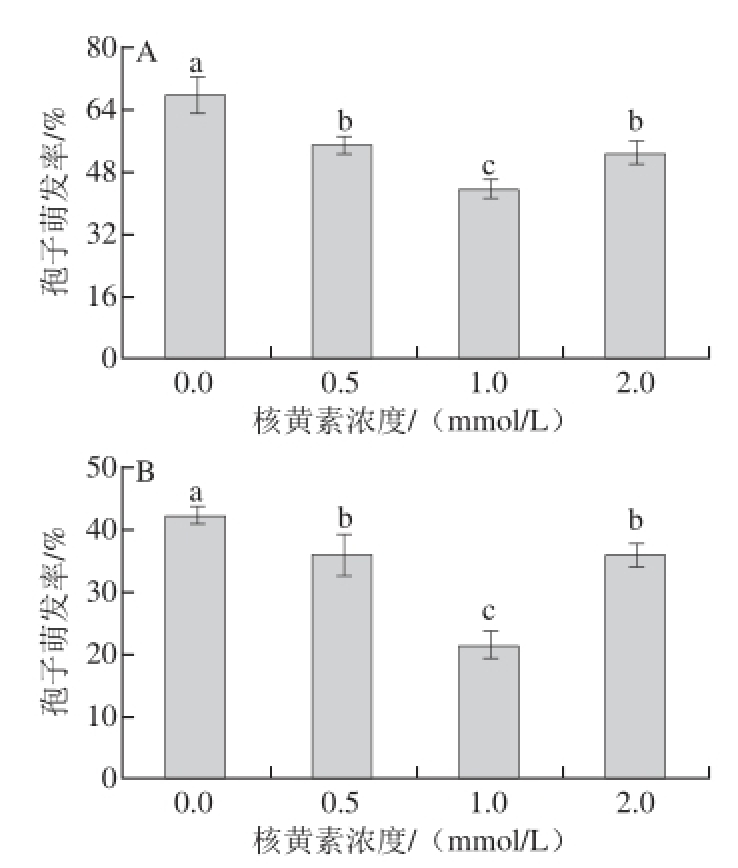
图2 不同浓度核黄素处理对T. rosseeuumm(A)和A. alternnaattaa(B)孢子萌发的影响
Fig. 2 Effects of different concentrations of riboflavin on spore germination of T. roseum (A) and A. alternata (B)
2.3 核黄素处理对果实损伤接种T. roseum和A. alternata病斑直径的影响

图3 不同浓度核黄素处理对甜瓜果实损伤接种T. rosseeuumm(A)和A. alternnaattaa(B)病斑直径的影响
Fig. 3 Effects of different concentrations of riboflavin on lesion diameter of muskmelon fruits inoculated with T. roseum (A) and A. alternata (B)
不同浓度核黄素处理对损伤接种甜瓜果实发病率没有影响,但抑制了接种果实病斑的扩展,损伤接种T. roseum的果实只有1.0 mmol/L核黄素处理显著抑制了病斑的扩展(图3A)。对于损伤接种A. alternata的果实,1.0 mmol/L和2.0 mmol/L核黄素处理均显著抑制了病斑的扩展,其中以1.0 mmol/L核黄素处理效果最佳(图3B)。2.4 核黄素处理对甜瓜果实POD和PAL活性的影响

图4 采后1.0 mmol/L核黄素处理对甜瓜果实POD(A)和PAL(B)活性的影响
Fig. 4 Effects of postharvest dipping in 11..00 mmol/L riboflavin on the activities of POD (A) and PAL (B)
在整个贮藏期间,对照和核黄素处理果实POD活性总体呈先升高后降低的变化趋势,但核黄素处理显著提高了果实POD活性,在贮藏第4天出现峰值,核黄素处理果实中POD活性比对照高24.1%(图4A)。核黄素处理和对照果实PAL的活性变化趋势大致相同,呈先升高后降低的趋势,但核黄素处理明显提高了果实PAL活性,二者均在贮藏第6天达到最大,核黄素处理果实中PAL活性高出对照30%(图4B)。
2.5 核黄素处理对甜瓜果实总酚、类黄酮和木质素含量的影响


图5 采后1.0 mmol/L核黄素处理对甜瓜果实总酚(A)、类黄酮(B)和木质素(C)含量的影响
Fig. 5 Effects of postharvest dipping in 1.0 mmol/L riboflavin on the contents of total phenolics (A), flavonoids (B) and lignin (C)
甜瓜果实中总酚含量总体变化波动较大,核黄素处理组和对照组的变化趋势大体一致,但核黄素处理果实中总酚含量高于对照果实,其中第4天的总酚含量核黄素处理组高于对照组34%(图5A)。核黄素处理后,类黄酮含量明显高于对照,其中第2天和第4天的差异最为明显,分别高于对照组49%和30%(图5B)。随着贮藏时间的延长,木质素含量总体呈上升趋势,核黄素处理显著提高了果实木质素含量,其中第6~8天差异最大,核黄素处理果实中木质素含量分别是对照果实的1.56、1.51倍(图5C)。
本实验表明核黄素对损伤甜瓜接种T. roseum和A. alternata的病斑直径在浓度为1.0 mmol/L时达到最佳抑制效果。离体实验结果也表明不同浓度的核黄素处理均对T. roseum和A. alternata菌丝生长和孢子萌发有显著的抑制作用,而1.0 mmol/L浓度核黄素处理抑制效果最佳,更高浓度的核黄素并没有增加抑制效果。这与对早酥梨的研究[9]结果相似。说明只有当核黄素达到某一浓度时才能有效启动果实的防卫反应,更高浓度并不能进一步增加防卫反应的强度[18]。
PAL是苯丙烷代谢途径的限速酶,它能够调控植物中酚类、黄酮、生物碱、花青素等抗菌物质的生成及细胞壁木质化的过程,与植物的抗病性密切相关[19]。采后核黄素处理提高了甜瓜果实的PAL活性,这表明核黄素处理可激活甜瓜果实苯丙烷代谢途径从而增强果实的采后抗病性。POD可促进酚酸类前体聚合为木质素,起到加固寄主细胞壁、抵抗病原物入侵的作用,另外它也是细胞内活性氧清除酶之一,避免活性氧的大量积累[20],采后核黄素处理提高了甜瓜果实的POD活性,说明核黄素在一定程度上通过提高甜瓜果实中POD活性促进木质素的积累。木质素可以起到加固寄主细胞壁、抵抗病原物入侵的作用[21-22]。酚类和类黄酮是苯丙烷代谢的末端产物,具有一定的抗菌作用,此外,酚类物质还是木质素等抗性物质合成的前体。类黄酮具有明显抗微生物活性,可抑制孢子萌发、芽管伸长、菌丝生长[23]。本实验也发现采后核黄素处理显著提高了果实中木质素、总酚和类黄酮的含量,说明核黄素处理促进了苯丙烷代谢产物的积累,增加果实的抗病性。
离体条件下核黄素对T. roseum和A. alternata的孢子萌发率和菌丝生长有显著抑制效果,并且核黄素处理对损伤接种T. roseum和A. alternata甜瓜果实病斑扩展具有显著的抑制作用,其中以1.0 mmol/L核黄素处理效果最好。核黄素处理显著提高了厚皮甜瓜果实POD和PAL的活性,促进了总酚、类黄酮、木质素的积累。
参考文献:
[1] REN Y L, WANG Y F, BI Y, et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit[J]. European Food Research and Technology, 2012, 234(6): 963-971. DOI:10.1007/ s00217-012-1715-x.
[2] GE Yonghong, BI Yang, LI Xuan, et al. Induced resistance against Fusarium and pink rotsby acibenzolar-S-methyl in harvested muskmelon (cv. Yindi)[J]. Agricultural Science in China, 2008, 7(1): 58-64. DOI:10.1016/S1671-2927(08)60022-X.
[3] TRIPATHI P, DUBEY N K. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J]. Postharvest Biology and Technology, 2004, 32(3): 235-245. DOI:10.1016/j.postharvbio.2003.11.005.
[4] BI Y, LI Y C, GE Y H, et al. Induced resistance in melons by elicitors for the control of postharvest diseases[J]. Postharvest Pathology, 2010, 2: 31-41. DOI:10.1007/978-1-4020-8930-53.
[5] BOUBAKRI H, WAHAB M A, CHONG J, et al. Thiamine induced resistance to Plasmopara viticola in grapevine and elicited host defense responses, including HR like-cell death[J]. Plant Physiology and Biochemistry, 2012, 57(8): 120-133. DOI:10.1016/ j.plaphy.2012.05.016.
[6] AHN I P, KIM S, LEE Y H. Vitamin B1functions as an activator of plant disease resistance[J]. Plant Physiology, 2005, 138(3): 1505-1515. DOI:10.1104/pp.104.058693.
[7] DONG H, BEER S V. Riboflavin induces disease resistance in plants by activating a novel signal transduction pathway[J]. Phytopathology, 2000, 90(8): 801-811. DOI:10.1094/PHYTO.2000.90.8.801.
[8] BORGES A A, PEREZ A B, FALCON M F. Induced resistance to fusarial wilt of banana by menadione sodium bisulphate treatments[J]. Crop Protection, 2004, 23(12): 1245-1247. DOI:10.1016/ j.cropro.2004.05.010.
[9] LI Y C, YIN Y, BI Y, et al. Effect of riboflavin on postharvest disease of Asia pear and the possible mechanisms involved[J]. Phytoparasitica, 2012, 40(3): 261-268. DOI:10.1007/s12600-011-0216-y.
[10] PUSHPALATHA H G, SUDISHA J, GEETHA N P, et al. Thiamine seed treatment enhances LOX expression, promotes growth and induces downy mildew disease resistance in pearl millet[J]. Biologia Plantarum, 2011, 55(3): 522-527. DOI:10.1007/s10535-011-0118-3.
[11] BOUBAKRI H, POUTARAUD A, WAHAB M A, et al. Thiamine modulates metabolism of the phenylpropanoid pathway leading to enhanced resistance to Plasmopara viticola in grapevine[J]. BMC Plant Biology, 2013, 13: 31-46. DOI:10.1186/1471-2229-13-31.
[12] BAHUGUNA R N, JOSHI R, SHUKLA A, et al. Thiamine primed defense provides reliable alternative to systemic fungicide carbendazim against sheath blight disease in rice (Oryza sativa L.)[J]. Plant Physiology and Biochemistry, 2012, 57: 159-167. DOI:10.1016/ j.plaphy.2012.05.003.
[13] 刘宇星. 核黄素影响拟南芥生长和抗病性信号传导的初步研究[D].南京: 南京农业大学, 2006.
[14] 彭建令. 两类激发子(harpins和核黄素)启动植物抗病防卫和生长信号传导的分子遗传学解析[D]. 南京: 南京农业大学, 2003.
[15] 葛永红, 王毅, 毕阳. 柠檬酸处理对厚皮甜瓜黑斑病的抑制及苯丙烷代谢的作用[J]. 食品工业科技, 2013, 34(19): 308-312. DOI:10.13386/j.issn1002-0306.2013.19.022.
[16] 邓惠文, 毕阳, 葛永红, 等. 采后BTH处理及粉红单端孢(Trichothecium roseum)挑战接种对厚皮甜瓜果实苯丙烷代谢活性的诱导[J]. 食品工业科技, 2013, 34(1): 323-326. DOI:10.13386/ j.issn1002-0306.2013.01.079.
[17] ZHANG Z K, BI Y, GE Y H, et al. Multiple pre-harvest treatments with acibenzolar-S-methyl reduce latent infection and induce resistance in muskmelon fruit[J]. Scientia Horticulturae, 2011, 130(1): 126-132. DOI:10.1016/j.scienta.2011.06.024.
[18] LIU H, JIANG W, BI Y, et al. Postharvest BTH treatment induces resistance of peach (Prunus persica L. cv. Jiubao) fruit to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J]. Postharvest Biology and Technology, 2005, 35(3): 263-269. DOI:10.1016/j.postharvbio.2004.08.006.
[19] VOGT T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010, 3(1): 2-20. DOI:10.1093/mp/ssp106.
[20] LIU Y Y, GE Y H, BI Y, et al. Effect of postharvest acibenzolar-S-methyl dipping onphenylpropanoid pathway metabolism in muskmelon (Cucumis melo L.) fruits[J]. Scientia Horticulturae, 2014, 168: 113-119. DOI:10.1016/j.scienta.2014.01.030.
[21] HÉMATY K, CHERK C, SOMERVILLE S. Host-pathogen warfare at the plant cellwall[J]. Current Opinion in Plant Biology, 2009, 12(4): 406-413. DOI:10.1016/j.pbi.2009.06.007.
[22] KÄRKÖNEN A, KÖUTANIEMI S. Lignin biosynthesis studies in plant tissue cultures[J]. Journal of Integrative Plant Biology, 2010, 52(2): 176-185. DOI:10.1111/j.1744-7909.2010.00913.x.
[23] PAN Y G, LIU X H. Effect of benzo-thiadiazole-7-carbothioic acid S-methylester (BTH) treatment on the resistant substance in postharvest mango fruits of different varieties[J]. African Journal of Biotechology, 2011, 10(69): 15521-15528. DOI:10.5897/AJB11.2150.
Effect of Riboflavin on Pink Mold and Black Spot of Muskmelon Fruits
LI Canying1, GE Yonghong1,*, LÜ Jingyi1, CHENG Baimiao2, WU Yongsheng2
(1. Food Safety Key Lab of Liaoning Province, National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural Products, College of Food Science and Technology, Bohai University, Jinzhou 121013, China; 2. College of Food Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
Abstract: The effects of postharvest riboflavin dipping at different concentrations on lesion development of muskmelon fruits artificially wounded and inoculated with Trichothecium roseum and Alternaria alternata were examined. The metabolisms of phenylpropanoid pathway and the effects of riboflavin at different concentrations on mycelia growth and spore germination of T. roseum and A. alternata were also studied. The results indicated that riboflavin at 1.0 mmol/L effectively decreased the lesion diameter of muskmelon fruits inoculated with T. roseum and A. alternata. In vitro test also indicated that riboflavin at 1.0 mmol/L effectively inhibited mycelia growth and spore germination of both pathogens. It was also shown that postharvest riboflavin treatment significantly enhanced the activities of peroxidase (POD) and phenylalanine ammonia lyase (PAL), and increased the contents of total phenolic compounds, flavonoids and lignin in muskmelon fruits. These results suggest that postharvest riboflavin treatment strengthens the cell wall through activating the phenylpropanoid pathway and enhancing the activities of defense-related enzymes and the accumulation of antifungal compounds to control postharvest diseases in fruits.
Key words: muskmelon; riboflavin; phenylpropanoid pathway; postharvest diseases
收稿日期:2015-10-08
基金项目:国家自然科学基金青年科学基金项目(31401554);渤海大学博士启动基金项目(bsqd201405)
作者简介:李灿婴(1981—),女,助理实验师,硕士,研究方向为果蔬采后生物学与技术。E-mail:cora_51@163.com
*通信作者:葛永红(1979—),男,副教授,博士,研究方向为果蔬采后生物学与技术。E-mail:geyh1979@163.com
DOI:10.7506/spkx1002-6630-201612044
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2016)12-0243-05引文格式: