1-MCP对低温贮藏苹果灰霉病抗性的诱导作用
周晓婉,唐永萍,石亚莉,周会玲*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:以红富士苹果为试材,研究1-甲基环丙烯(1-methylcyclopropene,1-MCP)对低温贮藏(0±1)℃苹果灰霉病的控制效果及其诱导抗病机理。结果表明:采后1 μL/L 1-MCP处理较对照可显著降低损伤接种苹果灰霉病的发病率,抑制病斑的扩展(P<0.05)。同时1-MCP处理能够诱导果实中苯丙氨酸解氨酶、多酚氧化酶、过氧化物酶、β-1,3-葡聚糖酶、几丁质酶活性的提高,促进总酚、类黄酮和木质素的积累,降低膜脂过氧化程度,减少丙二醛的产生,从而提高果实的抗病性。研究结果可为1-MCP防治苹果采后病害提供理论依据。
关键词:苹果;1-甲基环丙烯;低温贮藏;灰霉;诱导抗性
周晓婉, 唐永萍, 石亚莉, 等. 1-MCP对低温贮藏苹果灰霉病抗性的诱导作用[J]. 食品科学, 2016, 37(12): 254-260. DOI:10.7506/spkx1002-6630-201612046. http://www.spkx.net.cn
ZHOU Xiaowan, TANG Yongping, SHI Yali, et al. Mechanism of 1-MCP treatment in induced resistance to gray mold of apples during low-temperature storage[J]. Food Science, 2016, 37(12): 254-260. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612046. http://www.spkx.net.cn
苹果酸甜适口,美味多汁,加之富含维生素、膳食纤维、类黄酮、矿物质、果胶、蛋白质、氨基酸等多种营养,已成为人们膳食的重要组成部分。此外,苹果是我国生产和出口的主要水果,具有重要的经济价值[1]。然而,苹果采后贮藏期间会发生各种病害,造成严重的经济损失[2]。其中灰霉病是苹果采后常见的侵染性真菌病害之一,它有两种致病途径:一是伤口侵染;二是花期侵染,潜伏到贮藏后期才会发病[3]。化学药剂处理结合冷藏是目前苹果贮藏期间防治真菌性病害的常用方法,但由于灰葡萄孢具有很强的耐低温能力,即使在0 ℃冷藏条件下也会繁殖侵染,果实一旦感病,伤口便迅速感病,造成全果腐烂。病原真菌的危害不仅在于其采后侵染果实,造成腐烂和经济损失,而且由于很多病原真菌能够分泌产生许多次生代谢产物从而引起严重的食品安全问题,如灰葡萄孢产生的葡双醛霉素易造成污染,并且具有遗传毒性和抑制果实免疫活动[4]。加之人们对食品安全重视度的提高,绿色安全的防治技术成为研究的热点。
诱导抗性是利用生物或非生物激发子处理激活植物体自身的防御系统,且这种抗性具有持久性与广谱性,能够抵抗多种病菌的侵染,在果实采后病害防治中具有极好的应用前景[5]。近些年来,研究较多的防治措施主要有热处理[6]、紫外线照射[7]、化学诱导剂(钙、苯并噻二唑、水杨酸)[8-9]、植物提取物[10]、生物农药[11]、拮抗微生物[12]等。例如,红富士苹果经热处理后增强了果实苯丙氨酸解氨酶(phenylalanine amonialyase,PAL)和过氧化物酶(peroxidase,POD)活性,木质素和总酚含量提高,果实抗性增强,减弱了青霉病的发生[13];苯丙噻重氮处理国光苹果,显著提高了其果实中β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)、几丁质酶(chitinase,CHI)、PAL、POD的活性,增加了总酚、类黄酮和木质素的含量,增强了果实对采后病害的抗性[14]。1-甲基环丙烯(1-methylcyclopropene,1-MCP)作为乙烯受体抑制剂,能够延缓果蔬后熟与衰老,改善果实品质并延长贮藏期,在果蔬保鲜方面有良好的效果[15],且具有结构简单、稳定性能好、无毒、低量、高效等优点,在苹果贮藏过程中广泛应用。Jung等[16]研究发现,1-MCP通过抑制‘Cortland’和‘Law Rome’苹果表皮中α-法尼烯、共轭三烯含量的上升,从而降低虎皮病的发生率。李辉等[17]研究报道,1-MCP处理可有效控制油木奈果实腐烂,提高GLU和CHI的活性,从而诱导果实抗病性的增强。1-MCP对果实采后病害抗性诱导研究还不够完善,其作用机理仍需进一步深入研究。本实验以红富士苹果为材料,研究1-MCP对低温条件下苹果灰霉病抗性诱导机理,为1-MCP在苹果采后真菌性病害防治提供理论依据。
1 材料与方法
1.1 材料与试剂
灰葡萄孢(Botrytis cinerea Pers) 西北农林科技大学植物保护学院;红富士苹果(Malus domestica “Red Fuji”),于2014年10月14日采自陕西省白水县一管理良好的农家果园,选择色泽相近、果形端正、大小和成熟度基本一致、无机械损伤、无自然病虫害浸染的果实,采摘当天运回实验室。
1-MCP(有效成分0.14%的粉剂) 美国陶氏化学(上海)公司;无水乙醇、愈创木酚、十二水合磷酸氢二钠、二水合磷酸二氢钠、β-巯基乙醇、L-苯丙氨酸、葡萄糖、30%过氧化氢、聚乙烯吡咯烷酮、乙二胺四乙酸、邻苯二甲酸氢钾、硼砂、无水醋酸钠、Triton X-100、浓盐酸、聚乙二醇6000、牛血清蛋白、冰醋酸、硼酸均为国产分析纯。
1.2 仪器与设备
BCD-236DT型冰箱 青岛海尔股份有限公司;AUY220分析天平 日本岛津公司;SW-CJ-LB型无菌操作台 苏净集团安泰公司;3K15型高速冷冻离心机美国Sigma公司;HHS 21-4电热恒温水浴锅 北京长安科学仪器厂;UV-1800紫外-可见分光光度计 科大中佳公司;KQ-500DB 数控超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 菌种与样品处理
灰葡萄孢菌种在马铃薯葡萄糖琼脂培养基上进行继代培养,25 ℃条件下恒温避光培养1 周后,用含体积分数0.05% Tween 80的无菌水将菌落上的分生孢子冲洗下来,借助血球计数板调整为106个/mL的孢子悬浮液,随配随用。
散去田间热后将实验红富士苹果放入气调箱内,在20 ℃温室条件下,用1 μL/L的1-MCP熏蒸处理24 h,对照组果实放入气调箱中封闭24 h,开盖通风0.5 h,完毕后分别放入聚氯乙烯(polyvinyl chloride,PVC)保鲜袋中,置于低温(0±1)℃条件下贮藏1 周后接种。处理与对照均接种,接种前先用70%乙醇溶液轻轻擦拭苹果,对果皮进行消毒,自然晾干。每个红富士果实的赤道部位用无菌不锈钢铁钉(Φ=3 mm)形成两个均匀、大小一致的伤口(3 mm×3 mm)。待伤口处汁液晾干后,分别接种20 μL 1×106个/mL灰霉孢子悬浮液。稍作晾干后,放入PVC保鲜袋,于(0±1)℃、相对湿度80%~85%的冷库中平铺贮藏。每隔2 d统计发病率,测量病斑直径,取病斑周围1 cm范围内健康果肉组织混匀,用液氮研磨仪研成粉末后锡箔纸包裹,于-80 ℃保存进行各项活性指标的测定。每个处理设88 个果实,一次取8 个,重复3 次。
1.3.2 发病率和病斑直径测定
发病率为发病伤口数与总接种伤口数的比值,以病斑直径不小于0.5 mm确定为发病;病斑直径利用游标卡尺进行十字交叉法测定,每个病斑测量3 次,计算平均值作为其测量值,取各处理发病伤口病斑直径的平均值分别作为其病斑直径。
1.3.3 防御酶活性的测定
1.3.3.1 多酚氧化酶(polyphenol oxidase,PPO)活性测定
PPO活性测定采用邻苯二酚法,取1 g左右粉末样品,加入5 mL预冷(4 ℃)的pH 7.0磷酸缓冲液,充分混匀后静置提取1 h,期间摇动数次,然后在4 ℃、12 000×g条件下冷冻离心30 min,取上清液作为粗酶液测定相应酶活性。反应体系为:2 mL pH 7.0磷酸缓冲液加1 mL邻苯二酚(用50 mmol/L、pH 7.0磷酸缓冲液配制),再加0.5 mL粗酶液,混匀后15 s在420 nm波长条件下测定吸光度。以每分钟酶促反应体系吸光度增加1作为一个酶活性单位,结果以U/g表示,重复3 次。
1.3.3.2 POD活性测定
POD活性测定采用愈创木酚法,POD粗酶液的提取方法同PPO,愈创木酚与H2O2均用pH 5.5乙酸-乙酸钠缓冲液溶解,反应体系为:200 μL H2O2加3 mL的愈创木酚,再加入0.5 mL粗酶液,混匀后15 s在470 nm波长条件下测定吸光度。以每分钟酶促反应体系吸光度增加1作为一个酶活性单位,结果以U/g表示,重复3 次。
1.3.3.3 PAL活性测定
PAL活性测定参考曹建康等[18]方法,略有改动。称取1.0 g左右果肉粉末,加入预冷(4 ℃)5 mL的0.1 mol/L pH 8.8硼酸缓冲液(含40 g/L聚乙烯吡咯烷酮、2 mmol/L乙二胺四乙酸和5 mmol/L β-巯基乙醇),充分混匀后静置提取1 h,期间摇动数次,然后在4 ℃、12 000×g条件下冷冻离心30 min,取上清液作为粗酶液测定相应酶活性。取2 支试管,均分别加入3 mL 50 mmol/L pH 8.8硼酸缓冲液和0.5 mL 粗酶提取液,对照以蒸馏水代替L-苯丙氨酸,于37 ℃水浴保温60 min后以对照为参比调零,测定290 nm波长处吸光度,以每小时酶促反应体系吸光度增加1作为一个酶活性单位,结果以U/g表示,重复3 次。1.3.3.4 CHI活性测定
取1.0 g左右果肉粉末样品,加入5.0 mL预冷的0.1 mol/L pH 5.2乙酸-乙酸钠缓冲液(1 mmol/L乙二胺四乙酸和5 mmol/L β-巯基乙醇),充分混匀后提取1 h,呈匀浆后于4 ℃、12 000×g离心30 min,上清液即为粗酶提取液。参照曹建康等[18]方法,略有改动。以每秒钟每克样品中酶分解胶状几丁质产生的1×10-9mol N-乙酰葡萄糖胺为一个酶活性单位(U),重复3 次。
1.3.3.5 GLU活性测定
参考Cao等[19]的测定方法,略有改动,以单位时间鲜样果肉生成1 μmol葡萄糖的为一个酶活单位(U/g),重复3 次。
1.3.4 丙二醛含量的测定
参照高俊凤[20]的方法测定。
1.3.5 总酚和类黄酮含量测定
称取果肉粉末样品1.0 g左右,加入5 mL经4 ℃预冷的体积分数1% HCl-甲醇溶液,混匀充分,在4 ℃条件下提取1 h后,于4 ℃、12 000×g离心30 min。取上清液分别在280 nm和325 nm波长条件下比色测定吸光度。分别参考Toor[21]、González-Aguila[22]等方法测定,重复3 次。
1.3.6 木质素含量的测定
参考周会玲等[23]方法,以每克鲜质量果肉样品在280 nm波长处的吸光度表示,重复3 次。
1.4 数据处理
数据统计分析应用SPSS 17.0软件进行单因素方差分析,作图采用Excel软件,采用邓肯氏多重比较法进行差异显著性分析。
2 结果与分析
2.1 1 -MCP对低温贮藏苹果灰霉菌发病率和病斑直径的影响

图1 采后1-MCP对低温(0±1)℃条件下苹果采后灰霉病发病率(A)和病斑直径(B)的影响
Fig. 1 Effect of postharvest 1-MCP treatment on the infection rate and diameter of disease spot caused by Botrytis cinerea in “Red Fuji” apple fruits during storage at low temperature
同一接种时间不同字母表示差异显著(P<0.05)。
由图1可以看出,1-MCP能够显著降低苹果冷藏期间灰霉病发病率,减小病斑直径扩展。如图1A所示,接种灰霉菌1 d后,处理组与对照组果实均出现感病症状,但1-MCP处理组发病程度明显低于对照组(P<0.05),接种前7 d,二者发病率均较低,之后发病率迅速断升高,接种后第10天,对照组发病率迅速增加至57.43%,而处理组的发病率仅为26.5%,较对照组降低了53.86%;在观察后期,对照组的发病率趋近于平缓,最终达90%以上,而处理组发病率不足70%,直至最大。由图1B可见,接种后第4天,对照组与处理组的病斑直径分别为1.63、0.77 mm,处理组远大于对照组。随病害加重,果实病斑直径越来越大,对照组最后扩展至39.57 mm,甚至出现病斑重合,处理组病斑直径后期虽有所增加,但始终显著小于对照组(P<0.05)。可见1-MCP能够有效地抑制灰葡萄孢菌的生长与扩增,减弱苹果灰霉病的发生。
2.2 1-MCP对低温贮藏苹果果实各种酶活性的影响
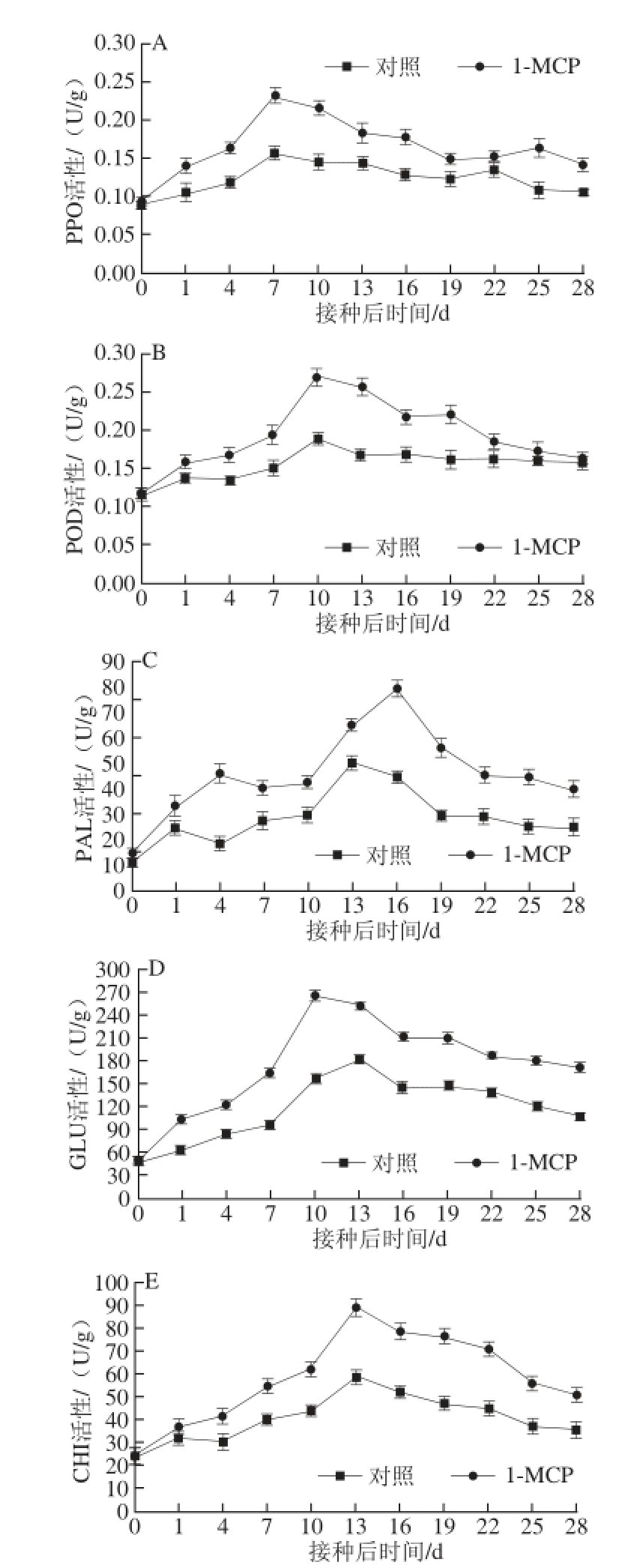
图2 1-MCP处理对低温(0±1)℃条件下苹果果实PPO(A)、POD(B)、PAL(C)、GLU(D)、CHI(E)活性的影响
Fig. 2 Effect of postharvest 1-MCP treatment on the activities of PPO, POD, PAL, GLU and CHI in “Red Fuji” apple fruits stored at low temperature
如图2A所示,接菌后苹果的PPO活性总体上呈先升高后降低的变化趋势。在第7天,两者同时达到最大值,此时1-MCP处理组的PPO活性高出对照组48.72%,随后处理组与对照组的PPO活性均开始下降,但处理组的PPO活性始终高于对照(P<0.05)。至接种19 d后,1-MCP处理组与对照组的PPO活性接近且均保持在一个相对平稳水平,差异不明显,但是对照组维系时间短,在第25天,对照组PPO活性下降,又显著低于处理组。说明1-MCP处理可提高苹果果实PPO的活性。
图2B表明,经接种灰葡萄孢后,POD活性在整个病害观察期均呈先逐渐升高后缓慢下降的趋势,不同的是,1-MCP处理组POD活性上升速率要大于对照组,并于接种后第4天,表现显著差异。二者均在接种后第10天出现最高峰,此时处理组POD活性是对照组的1.42 倍;随后POD活性开始下降,1-MCP处理组始终高于对照。在观察后期即22 d以后,处理组与对照组POD活性差异性不显著。
由图2C可知,1-MCP处理组和对照组的PAL活性整体上均呈先锯齿状上升后降低的变化趋势。接种后第1天,对照组便出现小峰,而处理组PAL活性不断升高,于第4天出现峰值,此时为对照PAL活性的2.54 倍,且差异性显著。之后二者PAL活性继续上升,对照组与处理组分别在第13、16天出现第2次峰值,即达到最大值,此时处理组分别比对照提高了28.91%、77.54%。随后两者PAL活性均降低,并最终趋于平缓,但处理组PAL活性始终高于对照(P<0.05)。结果表明,1-MCP处理不仅增强了果实PAL活性,并使其维持相对较高水平。
如图2D所示,各处理均可引起苹果果实GLU活性的增强。其中,1-MCP处理的GLU活性增加迅速并且显著高于对照组,在接菌后第10天达到最高峰,是对照组的1.17 倍;对照组出现最高峰的时间较处理组推迟了3 d,但仍比处理组要低28.08%。随后处理组与对照组GLU活性均开始降低,至病害观察后期,1-MCP处理组GLU活性依然远远高出对照。
如图2E所示,各处理CHI活性均呈先升高后降低的趋势,13 d达到最大值,其中1-MCP处理的最大值为88.47 U/g,是对照的1.50 倍。随后各处理CHI活性逐渐下降,但1-MCP处理的CHI活性一直高于对照组,且呈显著差异(P<0.05)。
2.3 1-MCP对苹果总酚、类黄酮和木质素含量的影响

图3 采后1-MCP处理对低温(0±1)℃条件下苹果果实总酚(A)、类黄酮(B)、木质素(C)含量的影响
Fig. 3 Effect of postharvest 1-MCP treatment on the contents of total phenols, flavonoid and lignin in “Red Fuji” apple fruits stored at low temperature
如图3A所示, 1-MCP处理组和对照组的总酚含量均先升高后降低,在接种后第19天,处理组达到最大值,此时比对照增加了49.55%,之后降低并在病害观察后期趋向平缓,但其总酚含量始终高于对照。由此可见,1-MCP可以刺激苹果果实中酚类物质的生成,提高病害发展过程中总酚的含量。
由图3B可以看出,随着接种时间的延长,1-MCP处理的类黄酮含量先缓慢增加后降低,对照类黄酮含量在处理周期内变化幅度不大。1-MCP处理在第19天出现峰值,较对照高出51.24%,之后开始下降,但始终比对照组要高,且差异显著(P<0.05)。第25天后,1-MCP处理类黄酮含量稍有升高,相反对照组一直在降低,到贮藏结束时,1-MCP处理苹果类黄酮含量比对照高了36.28%。
当植物体受到病原微生物侵染时,木质素在宿主细胞内快速合成与积累是植物体阻止病原菌扩张的重要抗性机制。接种灰葡萄孢菌后,1-MCP处理和对照苹果果实中的木质素含量都开始迅速增加,如图3C所示,与对照相比,1-MCP处理组的木质素含量上升速度较快,在第1天时,就与对照差异显著。之后两组木质素含量继续增大,并于第7天同时达到最大值。随后1-MCP处理组与对照组木质素含量均降低,从第10天起,两者木质素含量走向较为平缓,直至病害末期,再次降低,但是1-MCP处理组木质素含量自始至终高于对照。
2.4 1-MCP对苹果丙二醛含量的影响

图4 采后1-MCP处理对低温(0±1)℃条件下苹果果实丙二醛含量的影响
Fig. 4 Effect of postharvest 1-MCP treatment on MDA content in “Red Fuji” apple fruits stored at low temperature
如图4所示,由于打孔损伤导致各处理丙二醛含量呈现上升趋势,在实验前中期,1-MCP处理丙二醛含量变化幅度不大,对照丙二醛含量增加迅速,表明1-MCP处理有效抑制了苹果果肉膜脂过氧化的进程;实验后期,各处理丙二醛含量均升高,但1-MCP处理丙二醛含量始终低于对照(P<0.05)。
3 讨 论
1-MCP对果蔬的有益作用主要表现在两方面,一是延缓果蔬后熟衰老,保持品质延长货架期;二是诱导产生抗性提高对采后病害的抵抗能力。关于1-MCP延缓果蔬成熟衰老、改善品质方面已得到广泛研究。1-MCP对果蔬采后病害防治方面存在特异性,用量、果蔬种类和病原菌类别不同,其作用效果各不相同。Jiang等[24]在对草莓的研究中发现,低用量1-MCP处理可降低腐烂率,而高用量1-MCP处理增加了草莓对病原菌的敏感性,加快了果实病害的产生;1-MCP加速了由炭疽引起的芒果果实采后腐烂[25]。本实验结果表明,1-MCP能够有效控制低温条件下苹果采后灰霉病的发生与发展,较对照而言,显著降低了果实的发病率,抑制了病斑直径的扩展。这与1-MCP处理防治枣[26]、桃[27]、西洋梨[28]等果实采后真菌性病害的研究结果相似。
PAL、PPO、POD是植物体内重要的抗病防御相关酶,酚类物质是植物体的次生代谢产物,其合成途径主要是通过苯丙烷类代谢途径,在病害防御方面均发挥重要作用[29-30]。PAL是苯丙烷类代谢途径的关键酶与限速酶,由该途径合成的中间产物如酚类、类黄酮类、植保素以及木质素等都是植物体内重要的抑菌物质,可以对病原微生物进行直接的毒杀。PPO和POD是此代谢途径的末端酶,PPO主要参与酚类物质的氧化,生成醌类物质,醌类再经过非酶聚合反应生成黑色素,对病原微生物具有高毒性;POD在木质素、植保素等抗性物质的合成中起重要作用,木质素不仅可以提高果实细胞壁低抗病原微生物的能力,而且它的一些前体物质和多聚反应合成的游离基能够起到钝化病原微生物的作用。此外PPO、POD还参与活性氧代谢,生成氧中间体,如超氧阴离子和过氧化氢(H2O2),其中H2O2可作为一种信号因子,在植物体防御机制中起作用。Shao等[31]研究认为,果实受到病原菌侵染时,最早的防御方应之一就是产生活性氧,活性氧的产生不仅可以杀死病原菌微生物,还能够诱导果实的防御体系。大量研究显示,1-MCP处理可以诱导果蔬中PAL、PPO、POD等防御相关酶的提高。杜传来等[32]研究显示,1-MCP处理能提高几种菜叶PAL活性,减缓菜叶的衰老,提高了抗性;Liu 等[33]报道,1-MCP熏蒸处理久保桃24 h后,PAL、PPO和POD的活性显著升高,诱导了桃果实对扩展青霉的抗性,减轻了青霉病的发生。本实验研究表明,1-MCP处理能够有效提高PAL、PPO、POD 3种酶活性,同时加速了果实中总酚、类黄酮以及木质素等抗菌物质的合成,并使其含量均保持在相对较高水平,由此可见采后1-MCP处理能够激活苹果果实体内的酚类物质代谢途径,诱导其防御体系的增强,从而提高了苹果果实的抗病性。
GLU和CHI作为植物体内两种常见的病程相关蛋白,是植物体遭受逆境胁迫刺激后产生的一类防御蛋白,能够单独或协同分解病原真菌的细胞结构,致使其爆裂而亡,从而阻止病原菌的侵染。正常植物体内一般含量非常低甚至没有,但是当植物体受到胁迫或者激发子时能诱导GLU 和CHI活性的提高,从而增强抵御病原菌侵染的能力[34]。因此,在植物抗性反应中,GLU和CHI的快速合成是衡量植物抗病性的一个重要指标。前人实验结果显示,GLU 和CHI在杨梅[35]、芒果[36]和枇杷[19]果实的抗性反应发挥着重要作用。左豫虎等[37]研究报道,GLU和CHI还可能作为一种激发子,诱导其他防卫基因的表达。本实验中,1-MCP处理可诱导苹果果实中GLU和CHI活性的升高,且在病害观察期间一直显著高于对照,同时果实的发病率和病斑直径又明显低于对照,说明1-MCP控制苹果采后灰霉病与诱导果实GLU和CHI活性的升高密切相关。一是GLU和CHI对病原菌有直接杀伤作用,二是GLU和CHI也可能激活其他防御系统,进而增强抗性。
丙二醛是膜脂过氧化的中间产物,由于它能导致蛋白质上的氨基酸发生化学结构上的变化,产生氧化自由基,破坏细胞膜的完整性,造成细胞破裂瓦解,降低植物体的抗逆性并加速其衰老。结果发现,1-MCP处理可以显著抑制苹果果实丙二醛含量的的升高,因而减弱其对果实的伤害,提高果实的抵抗能力。
4 结 论
1 μL/L 1-MCP处理可显著降低低温条件下红富士苹果灰霉病的发病率,抑制其病斑直径的扩展,通过提高PAL、PPO、POD、CHI和GLU活性,促进总酚、类黄酮以及木质素的合成与积累,同时减少丙二醛的产生,从而保护组织细胞膜结果的完整性,进而增强了苹果果实对灰霉菌的抵抗能力。由此可见,1-MCP处理可用于苹果采后病害的防治,但其作用的分子机理有待进一步研究。
参考文献:
[1] 聂继云. 苹果的营养与功能[J]. 保鲜与加工, 2013, 13(6): 56-59. DOI:10.3969/j.issn.1009-6221.2013.06.013.
[2] XU L, DU Y. Effects of yeast antagonist in combination with UV-C treatment on postharvest diseases of pear fruit[J]. Biological Control, 2012, 57(3): 451-461. DOI:10.1007/s10526-011-9400-8.
[3] BERRIE A M, XU X M, JOHNSON D. Lower temperatures more effective than atmosphere modification in controlling Botrytis and Nectria rots in stored apples[J]. Journal of Phytopathology, 2011, 159(2): 73-79. DOI:10.1111/j.1439-0434.2010.01725.x.
[4] REBORDINOS L, CANTORAL J M, PRIETO M V, et al. The phytotoxic activity of some metabolites of Botrytis cinerea[J]. Phytochemistry, 1996, 42(2): 383-387. DOI:10.1016/0031-9422(95)00909-4.
[5] 李淼, 产祝龙, 田世平, 等. 果实采后病害诱导抗性研究进展[J]. 保鲜与加工, 2010, 10(5): 1-7. DOI:10.3969/ j.issn.1009-6221.2010.05.002.
[6] ZONG Y, LIU J, LI B, et al. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit[J]. Biological Control, 2010, 54(3): 316-321. DOI:10.1016/ j.biocontrol.2010.06.003.
[7] ZHANG C, CHEN K, WANG G. Combination of the biocontrol yeast Cryptococcus laurentii with UV-C treatment for control of postharvest diseases of tomato fruit[J]. Biological Control, 2013, 58(2): 269-281. DOI:10.1007/s10526-012-9477-8.
[8] NGADZE E, COUTINHO T A, ICISHAHAYO D, et al. Effect of calcium soil amendments on phenolic compounds and soft rot resistance in potato tubers[J]. Crop Protection, 2014, 62(1): 40-45. DOI:10.1016/j.cropro.2014.04.009.
[9] 张莹, 王艳辉, 郝敏, 等. 水杨酸诱导对玉米大斑病抗性的影响[J]. 农业生物技术学报, 2008, 16(3): 501-507. DOI:10.3969/ j.issn.1674-7968.2008.03.024.
[10] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-263. DOI:10.3969/ j.issn.1002-6819.2014.04.031.
[11] 赵建, 黄建国, 袁玲, 等. 寡雄腐霉发酵液对番茄生长的影响及对灰霉病的防治作用[J]. 生态学报, 2014, 34(23): 7093-7100. DOI:10.5846/stxb201303070373.
[12] JACOMETTI M A, WRATTEN S D, WALTER M. Review: alternatives to synthetic fungicides for Botrytis cinerea management in vineyards[J]. Australian Journal of Grape and Wine Research, 2010, 16(1): 154-172. DOI:10.1111/j.1755-0238.2009.0067.x.
[13] 邵兴锋, 屠康, 静玮, 等. 热处理对红富士苹果贮藏期间青霉病的抑制效果[J]. 园艺学报, 2007, 34(3): 743-746. DOI:10.3321/j.issn: 0513-353x.2007.03.037.
[14] 葛永红, 李灿婴, 朱丹实, 等. 采后BTH处理对苹果果实苯丙烷代谢和病程相关蛋白积累的增强作用[J]. 食品工业科技, 2015, 36(5): 306-310. DOI:10.13386/j.issn1002-0306.2015.05.056.
[15] LEE J, RUDELL D R, DAVIES P J, et al. Metabolic changes in 1-methylcyclopropene (1-MCP)-treated ‘Empire’ apple fruit during storage[J]. Metabolomics, 2012, 8(4): 742-753. DOI:10.1007/s11306-011-0373-5.
[16] JUNG S K, WATKINS C B. Superficial scald control after delayed treatment of apple fruit with diphenylamine (DPA) and 1-methylcyclopropene (1-MCP)[J]. Postharvest Biology and Technology, 2008, 50(1): 45-52. DOI:10.1016/ j.postharvbio.2008.05.006.
[17] 李辉, 林毅雄, 林河通, 等. 1-甲基环丙烯控制采后‘油(木奈)’果实腐烂与抗病相关酶诱导的关系[J]. 热带作物学报, 2015, 36(4): 786-791. DOI:10.3969/j.issn.1000-2561.2015.04.025.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007. DOI:10.1002/app.33935.
[19] CAO S, ZHENG Y. Effect of 1-methylcyclopropene on anthracnose rot caused by Colletotrichum acutatum and disease resistance in loquat fruit[J]. Journal of the Science of Food and Agriculture, 2010, 90(13): 2289-2294. DOI:10.1002/jsfa.4084.
[20] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 210-211.
[21] TOOR R K, SAVAGE G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International, 2005, 38(5): 487-494. DOI:10.1016/j.foodres.2004.10.016.
[22] GONZÁLEZ-AGUILAR G A, VILLEGAS-OCHOA M A, MARTÍNEZ-TÉLLEZ M A, et al. Improving antioxidant capacity of fresh-cut mangoes treated with UV-C[J]. Journal of Food Science, 2007, 72(3): S197-S202. DOI:10.1111/j.1750-3841.2007.00295.x.
[23] 周会玲, 袁仲玉, 吴主莲, 等. 壳聚糖涂膜对机械伤苹果抗性生理特征的影响[J]. 西北植物学报, 2013, 33(7): 1415-1420.
[24] JIANG Y, JOYCE D C, TERRY L A. 1-Methylcyclopropene treatment affects strawberry fruit decay[J]. Postharvest Biology and Technology, 2001, 23(3): 227-232. DOI:10.1016/S0925-5214(01)00123-5.
[25] HOFMAN P J, JOBIN-DECOR M, MEIBURG G F, et al. Ripening and quality responses of avocado, custard apple, mango and papaya fruit to 1-methylcyclopropene[J]. Animal Production Science, 2001, 41(4): 567-572. DOI:10.1071/EA00152.
[26] ZHANG Z, TIAN S, ZHU Z, et al. Effects of 1-methylcyclopropene (1-MCP) on ripening and resistance of jujube (Zizyphus jujuba cv. Huping) fruit against postharvest disease[J]. LWT-Food Science and Technology, 2012, 45(1): 13-19. DOI:10.1016/j.lwt.2011.07.030.
[27] 刘红霞, 姜微波, 罗云波, 等. 1-MCP及乙烯处理对损伤接种桃果实Penicillium expansum的抑制[J]. 食品工业科技, 2003, 24(增刊1): 152-156.
[28] SPOTTS R A, SHOLBERG P L, RANDALL P, et al. Effects of 1-MCP and hexanal on decay of d′Anjou pear fruit in long-term cold storage[J]. Postharvest Biology and Technology, 2007, 44(2): 101-106. DOI:10.1016/j.postharvbio.2006.12.003.
[29] 葛永红, 李灿婴, 王毅, 等. 硅酸钠处理对杏果实活性氧和苯丙烷代谢的影响[J]. 食品工业科技, 2014, 35(13): 317-320; 326. DOI:10.13386/j.issn1002-0306.2014.13.060.
[30] 张晓晓, 周会玲, 田蓉, 等. 短波紫外线照射对苹果采后灰霉病抗性诱导作用[J]. 食品科学, 2015, 36(2): 242-249. DOI:10.7506/ spkx1002-6630-201502047.
[31] SHAO X, TU K, TU S, et al. Effects of heat treatment on wound healing in gala and Red fuji apple fruits[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4303-4309. DOI:10.1021/jf904273m.
[32] 杜传来, 高会. 1-MCP对几种叶菜保鲜效果的影响[J]. 食品与机械, 2010, 26(3): 57-61. DOI:10.3969/j.issn.1003-5788.2010.03.016.
[33] LIU H, JIANG W, ZHOU L, et al. The effects of 1-methylcyclopropene on peach fruit (Prunus persica L. cv. Jiubao) ripening and disease resistance[J]. International Journal of Food Science and Technology, 2005, 40(1): 1-7. DOI:10.1111/j.1365-2621.2004.00905.x.
[34] JI C, KUC J. Antifungal activity of cucumber β-1,3-glucanase and chitinase[J]. Physiological and Molecular Plant Pathology, 1996, 49(4): 257-265. DOI:10.1006/pmpp.1996.0053.
[35] WANG K, CAO S, JIN P, et al. Effect of hot air treatment on postharvest mould decay in Chinese bayberry fruit and the possible mechanisms[J]. International Journal of Food Microbiology, 2010, 141(1): 11-16. DOI:10.1016/j.ijfoodmicro.2010.05.004.
[36] HU M, YANG D, HUBER D J, et al. Reduction of postharvest anthracnose and enhancement of disease resistance in ripening mango fruit by nitric oxide treatment[J]. Postharvest Biology and Technology, 2014, 97(1): 115-122. DOI:10.1016/j.postharvbio.2014.06.013.
[37] 左豫虎, 康振生, 杨传平, 等. β-1,3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报, 2009, 39(6): 600-607. DOI:10.3321/j.issn: 0412-0914.2009.06.006.
Mechanism of 1-MCP Treatment in Induced Resistance to Gray Mold of Apples during Low-Temperature Storage
ZHOU Xiaowan, TANG Yongping, SHI Yali, ZHOU Huiling*
(College of Horticulture, Northwest A&F University, Yangling 712100, China)
Abstract: This study aimed to investigate the effect of 1-methylcyclopropene (1-MCP) treatment on postharvest gray mold in “Red Fuji” apples and the mechanism of induced resistance during low-temperature storage at (0 ± 1) ℃. The results indicated that disease incidence and lesion diameter in apples after the inoculation were significantly reduced by 1 μL/L 1-MCP treatment when compared to control group (P < 0.05). Moreover, the activities of phenylalanine ammonia-lyase (PAL), polyphenol oxidase (PPO), peroxldase (POD), β-1,3-glucanase (GLU) and chitinase (CHI) of apple fruits were promoted remarkably by 1-MCP treatment. The contents of total phenolic compounds, flavonoids and lignin were also increased significantly. Besides, the content of malondialdehyde (MDA) was decreased by 1-MCP treatment. The results provide a theoretical basis for the use of 1-MCP as a control agent against apple postharvest diseases.
Key words: apple; 1-MCP; low-temperature storage; gray mold; resistance
收稿日期:2015-11-09
基金项目:国家现代农业(苹果)产业技术体系建设专项(nycylx-08-05-02)
作者简介:周晓婉(1990—),女,硕士研究生,研究方向为园艺产品采后处理及贮藏保鲜。E-mail:675799930@qq.com
*通信作者:周会玲(1969—),女,副教授,博士,研究方向为园艺产品采后生理及贮藏保鲜。E-mail:zhouhuiling@nwsuf.edu.cn
DOI:10.7506/spkx1002-6630-201612046
中图分类号:S661.1
文献标志码:A
文章编号:1002-6630(2016)12-0254-07引文格式:




