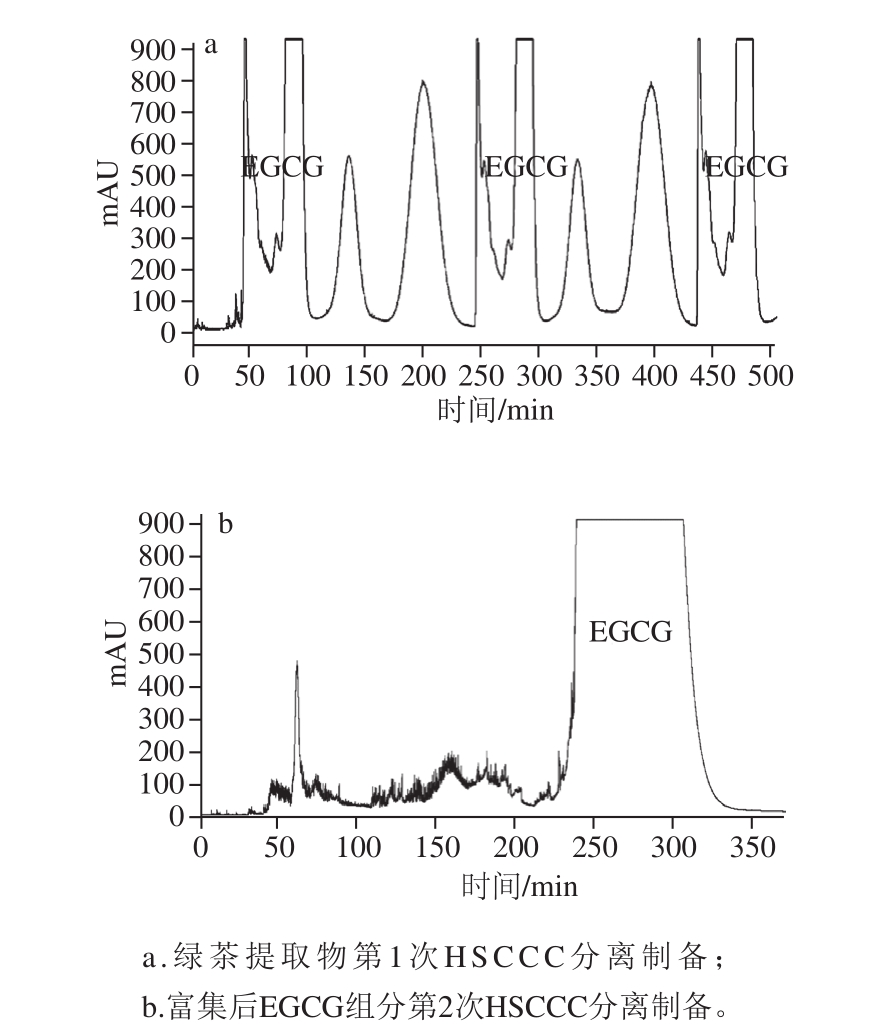
图 1 EGCG制备分离的HSCCC图
Fig. 1 HSCCC of EGCG
王 尉 1,2,林 楠 1,2,周晓晶 1,2,3,乐胜锋 1,2,杜 宁 1,2,3,张经华 1,3
(1.北京市理化分析测试中心,北京 100089;2.有机材料检测技术与质量评价北京市重点实验室,北京 100094;3.全国标准样品技术委员会天然产物标准样品专业工作组,北京 100094)
摘 要:依据GB/T 15000.3—2008《标准样品工作导则(3)标准样品:定值的一般原则和统计方法》,开展表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)国家标准样品研制工作。以绿茶样品作为研究材料,采用溶剂提取、萃取、高速逆流色谱分离纯化,制备得到EGCG。通过紫外-可见吸收光谱、红外光谱、质谱和核磁共振波谱等方法对EGCG样品进行结构鉴定,并进行均匀性、稳定性检验。采用8 家实验室进行联合定值,并对定值结果进行数据分析。结果:EGCG标准样品均匀性和稳定性良好,定值结果为99.29%,置信度95%的扩展不确定度为0.16%。结论:所制备得到的EGCG样品满足GB/T 15000.3—2008的要求,可用于绿茶相关产品中EGCG的质量控制和方法验证。
关键词:表没食子儿茶素没食子酸酯;绿茶;标准样品;均匀性;稳定性;定值
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是黄烷醇类化合物,是多酚类物质的主要成分。EGCG是绿茶中含量最高、活性最强的多酚类化合物,占多酚类总量40%以上 [1-2]。EGCG不仅对茶叶的滋味具有重要的影响,而且大量的研究表明EGCG等茶多酚成分具有重要的生物活性,如抗氧化 [3-4]、清除自由基 [5]、抗辐射 [6]、抗病毒 [7]、抗炎 [8]、修复细胞损伤 [9-10]、降血压血脂 [11]和预防癌症 [12-17]等。目前,EGCG的制备分离常以色谱技术为核心,运用多种化学方法达到分离纯化EGCG的目的。王霞等 [18]通过对茶多酚原料萃取,采用制备液相色谱的方法制备得到了纯度大于99%的EGCG。孙东魁等 [19]从茶多酚中提取全乙酰化的EGCG,采用高效液相色谱(high performance liquid chromatography,HPLC)法跟踪水解过程,优化水解条件,以较高收率得到高纯度的EGCG样品。朱斌等 [20]选择聚酰胺为柱填料对茶多酚样品进行分离,通过对洗脱剂pH值、温度等条件优化,制备得到了纯度大于93%的EGCG。
市场上绿茶相关的产品种类繁多,其中EGCG作为绿茶主要的化学成分,其含量的检测需要该标准样品作为检测对照;同时,在绿茶相关活性研究和产品开发中,EGCG也是重要的研究对象,因此迫切需要开展该标准样品的研制工作。本研究采用溶剂提取、萃取、高速逆流色谱(high-speed countercurrent chromatography,HSCCC)技术制备EGCG,通过紫外-可见吸收光谱(ultraviolet-visible absorption spectrometry,UV-VIS)、红外光谱(infrared spectroscopy,IR)、质谱(mass spectrometry,MS)和核磁共振(nuclear magnetic resonance,NMR)波谱等方法进行结构鉴定,并开展均匀性检验、稳定性检验、定值研究,最终得到纯度大于98%、扩展不确定度小于0.5%的EGCG标准样品。
1.1 材料与试剂
龙井绿茶 北京吴裕泰茶业股份有限公司。
乙醇、乙酸乙酯、正己烷、甲醇、乙酸(均为分析纯) 国药集团化学试剂有限公司;乙腈(色谱纯)美国Fisher Scientific公司;EGCG对照品(纯度>99%)上海融禾医药科技有限公司。
1.2 仪器与设备
LC-20A型HPLC系统(配SPD-M20A和ELSD-LTⅡ检测器)、UV-2550紫外-可见分光光度计 日本岛津公司;1100 Series LC/MSD Trap型液相MS仪 美国安捷伦公司;Spectrum400傅里叶变换红外-近红外光谱仪 德国珀金埃尔默公司;AVANCE 600超导脉冲傅里叶变换NMR仪 德国Bruker公司;ALPHA 1-2 plus冷冻干燥机德国Christ公司。
1.3 方法
1.3.1 EGCG样品制备和分装
将绿茶粉碎过0.3 mm筛(60 目),称取绿茶粉末200 g,加入80%乙醇溶液2 L,60 ℃回流提取3 次,每次1 h,过滤,合并滤液,减压回收乙醇得提取物浸膏。所得浸膏用蒸馏水分散,乙酸乙酯萃取3 次,合并萃取液,减压回收溶剂得乙酸乙酯浸膏,备用。
通过市售对照品跟踪EGCG,采用HSCCC进行EGCG样品的分离制备。将选定的溶剂体系充分混合后,静置分层,上相为固定相,下相为流动相。先以10 mL/min的流速泵入固定相,待固定相充满管道后。打开主机调整转速为900 r/min,主机正转,当达到设定转速时,以3 mL/min的流速泵入流动相。主机温度控制在25 ℃,检测波长设定为280 nm,当流动相从主机出口流出时进样。选定的HSCCC溶剂体系分别为正己烷-乙酸乙酯-甲醇-水(0.8∶5∶1∶5,V/V)和乙酸乙酯-乙醇-水(25∶1∶25,V/V),收集EGCG的色谱峰,旋转蒸发去除溶剂,冷冻干燥,最终得到高纯度EGCG样品。
将EGCG样品采用进口2 mL棕色样品瓶进行分装。分装是在相对独立和洁净空间进行的,以每瓶10 mg分装,用十万分之一天平称量,样品共100 瓶,以1~100号计。分装好的样品瓶放在4 ℃冰箱中长期保存。
1.3.2 纯度分析
配制质量浓度为0.5 mg/mL的EGCG样品溶液,采用HPLC峰面积归一法对EGCG进行纯度分析。采用不同色谱柱,相同分析条件:色谱柱分别为Diamonsil C 18(250 mm×4.6 mm,5 μm)、Luna C 18(250 mm×4.6 mm,5 μm)、Zorbax SBC 18(250 mm×4.6 mm,5 μm);流动相:1%乙酸-乙腈(85∶15,V/V);流速:1 mL/min;柱温:30 ℃;检测波长:273 nm。采用Diamonsil C 18色谱柱(250 mm×4.6 mm,5 μm)HPLC-二极管阵列检测器-蒸发光散射检测器联用,流动相:1%乙酸(A)-乙腈(B),线性梯度洗脱,10%~60% B(0~30 min);流速:1 mL/min;柱温:30 ℃;检测波长:273 nm;蒸发光散射检测器分析条件:载气压力350 kPa,漂移管温度40 ℃,增益值5。
1.3.3 结构鉴定
采用UV、IR、MS和NMR方法对EGCG进行结构鉴定。UV分析条件:甲醇作为溶剂,扫描范围200~800 nm;IR分析条件:KBr压片法,扫描范围400~4 000 cm -1。MS分析条件:离子源为电喷雾,采用正、负离子模式,喷雾器压力50 psi,脱溶剂气为氮气,温度350 ℃,流量10 L/min。NMR分析条件:氘代溶剂为氘代丙酮(Acetone-d 6)和重水(D 2O)的混合溶剂,采集 13C-NMR和 1H-NMR谱图。
1.3.4 均匀性、稳定性、定值测定
依据GB/T 15000.3—2008《标准样品工作导则(3)标准样品:定值的一般原则和统计方法》 [21]开展均匀性、稳定性、定值研究工作。均匀性:随机抽取10个样品,采用单因素多水平试验方差分析法进行纯度均匀性检验,判断EGCG的均匀性是否合格。稳定性:将EGCG样品避光贮存于4 ℃,开展12 个月长期稳定性的研究。分别于0、3、6、9、12 个月取样检测,采用直线作为经验模型,观察斜率值是否有显著变化,预测EGCG的稳定性变化。定值:采用多个实验室协作实验的联合定值方式,分别对随机抽取8 个样品进行检测,对所采集的测定结果采用格拉布斯(Grubbs)检验法进行检验,计算EGCG标准样品的标准值和不确定度。
2.1 EGCG制备及纯度分析

图 1 EGCG制备分离的HSCCC图
Fig. 1 HSCCC of EGCG
采用正己烷-乙酸乙酯-甲醇-水(0.8∶5∶1∶5,V/V)溶剂体系连续上样,富集EGCG组分,经乙酸乙酯-乙醇-水(25∶1∶25,V/V)溶剂体系二次分离纯化得到高纯度的EGCG样品(图1)。经HPLC分析,应用峰面积归一法计算纯度值,其纯度为99.30%(图2a)。
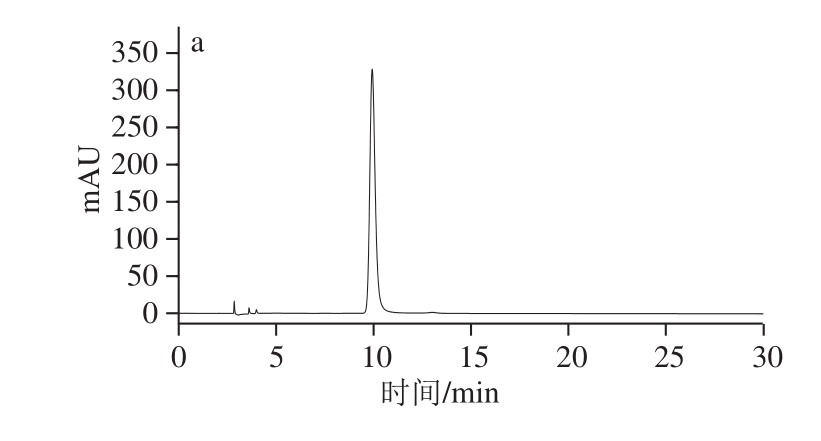
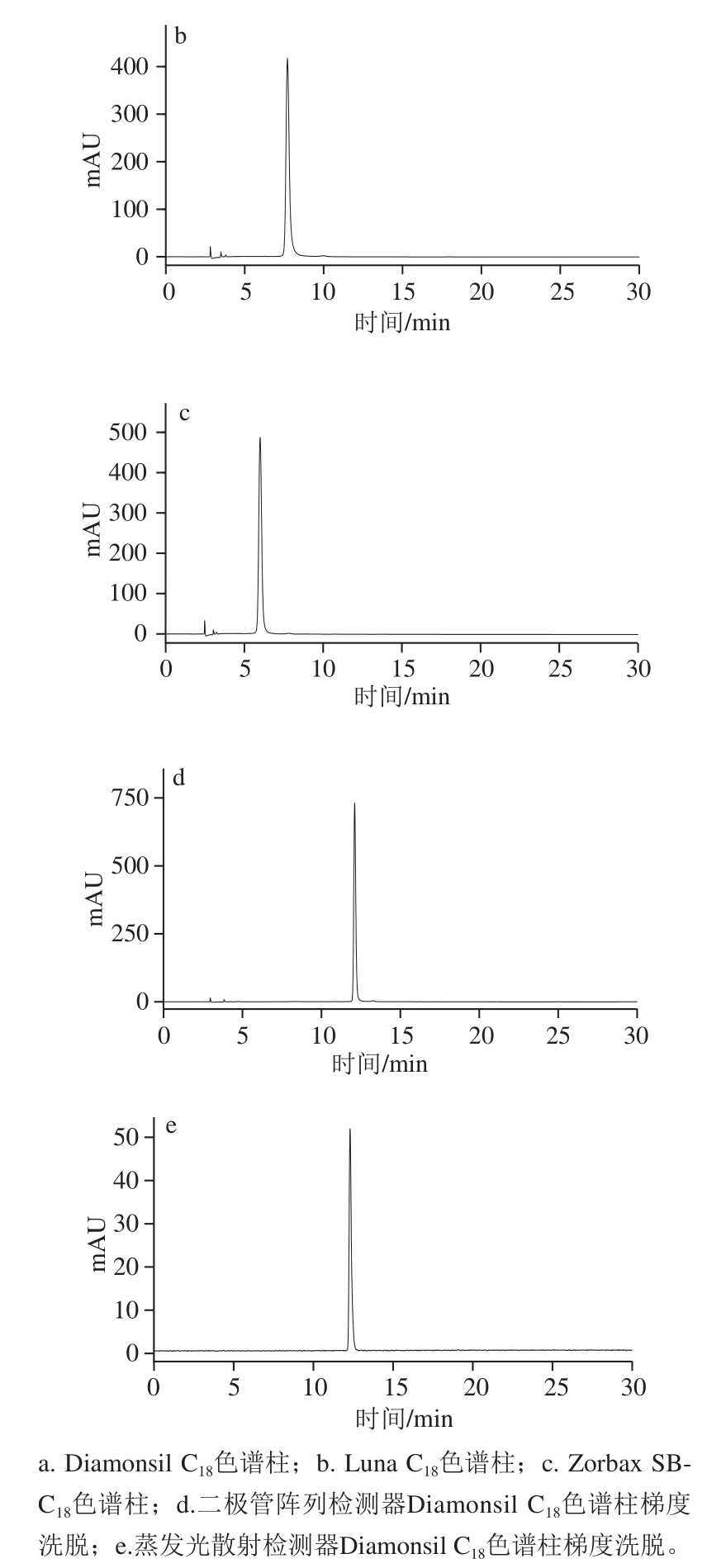
图 2 EGCG的HPLC图
Fig. 2 HPLC chromatograms of EGCG
2.2 EGCG结构鉴定
采用UV-VIS、IR、MS和NMR对EGCG进行结构鉴定。UV-VIS最大吸收波长为273 nm(图3a);IR吸收峰:3 224(—O—H)、1 692(—C=O)、1 613(—C=C)、1 518、1 450(Ar)、1 237(酯—C—O)、1 144、1 096、1 037(醚—C—O) cm -1(图3b)。UV、IR数据与文献[22-23]比较,光谱特征一致。通过ESI-MS正负离子模式扫描(图4)可得:[M+H] += 459.2,[M-H] -=457.1,故测定的相对分子质量为458,与EGCG相对分子质量相符 [24]。 1H和 13C-NMR测试结果见图5,通过对数据进行归属(表1),并与文献[25]比较,其核磁谱数据与报道的EGCG化合物基本一致,确定该样品为EGCG。
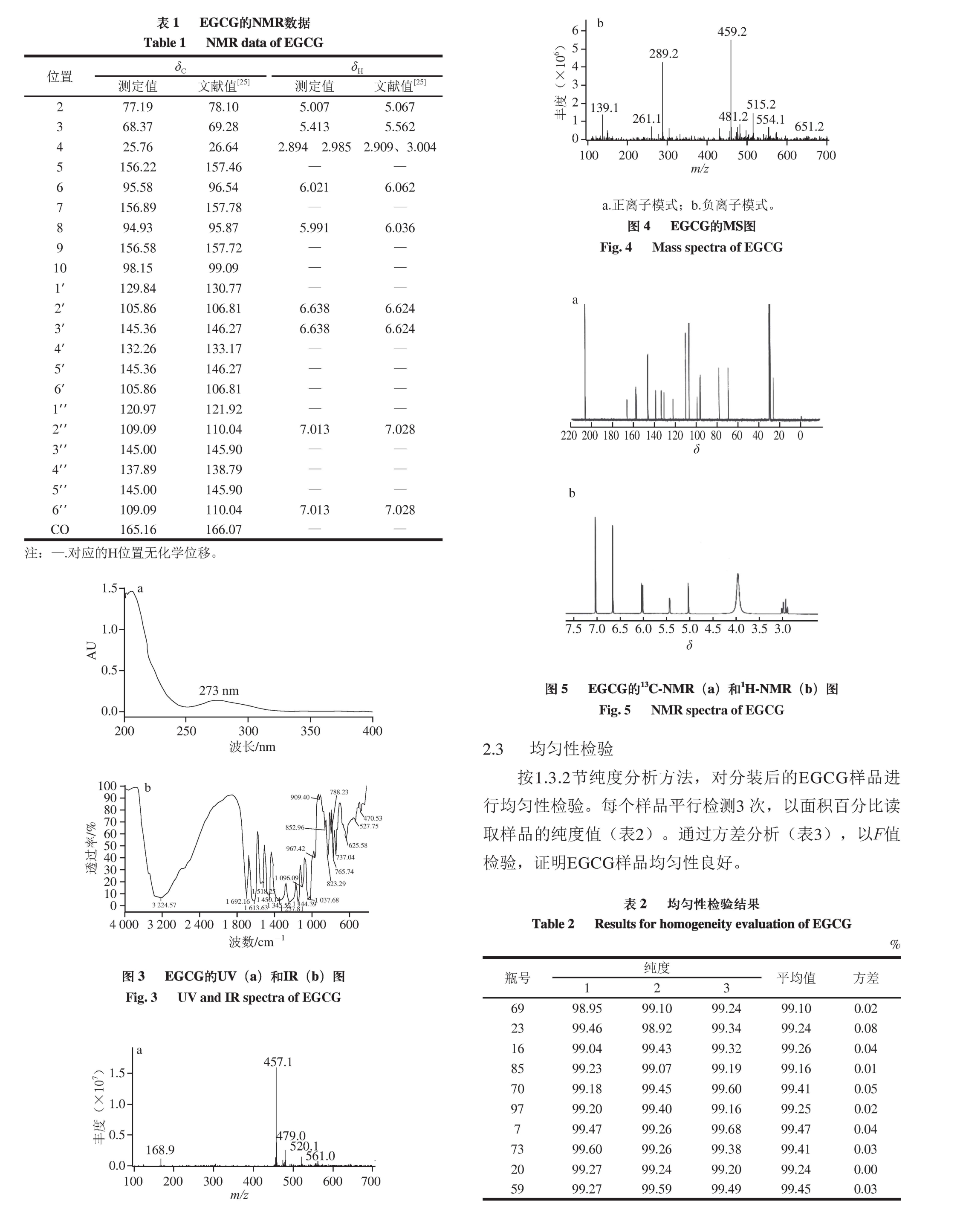
表3 均匀性检验方差分析结果
Table 3 Results of variance analysis for the homogeneity of EGCG
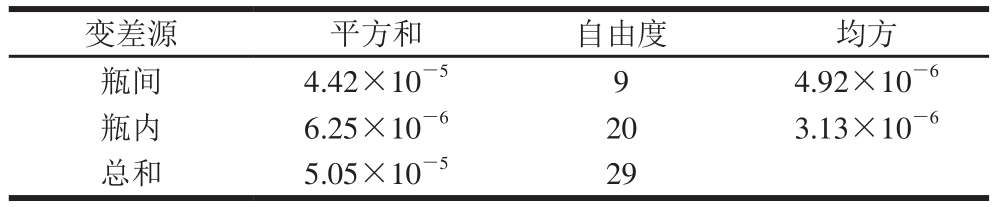
根据均匀性检验结果,计算瓶间和瓶内方差分析的均方,并计算F值为1.57。查F 临界值表,得F 0.05(9,20)=2.39,由于F的计算值小于F 临界值,所以可以认为本样品是均匀的。通过计算瓶间方差,取其平方根可得均匀性检验引入的不确定度u 均=7.73×10 -4。
2.4 稳定性检验
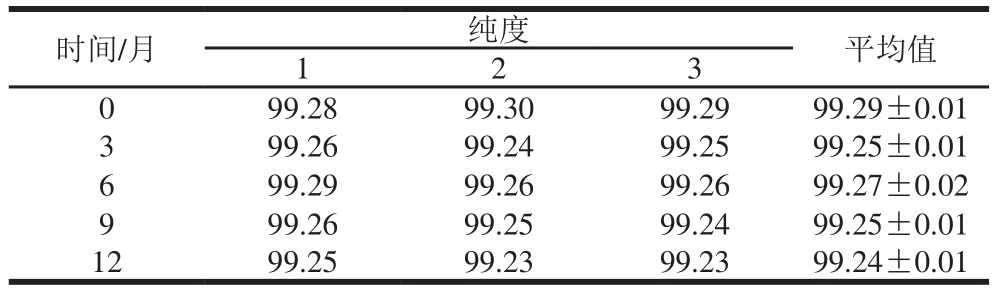
按1.3.2节纯度分析方法,对避光贮存的EGCG样品进行稳定性检验。每个样品平行检测3 次,以面积百分比读取样品的纯度值(表4),采用直线作为经验模型,未发现斜率值发生显著变化,可以确定EGCG样品在12 个月时间内稳定性良好。
表4 稳定性检验结果
Table 4 Results for stability evaluation of EGCG %
采用直线作为经验模型,观察斜率值是否有显著变化,以此对标准样品的稳定性变化进行预测。斜率:
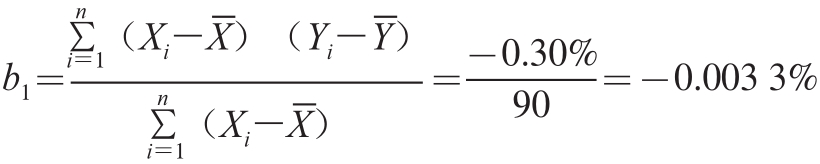
式中:
![]() 。
。
截距:
![]()
直线上的点的标准偏差计算:
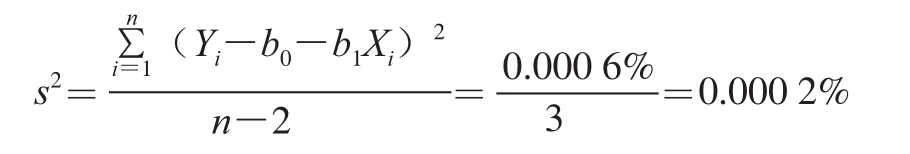
取其平方根s=0.14%,与斜率相关的不确定度计算:
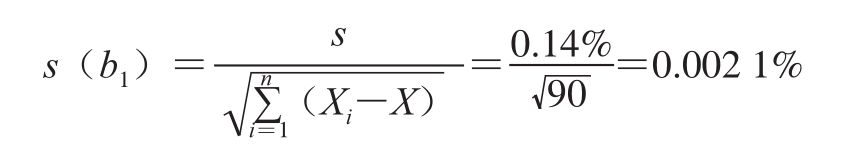
自由度为n-2和95%置信水平的分布t因子等于3.128,由于|b 1|<t 0.95(n-2)·s(b 1)=3.128×0.002 1%= 0.006 7%,故斜率是不显著的,因而未观测到该样品的不稳定性。12个月的长期稳定性的不确定度为:u 稳= s(b 1)·t=0.002 1%×12=2.52×10 -4。
2.5 定值
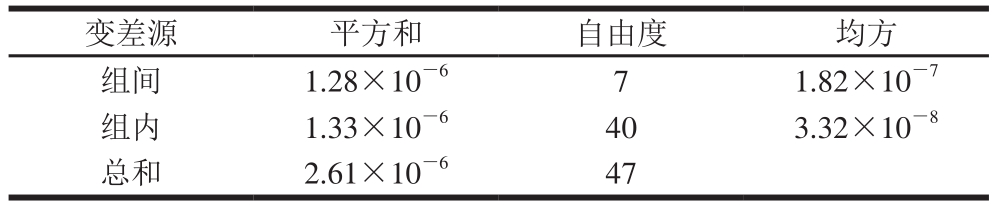
对联合定值的8 家实验室所采集的测定结果,采用Grubbs检验法进行检验,未发现异常值。经过数据统计,计算得出EGCG样品的标准值和不确定度。不同实验室检测和方差分析结果见表5、6。
表5 不同实验室检测结果
Table 5 Results from different laboratories %
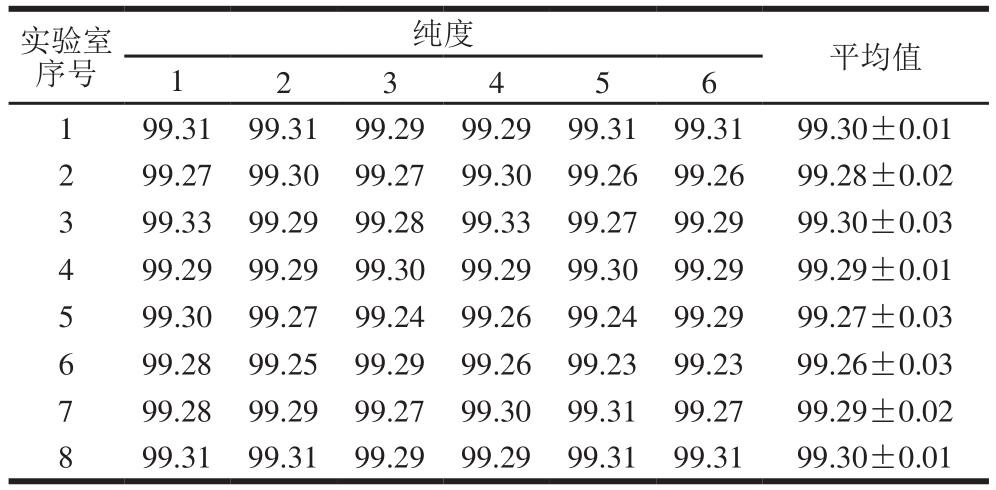
表6 不同实验室方差分析结果
Table 6 Results of variance analysis for different laboratories
总平均值(标准值)计算:
总平均值的不确定度计算:
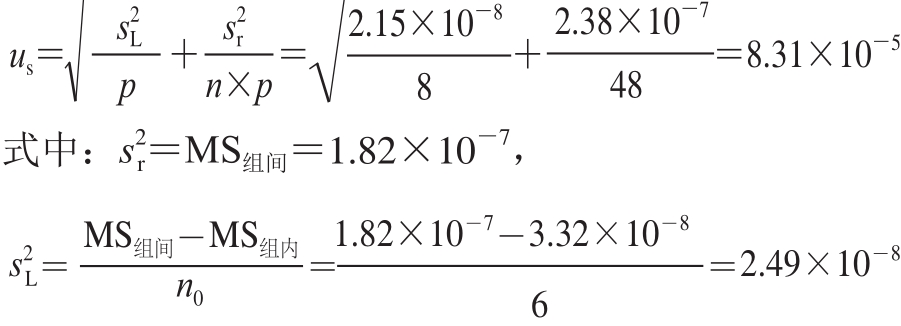
制备所得标准样品定值结果的不确定度(u
CRM)由以下几部分组成:1)均匀性检验引入的不确定度(u
均);2)稳定性检验引入的不确定度(u
稳);3)多个实验室定值引入的不确定度(
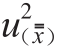 )。
)。
uCRM
2=
![]() ,故u
CRM=8.17×10
-4= 0.082%,在置信概率为95%时,k=2,则扩展不确定度U
CRM=2u
CRM=0.082%×2=0.16%。
,故u
CRM=8.17×10
-4= 0.082%,在置信概率为95%时,k=2,则扩展不确定度U
CRM=2u
CRM=0.082%×2=0.16%。
故EGCG定值结果为(99.29±0.16)%。
本研究在成功建立了EGCG样品制备方法的基础上,开展了该标准样品的研制工作。并依据GB/T 15000.3—2008,对制备得到的EGCG样品进行均匀性检验、稳定性检验及定值研究,最终申报获批成为国家标准样品(标准样品证书编号GSB 11-1439-2012)。
EGCG标准样品的标准值为99.29%,扩展不确定度(95%置信区间)为0.16%。该标准样品符合GB/T 15000.3—2008的要求,填补了国内该研究领域的空白。EGCG标准样品不仅可以满足茶叶及相关产品分析检测、质量控制工作的需求,同时,也为检测结果的准确性、可比性,以及溯源性提供了技术支持。
参考文献:
[1] 赵丽萍, 邵宛芳. 茶叶中EGCG功效研究进展[J]. 中国农学通报,2007, 23(7): 143-147. DOI:10.3969/j.issn.1000-6850.2007.07.034.
[2] 葛建, 林芳, 李明揆, 等. 表没食子儿茶素没食子酸酯(EGCG)生物活性研究进展[J]. 安徽农业大学学报, 2011, 38(2): 156-163. DOI:10.13610/j.cnki.1672-352x.2011.02.007.
[3] SONG Shuang, HUANG Yewei, TIAN Yang, et al. Mechanism of action of (-)-epigallocatechin-3-gallate: autooxidation-dependent activation of extracellular signal-regulated kinase 1/2 in Jurkat cells[J]. Chinese Journal of Natural Medicines, 2014, 12(9): 654-662. DOI:10.3724/SP.J.1009.2014.00654.
[4] 王媛, 殷红, 陈小波, 等. 茶多酚抗氧化作用的研究[J]. 安徽农业科学, 2013, 41(3): 1232-1235. DOI:10.13989/ j.cnki.0517-6611.2013.03.043.
[5] KERIOA L C, WACHIRAB F N, WANYOKO J K, et al. Total polyphenols, catechin profles and antioxidant activity of tea products from purple leaf coloured tea cultivars[J]. Food Chemistry, 2013,136(3/4): 1405-1413. DOI:10.1016/j.foodchem.2012.09.066.
[6] 官树, 姚思德, 倪谨, 等. EGCG辐射保护作用的研究[J]. 辐射研究与辐射工艺学报, 2002, 20(2): 87-92. DOI:10.3969/ j.issn.1000-3436.2002.02.002.
[7] 刘帅华, 李春英, 李朝, 等. EGCG及其衍生物的抗病毒作用研究进展[J]. 黑龙江医药, 2013, 26(1): 31-33. DOI:10.3969/ j.issn.1006-2882.2013.01.012.
[8] 孙海岚, 杨剑. 茶多酚的抗炎研究进展[J]. 重庆医学, 2012, 41(35):3766-3768. DOI:10.3969/j.issn.1671-8348.2012.35.034.
[9] 刘晓慧, 揭国良, 林康, 等. EGCG和茶氨酸对细胞氧化损伤的协同保护和修复作用研究[J]. 茶叶科学, 2014, 34(3): 239-247. DOI:10.13305/j.cnki.jts.2014.03.005.
[10] HE Wei, LI Lixia, LIAO Qingjiao, et al. Epigallocatechin gallate inhibits HBV DNA synthesis in a viral replication-inducible cell line[J]. World Journal of Gastroenterol, 2011, 17(11): 1507-1514. DOI:10.3748/wjg.v17.i11.1507.
[11] 王安琴, 郜蕊, 吕俊华. 茶多酚对高脂-高盐-果糖诱致左心室肥厚大鼠血压、血糖和血脂的影响[J]. 现代医院, 2012, 12(3): 29-31. DOI:10.3969/j.issn.1671-332X.2012.3.010.
[12] 温旭烨, 李记英, 蒋洁琳, 等. 表没食子儿茶素没食子酸酯的抗癌机制的研究进展[J]. 食品工业科技, 2013, 34(5): 347-352. DOI:10.13386/j.issn1002-0306.2013.05.010.
[13] 陈敏星, 郭雅玲. 基于茶叶EGCG的抗癌机制研究进展[J].热带作物学报, 2013, 34(4): 789-793. DOI:10.3969/ j.issn.1000-2561.2013.04.037.
[14] JOHNSONA J J, BAILEYB H H, MUKHTARC H. Green tea polyphenols for prostate cancer chemoprevention: a translational perspective[J]. Phytomedicine, 2010, 17(1): 3-13. DOI:10.1016/ j.phymed.2009.09.011.
[15] GAURAV K, PRERANA D, VAISHALI K, et al. Polymeric black tea polyphenols modulate the localization and activity of 12-O-tetradecanoylphorbol-13-acetate-mediated kinases in mouse skin: mechanisms of their anti-tumor-promoting action[J]. Free Radical Biology and Medicine, 2012, 53(6): 1358-1370. DOI:10.1016/ j.freeradbiomed.2012.07.017.
[16] YANG C S, LI Guangxun, YANG Zhihong, et al. Cancer prevention by tocopherols and tea polyphenols[J]. Cancer Letters, 2013, 334(1):79-85. DOI:10.1016/j.canlet.2013.01.051.
[17] ZHU Baohe, CHEN Huayun, ZHAN Wenhua, et al.(-)-Epigallocatechin-3-gallate inhibits VEGF expression induced by IL-6 via Stat3 in gastric cancer[J]. World Journal of Gastroenterol,2011, 17(18): 2315-2325. DOI:10.3748/wjg.v17.i18.2315.
[18] 王霞, 高丽娟, 林炳昌. 表没食子儿茶素没食子酸酯(EGCG)的分离与制备[J]. 食品科学, 2005, 26(9): 242-246. DOI:10.3321/ j.issn:1002-6630.2005.09.056.
[19] 孙东魁, 李婷婷, 江涛, 等. 表没食子儿茶素没食子酸酯的化学精制方法研究[J]. 中国海洋大学学报, 2009, 39: 55-58. DOI:10.13995/ j.cnki.11-1802/ts.1997.05.004.
[20] 朱斌, 陈晓光, 宋航, 等. 茶多酚制备高纯度EGCG的工艺研究[J]. 食品研究与开发, 2009, 30(4): 7-10. DOI:10.3969/ j.issn.1005-6521.2009.04.002.
[21] 国家质量监督检验总局, 中国国家标准化管理委员会. GB/T 15000.3—2008 标准样品工作导则(3): 标准样品: 定值的一般原则和统计方法[S]. 北京: 中国标准出版社, 2008.
[22] 黄静高. 高纯度儿茶素单体EGCG和ECG分离及纯化工艺研究[D].合肥: 合肥工业大学, 2004. DOI:10.7666/d.y596258.
[23] 张连水, 聂志矗, 赵晓辉, 等. 表儿茶素类单质红外光谱特性研究[J]. 茶叶, 2009, 35(3): 152-156. DOI:10.3969/ j.issn.0577-8921.2009.03.006.
[24] CAO Xueli, TIAN Yu, ZHANG Tianyou, et al. Separation and purification of three individual catechins from tea polyphenol mixture by CCC[J]. Journal of Liquid Chromatography and Related Technologies, 2001, 24(11): 1723-1732. DOI:10.1081/JLC-100104374.
[25] ADRIENNE L D, CAI Y, ALAN P D, et al. 1H and 13C NMR assignments of some green tea polyphenols[J]. Magnetic Resonsnce in Chemistry, 1996, 34: 887-890. DOI:10.1002/(SICI)1097-458X(199611)34:11<887::AID-OMR995>3.0.CO;2-U.
Development of EGCG Reference Material
WANG Wei
1,2, LIN Nan
1,2, ZHOU Xiaojing
1,2,3, LE Shengfeng
1,2, DU Ning
1,2,3, ZHANG Jinghua
1,3
(1. Beijing Centre for Physical and Chemical Analysis, Beijing 100089, China;2. Beijing Key Laboralory of Detection Technology & Quality Evaluation of Organic Material, Beijing 100094, China;3. Specialistic Group on Natural Product of National Technical Committee on Reference Materials, Beijing 100094, China)
Abstract:Objective: This study aimed to prepare epigallocatechin gallate (EGCG) reference material according to the Directives for the Work of Reference Materials (3): Reference Materials—General and Statistical Principles for Certifcation(GB/T 15000.3—2008). Methods: EGCG from green tea was separated by extraction and high speed counter current chromatography (HSCCC). Its chemical structure was identified by ultraviolet-visible (UV) spectroscopy, infrared (IR)spectroscopy, mass spectrometry (MS) and nuclear magnetic resonance (NMR) spectroscopy. The homogeneity and stability were systematically checked. A cooperative validation was conducted in 8 laboratories and the results of certifcation for EGCG were analyzed. Results: The homogeneity and stability of the reference material of EGCG were excellent, and the certified value was 99.29% with an expanded uncertainty of 0.16% at confidence coefficient of 95%. Conclusions: The reference material of EGCG conforms to the requirement of the Directives for the Work of Reference Materials (3) and can be used for validation of analytical methods for quality control of green tea products.
Key words:epigallocatechin gallate (EGCG); green tea; certifed reference material; homogeneity; stability; certifed value
DOI:10.7506/spkx1002-6630-201614019
中图分类号:TS272.7
文献标志码:A
文章编号:
引文格式:
王尉, 林楠, 周晓晶, 等. 表没食子儿茶素没食子酸酯(EGCG)标准样品的研制[J]. 食品科学, 2016, 37(14): 110-115.
DOI:10.7506/spkx1002-6630-201614019. http://www.spkx.net.cn
WANG Wei, LIN Nan, ZHOU Xiaojing, et al. Development of EGCG reference material[J]. Food Science, 2016, 37(14): 110-115.
(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201614019. http://www.spkx.net.cn
收稿日期:2015-11-13
基金项目:国家质检总局公益性行业科研发展专项(201210209)
作者简介:王尉(1984—),男,助理研究员,硕士研究生,研究方向为天然产物分离纯化。E-mail:wangwei_1217@126.com