刁明明,齐丹萍,张 充,别小妹,吕凤霞,陆兆新,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:研究半乳糖基甘油月桂酸单酯对食品中几种常见腐败菌的抑菌作用及其稳定性。方法:采用倍比稀释法测定半乳糖基甘油月桂酸单酯对5 种细菌和3 种真菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。同时以大肠杆菌和蜡样芽孢杆菌为指示菌,研究pH值、温度、紫外线照射及NaCl质量分数对半乳糖基甘油月桂酸单酯抑菌稳定性的影响。结果:半乳糖基甘油月桂酸单酯对大肠杆菌、蜡样芽孢杆菌等5 种细菌具有较好的抑菌活性,而对黄曲霉、黑曲霉和酿酒酵母等真菌的抑制效果不明显或无抑制效果。半乳糖基甘油月桂酸单酯对荧光假单胞菌的MIC为0.078 mg/mL,对大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌和金黄色葡萄球菌的MIC均为0.156 mg/mL。半乳糖基甘油月桂酸单酯在pH 5~8范围内具有较好的抑菌活性,经温度和紫外线照射处理后,抑菌活性有微弱下降,随着NaCl质量分数的增加,其抑菌活性显著下降。
关键词:半乳糖基甘油月桂酸单酯;抑菌活性;稳定性
刁明明, 齐丹萍, 张充, 等. 半乳糖基甘油月桂酸单酯的抑菌活性和稳定性[J]. 食品科学, 2016, 37(15): 1-6.
DIAO Mingming, QI Danping, ZHANG Chong, et al. Antimicrobial properties and stability of galactosyl monolaurin[J]. Food Science, 2016, 37(15): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615001. http://www.spkx.net.cn
在食品工业中,各类食品的防腐保鲜始终是一个亟待解决的重要问题,据不完全统计,我国每年约有20%~30%的食物因为各种腐败变质而损失 [1-2]。食品腐败的原因主要包括物理因素、化学因素、酶及微生物四方面,其中以微生物的作用最为严重 [3]。食品腐败变质不仅降低食品的营养价值,而且还可产生各种有毒有害物质,引起食用者发生急性中毒或产生慢性毒害。因此,食品防腐是防止食品的腐败、保障食品安全的重要手段。传统的防腐方法如烟熏、干制、盐腌等会影响食品的风味、质地,而现代的防腐技术如冷冻干燥、真空包装、辐射保藏等不能适用于所有食品,且成本较高,为保证食品在保质期内不发生腐败变质,食品防腐剂在现代食品工业中被广泛应用 [4-5]。随着食品工业的发展,人们对于防腐剂的要求越来越高,而传统的有机酸型食品防腐剂如山梨酸钾、苯甲酸钠等的功效受pH值的影响较大,在中性、偏碱性食品中效果不佳 [6]。因此,开发新型的抗菌性强、安全无毒、适应性广、稳定性强的食品防腐剂具有重要的意义。
甘油糖酯是糖类通过还原末端以α-或β-糖苷键与亲脂性的长链单脂酰基或二脂酰基甘油相连接起来的一类化合物 [7]。甘油糖酯广泛存在于植物界和微生物中,是细菌原生质膜、植物叶绿体类囊膜的主要组成成分,参与细胞膜的识别活动 [7-8]。甘油糖酯是一种非离子型表面活性剂,具有两亲性结构,这种特殊的两亲性使它具有抗氧化、抗菌、抗肿瘤、溶血、免疫抑制等多种生理活性 [8-13]。目前国内外对酶法合成的脂肪酸糖酯及其抗菌活性有较多的报道,刘巧瑜等 [14]研究发现月桂酸麦芽糖单酯和蔗糖月桂酸单酯对大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌等多种细菌具有较好的抑菌活性。Nobmann等 [15]报道了新合成的甲基化葡萄糖月桂酸单醋和月桂酸甘露糖单酯对L. monocytogenes具有较好的抑菌活性,而且甲基化的辛酸葡萄糖单酯对Escherichia coli和Pseudomouas fluorescens有一定的抑制作用。但关于甘油糖酯抑菌活性的研究却鲜有报道,有研究者从菊科植物Serratula strangulata的根茎中分离得到3 种甘油糖酯,其对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌3 种细菌具有明显的抑制作用 [16]。Deml等 [17]从苔草裂孢黑粉菌(Schizonella melanogramma)中分离到两种甘油糖酯Schizonelin A和B对革兰氏阳性菌和某些革兰氏阴性菌也有一定的抑制作用。为进一步研究甘油糖酯的抑菌活性,本实验采用酶法合成半乳糖基甘油月桂酸单酯(简称C12单酯),考察C12单酯对几种细菌、霉菌和酵母菌的抑菌活性大小及其对温度、pH值、紫外线、NaCl的抑菌稳定性,为开发一种高效、安全、适应性广的新型甘油糖酯类食品防腐保鲜剂奠定理论基础,同时丰富天然食品防腐剂的品种。
1.1 菌株与培养基
大肠杆菌(Escherichia coli)ATCC 25922、荧光假单胞菌(Pseudomouas fluorescens)ATCC 49642、枯草芽孢杆菌(Bacillus subtilis)ATCC 6633、蜡样芽孢杆菌(Bacillus cereus)ATCC 14579、金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、黑曲霉(Aspergillus niger)AS 3.350、黄曲霉(Aspergillus flavus)CICC 2062、酿酒酵母(Saccharomyces cerevisiae)CICC 32788,均由南京农业大学食品科技学院酶工程实验室保藏。
营养琼脂(NA)培养基用于细菌的培养,马铃薯葡萄糖(PDA)培养基用于真菌的培养 [18]。
1.2 材料制备
半乳糖基甘油、C12单酯(纯度>97%)由南京农业大学食品科技学院酶工程实验室自制。C12单酯为乳白色固体,性质稳定,在-20 ℃能贮存较长时间,不易溶于水,易溶于甲醇、乙醇、丙酮、三氯甲烷等有机溶剂中。
半乳糖基甘油的制备:以β-半乳糖苷酶为催化剂,以半乳糖为糖基供体,甘油为糖基受体,选择性合成半乳糖基甘油。随后对半乳糖基甘油进行分离纯化,得到的纯品进行高效液相色谱(high performance liquid chromatography,HPLC)、质谱(mass spectrometry,MS)、核磁共振(nuclear magnetic resonance,NMR)鉴定,确定其化学结构,以作为后期合成半乳糖基甘油酯的中间物 [7]。
C12单酯的制备:以固定化脂肪酶Novozyme435为催化剂,以半乳糖基甘油为糖基供体,以月桂酸为酰基供体,合成C12单酯,通过薄层色谱法(thin-layer chromatography,TLC)、硅胶柱层析、HPLC-蒸发光散射检测(evaporation light-scattering detection,ELSD)、MS等方法对C12单酯进行分离纯化和鉴定 [19]。
1.3 仪器与设备
SX-700高压蒸汽灭菌器 日本TOMY公司;HYL-A全温摇瓶柜 太仓市强乐实验设备厂;Orion 3 STAR pH计 美国Thermo公司;UV-2450紫外分光光度计日本岛津公司;迷你涡旋混匀器 美国精骐有限公司;AY120电子精密天平 日本Shimadzu公司;SW-CJ-IBU超净工作台 苏州净化设备有限公司。
1.4 方法
1.4.1 菌悬液的制备
1.4.1.1 细菌、酵母菌菌悬液
采用平板菌落计数法和分光光度法结合的方法,使用前将初始菌液稀释成浓度为10 6~10 7CFU/mL的菌悬液。
1.4.1.2 孢子菌悬液
用无菌生理盐水将霉菌产生的孢子从斜面洗下,转移至离心管中,涡旋振荡10 min,用已灭菌的脱脂棉过滤,用血球计数板计数,使用前将初始菌液稀释成浓度为10 6~10 7CFU/mL的菌悬液。
1.4.2 抑菌活性的测定
以荧光假单胞菌、大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌、黄曲霉、黑曲霉和酿酒酵母为指示菌,采用打孔法测定半乳糖基甘油和C12单酯的抑菌情况。将配好的菌悬液加入融化的NA培养基(霉菌和酵母菌为PDA培养基)中混匀,使培养基中菌浓度为10 6~10 7CFU/mL,室温冷却凝固后得到指示菌平板。用灭菌的5 mm打孔器打孔后用牙签将琼脂块挑出,向孔内加入50 μL制备好的样品溶液,以甲醇溶液为对照,细菌37 ℃培养24 h,霉菌和酵母菌28 ℃培养48 h后观察测量和记录抑菌圈的直径。每组进行3 次平行实验,并取其平均值。
1.4.3 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
使用倍比稀释法将C12单酯母液配制成质量浓度10、5、2.5、1.25、0.625、0.313、0.156、0.078、0.039 mg/mL的样品溶液,各取100 μL加入到含有100 μL菌浓度为10 6CFU/mL的NA培养基中,得到的样品质量浓度均减半。将处理后的96 孔板放在37 ℃培养箱内孵育24 h后,用酶标仪在600 nm波长处测定吸光度。以上述样品中对应的不同剂量的甲醇溶液作为对照(排除样品中甲醇对细菌的抑制作用)。选取抑菌活性最佳的质量浓度,观察记录MIC值,实验平行3 次。
1.4.4 抑菌时效的测定
以大肠杆菌和蜡样芽孢杆菌为指示菌,采用光电比浊法测定C12单酯的抑菌时效。将处于对数生长期的种子液接种至含有1×MIC C12单酯的NA液体培养基中,37 ℃、180 r/min进行培养,以不含C12单酯的甲醇溶液为对照组,每隔2 h测定600 nm波长处的吸光度。采用下式计算t时刻的抑菌率。
式中:A 0,ck、A t,ck分别为对照组在0、t时刻的吸光度;A 0,i、A t,i分别为实验组在0、t时刻的吸光度。
1.4.5 pH值对抑菌稳定性的影响
用氢氧化钠或盐酸调节固体培养基的pH值,配制成pH值分别为5、6、7、8、9的营养琼脂固体培养基,用平板菌落计数法,制成含1×MIC C12单酯的不同pH值环境的微生物培养平板,凝固后置于恒温培养箱中培养,以相同pH值的不含C12单酯的微生物平板为对照,37 ℃恒温培养24 h后观察平板中菌落的生长情况并计数,分别测定抑菌率。
式中:N 1为对照组的菌落数;N 2为实验组的菌落数。
1.4.6 温度对抑菌稳定性的影响
将C12单酯分装在5 个无菌样品瓶中,经40、60、80、100 ℃处理20 min,冷却后待用。采用平板菌落计数法,制成含1×MIC C12单酯的微生物培养平板,以甲醇溶液做对照实验。37 ℃恒温培养24 h后,观察平板中菌落的生长情况并计数,按公式(2)分别测定抑菌率。
1.4.7 紫外线照射对抑菌稳定性的影响
将不同质量浓度的样液置于40 W的紫外灯下,距离25 cm,照射5、10、15、20、25、30 min,以未经处理的相同质量浓度的C12单酯作对照,以大肠杆菌和蜡样芽孢杆菌作指示菌,测定抑菌率,比较紫外线照射前后的抑菌活性。
1.4.8 NaCl质量分数对抑菌稳定性的影响
以大肠杆菌和蜡样芽孢杆菌为供试菌株,分别向培养基中添加0%、1%、2%、4%、8%的NaCl,配制成含不同质量分数NaCl的微生物培养平板,在每一组相同的NaCl质量分数条件下,设置空白对照组,以等体积甲醇代替C12单酯溶液作为空白对照组,37 ℃恒温培养24 h后,观察平板中菌落的生长情况并计数,测定抑菌率。
1.5 数据统计分析
实验数据用
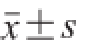 (n=3)表示,采用SAS 8.0统计软件处理数据,应用t-test检验组间差异显著性,P>0.05表示组间无显著差异,P<0.05表示组间差异显著。
(n=3)表示,采用SAS 8.0统计软件处理数据,应用t-test检验组间差异显著性,P>0.05表示组间无显著差异,P<0.05表示组间差异显著。
2.1 半乳糖基甘油与C12单酯的抑菌活性
国内外有很多的对酶法合成脂肪酸糖酯及其抑菌活性的报道,根据报道,糖酯对微生物具有较广泛的抑制作用 [20-23]。C12单酯对食品中几种腐败菌的抑制效果见表1。底物半乳糖基甘油没有抑菌活性,C12单酯对革兰氏阳性菌和阴性菌均具有抑菌活性,并且抑菌效果较好,而在黄曲霉、黑曲霉和酿酒酵母等真菌培养基上无明显抑菌圈出现,表明对其抑制效果不明显或无抑制性。这也与刘巧瑜等 [14]报道的质量分数0.09%的麦芽糖月桂酸单酯和蔗糖月桂酸单酯均可有效地抑制蜡状芽孢杆菌、枯草芽孢杆菌、大肠杆菌和金黄色葡萄球菌等多种细菌的生长,而麦芽糖单酯、蔗糖单酯和P1570对黑曲霉、青霉和酿酒酵母和葡萄酒酵母菌均无明显抑制效果的实验结果一致。
表1 C12单酯的抑菌谱
Table 1 Antimicrobial spectrum of galactosyl monolaurin

注:-. 无抑菌性(抑菌圈直径6 mm);+++. 中度敏感(抑菌圈直径11~15 mm)。
葡萄球菌黄曲霉黑曲霉酿酒酵母半乳糖基甘油--------C12单酯+++++++++++++++---样品荧光假单胞菌大肠杆菌枯草芽孢杆菌蜡样芽孢杆菌金黄色
2.2 C12单酯的MIC
分别以荧光假单胞菌、大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌和金黄色葡萄球菌为指示菌,二倍稀释法测定C12单酯的MIC,由表2可知,C12单酯能够有效抑制几种供试菌的生长,且其抑菌能力随着质量浓度的增加而增强。C12单酯对荧光假单胞菌的MIC为0.078 mg/mL,对大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌和金黄色葡萄球菌的MIC均为0.156 mg/mL。张希 [6]研究发现中链脂肪酸糖单酯对金黄色葡萄球菌具有较强的抑菌作用,对E. coli O157:H7和白色念珠菌的抑菌活性较弱,其中甲基葡萄糖苷月桂酸单酯、蔗糖月桂酸单酯和麦芽糖月桂酸单酯对金黄色葡萄球菌的MIC
表2 C12单酯对不同细菌的最小抑菌浓度
Table 2 MICs of galactosyl monolaurin against indicator bacteria

注:+. 有菌生长;-. 无菌生长。
供试菌C12单酯质量浓度/(mg/mL)对照组1052.51.25 0.625 0.313 0.156 0.078 0.039 0.019荧光假单胞菌--------+++大肠杆菌-------++++枯草芽孢杆菌-------++++蜡样芽孢杆菌-------++++金黄色葡萄球菌-------++++
值分别为0.188、0.25、0.25 mg/mL,甲基葡萄糖月桂酸单酯对E. coli O157:H7的MIC为0.188 mg/mL。本研究结果与之不符,说明C12单酯的抑菌活性与糖基有关,糖基不同,抑菌活性也不同。李更更 [24]在对不同亲水基团的脂肪酸酯的抑制效果的研究中也发现麦芽糖月桂酸单酯和蔗糖月桂酸单酯对大肠杆菌、沙门氏菌、枯草芽孢杆菌、酵母菌和霉菌都有一定的抑制作用,而N-乙酰氨基葡萄糖月桂酸单酯对大肠杆菌、沙门氏菌、金黄色葡萄糖球菌和白色葡萄糖球菌有一定的抑制作用,而对酵母菌和霉菌则无抑制作用,说明不同糖基的脂肪酸酯的抑菌效果存在明显差异。
2.3 C12单酯的抑菌时效
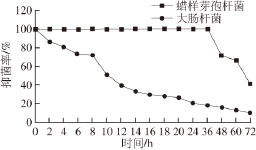
图1 C12单酯对大肠杆菌和蜡样芽孢杆菌的抑菌时效
Fig. 1 Antibacterial activity-time curves of galactosyl monolaurin against Escherichia coli and Bacillus cereus
采用比浊法测定C12单酯对大肠杆菌和蜡样芽孢杆菌的抑菌活性,结果如图1所示。随着培养时间的延长,C12单酯对大肠杆菌的抑菌率呈现急剧下降的趋势,72 h左右时,其对大肠杆菌几乎没有抑菌作用。而C12单酯对蜡样芽孢杆菌的抑菌率在前36 h基本不变,维持在90%以上,36 h以后抑菌率急剧下降。随着时间的延长,C12单酯对大肠杆菌和蜡样芽孢杆菌的抑菌率呈下降的趋势,这可能是因为大肠杆菌和蜡样芽孢杆菌酶系降解了C12单酯,解除其对细胞的生理代谢的干扰的结果。本实验与罗春燕 [25]研究单中碳链脂肪酸甘油酯对大肠杆菌和蜡样芽孢杆菌的抑制效果一致。
2.4 pH值对C12单酯抑菌活性的影响
表3 pH值对C12单酯抑菌活性的影响
Table 3 Effect of pH on antibacterial activity of galactosyl monolaurin

注:同行字母不同表示差异显著(P<0.05)。下同。
供试菌抑菌率/% pH 5pH 6pH 7pH 8pH 9蜡样芽孢杆菌96.80±1.28 a97.30±1.15 a97.90±1.77 a96.10±0.88 a93.65±2.33 b大肠杆菌95.48±0.36 A96.33±0.77 A97.14±2.06 A95.64±0.89 A93.62±0.89 B
以大肠杆菌和蜡样芽孢杆菌为供试菌,测定不同pH值条件下C12单酯的抑菌活性,评价其酸碱稳定性。由表3可知,在不同pH值条件下,C12单酯对大肠杆菌和蜡样芽孢杆菌仍保持较强的抑菌活性。在pH 5~8的范围内,C12单酯对大肠杆菌和蜡样芽孢杆菌的抑菌活性无显著变化;在pH 9时,C12单酯对两种菌的抑菌活性显著下降,但其抑菌率仍在93%以上,说明C12单酯具有良好的酸碱稳定性。本实验与刘燕 [26]和赵存洋 [27]的研究结果一致。
刘燕 [26]对单中碳链脂肪酸甘油酯抑菌活性的研究发现其对细菌、霉菌和酵母菌的MIC没有变化,表明在中性至微碱的环境下,单中碳链脂肪酸甘油酯的抑菌性能不受pH值的影响。赵存洋 [27]的研究表明pH值从3升高到9,单月桂酸甘油酯对大肠杆菌、枯草芽孢杆菌等6 种食品腐败菌的MIC均未发生变化,表明单月桂酸甘油酯在酸性至碱性环境中具有良好的抑菌活性。
2.5 温度对C12单酯抑菌活性的影响
表4 温度对C12单酯抑菌活性的影响
Table 4 Effect of temperature on antibacterial activity of galactosyl monolaurinaurin
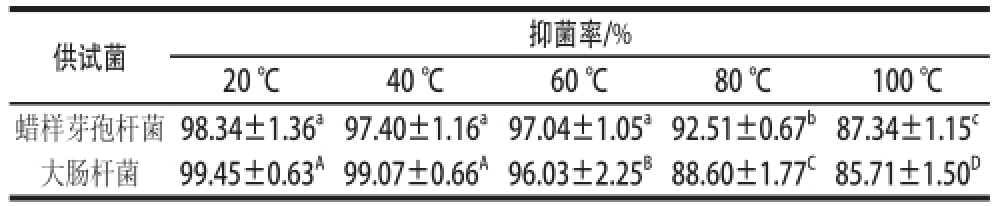
供试菌抑菌率/% 20 ℃40 ℃60 ℃80 ℃100 ℃蜡样芽孢杆菌98.34±1.36 a97.40±1.16 a97.04±1.05 a92.51±0.67 b87.34±1.15 c大肠杆菌99.45±0.63 A99.07±0.66 A96.03±2.25 B88.60±1.77 C85.71±1.50 D
以大肠杆菌和蜡样芽孢杆菌为供试菌,测定不同温度条件下C12单酯的抑菌活性,评价其热稳定性。由表4可知,温度对C12单酯的抑菌活性有较大影响。当温度低于60 ℃时,随着温度的升高,C12单酯对蜡样芽孢杆菌的抑菌活性的变化不大;当温度高于60 ℃时,其对蜡样芽孢杆菌的抑菌活性随温度的升高而显著下降。当温度低于40 ℃时,随着温度的升高,C12单酯对大肠杆菌的抑菌活性无显著变化;当温度高于40 ℃时,其对大肠杆菌的抑菌活性随温度的升高而显著下降。然而C12单酯经100 ℃处理20 min后,其对两种供试菌的抑菌率仍在85%以上,说明C12单酯具有较好的热稳定性。
2.6 紫外线照射时间对C12单酯抑菌活性的影响以大肠杆菌和蜡样芽孢杆菌为供试菌,测定紫外线照射不同时间后C12单酯的抑菌活性,由表5可知,经紫外线照射不同时间后,C12单酯对两种供试菌的抑菌活性基本保持不变,即紫外线照射对C12单酯的抑菌活性无显著影响,由此可见半乳糖基甘油月桂酸单对紫外光具有极高的稳定性。
表5 紫外线照射时间对C12单酯抑菌活性的影响
Table 5 Effect of UV irradiation on antibacterial activity of galactosyl monolaurinaurin

供试菌抑菌率/% 0 min5 min10 min15 min20 min25 min30 min蜡样芽孢杆菌96.67±2.72 a97.78±1.57 a94.44±1.67 a96.67±2.72 a97.78±1.57 a96.67±1.67 a95.56±1.05 a大肠杆菌97.90±1.49 A97.63±1.34 A96.84±2.58 A94.74±2.98 A96.84±2.58 A95.78±1.49 A96.73±1.31 A
2.7 NaCl质量分数对C12单酯抑菌活性的影响
表6 NaCl质量分数对C12单酯抑菌活性的影响
Table 6 Effect of NaCl concentration on antibacterial activity of galactosyl monolaurin

供试菌对照组抑菌率/% NaCl质量分数1%NaCl质量分数2%NaCl质量分数4%NaCl质量分数8%蜡样芽孢杆菌96.61±1.79 a86.07±1.86 b78.30±1.44 c73.33±1.18 d63.89±1.97 e大肠杆菌94.20±1.35 A88.64±0.93 B81.60±1.15 C72.34±1.64 D63.63±2.47 E
以大肠杆菌和蜡样芽孢杆菌为供试菌,测定不同NaCl质量分数下C12单酯的抑菌活性。由表6可知,NaCl质量分数对C12单酯的抑菌活性有较大影响。NaCl质量分数在1%~8%范围内,随着盐离子强度的增加,C12单酯对两种供试菌的抑菌活性呈现出显著下降的趋势。一般情况下认为抑菌物质与细菌相互作用的过程中,抑菌物质通过静电引力的方式吸附到细胞膜上后与之结合,实验中盐离子浓度的增加可能影响到C12单酯与细菌细胞膜的结合,从而影响了C12单酯抑菌活性的发挥 [28]。
C12单酯对大肠杆菌、荧光假单胞菌、枯草芽孢杆菌、蜡样芽孢杆菌、金黄色葡萄球菌均具有较好的抑菌活性,而对黄曲霉、黑曲霉和酿酒酵母等真菌的抑制效果不明显或无抑制性。对C12单酯的抑菌稳定性研究结果显示:C12单酯对pH值、温度和紫外线照射有较强的稳定性,但对NaCl不稳定。这可能是因为C12单酯是一种非离子表面活性剂,生物表面活性剂的主要特性就是耐酸、热及离子强度、低毒性和生物可降解性等 [29-30]。已有研究表明甘油单脂肪酸酯类对细菌、酵母菌和霉菌的生长都有较好的抑制作用,且其抑菌活性不受环境pH值的影响,被美国食品药品监督管理局批准为一般公认安全类食品添加剂 [31],这都说明C12单酯有成为一种高效、安全、适用性广的新型甘油糖酯类食品防腐保鲜剂的潜力。关于糖酯抑菌机理的研究,目前国内外的相关报道较少 [32]。一般认为防腐剂是通过影响细胞亚结构的正常生理功能来实现其抑菌作用的 [27]。C12单酯是一种非离子型表面活性剂,具有疏水特性,可能会以细胞膜为作用靶点,破坏细胞膜结构的完整性,从而改变细胞膜的通透性,抑制细菌的生长。后续将继续研究C12单酯对大肠杆菌和蜡样芽孢杆菌的抑菌机理,为C12单酯的进一步应用提供理论依据。
参考文献:
[1] 王丽, 张毓, 陈翠岚. 我国食品防腐剂的应用及发展趋势[J]. 食品安全质量检测学报, 2011, 2(2): 83-87.
[2] 罗傲霜, 淳泽, 罗傲雪, 等. 食品防腐剂的概况与发展[J]. 中国食品添加剂, 2005(4): 78-83. DOI:10.3969/j.issn.1006-2513.2005.04.015.
[3] 林科. 食品防腐剂的种类及其研究进展[J]. 广西轻工业, 2009,25(10): 9-11. DOI:10.3969/j.issn.1003-2673.2009.10.006.
[4] 肖燕清, 白卫东, 钱敏. 我国食品防腐剂的发展现状及对策[J]. 中国调味品, 2010, 35(11): 43-62. DOI:10.3969/ j.issn.1000-9973.2010.11.005.
[5] 王杉, 揭琴丰, 邱伟华. 食品防腐剂的应用现状、问题及对策[J]. 中国食品添加剂, 2011(6): 163-166. DOI:10.3969/ j.issn.1006-2513.2011.06.022.
[6] 张希. 中链脂肪酸糖单酯的酶法合成以及理化性质和抑菌活性研究[D]. 杭州: 浙江大学, 2014: 73-83.
[7] 魏微. 半乳糖基甘油脂酶法合成及其抗肿瘤活性研究[D]. 南京: 南京农业大学, 2014: 4-12.
[8] 李春霞, 李英霞, 管华诗. 甘油糖酯生物活性研究进展[J]. 中国海洋药物, 2002, 22(2): 47-52. DOI:10.3969/j.issn.1002-3461.2003.02.013.
[9] 蒋志国, 杜琪珍. 甘油糖酯生物活性最新研究进展[J]. 中国粮油学报, 2009, 24(9): 163-167.
[10] MATSUFUJI M, NAGAMATSU Y, YOSHIMOTO A. Protective effects of bacterial glyceroglycolipid M874B against cell death caused by exposure to heat and hydrogen peroxide[J]. Journal of Bioscience and Bioengineering, 2000, 89(4): 345-349. DOI:10.1016/S1389-1723(00)88957-4.
[11] KUNIHO N. High resistance to oxygen radicals and heat is caused by a galacticglycerolipid in Microbacterium sp. M874[J]. Journal of Biochemistry, 2000, 127(5): 731-737. DOI:10.1093/oxfordjournals. jbchem.a022664.
[12] COLOMBO D, COMPOSTELLA F, RONCHETTI F, et al. Antitumor-promoting effects of glycerolipid analogues on two-stage mouse skin carcinogens[J]. Cancer Letters, 2000, 161(2): 201-205. DOI:10.1016/S0304-3835(00)00610-8.
[13] 杨文, 候海彤, 冯福应, 等. 硫代异鼠李糖甘油二酯(SQDG)的生物合成与功能[J]. 植物学通报, 2003, 20(1): 103-114. DOI:10.3969/ j.issn.1674-3466.2003.01.015.
[14] 刘巧瑜, 张晓鸣. 麦芽糖单酯和蔗糖单酯的抑菌性研究[J]. 食品工业科技, 2010, 31(7): 313-315.
[15] NOBMANN P, SMITH A, DUNNE J, et al. The antimicrobial efficacy and structure activity relationship of novel carbohydrate fatty acid derivatives against Listeria spp. and food spoilage microorganisms[J]. International Journal of Food Microbiology, 2009, 128(3): 440-445. DOI:10.1016/j.ijfoodmicro.2008.10.008.
[16] DAI J Q, ZHU Q X, ZHAO C Y, et al. Three new glyceroglycolipids from Serratula strangulata[J]. Phytochemistry, 2001, 58(8): 135-139.
[17] DEML G, ANKE T, OBERWINKLER F, et al. Schizonellin A and B,new glycolipids from Schizonella melanogramma[J]. Phytochemistry,1980, 19(1): 83-87. DOI:10.1016/0031-9422(80)85018-7.
[18] 李平兰, 贺稚非. 食品微生物学实验原理与技术[M]. 北京: 中国农业出版社, 2005: 263-265.
[19] 齐丹萍, 刁明明, 陆兆新, 等. 响应面试验优化单半乳糖基甘油棕榈酸酯的酶法合成工艺[J]. 食品科学, 2015, 36(18): 1-6. DOI:10.7506/ spkx1002-6630-201518001.
[20] RIHAKOVA Z, PLOCKOVA M, FILIP V, et al. Antifungal activity of lauric acid derivatives against Aspergillus niger[J]. European Food Research and Technology, 2001, 213(6): 488-490. DOI:10.1007/ s002170100416.
[21] HABULIN M, SABEDER S, KNEZ Z. Enzymatic synthesis of sugar fatty acid esters in organic solvent and in supercritical carbon dioxide and their antimicrobial activity[J]. Journal of Supercritical Fluids,2008, 45(3): 338-345. DOI:10.1016/j.supflu.2008.01.002.
[22] THOMAS L V, DAVIES E A, DELVES-BROUGHTON J, et al. Synergist effect of sucrose fatty acid esters on nisin inhibition of Gram-positive bacteria[J]. Journal of Applied Microbiology, 1998,85(6): 1013-1022. DOI:10.1111/j.1365-2672.1998.tb05266.x.
[23] TSUCHIDO T, YOKOSUKA N, TAKANO M. Isolation and characteristics of a Bacillus subtilis mutant tolerant to the lytic action of sucrose esters of long-chain fatty acids[J]. Journal of Fermentation and Bioengineering, 1993, 75(3): 191-195. DOI:10.1016/0922-338X(93)90114-N.
[24] 李更更. 非水相酶催化合成脂肪酸酯及其抗菌性的研究[D]. 无锡:江南大学, 2008: 28-41. DOI:10.7666/d.y1398705.
[25] 罗春燕. 中碳链脂肪酸类食品添加剂的制备及性能研究[D]. 南昌:南昌大学, 2011: 40-47. DOI:10.7666/d.y1943143.
[26] 刘燕. 单中碳链脂肪酸甘油酯的制备及乳化和抑菌性能研究[D]. 南昌: 南昌大学, 2011: 66-68. DOI:10.7666/d.y1942871.
[27] 赵存洋. 单月桂酸甘油酯的抑菌性能及机理研究[D]. 南昌: 南昌大学, 2013: 19-31. DOI:10.7666/d.Y2402753.
[28] 李俊霖. 10-HDA对G +抑菌活性及机制的研究[D]. 济南: 齐鲁工业大学, 2014: 35-36.
[29] 侯占群, 高彦祥. 生物表面活性剂及其在食品工业中的应用进展[J].食品研究与开发, 2010, 31(4): 170-174.
[30] MOHAN P K, NAKHLA G, YANFUL E K. Biokinetics of biodegradability of surfactants under aerobic, anoxic and anaerobic conditions[J]. Water Research, 2006, 40(3): 533-540. DOI:10.1016/ j.watres.2005.11.030.
[31] HANNUKSELA M, HAAHTELA T. Hypersensitivity reactions to food additives[J]. Allergy, 1987, 42(8): 561-575. DOI:10.1111/j.1398-9995.1987.tb00386.x.
[32] 胡静, 赵小慧, 朱春玉, 等. 槐糖脂对金黄色葡萄球菌的抑菌机理[J].食品科学, 2012, 33(5): 33-36.
Antimicrobial Properties and Stability of Galactosyl Monolaurin
DIAO Mingming, QI Danping, ZHANG Chong, BIE Xiaomei, L☒ Fengxia, LU Zhaoxin, ZHAO Haizhen
*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Antimicrobial properties and stability of galactosyl monolaurin were investigated in this study. The minimum inhibitory concentration (MIC) of galactosyl monolaurin against five bacteria and three fungi from foods were determined by doubling dilution method. Escherichia coli and Bacillus cereus were used as indicator bacteria to investigate the effects of temperature, pH, UV irradiation and salt concentration on the stability of galactosyl monolaurin. Results showed that galactosyl monolaurin could inhibit five tested bacteria and had little or no effect on the growth of three tested fungi. The MIC of galactosyl monolaurin against Pseudomouas fluorescens was 0.078 mg/mL, and the same MIC value of 0.156 mg/mL was observed against Escherichia coli, Bacillus subtilis, Bacillus cereus and Staphylococcus aureus. In the pH range of 5 to 8, the antibacterial activity of galactosyl monolaurin was stable. Temperature and UV irradiation showed little effect on the antimicrobial activity of galactosyl monolaurin. With increasing NaCl concentration, this antimicrobial activity decreased significantly.
Key words:galactosyl monolaurin; antimicrobial activity; stability
DOI:10.7506/spkx1002-6630-201615001
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2016)15-0001-06
DOI:10.7506/spkx1002-6630-201615001. http://www.spkx.net.cn
收稿日期:2015-11-11
基金项目:国家自然科学基金青年科学基金项目(31301558);中央高校基本科研业务费专项资金项目(KJQN201427)
作者简介:刁明明(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:2013108058@njau.edu.cn
*通信作者:赵海珍(1975—),女,副教授,博士,研究方向为食品生物技术。E-mail:zhaohz@njau.edu.cn
引文格式: