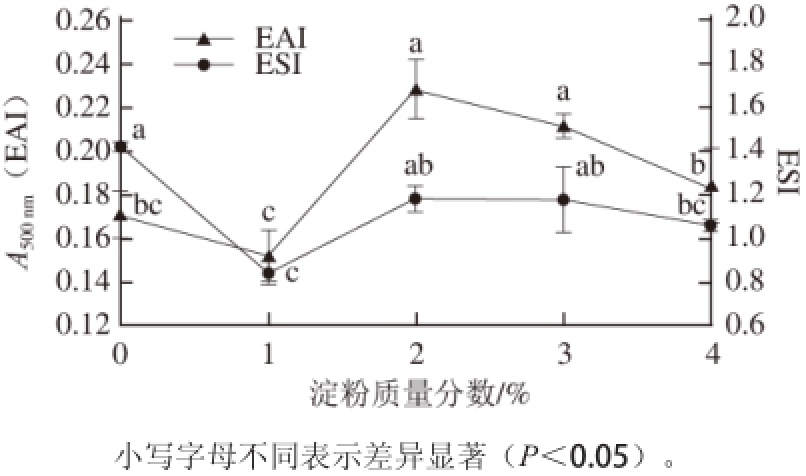
图1 不同质量分数淀粉对鸡胸肉蛋白乳化特性的影响
Fig. 1 Effect of starch content on emulsifying properties of chicken breast salt-soluble proteins
周 纷 1,谷大海 2,徐家慧 1,张骏龙 1,邓亚敏 1,李儒仁 1,刘登勇 1,邵俊花 1,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.云南农业大学食品科技学院,云南省畜产品加工工程技术研究中心,云南 昆明 650201)
摘 要:添加不同质量分数淀粉处理鸡胸肉盐溶性蛋白,研究淀粉含量对鸡胸肉蛋白质乳化特性的影响。结果表明:随着淀粉质量分数的增加,处理组淀粉蛋白乳化液的乳化活性和乳化稳定性均先上升后下降,乳化液中D10、D50和D90的粒径值逐渐降低,剪应力和黏度均为先下降后上升。此外,随着剪切速率的升高,不同处理组剪应力逐渐增加,而黏度均先下降随后趋于稳定。相关性分析结果表明:乳化液中淀粉质量分数与微粒D10的粒径(相关系数r=-0.598)成极显著负相关(P<0.01),乳化活性与微粒D50的粒径(相关系数r=0.549)、微粒D90的粒径(相关系数r=0.558)均成显著正相关(P<0.05)。这些结果说明适宜含量的淀粉添加至鸡胸肉盐溶性蛋白中,使得乳化液体系更稳定,形成的淀粉-蛋白质复合物会影响鸡胸肉蛋白质的加工特性。
关键词:淀粉;鸡胸肉;盐溶性蛋白;乳化;粒度分布;黏度
周纷, 谷大海, 徐家慧, 等. 淀粉对鸡胸肉盐溶性蛋白乳化特性的影响[J]. 食品科学, 2016, 37(15): 7-12. DOI:10.7506/ spkx1002-6630-201615002. http://www.spkx.net.cn
ZHOU Fen, GU Dahai, XU Jiahui, et al. Effect of starch content on emulsifying properties of chicken breast salt-soluble proteins[J]. Food Science, 2016, 37(15): 7-12. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615002. http://ww w.spkx.net.cn
蛋白质和多糖均是具有生物功能的大分子化合物,是食品的重要组成成分。其中,淀粉是自然界广泛分布的一种多糖,是人类食物中的三大营养物质之一,是摄取碳水化合物的主要来源。在肉糜制品加工中,淀粉由于具有一定的吸油性和保水性,常常作为填充剂、增稠剂、黏合剂、稳定剂等来改善制品的乳化性、保水性、组织状态和肉馅之间的黏合增稠性,从而使肉糜制品具有良好的口感 [1-2]。目前在肉制品中常用的淀粉种类包括玉米淀粉、木薯淀粉、马铃薯淀粉及其变性淀粉 [3]。
鸡肉是非常受消费者欢迎的一种肉制品,鸡胸肉的脂肪含量较低而且具有较高的营养价值,是良好的动物蛋白质来源 [4]。盐溶性蛋白也被称为肌原纤维蛋白,是一类具有重要生物学功能特性的结构蛋白质复合体,约占蛋白总量的50%~55% [5]。蛋白质的功能性质有乳化性、发泡性、胶凝性和溶解性,这些属性取决于内在(如分子的结构、组成)和外在(如温度、pH值) [6]因素。鸡胸肉盐溶性蛋白对保持肉制品良好质构和持水性具有重要作用,而且影响肉糜制品的乳化特性和流变特性,这些特性是生产和开发新的肉制品的关键 [7]。同时,蛋白质与多糖的结合可以显著改善蛋白质的物理和化学性质,如热稳定性、乳化性、凝胶性和抗氧化特性 [6]。
激光粒度分布仪是利用激光散射原理设计的一种测量微小颗粒的高端精密仪器,淀粉蛋白乳化液的乳化效果可以通过测定乳液微观结构(液滴大小)来反映 [8]。目前,关于多糖对蛋白质功能特性的影响研究很多,大多集中在蛋白质的热稳定性和乳状液的稳定性 [9],如Liu Haimei等 [10]研究发现马铃薯淀粉要比玉米淀粉更能改善鱼糜凝胶的硬度、咀嚼度、白度以及凝胶强度。Genccelep等 [11]研究发现预糊化的变性淀粉可以改善肉糜乳化体系的流变特性和乳化特性。淀粉含量如何影响鸡肉盐溶性蛋白乳化液的特性,又如何影响乳化液微粒的大小和粒度分布却未见报道。而淀粉与盐溶性蛋白交互作用对肉制品生产过程中肌肉 蛋白质的保水性和凝胶基质的形成至关重要。因此,本研究以鸡胸肉为原料,添加不同质量分数的淀粉(0%、1%、2%、3%、4%)制成淀粉蛋白乳化溶液,应用流变学和激光粒度分布仪研究淀粉和鸡胸肉盐溶性蛋白交互作用对蛋白乳化液的乳化活性(emulsifying activity index,EAI)、乳化稳定性(emulsifying stability index,ESI)和静态黏度的影响,同时建立乳化液微粒大小和粒度分布特点与复合蛋白乳化液稳定性之间的关系,进而揭示淀粉与盐溶性蛋白交互作用在肉制品生产过程中对肌肉蛋白质凝胶保水性的影响。
1.1 材料与试剂
新鲜鸡胸肉(胸大肌),购于昆明市大润发超市。
大豆油、玉米淀粉 昆明市大润发超市;氯化钠(分析纯,下同)、氢氧化钠、硫酸铜、酒石酸钾钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 天津市风船化学试剂科技有限公司。
1.2 仪器与设备
高速组织捣碎机 上海精科实业有限公司;磁力搅拌器 江苏国华仪器厂;UV2250紫外-可见分光光度计日本岛津公司;FE20 pH计 美国Mettler Toledo公司;T25 digital Ultra-turrak均质机 德国IKA公司;BT-9300ST激光粒度分布仪 丹东市百特仪器有限公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;Discovery DHR-1流变仪 美国TA公司。
1.3 方法
1.3.1 鸡胸肉盐溶性蛋白提取及含量测定
鸡肉盐溶性蛋白的提取根据Zorba [12]和亢春雨 [13]等的方法进行。具体步骤如下:将分割的鸡胸肉剔除脂肪和结缔组织,切成肉丁,每份称取50 g进行真空包装,置于-18 ℃条件下贮藏备用。将0.4 mol/L的NaCl溶液100 mL与25 g碎肉放入组织捣碎机,冰浴条件下18 000 r/min混合1 min,然后以8 000 r/min均质处理1 min。最后,用两层纱布过滤去掉结缔组织,滤液用0.4 mol/L的NaCl溶液和0.1 mol/L的NaOH溶液调节蛋白质质量浓度为30 mg/mL,pH 6.6。提取的可溶性蛋白质质量浓度测定采用双缩脲法 [14]。
1.3.2 淀粉蛋白乳化液的制备
研究不同淀粉质量分数蛋白乳化液的乳化特性。20 mL蛋白溶液(30 mg/mL)+6 mL豆油+4 mL不同质量分数(0%、1%、2%、3%、4%)的淀粉溶液在50 mL塑料离心管中进行均质,起始温度控制为0~4 ℃、9 500 r/min条件下均质1 min。4 ℃条件下保存备用,并在30 min之内全部用完。
1.3.3 EAI和ESI的测定
EAI和ESI的测定根据赵谋明等 [15]的方法,并进行适当调整。取20 mL 30 mg/mL的蛋白溶液、6 mL大豆油和4 mL淀粉溶液混合后0~4 ℃、9 500 r/min条件下均质1 min。然后分别于0 min和静置10 min后从底部吸取20 μL乳化液加入试管中,再加入0.1% SDS溶液5 mL进行稀释,振荡摇匀。利用分光光度计在500 nm波长处测定其吸光度。0 min测得的吸光度A 500 nm表示EAI,静置10 min后测定的吸光度与0 min测得的吸光度之比表示ESI。每个处理组平行测定3 次,实验重复3 次。
1.3.4 静态黏度的测定
不同质量分数的淀粉蛋白乳化液的黏度测定,参照张文会 [16]的方法,并进行适当调整。对均质处理过的不同质量分数的淀粉蛋白乳化液,利用流变仪测定其黏度-剪切速率曲线。测试条件为:恒温15 ℃,坠板直径40 mm,测定模式Flow Sweep,剪切速率选定10 个,分别是2、4、8、16、32、64、128、256、512、1 024 s -1,每个处理组平行测定3 次,实验重复3 次。
1.3.5 乳化液微粒大小和粒度分布的测定
采用激光粒度分布仪测定均质后的淀粉蛋白乳化液中微粒大小和粒度分布,得到乳化液微粒粒度分布图谱。如果体系粒径分布呈高斯分布状态,即平均值、中值和最频值恰好处在同一位置,则表示体系原处于比较稳定的状态。反之,则体系存在不稳定性因素 [17]。
测定具体参数设置如下:物质折射率为1.520,遮光率为16.63%,介质为水,介质遮光率为1.333,分析软件为配套软件。数据结果以D3、D6、D10、D16、D25、D50、D75、D84、D90、D97和D98表示。其中,D10、D50和D90分别表示微粒的累积体积占颗粒体积群总体积的10%、50%和90%时的粒径大小,即小于该粒径的微粒体积占颗粒群总体积的10%、50%和90% [18],每个处理组平行测定3 次,实验重复3 次,选取D10、D50和D90进行结果分析。
1.4 数据分析
本实验中单因素数据采用统计软件SPSS 19.0进行相关性分析和方差分析(analysis of variance,ANOVA),数据进行正态分布检验,符合正态分布的多重比较采用Duncan’s法,并应用Pearson系数进行相关性分析;不符合正态分布的用Kruskal-Wallis检验,差异显著性为P<0.05。每个实验重复3次,每个处理3 个平行。作图采用软件Origin 8.0和Sigma Plot 12.5。
2.1 淀粉质量分数对EAI和ESI的影响

图1 不同质量分数淀粉对鸡胸肉蛋白乳化特性的影响
Fig. 1 Effect of starch content on emulsifying properties of chicken breast salt-soluble proteins
EAI和ESI的增加有利于乳化物的形成和稳定 [12]。由图1可知,在淀粉质量分数为0%~2%时,处理组的EAI和ESI均呈现先下降后上升的趋势,在淀粉质量分数为2%~4%时均呈现缓降的趋势。这说明一 定质量分数的淀粉可以增加复合蛋白乳液的EAI和ESI。当淀粉质量分数为1%时,蛋白溶液EAI和ESI均小于其他组,且与质量分数为2%和3%两组差异显著(P<0.05)。这说明质量分数为1%的淀粉可能导致蛋白乳液间发生桥连絮凝作用,加速了乳液失稳,从而导致ESI下降 [19];在淀粉质量分数1%~2%范围内,EAI和ESI均处于上升阶段,此阶段可能是淀粉颗粒在冷水溶液中可逆的吸收水分,慢慢膨胀,淀粉颗粒粉碎,然后融合到乳化液中。复合乳化液中淀粉和蛋白质发生相互作用,使得吸附着蛋白质的油滴因被固定于多糖形成的交联网状结构中不能相互靠近,从而增加了体系的稳定性和蛋白质-淀粉复合物的界面活性 [19-21];而淀粉质量分数在2%~3%范围内,ESI处于较平稳状态,这种由于桥联絮凝引起乳浊液不稳定,增加其浓度使得乳浊液重新趋于稳定的现象,在其他乳浊液体系如蛋白质-卡拉胶混合体系中也有所报道 [22-23];当淀粉质量分数超过3%以后,由于淀粉浓度相对较高,则引起排斥絮凝 [24],导致复合乳化液的EAI和ESI均呈现下降的趋势。
2.2 淀粉质量分数对蛋白质乳化液黏度和剪应力的影响
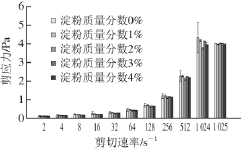
图2 不同剪切速率下淀粉质量分数对乳化液剪应力的影响
Fig. 2 Effect of starch content on the shear stress of emulsions at different shear rates
食品流体或者半流体的黏度相关特征一般是通过测量样品的抗流动性来衡量 [25]。由图2可知,各组的剪应力随着剪切速率的增加均呈现先缓慢增加后急速上升的趋势。这一结果与Er☒elebi等 [26]研究乳清分离蛋白中添加果胶和瓜尔豆胶的研究结果相似。此外,在同一剪切速率下,剪应力随着乳化液中淀粉质量分数的增加大体呈现先下降后上升随后又下降的趋势(2%<4%<3%<1%<0%)。当剪切速率在2~256 s -1过程中,各组剪应力随剪切速率缓慢上升,此阶段是淀粉和蛋白质竞争吸附的过程,表面的剪应力开始被表面活性物质所控制 [27];当剪切速率为8 s -1时,剪应力随着淀粉质量分数的增加而减小(4%<3%<2%<1%<0%),这可能是因为不同质量分数的淀粉在蛋白乳液中的溶解度也会影响乳化液的流变特性 [1];当剪切速率超过256 s -1,各组的剪应力急剧上升,此时由于淀粉颗粒与蛋白发生交互作用或者以物理的形式镶嵌在蛋白基质中,使得淀粉颗粒周围有大量蛋白膜存在,束缚和限制了乳化液的流动,导致乳化液很难发生流动 [28],因而需要较大的剪应力。

图3 不同剪切速率下淀粉质量分数对乳化液黏度的影响
Fig. 3 Effect of starch content on the viscosity of emulsions at different shear rates
剪切稀化在乳液的流变特性研究领域中是最常遇到的现象,它表现为剪切速率越大,黏度则越小 [8]。由图3可知,随着剪切速率的增大,乳浊液黏度逐渐减小,最后趋于平缓。其中,在较低的剪切速率下,随着剪切速率的增大乳浊液黏度急剧下降;在较高的剪切速率下,随着剪切速率的增大乳浊液黏度下降幅度很小,主要原因可能是在剪应力的作用下液滴的取向作用远高于布朗运动所引起的随机效应,黏度随之下降,当剪切作用力达到一定程度时,液滴定向排布,黏度趋于定值 [29]。此外,处理组的黏度几乎都小于无淀粉添加组,这可能是淀粉的添加在蛋白质的表面形成了一层保护层,在一定程度上阻碍了蛋白质发生聚集,从而使得乳化液的黏度降低 [6]。在一定剪切速率下,乳化液黏度随着淀粉质量分数的增加大致呈现先降低后上升的趋势(2%<3%<4%<1%<0%),而且由图3可知,当淀粉质量分数为2%时,相对来说黏度较小,这与剪应力随着淀粉含量的增加变化趋势相似。产生这种现象的原因可能是剪切速率的增加使得乳化体系在剪切下产生的流动变得更加有序,从而降低了剪切抗性,使黏度降低 [30-31]。另一方面,蛋白质与脂肪球结合发生乳化反应,也会导致乳化体系黏度的降低 [32]。
此外,相关性分析结果表明:各组中不同剪切速率下对应的黏度均呈极显著相关性。这可能是因为淀粉溶液加入到由大豆油乳化的蛋白液后,复合蛋白质溶液中淀粉颗粒由盐溶性肌原纤维蛋白膜层包裹,有不溶性的络合物凝聚,在不同剪切速率下,经过剪切成为细小的复合乳液颗粒,剪切速率不同,络合物的凝聚性不同,进而对应 的黏度会有所差异 [33-34]。
2.3 淀粉质量分数对蛋白质乳化液粒度大小与分布的影响
表1 不同质量分数淀粉对鸡胸肉乳化液粒径大小的影响(x
Table 1 Effect of starch content on particle size distribution parameters of chicken breast salt-soluble protein emulsion (x

注:同列小写字母不同表示差异显著(P<0.05)。
μm 1.313± 0.039 bc12.534±2.042 b32.660±4.382 c1 1.366±0.028 a15.624±1.499 a39.336±2.539 ab2 1.351±0.034 ab15.532±0.900 a39.259±1.541 a3 1.274±0.021 c14.433±1.476 a38.581±2.964 ab41.245±0.009 d12.766±1.425 b35.392±3.660 bc淀粉质量分数/%D10D50D90 0
乳状液中分散相微粒的大小和粒度分布可以影响乳状液的物理化学性质,目前多利用激光粒度分布仪来精确地测量和分析乳化状液中分散相微粒大小和分布特点 [18]。由表1可知,空白组的D10、D50和D90对应的粒径均小于淀粉组;在添加淀粉的处理组中,随着淀粉 质量分数的增加,乳化液微粒累积体积占总体积10%、50%和90%的粒径数值分别依次减小。其中,中值粒径D50值越大表明EAI越小 [18],而当淀粉质量分数为1%时,D50达到最大,说明此时EAI最小,这与图1中淀粉质量分数为1%时,所对应的EAI研究结果一致;当淀粉质量分数为2%和3%时,两个处理组D50和D90的粒径差异不显著(P>0.05),说明此添加量下,乳化液微粒的大小可能达到稳定复合乳化液的粒径。产生这种现象的原因可能是添加2%和3%淀粉溶液之后,形成了比较均匀的淀粉微粒,它们分散在基质中,与盐溶蛋白形成了相对稳定的乳化液。这与图1中淀粉质量分数为2%和3%时,所对应的ESI研究结果一致。
另外,通过结果相关性分析得知乳化液微粒累积体积占总体积10%的粒径数值(D10)与淀粉质量分数(相关系数r=-0.598)成极显著负相关(P<0.01);乳化活性与微粒D50的粒径(相关系数r=0.549)、微粒D90的粒径(相关系数r=0.558)均成显著正相关(P<0.05)。这说明,乳状液中分散相微粒的大小和分布不仅与淀粉质量分数有关,同时也受复合蛋白乳化液的乳化活性的影响。
实际食品乳状液中微粒尺寸是分布在一定尺寸范围内的,并且属于多分散乳状液。多分散相乳状液可以用单峰、双峰或者多峰来表示,这主要取决于微粒尺寸分布的峰值数量 [18,35-36]。图4显示的是在不同质量分数淀粉乳化液中微粒的粒度分布图,其中横坐标是乳化液微粒的直径大小,纵坐标是某一粒径的微粒占颗粒群总体积的百分比。整体上粒度分布曲线呈“双峰”型,而且出现双峰的范围不一样。“双峰”的第一个峰出现在粒径为3 μm左右,第二峰出现范围是粒径为10~80 μm之间,所有组的变化趋势相当;淀粉质量分数为1%、2%和3%处理组的第二个峰出现在为27 μm左右,分别占所在乳化液颗粒群总体积的5.036%、5.097%和4.746%,另外0%和4%处理组主要出现在25 μm左右,分别占所在乳化液颗粒群总体积的4.812%和4.60%。说明乳化液微粒出现频率最高的粒径为27 μm和25 μm。
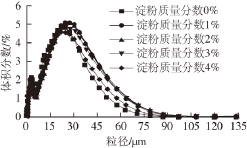
图4 不同质量分数淀粉对鸡胸肉蛋白乳化液粒度分布的影响
Fig. 4 Effect of starch content on the particle size distribution of chicken breast salt-soluble proteins
由图4可知,添加淀粉组的粒径分布范围一致,即0~108 μm,之后某一粒径的微粒粒度分布右移,而且占颗粒群总体积的百分比均趋为0,造成小拖尾的可能原因是均质过程中由于均质压力场中强大的湍流和剪切流增强了液滴间的碰撞次数,使得被破碎的小液滴重新聚结所形成 [32],也可能是均质后乳液粒径变小,液滴间布朗运动更加剧烈,液滴间碰撞的几率相应增加,液滴重新聚结的能力也增强 [21]。粒度分布范围越窄,表明微粒的分散程度越小、集中程度越高。当粒径大于30.39 μm后,各组的微粒占颗粒群总体积分数急速下降,然后趋于0。其中微粒粒径在30.39~108 μm之间时,随着淀粉含量的增加,各组的微粒大小和微粒占颗粒总体积分数的趋势均是先增加后下降(0%<4%<3%<1%<2%)。因此,添加淀粉使得乳化液微粒分布更为趋集中。
本实验研究结果表明不同质量分数的淀粉对复合乳化液的EAI、ESI、静态黏度、粒径大小和粒度分布均有影响。随着淀粉质量分数的增加,EAI和ESI均呈现先增加后减小现象,说明添加适量的淀粉,可以更好地促进淀粉与盐溶性蛋白溶液的交互作用,使淀粉充分镶嵌在蛋白质基质中,形成更稳定的乳化体系,进而影响肉制品生产过程中肌肉蛋白质凝胶的保水性。随着淀粉质量分数的增加,黏度和剪应力均大致呈现先下降后上升趋势,说明淀粉的添加束缚和限制了乳化液的流动。另一方面,随着淀粉质量分数的增加,复合乳液D10、D50和D90的粒径逐渐降低,且淀粉质量分数为2%和3%时D50和D90的粒径变化不大,说明此阶段复合乳液的乳化稳定较好;此外,随着淀粉质量分数的增加,各组的微粒大小和微粒占颗粒总体积分数均是先增加后下降,说明一定质量分数的淀粉对乳化液中分散相微粒大小和分布有一定的影响。因此,将适宜质量分数的淀粉添加至鸡胸肉盐溶性蛋白中,使乳化液体系更稳定。实际生产过程中,为获得更优质的产品,应考虑淀粉添加量因素。
参考文献:
[1] LIN J H, SINGH H, CHEN F B, et al. Changes in swelling and rheological properties of corn starches after acid-methanol degradation[J]. Food Hydrocolloids, 2015, 45: 361-368. DOI:10.1016/ j.foodhyd.2014.11.031.
[2] SEUNG D, SOYK S, COIRO M, et al. Protein targeting to starch is required for localising granule-bound st arch synthase to starch granules and for normal amylose synthesis in arabidopsis[J]. PLoS Biology, 2015, 13(2): e1002080. DOI:10.1371/journal.pbio.1002080.
[3] 孙建清, 徐宝才, 余忠, 等. 淀粉类对低温乳化香肠品质的影响[J]. 肉类研究, 2011, 25(12): 1-5. DOI:10.3969/ j.issn.1001-8123.2011.12.002.
[4] CHOI Y S, KIM H W, HWANG K E, et al. Effects of gamma irradiation on physicochemical properties of heat-induced gel prepared with chicken salt-soluble proteins[J]. Radiation Physics and Chemistry,2015, 106(1): 16-20. DOI:10.1016/j.radphyschem.2014.06.029.
[5] 郭世良, 赵改名, 王玉芬, 等. 离子强度和pH值对肌原纤维蛋白热诱导凝胶特性的影响[J]. 食品科技, 2008, 33(1): 84-87. DOI:10.3969/ j.issn.1005-9989.2008.01.023.
[6] 张曼, 王岸娜, 吴立根, 等. 蛋白质、多糖和多酚间相互作用及研究方法[J]. 粮食与油脂, 2015(4): 42-46. DOI:10.3969/ j.issn.1008-9578.2015.04.012.
[7] SUN J, WU Z, XU X, et al. Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation[J]. Meat Science, 2012,91(1): 88-92. DOI:10.1016/j.meatsci.2011.12. 010.
[8] BOUYER E, MEKHLOUFI G, ROSILIO V, et al. Prot eins,polysaccharides, and their complexes used as stabilizers for emulsions: al ternatives to synthetic surfactants in the pharmaceutical field?[J]. International Journal of Pharmaceutics, 2012, 436(1): 359-378. DOI:10.1016/j.ijpharm.2012.06.052.
[9] MAR☒A J S, MAR☒A J M, ANA M R, et al. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J]. Food Hydrocolloids, 20 14, 39: 223-230. DOI:10.1016/j.foodhyd.2014.01.014.
[10] LIU H M, NIE Y, CHEN H. Effect of different starches on colors and textural properties of surimi-starch gels[J]. International Journal of Food Properties, 2014, 17(7): 1439-1448. DOI:10.1080/10942912.201 2.68022 4.
[11] GENCCELEP H, SARICAOGLU F T, ANIL M, et al. The effect of starch modification and concentration on steady-state and dynamic rheology of meat emulsions[J]. Food Hydrocolloids, 2015, 48: 135-148. DOI:10.1016/j.foodhyd.2015.02.002.
[12] ZORBA ☒. The effects of the amount of emulsified oil on the emulsion stability and viscosity of myofibrillar prot eins[J]. Food Hydrocolloids,2006, 20(5): 698-702. DOI:10.1016/j.foodhyd.2005.06.010.
[13] 亢春雨, 赵春青. 鸡胸肉盐溶蛋白热诱导凝胶保水性和超微结构的研究[J]. 食品科学, 2007, 28(1): 50-53. DOI:10.3321/ j.issn:1002-6630.2007.01.007.
[14] 张龙翔, 张庭芳, 李令媛, 等. 生物化学实验方法和技术[M]. 2版. 北京: 高等教育出版社, 1997: 136-137.
[15] 赵谋明, 林伟锋, 胡坤, 等. 多糖对大豆蛋白在水相介质中乳化特性的影响研究[J]. 食品工业科技, 2002, 23(6): 3 1-34. DOI:10.3969/ j.issn.1002-0306.2002.06.010.
[16] 张文会. 马铃薯分离蛋白溶液流变学特性及热稳定性研究[D]. 长春: 吉林农业大学, 2011: 14-21.
[17] 许小刚, 周雪松. 曾建新. 粒径分析法快速判定均质工艺对水牛奶稳定性的影响[J]. 中国乳品工业, 2009, 37(1): 42-44. DOI:10.3969/ j.issn.1001-2230.2009.01.011.
[18] 高菲菲, 汪张贵, 彭增起, 等. 剪切时间对肉糜中微粒分散特性的影响[J]. 食品科学, 2012, 33(5): 74-77.
[19] LIU L, ZHAO Q, LIU T, et al. Sodium caseinate/ carboxymethylcellulose interactions at oil-water interface: relationship to emulsion stability[J]. Food Chemistry, 2012, 132(4): 1822-1829. DOI:10.1016/j.foodchem.2011.12.014.
[20] WANG S, LI C, YU J, et al. Phase transition and swelling behaviour of different starch granules over a wide range of water content[J]. LWTFood Science and Technology, 2014, 59(2): 597-604. DOI:10.1016/ j.lwt.2014.06.028.
[21] CHENG J, MA Y, LI X, et al. Effects of milk protein-polysaccharide interactions on the stability of ice cream mix model systems[J]. Food Hydrocolloids, 2015, 45: 327-336. DOI:10.1016/j.lwt.2015.12.064.
[22] RU Q, YU H, HUANG Q. Encapsulation of epigallocatechin-3-gallate(EGCG) using oil-in-water (O/W) submicrometer emulsions stabilized by ι-carrageenan and β-lactoglobulin[J]. Journal of Agricultural and Food Chemistry, 2010, 58(19): 10373-10381. DOI:10.1021/ jf101798m.
[23] GU Y S, DECKER E A, MCCL EMENTS D J. Influence of pH and carrageenan type on properties of β-lactoglobulin stabilized oilin-water emulsions [J]. Food Hydrocolloids, 2005, 19(1): 83-91. DOI:10.1016/j.foodhyd.2004.04.016.
[24] SURH J, GU Y S, DECKER E A, et al. Influence of environmental stresses on stability of O/W emulsions containing cationic droplets stabilized by SDS-fish gelatin mem branes[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4236-4244. DOI:10.1021/ jf047944i.
[25] RAM☒REZ-SU☒REZ J C, ADDO K, XIONG Y L. Gelation of mixed myofibrillar/wheat gluten proteins treated with microbial trans glutaminase[J]. Food Research International, 2005, 38(10): 1143-1149. DOI:10.1016/j.foodres.2 005.04.004.
[26] ER☒ELEBI E A, IBANOGLU E. Rheological properties of whey protein isolate stabilized emulsions with pectin and guar gum[J]. European Food Re search and Technology, 2009, 229(2): 281-286. DOI:10.1016/j.foodhyd.2014.09.025.
[27] KLEIN M, ASERIN A, IS HAI P B, et al. Interactions between whey protein isolate and gum Arabic[J]. Colloids and Surfaces B: Biointerfaces, 2010, 79(2): 377-383. DOI:10.1016/ j.colsurfb.2010.04.021.
[28] INNOCENTE N, BIASUTTI M, VENIR E, et al. Effect of highpressure homogenization on droplet size distribution and rheological properties of ice cream mixes[J]. Journal of Dairy Science, 2009,92(5): 1864-1875. DOI:10.3168/jds.2008-1797.
[29] QUEMADA D. Rheology of concentrated disperse systems II. A model for non-newtonian shear viscosity in steady flows[J]. Rheologica Acta, 1978, 17(6): 632-642. DOI:10.1007/BF01522036.
[30] SUN C, GUNASEKARAN S, RICHARDS M P. Effect of xanthan gum on physicochemical properties of whey protein isolate stabilized oil-in-water emulsions[J]. Food Hydrocolloids, 2007, 21(4): 555-564. DOI:10.1016/j.foodhyd.2006.06.003.
[31] XIANG B Y, SIMPSON M V, NGADI M O, et al. Flow behaviour and viscosi ty of reconstituted skimmed milk treated with pu lsed electric field[J]. Biosystems Engineering, 2011, 109(3): 228-234. DOI:10.1016/j.biosystemseng.2011.04.004.
[32] H☒KANSSON A, TR☒G☒RDH C, BERGENST☒HL B. Studying the effects of adsorption, recoales cence and fragmentation in a high pressu re homogenizer using a dynamic simulation model[J]. Food Hydrocolloids, 2009, 23(4): 1177-1183. DOI:10.1016/ j.foodhyd.2008.10.003.
[33] STASZEWAKI M, JARA F L, RUIZ A L, et al. Nanocomplex formation between β-lactoglobulin or caseinomacropeptide and green tea polyphenols: impac t on protein gelation and polyphenols antiproliferative activity[J]. Journal of Functional Foods, 2012, 4(4): 800-809. DOI:10.1016/j.jff.2012.05.008.
[34] RYAN K N, VARDHANABHUTI B, JARAMILLO D P, et al. Stability and mechanism of whey protein soluble aggregates thermally treated with salts[J]. Food Hydrocolloids, 2012, 27(2): 411-420. DOI:10.1016/j.foodhyd.2011.11.006.
[35] GELIN J L, POYEN L, COURTHAUDON J L, et al. Structural changes in oil-in-water emulsions during the manufacture of ice cream[J]. Food Hydrocolloids, 1994, 8(3): 299-308. DOI:10.1016/ S0268-005X(09)80342-1.
[36] SCH☒MANN H, KHATIB M, TUTKUN M, et al. Droplet size measurements in oil-water dispersions: a comparison study using FBRM and PVM[J]. Journal of Dispersion Science and Technology,2015, 36(10): 1432-1443. DOI:10.1080/01932691.2014.98956.
Effect of Starch Content on Emulsifying Properties of Chicken Breast Salt-Soluble Proteins
ZHOU Fen
1, GU Dahai
2, XU Jiahui
1, ZHANG Junlong
1, DENG Yamin
1, LI Ruren
1, LIU Dengyong
1, SHAO Junhua
1,*
(1. National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food Science and Project Engineering, Bohai University, Jinzhou 121013, China; 2. Yunnan Engineering Technology Research Center for Processing of Livestock Products,College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China)
Abstract:The effect of addition of different amounts of starch on emulsifying properties of chicken breast salt-soluble proteins was investigated. The results showed that with the increase of starch content, emulsify activity and emulsifying stability rose first and then decrease, the D10, D50 and D90 values of emulsions gradually reduced, and shear stress and viscosity decreased first and then rose. Besides, with the increase of shear rate, the shear stress of emulsions increased gradually, and viscosity declined first and then remained stable. The correlation analysis showed that there was a significantly(P < 0.01) negative correlation between D10 value and starch content (r = -0.598), and a significantly (P < 0.05) positive correlation between the emulsifying activity of salt-soluble proteins and either D50 ( r = 0.549) or D90 (r = 0.558). All of these results indicated that the appropriate amount of starch added to chicken breast salt-soluble protein could make the emulsion system more stable. Ultimately, the formation of starch-protein complexes would affect processing properties of chicken breast proteins.
Key words:starch; chicken breast; salt-soluble proteins; emulsion; size distribution; viscosity
DOI:10.7506/spkx1002-6630-201615002
中图分类号:TS251
文献标志码:A
文章编号:1002-6630(2016)15-0007-06
收稿日期:2015-12-12
基金项目:国家自然科学基金青年科学基金项目(31301510);国家自然科学基金面 上项目(31571860);“十二五”国家科技支撑计划项目(2012BAD28B03)
作者简介:周纷(1989—),女,硕士研究生,研究方向为肉品加工与质量安全控制。E-mail:zzhoufen@163.com
*通信作者:邵俊花(1980—),女,副教授,博士,研究方向为肉品加工与质量安全控制。E-mail:shaojh024@163.com
引文格式: