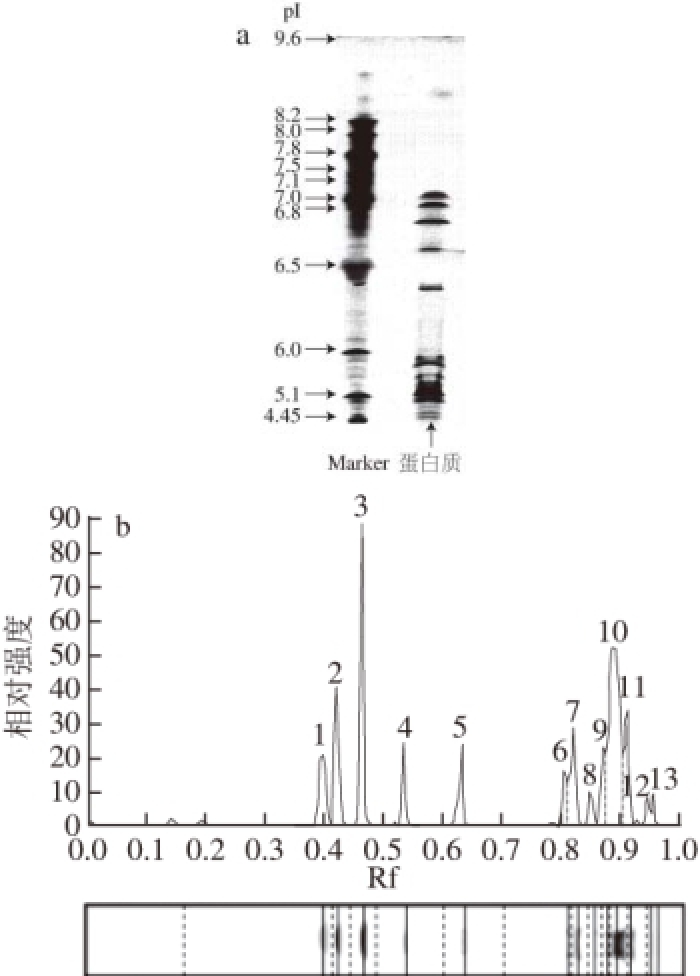
图1 芋艿分离蛋白的等点聚焦电泳图谱和含量分布
Fig. 1 Isoelectric point focusing electrophoresis and content distribution of taro protein isolates
黄友如,王教飞,朱东兴,李昕蓓,徐田甜
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
摘 要:针对芋艿分离蛋白的等电点、变性温度、氨基酸组成及亚基分子质量分布等重要理化性质进行研究。结果表明,芋艿分离蛋白各组分的等电点主要集中在pI值为6.73和5.21两个条带,分别占分离蛋白总量的16.36%和27.30%;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析表明芋艿分离蛋白主要由4 种亚基组成,其分子质量分别分布在57 000、46 300、34 200、8 500 D左右,添加巯基乙醇可增加分子质量在23 100 D左右的条带,证明芋艿分离蛋白亚基间有二硫键的交联;差示扫描量热(differential scanning calorimetry,DSC)分析确定芋艿分离蛋白的变性温度为(71.3±0.2) ℃,变性焓Δ H为1.550 J/g;氨基酸组成分析表明,非极性氨基酸含量占37.26%,极性氨基酸含量占62.74%;必需氨基酸(色氨酸除外)含量占39.02%,幼儿所必需的半必需氨基酸(即精氨酸、组氨酸)含量占9.9%。
关键词:芋艿分离蛋白;等电点;变性温度;氨基酸组成;分子质量
黄友如, 王教飞, 朱东兴, 等. 芋艿分离蛋白的理化性质[J]. 食品科学, 2016, 37(15): 45-48. DOI:10.7506/spkx1002-6630-201615008. http://www.spkx.net.cn
HUANG Youru, WANG Jiaofei, ZHU Dongxing, et al. Partial physicochemical characterization of taro protein isolates[J]. Food Science,2016, 37(15): 45-48. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615008. http://www.spkx.net.cn
芋艿分离蛋白是以芋艿地下球茎为原料提取的,蛋白质含量≥90%。目前,有关芋艿分离蛋白的分析研究较少。王教飞等 [1]以芋艿分离蛋白为材料,研究了不同pH值环境条件下芋艿分离蛋白的流变特性、紫外和荧光光谱,证明在pH 7.0时,芋艿分离蛋白的紫外吸收峰位于284 nm;其荧光光谱最大激发波长为289.7 nm,最大发射波长为330.3 nm;pH值环境对芋艿蛋白的变性及聚集有明显的影响。孙啊敏等 [2]研究了金属离子种类及强度对芋艿分离蛋白流变特性、起泡性及泡沫稳定性和乳化性及乳化稳定性的影响,认为盐离子种类及其浓度对芋艿分离蛋白的功能特性有明显的影响。本实验在前期有关芋艿分离蛋白研究的基础上,进一步对芋艿分离蛋白的等电点、变性温度、氨基酸组成与含量、亚基相对分子质量分布等重要理化性质进行探讨,以期较为系统、全面地了解芋艿分离蛋白这一蛋白资源。
1.1 材料与试剂
芋艿:产自常熟。
丙烯酰胺、N,N,N’,N’-四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、过硫酸胺(ammonium persulphate,AP)、三(羟甲基)胺基甲烷(Tris(hydroxymethyl)methyl aminomethane,Tris)、低分子质量标准蛋白、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甲叉双丙烯酰胺 美国Sigma公司;溴酚蓝 上海三爱思试剂有限公司;考马斯亮蓝R-250、石油醚(沸程30~60 ℃)、酒精、氢氧化钠、浓盐酸、浓硫酸、硫酸铜、硫酸钾、过氧化氢、硼酸、甲基红、溴甲酚绿、优级浓盐酸、醋酸钠、磺基水杨酸、茚三酮、磷酸氢二钠、蔗糖、磷酸二氢钠(均为分析纯)、甲醇和乙腈(均为色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Powerpac Basic电泳仪、Protein II垂直电泳系统、Bio-Rad凝胶成像系统 美国Bio-Rad公司;Multiphor Ⅱ电泳系统、EPS 3501 XL电源供应器 美国GE Healthcare公司;Christ冷冻干燥机 德国Christ公司;CR22G II高速冷冻离心机 日本Hitachi Koki公司;Agilent 1100型氨基酸自动分析仪 美国Agilent公司;2920型差示扫描量热分析仪(differential scanning calorimetry,DSC) 美国TA Instrument公司。
1.3 方法
1.3.1 芋艿分离蛋白的制备
参考文献:[1]中1.3.1节芋艿分离蛋白的提取工艺,芋艿分离蛋白的蛋白质含量为96.72%。
1.3.2 芋艿分离蛋白等电点的测定 [3-6]
取1.5 mg芋艿分离蛋白粉用500 μL水化液(DL-二硫苏糖醇(DL-dithiothreitol,DTT)和IPG Buffer现加现用)重新溶解。12 000 r/min高速离心30 min,选用适当的超滤管超滤浓缩,再以1%甘氨酸进行置换超滤清洗,重复3 次后反超得测试样品。取测试样品40 μL和对应的标准品至上样孔,按照电压500 V,电流50 mA,功率为每1 cm凝胶1 W的电泳条件,电泳20 min,之后设置电压2 000 V,电流50 mA,功率为每1 cm凝胶1 W,再电泳90 min。电泳结束后将凝胶支持膜从电泳槽中取出浸入固定液中,至少30 min后转移至染色液中染色,至少120 min后再转移到脱色液中脱色。待凝胶背景清晰后转移至扫描仪进行图像扫描,之后用ImageQuant TL Version 7.0软件分析样品的等电点。
1.3.3 芋艿分离蛋白的非还原和还原SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析
样品溶解液 [7-12]:0.5 mol/L pH 6.8 Tris-HCl缓冲液25 mL,10% SDS 40 mL,巯基乙醇10 mL(还原),溴酚蓝10 mg,甘油20 mL。电极缓冲液:Tris 3.03 g,甘氨酸14.42 g,加入蒸馏水800 mL后,加入10% SDS 1 mL溶解定容至1 000 mL,最终pH值为8.3。固定液:取冰乙酸46 mL,50%甲醇454 mL混匀。染色液:加上述固定液250 mL,0.125 g考马斯亮蓝R-250,过滤。脱色液:冰乙酸75 mL,蒸馏水定容到1 000 mL。
采用不连续系统凝胶配制,电泳时采用稳流操作,5%浓缩胶时的电流为10 mA,10%分离胶的电流为20 mA。Marker作分子质量标准。溴酚蓝为指示剂,根据芋艿分离蛋白对应Marker蛋白相对位置计算其分子质量。
1.3.4 芋艿分离蛋白热稳定性测定 [13-16]
使用2 9 2 0改进型D S C测定,用蒸馏水配制12 g/100 mL的芋艿蛋白溶液,然后取60 mg溶液放在铝箔中以1 ℃/min的速率从25 ℃ 加热到150 ℃,同时做空白平行实验,重复实验3 次。用配套程序记录变性温度(denatured temperature),峰值点温度计为变性温度,并计算吸热曲线形成峰的面积,即蛋白质变性的能量。
1.3.5 芋艿分离蛋白的氨基酸组成分析 [8,17]
准确称取10~20 mg的样品(精确到0.000 1 g),置于水解管中,加15.00 mL的 6.0 mol/L盐酸,1.00 mL巯基乙醇,旋紧胶塞,抽真空。将此水解管封口放入(110±1) ℃的恒温干燥箱中24 h,取出冷却、过滤,并冲洗定容至50.00 mL。取滤液1.00 mL于25 mL烧杯中,水浴蒸干,用1~2 mL水溶解再蒸干,重复3 次,最后残留物用0.02 mol/L的盐酸1.00 mL溶解上机测定。色谱条件:离子交换柱树脂2619#(2.5 mm×150 mm);柱温53 ℃;缓冲液流速0.25 mL/min;茚三酮流速0.3 mL/min;柱压80~120 kg/cm 2。样品测试3 次取平均值。
2.1 芋艿分离蛋白的等电点
芋艿分离蛋白等电点聚焦电泳如图1所示,芋艿分离蛋白共检出13 个可辨条带。其中含量较高的条带为4号和10号条带,pI值分别为6.73和5.21,分别占到分离蛋白总量的16.36%和27.30%,结合本实验室后续的芋艿蛋白分级分离研究可初步确定分属谷蛋白与球蛋白组分;其余含量较低的等电点条带pI值分别为7.03、6.90、6.58、6.37、5.88、5.75、5.52、5.34、4.99、4.64、4.52等,它们的含量均少于10%。除pI值在7.03的条带外,图上的可辨条带pI值均在7.0以下。以上研究结果表明,芋艿分离蛋白各组分的等电点pI值主要集中在4.99~6.90之间,即以酸性蛋白为主。

图1 芋艿分离蛋白的等点聚焦电泳图谱和含量分布
Fig. 1 Isoelectric point focusing electrophoresis and content distribution of taro protein isolates
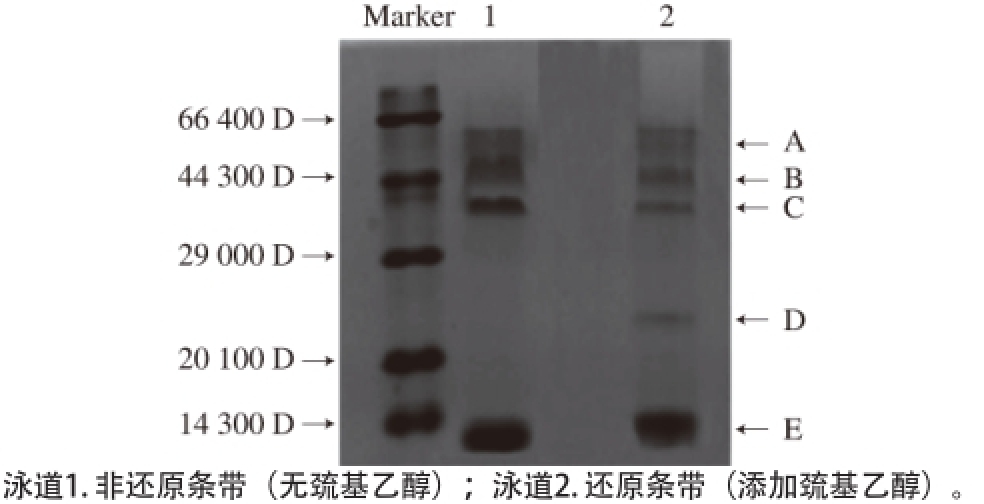
图2 芋艿分离蛋白SDS-PAGEE条带
Fig. 2 SDS-PAGE of taro protein isolates
2.2 芋艿分离蛋白的分子质量分布
由图2可知,没有添加巯基乙醇的芋艿分离蛋白SDS-PAGE主要有A、B、C和E这4 个条带,分子质量分别在57 000、46 300、34 200、8 500 D左右,其中34 200、8 500 D两个条带着色较深、相对含量较高。与泳道1(无巯基乙醇)相比,泳道2(添加巯基乙醇)增加了D带(分子质量约在23 100 D左右),且A、B、C和E带着色较浅,表明芋艿分离蛋白组分含有链间二硫键,添加巯基乙醇可打开二硫键,降低部分亚基的分子质量,导致若干电泳条带的暗淡甚至出现分子质量较低的新条带(如D带)。后面的氨基酸组成分析也表明芋艿分离蛋白含有0.91%的胱氨酸。
2.3 芋艿分离蛋白热稳定性分析
一般而言,蛋白样品在升温的过程中结构若发生变化,样品吸热,DSC曲线上会出现一个吸热峰,DSC曲线上显示的转变温度即蛋白结构发生转变的温度 [18]。热焓,确切地说应是焓变,即样品发生转变前后的ΔH(图3吸热峰的峰面积)与蛋白质有序二级结构的含量有关 [19]。由图3芋艿分离蛋白热变性曲线可以看出,芋艿分离蛋白的变性温度为(71.3±0.2) ℃,变性焓ΔH为1.550 J/g。吸热峰的出现表明芋艿分离蛋白质分子由于加热而经历着解折叠,即从天然态到变性态的构象转变过程。由芋艿分离蛋白及其组分的制备、分离过程及后续的结构分析等来看,芋艿分离蛋白的主要组分是球蛋白和谷蛋白,两者β-折叠结构的总量分别是38.4%与49.0%。蛋白质变性温度与其β-折叠结构含量成正相关,蛋白质变性过程中热能的变化主要源于分子间氢键的断裂 [20-24],芋艿分离蛋白的变性焓较高,证明其有序结构所占比例较高,这与芋艿球蛋白和谷蛋白中β-折叠结构含量高的结论相吻合。
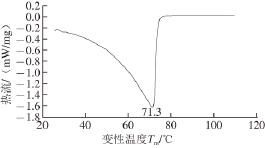
图3 芋艿分离蛋白热变性曲线
Fig. 3 Differential scanning calorimetry curves of taro protein isolates
2.4 芋艿分离蛋白的氨基酸组成

图4 芋艿分离蛋白的氨基酸组成
Fig. 4 Amino acid composition analysis of taro protein isolates
芋艿分离蛋白的酸水解,不引起消旋作用,得到的均是L型的氨基酸,除色氨酸完全被破坏外,另有一小部分丝氨酸及苏氨酸被分解,而谷氨酰胺和天冬酰胺的酰胺基则被水解下来成为相应的谷氨酸和天冬氨酸。芋艿分离蛋白的氨基酸组成如图4所示,一氨基一羧基的中性氨基酸(即甘氨酸、丙氨酸、丝氨酸、苏氨酸、亮氨酸、异亮氨酸、缬氨酸、蛋氨酸和胱氨酸)含量占44.60%;一氨基二羧基酸性氨基酸及其酰胺(即天冬氨酸与谷氨酸及其酰胺)含量占26.59%;二氨基一羧基碱性氨基酸(即精氨酸和赖氨酸)含量占12.27%;芳香族氨基酸(即苯丙氨酸与酪氨酸)含量占10.24%;杂环氨基酸(即组氨酸和脯氨酸,色氨酸除外)含量占6.31%;非极性氨基酸(即丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸和蛋氨酸,色氨酸除外)含量占37.26%;不带电荷的极性氨基酸(如甘氨酸、丝氨酸、苏氨酸、胱氨酸、酪氨酸,天冬酰胺、谷氨酰胺除外)含量占21.03%;带正电荷的极性氨基酸(即赖氨酸、精氨酸和组氨酸)含量占15.11%;带负电荷的极性氨基酸(即天冬氨酸与谷氨酸,含天冬酰胺与谷氨酰胺)含量占26.59%。必需氨基酸(即苏氨酸、缬氨酸、亮氨酸、异亮氨酸、赖氨酸、苯丙氨酸和蛋氨酸,色氨酸除外)含量占39.02%;为幼儿所必需的半必需氨基酸(即精氨酸、组氨酸)含量占9.9%,这与藤葳等 [25]的研究结果较为一致。
有关芋艿分离蛋白的分离、提取及结构方面的表征,除本实验室的部分成果外,国内外文献鲜见报道。本实验通过等电聚焦方法确定芋艿分离蛋白的等电点主要集中在pI值为6.73、相对含量为16.36%和pI值为5.21、相对含量为27.30%的两个条带。SDS-PAGE分析证明芋艿分离蛋白主要由4 种亚基组成,其分子质量分别分布在57 000、46 300、34 200、8 500 D左右,亚基间有二硫键的交联。热稳定性分析表明,芋艿分离蛋白的变性温度为(71.3±0.2) ℃,变性焓ΔH为1.550 J/g。氨基酸组成分析表明,脂肪族氨基酸含量占83.46%,芳香族氨基酸含量占10.24%,杂环氨基酸含量占6.31%。必需氨基酸(色氨酸除外)含量占39.02%,为幼儿所必需的半必需氨基酸(即精氨酸、组氨酸)含量占9.9%。上述结论初步确立了芋艿分离蛋白的理化基础,为进一步研究揭示芋艿分离蛋白的功能性质及其结构信息提供参考。
参考文献:
[1] 王教飞, 黄友如, 钱雅萍, 等. 芋艿分离蛋白质流变特性研究[J]. 食品科学, 2015, 36(9): 17-21. DOI:10.7506/spkx1002-6630-201509004.
[2] 孙啊敏, 王教飞, 黄友如, 等. 金属离子对芋艿分离蛋白食品功能特性的影响[J]. 安徽农业科学, 2015, 43(15): 235-239. DOI:10.13989/ j.cnki.0517-6611.2015.15.084.
[3] UTSUMI S, MARUYAMA N, SATOH R, et al. Structure-function relationships of soybean proteins revealed by using recombinant systems[J]. Enzyme and Microbial Technology, 2002, 30(3): 284-288. DOI:10.1016/S0141-0229(01)00507-5.
[4] MARUYAMA N, FUKUDA T, SAKA S, et al. Molecular and structural analysis of electrophoretic variants of soybean seed storage proteins[J]. Phytochemistry, 2003, 64(3): 701-708. DOI:10.1016/ S0031-9422(03)00385-6.
[5] ZHANG H, LI L, TATSUMI E, et al. Influence of high pressure on conformational changes of soybean glycinin[J]. Innovative Food Science and Emerging Technologies, 2003, 4(3): 269-275. DOI:10.1016/S1466-8564(03)00043-2.
[6] BADII F, HOWELL N K. Changes in the texture and structure of cod and haddock fillets during frozen storage[J]. Food Hydrocolloids,2002, 16(4): 313-319. DOI:10.1016/S0268-005X(01)00104-7.
[7] HUA Y F, HUANG Y R, QIU A Y, et al. Properties of soy protein isolate prepared from aqueous alcohol washed soy flakes[J]. Food Research International, 2005, 38(3): 273-279. DOI:10.1016/ j.foodres.2004.05.010.
[8] HUANG Y R, HUA Y F, QIU A Y. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39(2): 240-249. DOI:10.1016/ j.foodres.2005.07.012.
[9] HUANG Youru, YU Da, HUA Yufei, et al. Detection of free radical transfer in lipoxygenase I-B-catalyzed linoleic acid-soybean proteins interaction by electron spin resonance spectroscopy (ESR)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(24): 9216-9220. DOI:10.1021/jf061148q.
[10] SUMATHI S, PATTABIRAMAN T N. Natural plant enzyme inhibitors. VI. Studies on trypsin inhibitors of Colocasia antiquorum tubers[J]. Biochimica et Biophysica Acta (BBA) -Enzymology, 1979,566(1): 115-127. DOI:10.1016/0005-2744(79)90254-7.
[11] HAMMER B C, SHAW D C, BRADBURY J H. Trypsin inhibitors from Colocasia esculenta, Alocasia macrorrhiza and Cyrtosperma chamissonis[J]. Phytochemistry, 1989, 28(11): 3019-3026. DOI:10.1016/0031-9422(89)80271-7.
[12] BOATRIGHT W L, HETTIARACHCHY N S. Effect of lipids on soy protein isolate solubility[J]. Journal of the American Oil Chemists’Society, 1995, 72(12): 1439-1444. DOI:10.1007/BF02577835.
[13] 华欲飞, CUI S W, WANG Qi, et al. 不同大豆分离蛋白凝胶的流变学性质[J]. 中国粮油学报, 2003, 18(6): 43-48. DOI:10.3321/ j.issn:1003-0174.2003.06.010.
[14] VIDAL-VALVERDE C, FRIAS J, DIAZ-POLLAN C, et al. Influence of processing on trypsin inhibitor activity of faba beans and its physiological effect[J]. Journal of Agricultural and Food Chemistry,1997, 45(9): 3559-3564. DOI:10.1021/jf9700236.
[15] OBATA A, MATSUURA M, KITAMURA K. Degradation of sulfhydryl groups in soymilk by lipoxygenases during soybean grinding[J]. Bioscience, Biotechnology, and Biochemistry, 1996,60(8): 1229-1232. DOI:10.1271/bbb.60.1229.
[16] LIU H L, CHEN W J, CHOU S N. Mechanisms of aggregation of alpha- and beta-amylases in aqueous dispersions[J]. Colloids and Surfaces B: Biointerfaces, 2003, 28(2/3): 215-225. DOI:10.1016/ S0927-7765(02)00142-X.
[17] BADII F, HOWELL N K. Elucidation of the effect of formaldehyde and lipids on frozen stored cod collagen by FT-Raman spectroscopy and differential scanning calorimetry[J]. Journal of Agricultural and Food Chemistry, 2003, 51(5): 1440-1446. DOI:10.1021/jf020492u.
[18] 黄友如, 华欲飞, 王晓虹. DSC在大豆蛋白功能性质研究中应用[J]. 粮食与油脂, 2003(8): 15-17. DOI:10.3969/j.issn.1008-9578.2003.08.005.
[19] KOSHIYAMA I, HAMANO M, FUKUSHIMA D. A heat denaturation study of the 11S globulin in soybean seeds[J]. Food Chemistry, 1981,6(4): 309-322. DOI:10.1016/0308-8146(81)90004-2.
[20] PRIVALOV P L, KHECHINASHVILI N N. A thermodynamic approach to the problem of stabilization of globular protein structure: a calorimetric study[J]. Journal of Molecular Biology, 1974, 86(3): 665-684. DOI:10.1016/0022-2836(74)90188-0.
[21] WILLS R B H, LIM J S K, GREENFIELD H, et al. Nutrient composition of taro (Colocasia esculenta) cultivars from the Papua New Guinea highlands[J]. Journal of the Science of Food and Agriculture, 1983, 34(10): 1137-1142. DOI:10.1002/jsfa.2740341015.
[22] KAUSHAL P, KUMAR V, SHARMA H K. Utilization of taro(Colocasia esculenta): a review[J]. Journal of Food Science and Technology, 2015, 52(1): 27-40. DOI:10.1007/s13197-013-0933-y.
[23] KAUR M, KAUSHAL P, SANDHU K S. Studies on physicochemical and pasting properties of Taro (Colocasia esculenta L.) flour in comparison with a cereal, tuber and legume flour[J]. Journal of Food Science and Technology, 2013, 50(1): 94-100. DOI:10.1007/s13197-010-0227-6.
[24] HUANG A S, TANUDJAJA L S. Application of anion-exchange high-performance liquid chromatography in determining oxalates in taro (Colocasia esculenta) corms[J]. Journal of Agricultural and Food Chemistry, 1992, 40(11): 2123-2126. DOI:10.1021/jf00023a016.
[25] 藤葳, 柳琪, 黎秀卿, 等. 芋头蛋白质含量及氨基酸组分的分析与营养评价[J]. 莱阳农学院学报, 1992(4): 310-314.
Physicochemical Characterization of Taro Protein Isolates
HUANG Youru, WANG Jiaofei, ZHU Dongxing, LI Xinbei, XU Tiantian
(School of Biological Science and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Abstract:Isoelectric point (pI), denaturation temperature, amino acid composition, and molecular weight of taro protein isolates were studied in this research. The results showed taro protein isolates had two main pI bands near 6.73 and 5.21, accounting for 16.36% and 27.30% of the total proteins, respesctively. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) analysis indicated that taro protein isolates were mainly composed of four subunits with relative molecular weights distributed around 57 000, 46 300, 34 200 and 8 500 D. A new band having a molecular weight of about 23 100 D appeared with added mercaptoethanol suggesting that taro protein isolates had disulfide bonds between subunits. Differential scanning calorimetry (DSC) analysis confirmed that denaturation temperature of taro protein isolates was (71.3 ± 0.2) ℃ with an enthalpy change (ΔH) of 1.550 J/g. Amino acid analysis demonstrated that the contents of non-polar and polar amino acids were 37.26% and 62.74%, respectively. The content of essential amino acids except for tryptophan was 39.02% and the content of semi-essential amino acids for very young children was 9.9%.
Key words:taro protein isolates; isoelectric point; denaturation temperature; amino acid composition; molecular weight
DOI:10.7506/spkx1002-6630-201615008
中图分类号:TS201.21;TQ645.99
文献标志码:A
文章编号:1002-6630(2016)15-0045-04
收稿日期:2015-09-22
基金项目:“十二五”农村领域国家科技计划课题(2012BAD34B04-1;2013AA102203-03)
作者简介:黄友如(1966—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:huangyouru@aliyun.com
引文格式: