
图1 莲子红衣中性多糖(Ⅰ)和酸性多糖(Ⅱ)在DEAEE--CC树脂上的洗脱曲线
Fig. 1 Elution curve of water-soluble crude polysaccharides on DEAE-C column
高 航 1,高延芬 2,徐 虹 1,*
(1.北京工商大学 北京市食品添加剂工程技术研究中心,北京食品营养与人类健康高精尖创新中心,北京 100048;2.深圳市农科集团有限公司,广东 深圳 518040)
摘 要:以莲子红衣为实验对象,将其中的多糖进行分离、纯化并表征结构。采用酶提醇析法提取莲子红衣粗多糖,选择DEAE-C阴离子交换树脂和Sephadex G-25凝胶柱层析,从莲子红衣粗多糖中分离纯化得到中性多糖和酸性多糖两种组分。经凝胶渗透色谱测定,中性和酸性多糖的重均分子质量分别为3.78×10 4D和4.94×10 4D,纯度分别为91.16%和90.24%。中性多糖组分由葡萄糖、木糖、甘露糖、半乳糖4 种单糖组成;酸性多糖组分由葡萄糖、木糖、半乳糖、岩藻糖、阿拉伯糖5 种单糖组成。红外光谱证明两种多糖中均含有糖类特征吸收峰,且为α构型的吡喃型多糖。核磁共振氢谱检测又进一步证实了两种多糖均为α构型。
关键词:莲子红衣;多糖;分离纯化;结构表征
高航, 高延芬, 徐虹. 莲子红衣多糖的分离纯化及结构表征[J]. 食品科学, 2016, 37(15): 94-99. DOI:10.7506/spkx1002-6630-201615016. http://www.spkx.net.cn
GAO Hang, GAO Yanfen, XU Hong. Separation, purification and structural characteristics of polysaccharides from red skin of lotus seeds[J]. Food Science, 2016, 37(15): 94-99. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615016. http://www.spkx.net.cn
莲子又名水芝丹,属睡莲科莲属(Nympheaceae nelumbo Adans),是水生蔬菜栽培中的特种挻水宿根经济植物。莲子是中国传统的滋补佳品,具有多种保健功效 [1-2]。莲子的加工通常经过干燥、分级、去壳、去皮心等工序,一般采用手工和机械磨皮两种方式,但是在加工过程中会产生大量莲子壳、莲子红衣等副产物 [3]。经测定,莲子红衣中营养成分和活性物质的含量较高 [3-6],但并未得到有效利用,造成了资源浪费及环境污染。多糖是由单糖聚合形成的糖类,是自然界中分子结构复杂的一类高分子化合物,广泛存在于动物和植物中,它是维持生命机体正常运转的物质之一。植物、海洋生物及菌类等来源的多糖已作为具有生物活性的天然产物中的一个重要类型出现,各种多糖所具有的抗肿瘤、免疫、抗凝血、降血糖和抗病毒活性已相继被发现 [7-9]。据报道,香菇多糖、苦瓜多糖、茶多糖等天然植物多糖表现出了很好的功能性 [10-12],具有极高的开发前景和应用价值。然而到目前为止,虽然国内外对多糖的研究日益重视,但就其研究的层次和水平来说,与蛋白质和核酸相比还有很大的差距。因此,对多糖结构的深入研究将为探讨发展多糖类药物及功能性食品奠定基础。
本研究拟以莲子红衣为原材料,提取莲子红衣多糖,分离纯化后对其分子质量和结构进行表征,以为日后深入探索植物多糖的分子修饰、构效关系以及功能性食品的研发提供理论基础,同时可为莲子红衣的开发利用提供科学指导,使莲子加工副产物得到充分利用,从而减少资源浪费。
1.1 材料与试剂
莲子红衣 湖南三湘贸易有限公司。
DEAE-C 上海金穗生物科技有限公司;Sephadex G-25 美国法玛西亚公司;透析袋 美国GE公司;α-淀粉酶 北京奥博星生物技术有限责任公司;溴化钾、单糖标准品 上海源叶生物科技公司;苯酚 汕头市西陇化工厂有限公司;硫酸、盐酸、乙醇 北京化工厂;氢氧化钠 天津光复科技发展有限公司;三氯乙酸国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
R-3型旋转蒸发器 瑞士Büchi公司;FreeZone-12L美国Labconco公司;层析柱(50 cm×2.6 cm、120 cm×1.6 cm)、DBS-100电脑全自动部分收集器上海沪西分析仪器厂有限公司;Synergy H1全功能酶标仪 美国BioTek公司;高效凝胶色谱分析系统日本岛津公司;DAWN HELEOS-II 型激光多角度散射检测器、Optilab rex示差检测器 美国Wyatt公司;Shodex SB-806M高效凝胶色谱柱 日本Shodex公司;Bruker AV 600核磁共振仪 德国Bruker公司。
1.3 方法
1.3.1 莲子红衣多糖的提取
称取一定量过80 目筛的莲子红衣粉,按一定比例加入蒸馏水,充分搅拌后于恒温水浴锅中加热。待加热到55 ℃时按0.1 mg/g比例加入α-淀粉酶酶解(即每克莲子红衣粉加入0.1 g α-淀粉酶),酶解一定时间后,用电磁炉煮沸10 min,以终止酶继续反应,冷却后抽滤,取滤液加入6%三氯乙酸,在4 000 r/min的条件下离心15 min。取上清液加入5 倍体积的95%乙醇沉降过夜。次日,在4 000 r/min条件下离心15 min,取沉淀物先在-20 ℃预冻,之后冷冻干燥48 h,即得莲子红衣粗多糖。
1.3.2 DEAE-C树脂的预处理
称取所需DEAE-C,用蒸馏水浸泡过夜,每5 h换水一次,且去除上层细小漂浮物,去离子水洗至泡沫很少时为止,滤干,先用0.05 mol/L HCl溶液浸泡过夜,用无离子水漂洗,再改用0.05 mol/L NaOH溶液浸泡过夜,用无离子水洗净,pH试纸检测中性即可使用。
1.3.3 莲子红衣中性和酸性多糖的分离
DEAE-C预处理后上柱。配制8 mg/mL的粗多糖溶液100 mL,滤过0.45 μm滤膜,以2 mL/min速率进样,待上样完毕后,先用去离子水洗脱,使未与阴离子交换剂结合部分流出,即得到中性多糖;后改为0.1 mol/L NaCl 溶液洗脱,使与阴离子交换剂结合部分流出,得到酸性多糖。此后,再分别进行0.3、0.5、0.7、0.9 mol/L NaCl梯度洗脱,但是几乎不再有峰出现,当采用0.1 mol/L的NaOH洗脱时,其对DEAE-C填料的稳定性有影响。因此,仅用0.1 mol/L NaCl溶液进行洗脱。每管洗脱液取200 μL,加入9%的苯酚溶液和硫酸(体积比1∶5),沸水浴20 min,于490 nm波长处测吸光度。绘制管数与吸光度曲线,并按峰型合并阳性部分。
1.3.4 莲子红衣中性多糖的纯化
采用Sephadex G-25层析柱纯化,根据多糖分子质量的不同,可对莲子红衣中性多糖进一步纯化。首先,分别进行流速和上样量的最佳条件选定,然后根据最佳纯化条件进行纯化。将中性多糖溶于1 mL去离子水中,得到30 mg/mL的多糖溶液,用滴管小心加入层析柱中,用去离子水洗脱,流速为0.25 mL/min,同时每5 min收集1 管流出液,根据苯酚-硫酸法绘制洗脱曲线,并按峰型合并洗脱液。
1.3.5 纯度及重均分子质量的检测
采用最佳的洗脱流速和上样量进行分离纯化,隔管通过苯酚-硫酸法测定吸光度并绘制洗脱曲线,按照峰型合并阳性部分,冷冻干燥即得到纯化后的多糖组分。采用凝胶色谱示差检测器和激光多角度散射器检测多糖的纯度和重均分子质量。
凝胶渗透色谱条件:色谱柱为Shodex SB-806M(7.8 mm×300 mm);流动相为0.1 mol/L硝酸钠溶液;流速为0.5 mL/min;柱温为40 ℃;进样体积为200 ☒L;检测器为示差器及激光多角度散射检测器。
1.3.6 莲子红衣多糖的单糖组成分析 [13-15]
分别移取7 种标准单糖溶液与NaOH溶液混合均匀。取混合后的溶液100 μL于5 mL的具塞试管中,加0.5 mol/L的1-苯基-3-甲基-5-吡唑啉酮甲醇溶液漩涡式混匀,在75 ℃的恒温鼓风干燥箱中反应2 h,取出后冷却至室温。随后加入0.3 mol/L的盐酸溶液10 mL中和,蒸干。加入氯仿和水各2 mL,混合摇匀,待分层后弃去氯仿层,重复萃取3 次后即可进样。
移取100 μL质量浓度为2 mg/mL的多糖样品,加入100 μL三氟乙酸,充氮气封管,在恒温鼓风干燥箱中110 ℃水解2 h,冷却至室温后加200 μL甲醇溶液后旋转蒸干,重复操作以去除三氟乙酸,之后加入NaOH溶液将残渣充分溶解,然后再加入100 μL的1-苯基-3-甲基-5-吡唑啉酮甲醇溶液,在恒温鼓风干燥箱中70 ℃反应2 h,冷却后完成中和、萃取操作即可进样。
高效液相色谱(high performance liquid chromatography,HPLC)检测条件:Shodex SB-230色谱柱(8.0 mm×300 mm);柱温:30 ℃;流速:1.0 mL/min;流动相A:高纯水,流动相B:乙腈,流动相A与B(83∶17,V/V);进样量:10 μL。
1.3.7 莲子红衣多糖的红外光谱分析
分别称取分离纯化后得到的中性多糖及酸性多糖,各按质量比1∶100的比例与干燥的KBr混匀,在玛瑙研钵中研磨5~10 min。混合压膜,测定波数在4 000~400 cm -1的红外光谱,实验中均采用干燥的KBr作为背景。
1.3.8 莲子红衣多糖的核磁共振氢谱分析
将一定量的两个多糖纯品分别溶于D 2O中,在293 K温度下进行600 Hz的核磁共振仪分析。
2.1 莲子红衣中性和酸性多糖的分离结果

图1 莲子红衣中性多糖(Ⅰ)和酸性多糖(Ⅱ)在DEAEE--CC树脂上的洗脱曲线
Fig. 1 Elution curve of water-soluble crude polysaccharides on DEAE-C column
按照1.3.3节方法将莲子红衣粗多糖经DEAE-C离子交换层析分离后,采用苯酚-硫酸法隔管测定糖含量并作与所对应管号的曲线图。由图1可知,7~27 管内的多糖是未与阴离子交换剂结合的部分,经合并,冻干,为中性多糖,得到28 mg;59~75 管为0.1 mol/L NaCl洗脱部分,经合并,搅拌透析48 h,中间换水一次,冻干,为酸性多糖,得到25 mg,所得中性多糖的提取率为13.56%,酸性多糖的提取率为8.49%。
2.2 凝胶柱层析的纯化结果
2.2.1 洗脱流速的选择
以葡聚糖凝胶Sephadex G-25为分离介质,上样1 mL,在30 mg/mL恒定上样量条件下,选择0.1、0.25、0.4 mL/min这3 种流速以确定纯化中性多糖的最佳分离条件。从图2可以看出,在选定的3 个流速下均能使阳性部分分离开来。但在0.10 mL/min的流速下,分离时间较长;0.25 mL/min能将时间缩短近一半,且分离效果较好;0.40 mL/min流速下,可在较短时间内完成分离,但是阳性部分出现拖尾现象。因此最终选择流速为0.25 mL/min进行纯化。

图2 不同流速的洗脱曲线
Fig. 2 Elution curves of the neutral polysaccharide at different flow rates
2.2.2 上样量的选择
以葡聚糖凝胶Sephadex G-25为分离介质,在0.25 mL/min的恒定流速下,选择15、30、45 mg/mL这3 种上样量以确定最佳分离条件。由图3可知,3 种上样量均可使中性多糖完全分离,但当上样量为15 mg/mL时,为达到目标样品量,所需纯化次数较多,耗时较长。当上样量为45 mg/mL时,与其他峰间隔较小,且有轻微的拖尾现象。为保证实验重现性及准确性,最终选定30 mg/mL为最佳上样量。
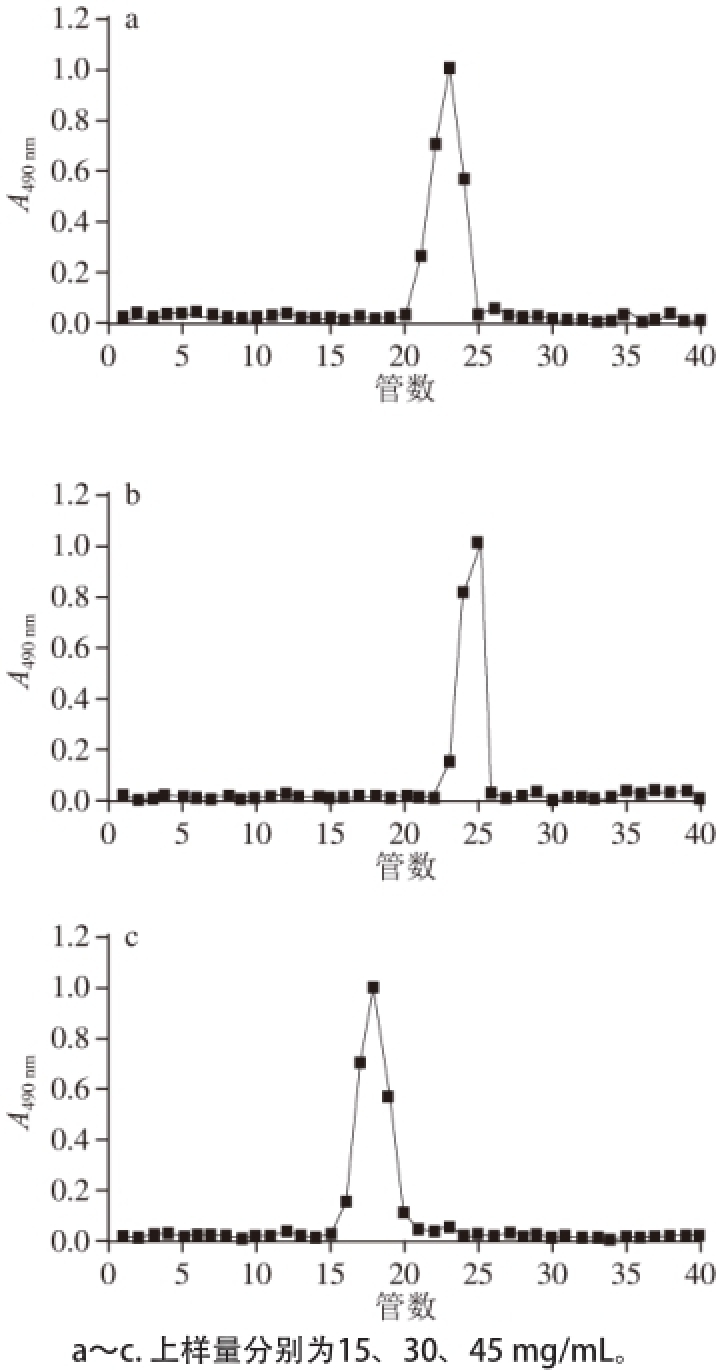
图3 不同上样量的洗脱曲线
Fig. 3 Elution curves of the neutral polysaccharide at different sample loading amounts
2.3 高效凝胶柱层析的纯化结果

图4 莲子红衣中性多糖(a)和酸性多糖(b)的高效渗透凝胶图谱
Fig. 4 GPC chromatograms of the neutral (a) and acidic (b) polysaccharides
如图4可知,曲线Ⅰ显示的是DAWN HELEOS-Ⅱ型激光多角度散射检测器的信号,测定的是各个组分分子质量的大小;曲线Ⅱ显示的是Optilab rex示差检测器的信号,测定各个组分质量浓度。中性多糖(图4a)包含两种分子质量组分,保留时间分别为15 min和20 min。但从曲线Ⅱ得知,保留时间为15 min的物质,分子质量较大,但含量极少;而保留时间为20 min的物质,含量极高。酸性多糖(图4b)中也存在大分子物质,但含量较低。此外,通过示差信号显示出的两种多糖的图谱分别为单一对称峰,进一步说明了均一性良好。通过曲线积分面积分别计算得出中性及酸性多糖的纯度分别为91.16%和90.24%。由激光信号测得重均分子质量分别为3.78×10 4D和4.94×10 4D,分散系数为1.12,均一性较好。
2.4 莲子红衣中性和酸性多糖的单糖组成分析
从化学结构上分析,酸性多糖链除了含酸性基团外,可能还含有中性单糖或碱性单糖。至于酸性多糖中酸性基团和比例或者其酸度目前都没有明确规定,文献[16]中一般把含有酸性基团的多糖都称为酸性多糖。由图5及表1可知,酸性多糖较中性多糖来说,成分较为复杂,而酸性多糖中含有的阿拉伯糖等也均为酸性糖,中性多糖中则以葡萄糖为主,而酸性多糖以木糖为主,同时葡萄糖所占比例也较高。
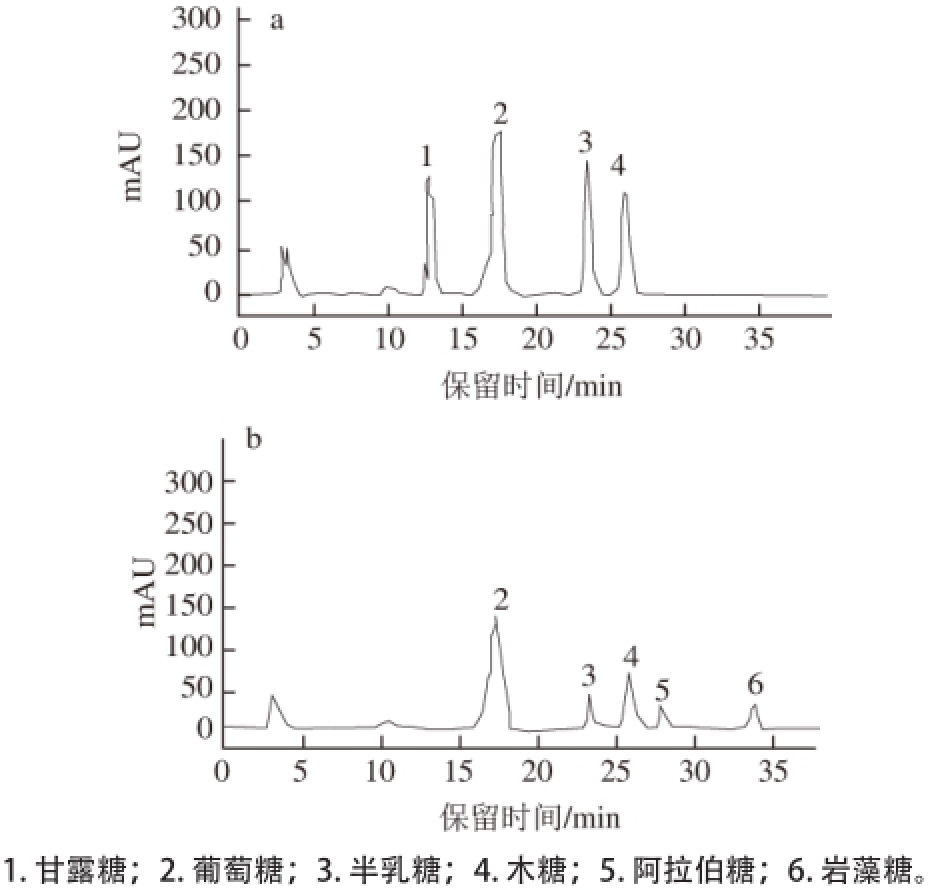
图5 莲子红衣中性多糖(a)和酸性多糖(b)的单糖组成色谱图
Fig. 5 Monosaccharide composition analysis of the neutral (a) and acidic (b) polysaccharides
表1 莲子红衣中性和酸性多糖的单糖组成及含量
Table 1 Monosaccharide compositions of the neutral and acidic polysaccharidesrides mg/g

注:—.未检出。
多糖种类鼠李糖岩藻糖阿拉伯糖木糖甘露糖葡萄糖半乳糖中性多糖——21.96719.97678.24120.351酸性多糖—0.0761.97613.186—10.3863.540
2.5 莲子红衣中性和酸性多糖的红外光谱分析

图6 莲子红衣中性多糖(a)和酸性多糖(b)的红外光谱
Fig. 6 Infrared absorption spectra of the neutral (a) and acidic (b)polysaccharides
由图6可知,3 300 cm -1左右出现的宽峰为糖类物质O—H的伸缩振动(γ OH);2 900 cm -1左右出现的峰为烷基中C—H键的伸缩振动(γ CH),1 360 cm -1附近出现C—H的弯曲振动峰(δ CH)为旁证,而酸性多糖中未出现该峰,说明不存在亚甲基或甲基;在1 400~1 200 cm -1
范围内所看到的不太尖的吸收峰1 361.23 cm -1是C—H的变角振动;1 640 cm -1附近的峰为酯羰基中C—O键的伸缩振动峰(γ CO);1 148、1 076、997 cm -1左右出现了较强的3 个吸收峰,在1 100~1 000 cm -1范围内出现3 个强峰为吡喃环的特征吸收峰,其中1 077 cm -1和997 cm -1为吡喃糖环的醚键(C—O—C)伸缩振动和羟基(C—O—H)的吸收峰;928 cm -1附近的吸收峰也进一步证实了吡喃糖中糖苷键C—O—C为非对称环;红外光谱在890 cm -1附近无吸收峰,而在848 cm -1有吸收峰,这也是存在α-D-吡喃糖的旁证。另外,在875 cm -1和810 cm -1无吸收峰,表明不含甘露吡喃糖和半乳吡喃糖。而759 cm -1的吸收峰也再次证实了其结构中含有吡喃糖。
2.6 莲子红衣中性和酸性多糖的核磁共振氢谱分析
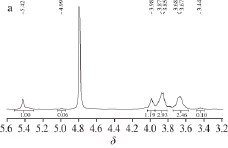

图7 莲子红衣中性多糖(a)和酸性多糖(b)的核磁共振氢谱
Fig. 7
1H-NMR spectra of the neutral (a) and acidic (b) polysaccharides
核磁共振波谱法是利用自旋原子核在外磁场作用下的核自旋能级间跃迁所吸收的电磁波谱来研究化合物结构与组成的分析方法。核磁共振氢谱主要解决多糖结构中糖苷键构型及结构中氢个数比的问题,但是由于非异头质子化学位移δ相近,且有部分重叠现象,使多数质子信号较难解析。一般来说,α构型糖苷的异头质子的化学位移δ大于5.0,而β构型的异头质子的化学位移δ小于5.0 [17],由图7可知,中性和酸性多糖组分为α构型。
本实验采用的多糖分离纯化方法简单可靠,中性多糖提取率为13.56%,酸性多糖提取率为8.49%。由于中性及酸性多糖具有不同的功能性,因而众多学者将其进行分离纯化。芮海云等 [18]研究显示白芨中性多糖能有效清除羟自由基(·OH),并呈量效关系;对D-半乳糖所致小鼠体质量负增长和体内超氧化物歧化酶(superoxide dismutase,SOD)活性下降有显著抑制作用。刘晓宇 [19]的研究显示,经硫酸化和羧甲基化修饰的黄药子中性多糖可以有效抑制肿瘤细胞的增殖。酸性多糖由于含有糖醛酸这一特殊结构,使得其具有特殊生理活性。另有研究显示,酸性多糖具有明显的抗炎活性、抗氧化活性等,且随其糖醛酸含量的增加逐渐增强 [20-21]。
对于多糖的纯化步骤,木瓜蛋白酶-Sevag法效果最好,反应较温和,可同时实现高蛋白脱除率和低多糖损失率的目标 [18],然而受到木瓜蛋白酶价格昂贵等多种因素影响,三氯乙酸法目前也成为脱除多糖中蛋白的常用方法 [19]。本研究采用了DEAE-C柱层析将中性和酸性多糖分离出来,虽然纯度有了一定的提高,但是仍存在一些杂质。因而又使用葡聚糖凝胶Sephadex G-25凝胶柱进行纯化精制,纯度可达到较高的水平。
多糖的结构检测手段很多,本研究主要采用凝胶渗透色谱的方法分析了莲子红衣多糖的分子质量及纯度,通过本实验方法得到的多糖均一性较好;红外光谱及核磁共振分析了其糖键结构,表明莲子红衣多糖具有糖类物质的特征吸收峰且为α构型;采用衍生的方法分析了其单糖组成,为莲子红衣多糖产品的开发和利用提供了理论依据。
目前对于多糖的研究多集中在其特征官能团和单糖组成方面,但是对于多糖糖苷键构型、连接方式等的研究上还远远不够 [20],这一原因主要是由于分析以上两种结构的步骤繁琐,并且多糖甲基化方法分析糖苷键构型中,多糖不能完全甲基化也是研究中的一个瓶颈问题。此外,受到不同研究者选用的原料不同、分离提取方法不同等因素的影响,得到的单糖组成及含量会有一定的差异 [21-22]。对于多糖的纯度检测,由于目前尚未找到合适的标准品,因此通过各种检测方法得到的多糖纯度仍然是较为粗略的结果,日后也期待找到更加方便、重复性更高的方法以解决多糖的结构解析。
参考文献:
[1] 吴芳彤, 肖贵平. 莲子的营养保健价值及其开发应用[J]. 亚热带农业研究, 2013, 8(4): 274-278.
[2] 李卓瓦. 莲子的营养价值及加工利用[J]. 农产品加工(学刊),2008(6): 42-43. DOI:10.3969/j.issn.1671-9646-B.2008.06.013.
[3] 曹杨, 徐虹, 王静, 等. 莲天然产物及其生物活性研究进展[J]. 食品工业科技, 2012, 33(8): 402-405.
[4] 徐虹, 朱雨薇, 曹杨, 等. 莲子红皮多糖提取工艺研究[J]. 食品工业科技, 2011, 32(2): 266-268.
[5] 徐虹, 王馨仪, 曹杨, 等. 莲子红皮蛋白微波辅助盐提工艺优化[J].食品科学, 2011, 32(4): 87-91.
[6] 高航, 高延芬, 徐虹. 莲子红衣醇提物的抗氧化和抗褐变活性[J]. 食品科学, 2013, 34(11): 83-87.
[7] 林俊, 李萍, 陈靠山. 近5 年多糖抗肿瘤活性研究进展[J]. 中国中药杂志, 2013, 38(8): 1116-1125. DOI:10.4268/cjcmm20130802.
[8] 申利红, 王建森, 李雅, 等. 植物多糖的研究及应用进展[J]. 中国农学通报, 2011, 27(2): 349-352.
[9] 齐素芬, 张华峰, 姚美, 等. 苯酚-硫酸法测定花椒叶多糖含量[J]. 食品科学技术学报, 2014, 32(6): 53-59. DOI:10.3969/j.issn.2095-6002.2015.04.008.
[10] ZHANG Yangyang, LI Sheng, WANG Xiaohua, et al. Advances in lentinan: isolation, structure, chain conformation and bioactivities[J]. Food Hydrocolloids, 2011, 25(2): 196-206. DOI:10.1016/ j.foodhyd.2010.02.001.
[11] PANDA B C, MONDAL S, DEVI S P, et al. Pectic Polysaccharide from the green fruits of Momordica charantia (Karela): structural characterization and study of immunoenhancing and antioxidant properties[J]. Carbohydrate Research, 2015, 401(4): 24-31. DOI:10.1016/j.carres.2014.10.015.
[12] XU Renjie, YE Hong, SUN Yi, et al. Preparation, preliminary characterization, antioxidant, hepatoprotective and antitumor activities of polysaccharides from the flower of tea plant (Camellia sinensis)[J]. Food and Chemical Toxicology, 2012, 50(7): 2473-2480. DOI:10.1016/j.fct.2011.10.047.
[13] LI Jinwei, FAN Liuping, DING Shaodong. Isolation, purification and structure of a new water-soluble polysaccharide from Zizyphus jujuba cv. JinSiXiaoZao[J]. Carbohydrate Polymers, 2011, 83(2): 477-482. DOI:10.1016/j.carbpol.2010.08.014.
[14] 刘芳, 陈贵堂, 胡秋辉, 等. 金针菇锌多糖分离纯化及其结构特征[J].食品科学, 2014, 35(5): 1-7. DOI:10.7506/spkx1002-6630-201405001.
[15] 王强, 李盛钰, 杨帆, 等. 玉竹中性多糖的分离纯化及单糖组成分析[J].食品科学, 2010, 31(15): 100-102.
[16] 熊双丽, 李安林. 酸性多糖的最新研究进展[J]. 食品科技, 2010,35(5): 80-83.
[17] 刘微微, 刘旭, 曹学丽. 白背三七多糖的分离纯化[J]. 食品科学,2011, 32(23): 58-63.
[18] 芮海云, 吴国荣, 陈景耀, 等. 白芨中性多糖抗氧化作用的实验研究[J].南京师范大学学报(自然科学版), 2003, 27(4): 94-98. DOI:10.3969/ j.issn.1001-4616.2003.04.020.
[19] 刘晓宇. 黄药子中性多糖的结构分析及其抗肿瘤活性研究[D]. 长春: 东北师范大学, 2013.
[20] 王莹莹, 熊双丽, 史敏娟, 等. 夏枯草酸性多糖的理化性质分析及活性分析[J]. 精细化工, 2012, 29(5): 476-481.
[21] 朱燕, 陈运喜, 吴俊华, 等. 中华芦荟酸性多糖的分离纯化与抗炎活性[J]. 中国天然药物, 2007, 5(3): 197-200.
[22] 朱泉, 韩永斌, 顾振新, 等. 百合多糖研究进展[J]. 食品工业科技,2012, 33(11): 370-374.
Separation, Purification and Structural Characteristics of Polysaccharides from Red Skin of Lotus Seeds
GAO Hang
1, GAO Yanfen
2, XU Hong
1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology and Business University, Beijing 100048, China; 2. Shenzhen Nongke Group Co. Ltd.,Shenzhen 518040, China)
Abstract:The crude polysaccharides isolated from the red skin of lotus seeds by enzymatic extraction and ethanol precipitation were separated into neutral and acidic polysaccharides by DEAE-C column chromatography and subsequent Sephadex G-25 gel column chromatography. Gel permeation chromatography (GPC) analysis showed that the molecular weights of the neutral and acidic polysaccharides were 3.78 × 10 4D and 4.94 × 10 4D with a purity of 91.16% and 90.24%,respectively. The neutral polysaccharide was composed of 4 monosaccharides including glucose and xylose, while the acidic polysaccharide was mainly composed of 5 monosaccharides including glucose, xylose and galactose. Infrared spectra preliminarily confirmed that both purified fractions were pyranoses with α configuration. This conclusion was further proved by nuclear magnetic resonance.
Key words:red skin of lotus seeds; polysaccharide; separation and purification; structural characterization
DOI:10.7506/spkx1002-6630-201615016
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)15-0094-06
收稿日期:2015-09-20
基金项目:北京市自然科学基金项目(6162003);北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20130506)作者简介:高航(1992—),女,硕士研究生,研究方向为功能性食品。E-mail:gaohang0928@163.com
*通信作者:徐虹(1977—),女,副教授,博士,研究方向为食品营养与安全。E-mail:xuhong@th.btbu.edu.cn
引文格式: