唐骥龙 1,闫亚美 1,2,*,曹有龙 2,*,曾晓雄 1,孙 怡 1,胡 冰 1,周 莉 1
(1.南京农业大学食品科技学院,江苏 南京 210095;2.国家枸杞工程技术研究中心,宁夏 银川 750004)
摘 要:以黑果枸杞为原料,利用ÄKTA Purifier蛋白纯化系统分离纯化得到1 种纯度97%以上的花色苷物质。通过质谱和核磁共振分析,鉴定该花色苷物质为矮牵牛素3-O-芸香糖(反式-香豆酰基)-5-O-葡萄糖苷(petunidin 3-O-[rhamnopyranosyl-(trans-p-coumaroyl)]-5-O-(β-D-glucopyranoside)。体外抗氧化活性分析表明该花色苷物质具有显著的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基(O 2 -·)清除能力。
关键词:黑果枸杞;花色苷;纯化;结构鉴定;抗氧化活性
唐骥龙, 闫亚美, 曹有龙, 等. 黑果枸杞中一种花色苷类物质的分离纯化及抗氧化活性[J]. 食品科学, 2016, 37(15): 113-117. DOI:10.7506/spkx1002-6630-201615019. http://www.spkx.net.cn
TANG Jilong, YAN Yamei, CAO Youlong, et al. Purification and antioxidant activity of an anthocyanin from Lycium ruthenicum Murray[J]. Food Science, 2016, 37(15): 113-117. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615019. http://www.spkx.net.cn
天然花色苷类色素在自然界分布广泛且安全无毒,大量体内外研究表明花色苷具有较强的抗氧化活性,主要表现在抗炎、保护心血管、抗肿瘤等方面 [1-3]。黑果枸杞(Lycium ruthenicum Murray)为茄科(Solanceae)枸杞属(Lycium L.)植物,果实黑色,是近年来新发掘的多年生耐盐、抗旱野生枸杞资源,主要分布于宁夏、新疆、西藏、青海、内蒙、甘肃等地。黑果枸杞成熟浆果中富含花色苷,花色苷的功效作用及营养价值特别是其抗氧化及防治心脑血管疾病的功效,已被社会公众所认同和接受,成为研究的热点 [4-7]。
花青素化合物属于黄酮类物质,Castaneda-Ovando等 [8]报道了在自然界天然色素通常为天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)、飞燕草色素(delphinidin)、芍药花色素(peonidin)、矮牵牛花色素(petunidin)以及锦葵色素(malvidin)。李进 [9]、李淑珍 [10]等对黑果枸杞色素的提取和精制工艺进行了研究,得到以体积分数80%的乙醇(酸性)能较好地提取黑果枸杞色素,并筛选出AB-8大孔树脂能较好地分离黑果枸杞中的花色苷类物质。闫亚美等 [6]通过体外抗氧化实验得出黑果枸杞中的花色苷具有较强的抗氧化活性。Zheng Jie等 [1]利用高效液相色谱电喷雾串联质谱(high performance liquid c hromatography-electrospray ionizationmass spectrometry,HPLC-ESI/MS)分离并检测了黑果枸杞中的花色苷并初步分析了其结构和抗氧化活性,Jin Hongli等 [11-12]利用XCharge C8SAX色谱柱有效地分离出黑果枸杞中同种花色苷的顺反结构单体。基于前期研究基础,本研究通过带二极管矩阵检测器的高效液相色谱(high-performance liquid chromatography-diode array detector,HPLC-DAD)分析黑果枸杞花色苷的组成,参考苦丁茶中咖啡酰类物质的分离纯化方法 [13],利用ÄKTA Purifier蛋白纯化系统分离纯化黑果枸杞花色苷中主要的矮牵牛花色苷;通过质谱(mass spectrometry,MS)、核磁共振仪(nuclear magnetic resonance,NMR)解析其结构,并通过体外抗氧化实验分析其抗氧化活性。
1.1 材料与试剂
黑果枸杞鲜果,采摘于宁夏银川国家枸杞工程技术研究中心资源圃并于-20 ℃环境下保存。
AB-8大孔吸附树脂 南开大学化工厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三氟乙酸(trifluoroacetic acid,TFA)、氯化硝基四氮唑蓝(nitroblue tetrazolium,NBT)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)美国Sigma公司;乙腈、甲醇和甲酸(色谱纯) 江苏汉邦科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BL-220H分析天平 日本岛津公司;真空旋转蒸发仪 德国Heidolph公司;冷冻干燥机 美国Labconco公司;Synergy-2酶标仪 美国BioTek公司;Agilent 1100型高效液相色谱仪(包括G1311A 四元泵、G1379A真空脱气机、G1316A 柱温箱、G1315BDAD和化学工作站)、Agilent G24450型HPLC-ESI/MS 美国Agilent公司;TSKgel ODS-80 TsQA色谱柱(4.6 mm×250 mm,5 μm) 日本Tosoh公司;YMC-PACK ODS-A色谱柱(20 mm×250 mm,5 μm) 日本YMC公司;ÄKTA Purifi er蛋白纯化系统 美国通用电气公司;Bruker DRX Avance核磁共振仪(500 MHz) 德国Bruker公司;DHL-B电脑恒流泵、DBS-100电脑全自动部分收集器上海青浦沪西仪器厂。
1.3 实验方法
1.3.1 黑果枸杞花色苷粗提物的制备
准确称量20 g黑果枸杞鲜果以料液比1∶40(m/V)加入体积分数80%乙醇(含体积分数0.1%甲酸)800 mL,50 ℃水浴浸提3 h后用滤纸过滤,将滤液用真空旋蒸仪旋蒸,旋蒸温度为45 ℃,基本旋干后用体积分数0.5% TFA溶液定容至10 mL。参照Xi Lishan等 [14]方法,将10 mL旋蒸液上样于AB-8大孔树脂层析柱(5 cm×30 cm),先通过去离子水洗脱两个柱体积,再用体积分数95%(pH 2.0)的乙醇溶液洗脱,流速控制在2 mL/min,收集颜色较深的洗脱液并用真空旋蒸仪旋干,用含0.1% TFA溶液稀释至50 mL即得到黑果枸杞花色苷粗提物。
1.3.2 花色苷单体的制备
将花色苷粗提物经0.45 μm微孔膜过滤后,利用ÄKTA纯化系统制备花色苷单体。YMC-PACK ODS-A色谱柱,检测波长为280 nm,每管收集5 mL;洗脱液流动相:体积分数4%甲醇+19%乙腈+1%甲酸溶液,流速2 mL/min,通过紫外检测器的实时监测并收集洗脱液,多次上样,富集出峰时间相同的物质,用HPLC分析出纯度较高的组分,将其合并、浓缩并冷冻干燥。
1.3.3 HPLC-DAD分析
使用Agilent 1100 HPLC系统,检测器DAD,色谱柱TSKgel ODS-80 TsQA,柱温35 ℃,检测波长530 nm和280 nm,进样体积20 μL;采用梯度洗脱,流动相A:体积分数1%甲酸+0.1% TFA溶液,流动相B:体积分数15%甲醇-乙腈溶液,梯度洗脱条件如下:0 min 15% B,10 min 30% B,20 min 50% B,流速控制在0.6 mL/min。
1.3.4 HPLC-DAD/MS检测
用去离 子水溶解适量花色苷单体,过0.45 μm微孔滤膜,即为分析用液。HPLC分析条件同上。质谱条件:ESI,正离子检测,扫描范围m/z 0~2 000,雾化气体为氮气,流速为2 mL/min,电离电压为4.5 kV,锥孔电压为25 V,离子源温度250 ℃。
1.3.5 NMR分析
将花色苷单体溶于氘代甲醇(CD 3OD)中,V arian 500进行 1H NMR分析,操作温度为300 K。
1.3.6 花色苷单体化合物的体外抗氧化活性测定
1.3.6.1 DPPH自由基清除能力测定
参照Hu Bing [15]、Liu Ying [16]等报道的方法并略做改动,用无水乙醇配制0.4 mmol/L的DPPH溶液,取一定质量浓度梯度(0.01、0.02、0.05、0.10、0.15、0.20、0.35、0.50 mg/mL)的样品25 μL与150 μL的DPPH溶液分别加入到96 孔板,30 ℃条件下暗反应30 min,通过酶标仪测定反应体系在517 nm波长处的吸光度。IC 50用来表示清除率达到50%的样品质量浓度。
式中:A 0为以水代替样品溶液实验组的吸光度;A 2为以乙醇代替DPPH溶液实验组的吸光度;A 1为样品与DPPH反应后的吸光度。
1.3.6.2 超氧阴离子自由基(O 2 -·)清除能力测定
采用Beauchamp等 [17]方法,略做改动,0.1 mol/L、pH 7.4的磷酸盐缓冲液(phosphate buffer saline,PBS)配制156 μmol/L NBT溶液、468 μmol/L NADH溶液、60 μmol/L吩嗪硫酸甲酯溶液(phenazine methosulphate,PMS)。取50 μL一定质量浓度梯度(0.02、0.05、0.10、0.15、0.20、0.35、0.50 mg/mL)样品+50 μL NBT+50 μL NADH+ 50 μL PMS于96 孔板,混匀反应体系,25 ℃水浴5 min,通过酶标仪测定560 nm波长处测吸光度。
式中:A 0为以水代替样品实验组的吸光度;A 2为以磷酸盐缓冲液代替NBT溶液实验组的吸光度;A 1为样品参与的吸光度。
1.4 统计分析
采用Origin 8.0、SPSS 19.0、MestReNova软件,利用方差分析(analysis of variance,ANOVA)进行实验数据处理及分析,P<0.01为差异极显著。
2.1 黑果枸杞花色苷单体的分离纯化
黑果枸杞通过浸提、过滤、浓缩、AB-8大孔树脂处理,得到花色苷粗提物。粗提物按照1.3.3节方法进行HPLC分析,结果如图1。黑果枸杞中含有一种含量较高、在280 nm和530 nm波长处有较高吸收峰的花色苷物质(P1)。
通过ÄKTA蛋白纯化系统和YMC-PACK ODS-A色谱柱(20 mm×250 mm,5 μm)对花色苷粗提物进行分离纯化(图2),将不同出峰时间的收集物按1.3.2节方法进行HPLC分析发现第9、10两管收集的组分纯度很高(97%以上),在相同的HPLC条件下的出峰时间(图3)与粗提物中含量最高的花色苷类物质P 1(图1)相同,可以确定通过ÄKTA系统成功将黑果枸杞中的花色苷类物质P1分离纯化,得到纯度较高的该花色苷单体。
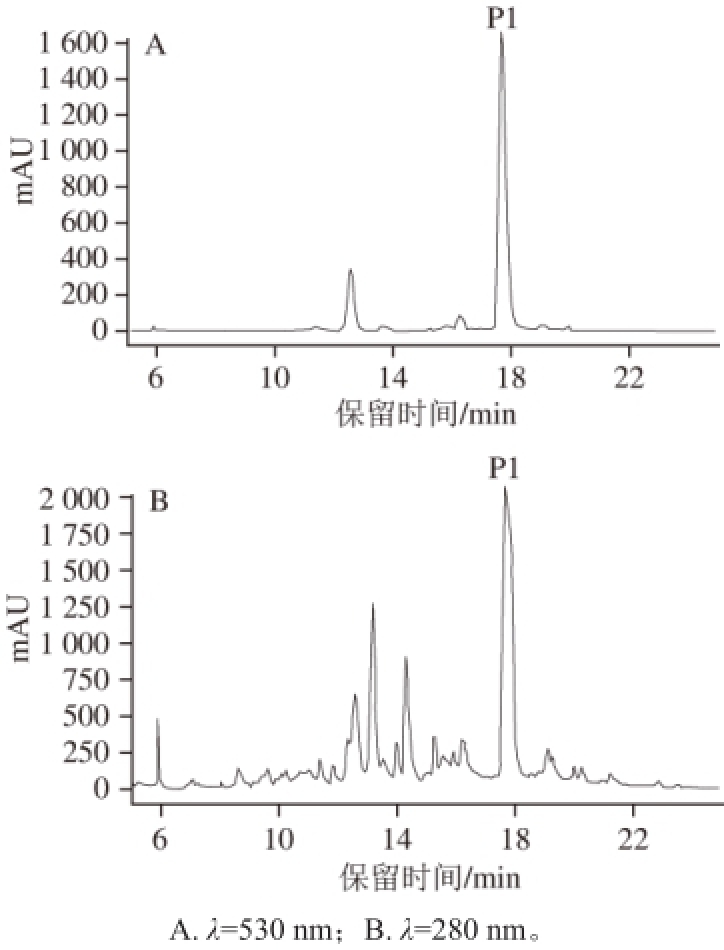
图1 黑果枸杞粗提物的HPLCC色谱Fig. 1 HPLC chromatogram of the crude extract from Lycium ruthenicum Murray fruit

图2 黑果枸杞粗提物经☒KTA蛋白纯化系统分离纯化的色谱图
Fig. 2 Chromatogram of the crude extract from Lycium ruthenicum Murray fruits by ☒KTA protein purification system
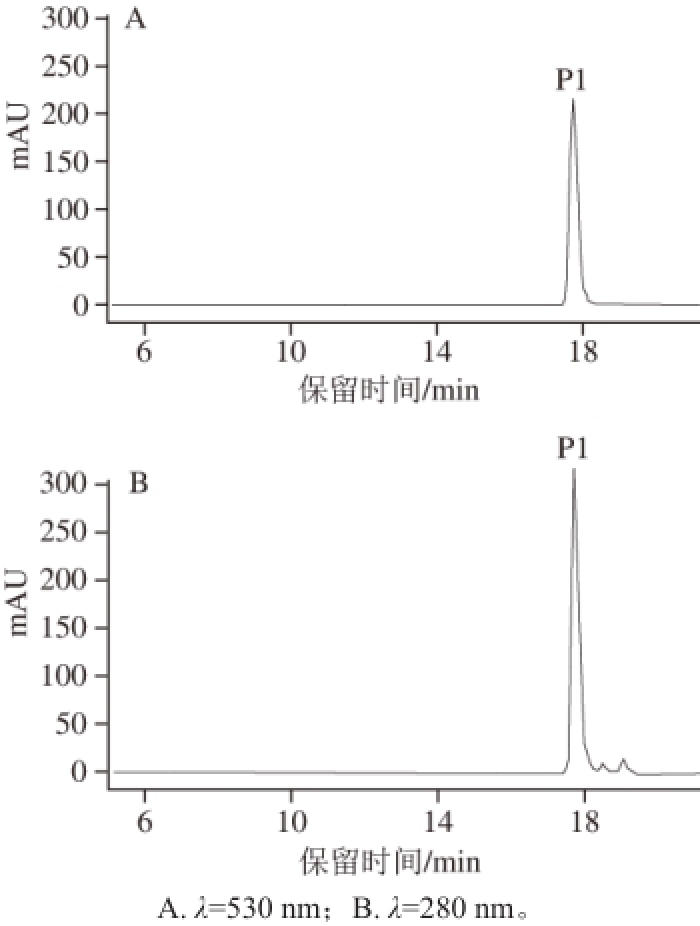
图3 P1的HPLC色谱图
Fig. 3 HPLC chromatogram of P1
2.2 花色苷类物质P1的结 构解析
将样品P1溶解过膜进行HPLC-DAD/MS分析,得到化合物P1的一级质谱(图4)和二级质谱图(图5)。通过图4可得化合物P1([M+H] +)m/z 933.4,从图5可看出其共有3 个分子片段, m/z 771.3 (M-162)表明P1失去一分子葡萄糖(m/z 162);m/z 479.1(M-308-146)表明P1失去了一分子的香豆酸(m/z 146)和一分子的芸香糖(m/z 308);m/z 317.1(M-308-146-162)表明P1拥有一个矮牵牛素配基(m/z 317) [18-20],目前为止对黑果枸杞的研究表明黑果枸杞中的花色苷主要是矮牵牛素花色苷、飞燕草素花色苷和锦葵素花色苷 [12],且矮牵牛素花色苷的含量远多于其他种类的花色苷 [1]。综上可认定花色苷类物质P1为矮牵牛素花色苷的衍生物,通过计算可得其分子式为C 43H 49O 23。
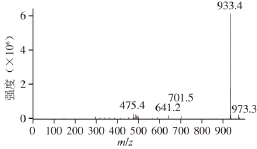
图4 P1的一级质谱图
Fig. 4 Mass spectrum of P1
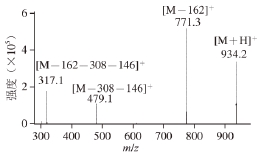
图5 P1的二级质谱图
Fig. 5 MS/MS spectrum of P1
通过MestReNova分析化合物P1核磁数据[ 1H NMR(500 MHz, CD 3OD): δ 8.95 (s, 1H), 8.08 (d, J = 5.2 Hz, 1H),7.99 (s, 1H), 7.82 (s, 1H), 7.63 (d, J = 6.3 Hz, 1H), 7.61~7.58(m, 1H), 7.55 (s, 1H), 7.48~7.45 (m, 1H), 7.42 (d, J = 8.6 Hz,1H), 7.04 (d, J = 19.3 Hz, 1H), 6.81 (dd, J = 8.7, 2.4 Hz, 1H),6.76 (d, J = 1.9 Hz, 1H), 6.74 (dd, J = 3.7, 2.0 Hz, 1H), 6.71 (d,J = 2.0 Hz, 1H), 6.66 (t, J = 2.8 Hz, 1H), 6.64 (d, J = 2.0 Hz,1H), 6.36 (s, 1H), 6.33 (s, 1H), 6.29 (dd, J = 6.6, 2.1 Hz, 1H),6.26 (s, 1H), 6.23 (s, 1H), 6.10 (d, J = 2.0 Hz, 1H), 6.07 (d, J = 2.0 Hz, 1H), 5.50 (d, J = 6.8 Hz, 1H), 5.19 (d, J = 7.1 Hz,1H) , 4.98 (d, J = 3.1 Hz, 1H), 4.96 (s, 1H), 4.93 (s, 1H), 4.90(d, J = 4.1 Hz, 1H), 4.82 (s, 29H), 4.71 (s, 1H), 4.04 (s, 1H),4.02 (s, 1H), 4.00 (d, J = 4.7 Hz, 1H), 3.95 (s, 1H), 3.91~3.86(m, 1H), 3.82 (d, J = 2.8 Hz, 1H), 3.73 (s, 1H), 3.56 (s, 1H),3.51 (s, 1H), 3.49 (s, 1H), 3.47 (d, J = 3.6 Hz, 1H), 3.45 (s,1H), 3.43 (s, 1H), 3.41 (s, 1H), 3.38 (s, 1H), 3.29 (s, 1H), 3.28(s, 1H), 3.26 (s, 1H), 3.24 (s, 1H), 1.99 (s, 1H), 1.94 (s, 1H),1.13~1.10 (m, 1H), 1.00 (d, J = 6.3 Hz, 1H)]和根据有关报道花青素顺反结构的异同主要体现在 1H NMR谱耦合常数的差异,参考相关文献[1,11,21-25]鉴定P1为矮牵牛素3-O-芸香糖(反式-香豆酰基)-5-O-葡萄糖苷,其结构如图6所示。

图6 矮牵牛素33--O-芸香糖(反式-香豆酰基)--55--O-葡萄糖苷的结构图
Fig. 6 Struc ture of petunidin 3-O-[rhamnopyranosyl-(trans-pcoumaroyl)]-5-O-[β-D-glucopyranoside]
2.3 花色苷类物质P1的体外抗氧化活性
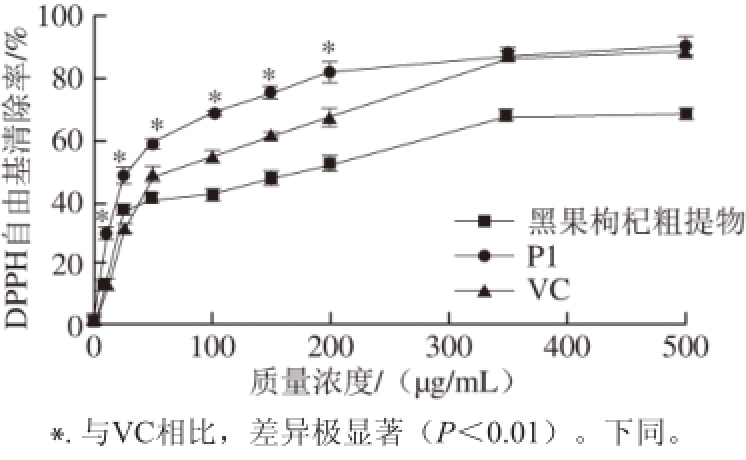
图7 P1、黑果枸杞粗提物、VC对DPPH自由基的清除能力
Fig. 7 Scavenging activities of P1, crude extract and VC on DPPH free radicals
以抗坏血酸(VC)为阳性对照,对比花色苷类物质P1与黑果枸杞粗提物的体外抗氧化能力,从图7可以看出,在0~300 μg/mL质量浓度范围内花色苷P1对DPPH自由基的清除能力极显著强于VC和黑果枸杞粗提物(P<0.01),其IC
50为32.5 μg/mL;在300~500 μg/mL质量浓度范围内P1对DPPH自由基的清除能力相对于VC无显著性差异,但P1对DPPH自由基的清除能力仍极显著高于黑果枸杞粗提物(P<0.01)。从图8可以看出,P1相对于黑果枸杞粗提物、VC之间对
 的清除率均有极显著性差异(P<0.01),P1对
的清除率均有极显著性差异(P<0.01),P1对
 的清除作用明显强于黑果枸杞粗提物和VC,其IC
50为106.5 μg/mL。因此,经分离纯化后的花色苷单体化合物P1具有显著的清除DPPH自由基和
的清除作用明显强于黑果枸杞粗提物和VC,其IC
50为106.5 μg/mL。因此,经分离纯化后的花色苷单体化合物P1具有显著的清除DPPH自由基和
 的能力。
的能力。
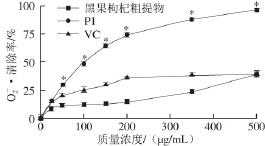
图8 P1、黑果枸杞粗提物、
 ·的清除能力
·的清除能力
Fig. 8 Scavenging activities of P1, crude extract and VC on superoxide anion free radicals
利用AB-8大孔树脂柱层析、ÄKTA Purifier蛋白纯化系统、YMC-PACK ODS-A色谱柱从黑果枸杞中分离纯化了一种高含量的花色苷类物质P1,经HPLC-MS和NMR分析P1为矮牵牛素3-O-芸香糖(反式-香豆酰基)-5-O-葡萄糖苷,体外抗氧化实验表明该花色苷具有显著的DPPH自由基和
 清除能力。
清除能力。
参考文献:
[1] ZHENG Jie, DING Chenxu, WANG Liangsheng, et al. Anthocyanins composition and antioxidant activity of wild Lycium ruthenicum Murr. from Qinghai-Tibet Plateau[J]. Food Chemistry, 2011, 126(3): 859-865. DOI:10.1016/j.foodchem.2010.11.052.
[2] STINTZING F C, CARLE R. Functional properties of anthocyanins and betalains in plants food and in human nutrition[J]. Trends in Food Science & Technology, 2004, 15(1): 19-38. DOI:10.1016/ j.tifs.2003.07.004.
[3] 李进, 原惠, 曾献春, 等. 黑果枸杞色素的毒理学研究[J]. 食品科学,2007, 28(7): 470-475. DOI:10.3321/j.issn:1002-6630.2007.07.115.
[4] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933. DOI:10.1016/S0031-9422(03)00438-2.
[5] 闫亚美, 戴国礼, 冉林武, 等. 不同产地野生黑果枸杞资源果实多酚组成分析[J]. 中国农业科学, 2014, 47(22): 4540-4550. DOI:10.3864/ j.issn.0578-1752.2014.22.020.
[6] 闫亚美, 代彦满, 冉林武, 等. 黑果枸5种果蔬中花色苷组成及体外抗氧化活性比较[J]. 食品工业科技, 2014, 35(16): 133-136. DOI:10.13386/j.issn1002-0306.2014.16.021.
[7] 林丽, 李进, 丁成丽. 高效液相色谱法测定黑果枸杞果实中花色苷的含量[J]. 食品科学, 2013, 34(6): 164-166.
[8] CASTANEDA-OVANDO A, de LOURDES PACHECOHERNÁNDEZ M, PÁEZ-HERNÁNDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871. DOI:10.1016/j.foodchem.2008.09.001.
[9] 李进, 瞿伟菁, 吕海英, 等. 黑果枸杞色素的提取和精制工艺研究[J]. 天然产物研究与开发, 2006, 18(4): 650-654. DOI:10.3969/ j.issn.1001-6880.2006.04.031.
[10] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果枸杞总黄酮的研究[J]. 食品科学, 2009, 30(1): 19-24. DOI:10.3321/ j.issn:1002-6630.2009.01.003.
[11] JIN Hongli, LIU Yanfang, GUO Zhimou, et al. High-performance liquid chromatography separation of cis-trans anthocyanin isomers from wild Lycium ruthenicum Murr. employing a mixed-mode reversed-phase/strong anion-exchange stationary phase[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 500-508. DOI:10.1021/ jf504525w.
[12] JIN Hongli, LIU Yangfang, YANG Fan, et al. Characterization of anthocyanins in wild Lycium ruthenicum Murray by HPLC-DAD/ QTOF-MS/MS[J]. Analytical Methods, 2015, 7(12): 4947-4956. DOI:10.1039/c5ay00612k.
[13] 王晴川, 张鑫, 张文芹, 等. 苦丁冬青苦丁茶中咖啡酰奎尼酸类物质的分离纯化和高效液相色谱法分析[J]. 食品科学, 2013, 34(22): 119-122. DOI:10.7506/spkx1002-6630-201322024.
[14] XI Lishan, MU Taihua, SUN Hongnan. Preparative purification of polyphenols from sweet potato (Ipomoea batatas L.) leaves by AB-8 macroporous resins[J]. Food Chemistry, 2015, 172: 166-174. DOI:10.1016/j.foodchem.2014.09.039.
[15] HU Bing, WANG Yan, XIE Minhao, et al. Polymer nanoparticles composed with gallic acid grafted chitosan and bioactive peptides combined antioxidant, anticancer activities and improved delivery property for labile polyphenols[J]. Journal of Functional Foods, 2015,15: 593-603. DOI:10.1016/j.jff.2015.04.009.
[16] LIU Ying, MA Shuangshuang, IBRAHIM S A, et al. Identifi cation and antioxidant properties of polyphenols in lotus seed epicarp at different ripening stages[J]. Food Chemistry, 2015, 185: 159-164. DOI:10.1016/ j.foodchem.2015.03.117.
[17] BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 1971, 44(1): 276-287. DOI:10.1016/0003-2697(71)90370-8.
[18] HU Na, ZHENG Jie, LI Wencong, et al. Isolation, stability, and antioxidant activity of anthocyanins from Lycium ruthenicum Murray and Nitraria Tangutorum Bobr of Qinghai-Tibetan Plateau[J]. Separation Science and Technology, 2014, 49(18): 2897-2906. DOI:10.1080/01496395.2014.943770.
[19] CAO Shaoqian, PAN Siyi, YAO Xiaolin, et al. Isolation and purification of anthocyanins from blood oranges by column chromatography[J]. Agricultural Sciences in China, 2010, 9(2): 207-215. DOI:10.1016/S1671-2927(09)60085-7.
[20] DOWNEY M O, ROCHFORT S. Simultaneous separation by reversedphase high-performance liquid chromatography and mass spectral identification of anthocyanins and flavonols in Shiraz grape skin[J]. Journal of Chromatography A, 2008, 1201(1): 43-47. DOI:10.1016/ j.chroma.2008.06.002.
[21] ANDO T, SAITO N, TATSUZAWA F, et al. Floral anthocyanins in wild taxa of Petunia (Solanaceae)[J]. Biochemical Systematics and Ecology,1999, 27(6): 623-650. DOI:10.1016/S0305-1978(98)00080-5.
[22] CAPITANI D, SOBOLEV A P, DELFINI M, et al. NMR methodologies in the analysis of blueberries[J]. Electrophoresis, 2014,35(11): 1615-1626. DOI:10.1002/elps.201300629.
[23] HAN K H, KITANO-OKADA T, SEO J M, et al. Characterisation of anthocyanins and proanthocyanidins of adzuki bean extracts and their antioxidant activity[J]. Journal of Functional Foods, 2015, 14: 692-701. DOI:10.1016/j.jff.2015.02.018.
[24] SIMIRGIOTIS M J, SCHMEDA-HIRSCHMANN G. Direct identification of phenolic constituents in Boldo Folium (Peumus boldus Mol.) infusions by high-performance liquid chromatography with diode array detection and electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217(4): 443-449. DOI:10.1016/j.chroma.2009.11.014.
[25] GEORGE F, FIGUEIREDO P, TOKI K, et al. Infl uence of trans-cis isomerisation of coumaric acid substituents on colour variance and stabilisation in anthocyanins[J]. Phytochemistry, 2001, 57(5): 791-795. DOI:10.1016/S0031-9422(01)00105-4.
Purification and Antioxidant Activity of an Anthocyanin from Lycium ruthenicum Murray
TANG Jilong
1, YAN Yamei
1,2,*, CAO Youlong
2,*, ZENG Xiaoxiong
1, SUN Yi
1, HU Bing
1, ZHOU Li
1
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. National Wolfberry Engineering Research Center, Yinchuan 750004, China)
Abstract:An anthocyanin compound with over 97% purity was purifi ed from fruits of Lycium ruthenicum Murray with an ÄKTA protein purifi cation system (equipped with a YMC-PACK ODS-A column with methanol: acetonitrile: formic acid in water (4:19:1, V/V) as mobile phase at a fl ow rate of 2 mL/min). The purifi ed anthocyanin was identifi ed as petunidin 3-O-[rhamnopyranosyl-(trans-p-coumaroyl)]-5-O-[β-D-glucopyranoside] by mass spectrometry and nuclear magnetic resonance spectrometry. Furthermore, the anthocyanin showed potent scavenging activities on 1,1-diphenyl-2-picrylhydrazyl(DPPH) and superoxide anion free radicals in antioxidant assays in vitro.
Key words:Lycium ruthenicum Murray; anthocyanin; purifi cati on; structural identifi cation; antioxidant activity
DOI:10.7506/spkx1002-6630-201615019
中图分类号:Q946.83;TS201.2
文献标志码:A
文章编号:1002-6630(2016)15-0113-05
收稿日期:2015-09-30
基金项目:宁夏自然科学基金项目(NZ15124);宁夏农林科学院对外合作项目(JLC201601);宁夏农林科学院先导项目(NKYJ-15-16;NKYZ-16-0505);江苏高校优势学科建设工程资助项目
作者简介:唐骥龙(1990—),男,硕士研究生,研究方向为食品生物技术。E-mail:2013108022@njau.edu.cn
*通信作者:闫亚美(1982—),女,副研究员,博士,研究方向为枸杞加工与贮藏。E-mail:yanyamei@163.com
曹有龙(1963—),男,研究员,博士,研究方向为枸杞植物学。E-mail:youlongck@163.com
引文格式: