宋雪梅 1,2,张 炎 1,2,杨 敏 2,3,梁 琪 1,2,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省功能乳品工程实验室,甘肃 兰州 730070;3.甘肃农业大学理学院,甘肃 兰州 730070)
摘 要:为了探究牦牛乳硬质干酪中苦味肽组成特征,采用氯仿-甲醇法提取苦味肽,通过Sephadex G-25葡聚糖凝胶色谱进行分离纯化,并利用液相色谱-串联质谱(liquid chromatography-mass spectrometry/mass spectrometry,LC-MS/MS)对其分离的苦味较强组分进行特征鉴定。结果表明:经Sephadex G-25葡聚糖凝胶色谱分离得到3 个不同分子质量的组分,组分Ⅱ具有明显苦味。LC-MS/MS鉴定出组分Ⅱ中存在14 种苦味肽,主要为氨基酸残基数目7~17个、分子质量小于2 000 D的小肽,苦味肽序列中存在的疏水性氨基酸主要有脯氨酸、缬氨酸、亮氨酸、苯丙氨酸、异亮氨酸,800~1 500 D苦味肽占64.29%,源自β-酪蛋白(β-casein,β-CN)降解产物的苦味肽占92.86%。因此,干酪成熟过程中源自β-CN的具有较强疏水性、分子质量小于2 000 D的混合多肽的积累可能对干酪苦味的产生有较大影响。
关键词:牦牛乳硬质干酪;苦味肽;特征;β-酪蛋白
宋雪梅, 张炎, 杨敏, 等. 牦牛乳硬质干酪苦味肽的分离与特征鉴定[J]. 食品科学, 2016, 37(15): 160-164. DOI:10.7506/ spkx1002-6630-201615027. http://www.spkx.net.cn
SONG Xuemei, ZHANG Yan, YANG Min, et al. Separation and characterization of bitter peptides from hard cheese made from yak milk[J]. Food Science, 2016, 37(15): 160-164. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615027. http://www.spkx.net.cn
在干酪成熟过程中,酪蛋白在凝乳酶、纤维蛋白溶酶、发酵剂蛋白酶和肽酶等作用下,逐渐降解成寡肽、小肽和游离氨基酸,但是成熟过程中发生不恰当降解时,干酪将产生苦味等缺陷。研究表明,酪蛋白降解产物——苦味肽对Cheddar干酪 [1]、Ragusano干酪 [2]等苦味的产生起了重要作用。
肽的苦味源自于肽的疏水性氨基酸如精氨酸、亮氨酸、甘氨酸、苯丙氨酸和脯氨酸,它们是苦味受体的结合位点 [3]。多肽中的疏水性氨基酸不像完整蛋白质分子被包藏在内部,而是暴露在外,当接触味蕾时,就会产生苦味。疏水性氨基酸侧链暴露越多,多肽苦味强度就越大 [4]。干酪中苦味肽的产生主要与凝乳酶和发酵剂有关 [5]。干酪成熟过程中酪蛋白降解程度的增加或者降解过程中形成的中间产物没有被充分降解时,将会产生苦味肽。干酪中积累的苦味肽超过一定阈值后,干酪将产生苦味。干酪苦味影响了消费者的接受程度和市场前景,因此,基于重要的经济原因,干酪苦味及苦味肽受到特别关注。
近年来,随着先进分析技术的发展(如质谱),已鉴定出许多苦味肽。Guigoz等 [6]从Swiss-Mountain干酪中分离到具有苦感的二肽。Broadbent等 [7]认为苦味肽β-CN(f193-209)和α s1(f1-9)含量能够作为Cheddar干酪和模拟干酪产生过度苦味的指标。Toelstede等 [8-9]通过感官引导分级技术,在Gouda干酪中发现了有助于干酪产生苦味的12 种多肽。Karametsi等 [10]通过凝胶色谱、半制备型反相液相色谱和串联质谱在具有刺激性苦味干酪中鉴定出了5 种苦味肽。Liu Xiaowei等 [11]利用液相色谱-飞行时间串联质谱(liquid chromatography-time of flight-mass spectrometry/mass spectrometry,LC-TOF-MS/MS)鉴定了乳清蛋白酶解产物中存在的苦味肽。
牦牛乳硬质干酪营养丰富、成熟期较长,且原料乳中有较高含量的β-酪蛋白(β-casein,β-CN) [12],因此,鉴于不同干酪在原料乳、制作工艺、成熟方法等方面存在的差异,本研究通过提取牦牛乳硬质干酪中的苦味肽,采用葡聚糖凝胶色谱对其进行分离纯化,结合感官评价和液相色谱-串联质谱(liquid chromatography-mass spectrometry/mass spectrometry,LC-MS/MS)技术对其苦味肽组分进行鉴定,寻求干酪中存在的主要苦味肽,了解其苦味肽特征,为更好地控制牦牛乳硬质干酪苦味、获得干酪良好风味提供相关数据。
1.1 材料与试剂
15 ℃成熟4 个月的牦牛乳硬质干酪。
蓝色葡聚糖2000、Sephadex G-25葡聚糖凝胶 美国GE公司;氯仿、甲醇(均为分析纯) 天津市光复科技发展有限公司;硫酸奎宁(分析纯) 上海源叶生物科技有限公司;甲酸(分析纯)、乙腈(色谱纯)国药集团化学试剂有限公司。
1.2 仪器与设备
1.6 mm×75 cm普通层析柱 上海基星生物科技有限公司;MODEL BSZ-160自动部分收集器 上海青普沪西仪器厂;754PC型紫外分光光度计 上海光谱仪器有限公司;RE-5205旋转蒸发器 上海亚荣生化仪器厂;GLZ-0.4冷冻真空干燥机 北京速原中天科技有限公司;LTQ-Velos LC-MS/MS双压线性离子阱质谱仪美国Thermo Finnigan公司。
1.3 方法
1.3.1 干酪苦味肽的提取
参考Harwalkar等 [13]方法,采用氯仿-甲醇法提取干酪中苦味肽,并将提取的苦味肽真空冷冻干燥后贮藏在-18 ℃备用。
1.3.2 Sephadex G-25凝胶色谱分离纯化
将苦味肽配制成70 mg/mL的溶液,上样体积为1 mL,去离子水洗脱,洗脱速率为0.5 mL/min,每管收集体积为4.0 mL,检测波长为220 nm,收集液通过旋转蒸发浓缩后进行后续实验。
1.3.3 苦味肽各组分的苦味程度评价
经过培训和感官能力测试后,筛选出7 人组成评价小组,以0、2.9×10 -3、5.8×10 -3、1.2×10 -2、2.4×10 -2mmol/L硫酸奎宁作为参比溶液,评定员由弱到强地品尝参比溶液,记住每种溶液的苦味程度。采用5 分制进行评定、打分,1~5 分表示干酪苦味程度为几乎检测不到苦味、轻微苦味、中等苦味、非常强的苦味、令人难以接受的苦味。为了在相同条件下品尝苦味肽的苦味程度,在评定之前,将其配成相同浓度的苦味肽样品。评定员用蒸馏水漱口之后,将1 mL苦味肽溶液含在嘴里,大约10 s后吐出,进行评定、打分。
1.3.4 LC-MS/MS鉴定苦味肽特征
液相条件:分离柱为RP柱(150 μm×100 mm,5 μm)。流动相A:0.1%甲酸-水溶液;流动相B:0.1%甲酸-乙腈;上样量为20 μg,流速为2 μL/min;线行梯度洗脱:0~50 min,4%~50% B;50~54 min,50%~100% B;54~60 min,维持100% B。
LTQ Velos质谱仪通过微喷雾接口接到LC设备上,二级质谱数据同时获得。全扫描范围m/z 300~1 800,每次全扫描后采集20 个最强离子碎片图谱,动态排除设置:重复点2;重复持续时间30 s;排除重复时间90 s。二级质谱数据自动通过BioworksBrowser rev. 3.1在ipi.HUMAN.v3.53中获得。SEQUEST检索结果再用Build Summary软件进行比较,整合删除冗余信息,保证数据的正确性。
1.3.5 计算苦味肽的平均疏水性值(Q)
针对LC-MS/MS鉴定出的苦味肽,根据构成它的氨基酸种类和数目,参考Ney [14]的方法计算苦味肽的平均疏水性值(Q)。具体计算公式如下:
式中:Δf t为氨基酸自由能改变量;n为肽中氨基酸残基数目。
1.4 数据统计分析
数据采用SPSS软件进行显著性分析,Origin 8.0软件进行作图。
2.1 Sephadex G-25葡聚糖凝胶色谱分离纯化结果

图1 牦牛乳硬质干酪苦味肽的Sephadex G-25葡聚糖凝胶色谱图
Fig. 1 Sephadex G-25 gel filtration chromatogram of bitter peptides in hard cheese made from yak milk
由图1可知,提取到的苦味肽经Sephadex G-25葡聚糖凝胶,被分离成3 个组分。依据苦味肽洗脱的前后顺序,将3 个组分分别命名为组分Ⅰ、Ⅱ、Ⅲ。
2.2 干酪中苦味肽各组分苦味程度的比较

图2 Sephadex G-25葡聚糖凝胶色谱分离的各组分苦味程度的比较
Fig. 2 Comparison of bitterness of different components separated by Sephadex G-25 gel column chromatography
由图2可知,苦味肽组分Ⅱ具有轻微苦味,其苦味程度强于组分Ⅰ和组分Ⅲ。苦味肽组分Ⅱ与组分Ⅰ、Ⅲ之间的苦味程度差异显著(P<0.05),苦味肽组分Ⅰ、Ⅲ之间的苦味程度差异不显著(P>0.05)。
2.3 苦味肽组分Ⅱ的LC-MS/MS鉴定
通过LC-MS/MS对苦味肽组分Ⅱ进行分离鉴定,得到的样品基峰离子流色谱见图3。在质谱分析过程中,精确质量数扫描可以确定离子所带电荷数,利用二级质谱得到的碎片离子可识别肽段的氨基酸序列。通过与数据库搜索匹配,结合肽片段检测频次和文献[15]报道,筛选出17 种多肽,其具体结果见表1。

图3 Sephadex G-25葡聚糖凝胶色谱分离的苦味肽组分Ⅱ的基峰离子流色谱图
Fig. 3 Base peak ion chromatography of fraction II separated by Sephadex G-25 gel filtration chromatography
表1 Sephadex G-25葡聚糖凝胶色谱分离的苦味肽组分Ⅱ中鉴定的特征肽段
Table 1 Specific peptide sequences identified in fraction II separated by Sephadex G-25 gel filtration chromatography

注:A. 丙氨酸;L. 亮氨酸;R. 精氨酸;K. 赖氨酸;D. 天冬氨酸;M. 甲硫氨酸;C. 半胱氨酸;F. 苯丙氨酸;E. 谷氨酸;P. 脯氨酸;Q. 谷氨酰胺;S. 丝氨酸;T. 苏氨酸;H. 组氨酸;W. 色氨酸;I. 异亮氨酸;Y. 酪氨酸;G. 甘氨酸;V. 缬氨酸;N. 天冬氨酰。
酪蛋白种类和肽链数目肽段序列分子质量/D氨基酸残基数目疏水残基比例/% α s1-CN(4)RPKHPIK875.09757 IKHQGLPQ920.08862 HQGLPQE807.86757 SDIPNPIGSENSG1 286.321346 YQEPVLGPVRGPFPIIV1 881.251782 YQEPVLGPVRGPFPII1 782.121681 YQEPVLGPVRGPFPI1 668.961580 QEPVLGPVRGPFP1 392.621377 YQEPVLGPVRGPFP1 555.801479 TPVVVPPFL969.209100 VYPFPGPIPN1 100.281090 LPPTVMFPPQ1 126.381090 LPPTVMFPPQS1 213.461182 SLVYPFPGPIPN1 300.521283 KVLPVPQ779.98771 QEPVLGPVRGPFPII1 618.941580 EPVLGPVRGPFPII1 490.811486 β-CN(13)
由表1可知,大部分匹配的多肽源自酪蛋白,组分Ⅱ中存在的特征肽均为氨基酸残基数目7~17 个、分子质量小于2 000 D的肽段,其中分子质量在800~1 500 D的肽段为苦味肽的主要部分,占71%。各肽段中氨基酸出现频率较高的疏水性氨基酸主要有脯氨酸、缬氨酸、亮氨酸、苯丙氨酸、异亮氨酸。苦味肽主要源自β-CN和α s1-酪蛋白(α s1-CN)的降解产物,特别是β-CN。源自于β-CN降解产物的肽链13 条,其中大部分主要源自C末端多肽的降解,且肽段中的疏水性残基比例在71%以上。由于在所有牛乳蛋白中β-CN最疏水,而其C末端序列又是β-CN肽链中最疏水的 [16],因此比较容易产生苦味肽。源自于α s1-CN降解产物的苦味肽肽链有4 条,主要源自多肽的N末端降解,且肽段中的疏水性残基比例在62%以下。
2.4 组分Ⅱ中各苦味肽疏水性值分析
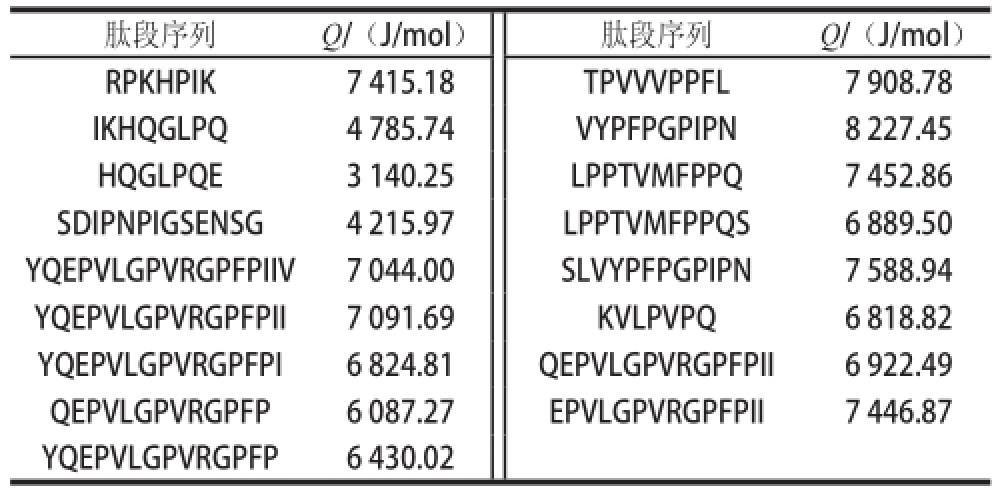
一般通过肽的疏水程度可以判断其是否具有苦味,当疏水性氨基酸残基裸露在肽链表面时,刺激舌上的苦味受体(味蕾)产生苦味。因此,按照Ney [14]的方法,计算出苦味肽组分Ⅱ中17 种多肽的疏水性值,见表2。
表2 牦牛乳硬质干酪中苦味肽组分Ⅱ中所鉴定特征肽的疏水性值(Q)
Table 2 Hydrophobicity of characteristic peptides from fraction II
肽段序列Q/(J/mol)肽段序列Q/(J/mol)RPKHPIK7 415.18 TPVVVPPFL7 908.78 IKHQGLPQ4 785.74VYPFPGPIPN8 227.45 HQGLPQE3 140.25LPPTVMFPPQ7 452.86 SDIPNPIGSENSG4 215.97LPPTVMFPPQS6 889.50 YQEPVLGPVRGPFPIIV7 044.00SLVYPFPGPIPN7 588.94 YQEPVLGPVRGPFPII7 091.69KVLPVPQ6 818.82 YQEPVLGPVRGPFPI6 824.81QEPVLGPVRGPFPII6 922.49 QEPVLGPVRGPFP6 087.27EPVLGPVRGPFPII7 446.87 YQEPVLGPVRGPFP6 430.02
由表2可知,除了来自α s1-CN降解产物IKHQGLPQ、HQGLPQE、SDIPNPIGSENSG的多肽Q值<5 443.1 J/mol之外,其他14 种多肽的Q值>5 861.8 J/mol。因此,根据Q值规则,苦味肽组分Ⅱ中存在14 种具有苦味的肽,源自β-CN降解产物的苦味肽占92.86%,800~1 500 D苦味肽占64.29%。
Champion等 [1]发现Cheddar干酪中苦味肽分子质量为190 D。Engel等 [17]通过消除实验,确定苦Camembert干酪的苦味主要由400~3 000 D的小肽所引起。Topcu等 [18]利用超滤、凝胶色谱和反相高效液相色谱从Turkish白干酪和Kasar干酪中分离的苦味肽分子质量为500~4 000 D和200~700 D。来自血红蛋白、玉米蛋白、酪蛋白和大豆蛋白等降解物的苦味肽也是由2~27 个氨基酸残基组成,分子质量为200~3 000 D。因此,牦牛乳硬质干酪中苦味肽分子质量(875.09~1 881.25 D)在所报道的苦味肽分子质量范围之内。
Edwards等 [19]发现来自Cheddar干酪的苦味肽中具有较高含量的谷氨酸、脯氨酸、亮氨酸和缬氨酸,而组氨酸、酪氨酸和甲硫氨基酸的含量较低。Toshikazu等 [20]在大豆蛋白苦味肽的研究中也发现,缬氨酸、亮氨酸、苯丙氨酸、酪氨酸和异亮氨酸含量较高。Fitzgerald等 [21]发现苦味肽中含有较多的脯氨酸。本实验发现苦味肽序列中疏水性氨基酸频数从高到低的顺序依次为脯氨酸、缬氨酸和亮氨酸、苯丙氨酸、异亮氨酸。肽的苦味作用主要取决于肽侧链末端的疏水性氨基酸残基,这具备了与苦味受体结合的前提条件。疏水性氨基酸残基在多肽中比例越高,则该多肽苦味越重 [22],而在本实验中测定的大多数肽段中疏水性残基比例在71%以上,这使得多肽的苦味程度可能较强。
另外,苦味肽的苦味还与特定分子构象相关。当多肽链两端形成回折构象时,苦味较重,而脯氨酸(Pro)残基对多肽链形成回折构象起着重要的作用 [23]。本实验发现大部分鉴定出的多肽末端部位多次出现疏水性氨基酸如脯氨酸、亮氨酸、缬氨酸等,且脯氨酸出现的频率很高。在—Pro—Pro—基团间插入L-型或疏水性氨基酸时苦味并不减弱,插入苯丙氨酸时,苦味将大大增强 [24]。本实验测定的苦味肽序列如YQEPVLGPVRGPFPIIV、YQEPVLGPVRGPFPII、Q E P V L G P V R G P F P、Y Q E P V L G P V R G P F P、V Y P F P G P I P N、Q E P V L G P V R G P F P I I、EPVLGPVRGPFPII中发现在脯氨酸和脯氨酸基团之间插入了疏水性氨基酸或者苯丙氨酸。在牦牛乳硬质干酪中发现存在YQEPVLGPVRGPFPIIV序列,而苦味肽β-CN(f193-209)的序列为YQQPVLGPVRGPFPIIV,将Q变成E,因此可判断YQEPVLGPVRGPFPIIV具有苦味。在重口味Cheddar干酪 [10]和Gouda干酪 [8]中发现的苦味肽YQEPVLGPVRGPFPI也存在于牦牛乳硬质干酪中。同时还存在与YQEPVLGPVRGPFPI 前后差1或2 个氨基酸肽段YQEPVLGPVRGPFPII、QEPVLGPVRGPFPII、YQEPVLGPVRGPFP、EPVLGPVRGPFPII、QEPVLGPVRGPFP等。Karametsi等 [10]发现GPVRGPFPIIV是重口味Cheddar干酪中苦味程度的主要贡献者。Singh等 [25]曾发现与β-CN(f193-209)相关的降解物β-CN(f196-209)、β-CN(f200-209)、β-CN(f202-209)的苦味阈值低于β-CN(f193-209)。Broadbent等 [26]在Cheddar干酪中发现的α s1-CN(f1-7)有助于干酪产生苦味,而在牦牛乳硬质干酪中也发现了类似的多肽序列RPKHPIK。
综上所述,本实验所测定的牦牛乳硬质干酪中苦味肽具有呈现苦味的特征,且苦味较强的多肽主要有RPKHPIK、YQEPVLGPVRGPFPIIV、Q E P V L G P V R G P F P、Y Q E P V L G P V R G P F P、VYPFPGPIPN、QEPVLGPVRGPFPII、LPPTVMFPPQ、YQEPVLGPVRGPFPI、TPVVVPPFL、VYPFPGPIPN。
Sephadex G-25葡聚糖凝胶色谱将苦味肽分离成3 个不同分子质量的组分,且组分Ⅱ具有明显苦味。经LC-MS/MS对组分Ⅱ进行鉴定,组分Ⅱ中有14 种苦味肽,主要是氨基酸残基数目为7~17 个、分子质量小于 2 000 D的小肽,其中800~1 500 D的苦味肽占64.29%,苦味肽序列中出现的疏水性氨基酸频数从高到低依次为脯氨酸、缬氨酸、亮氨酸、苯丙氨酸、异亮氨酸,源自β-CN的降解产物的苦味肽占92.86%。
参考文献:
[1] CHAMPION H M, STANLEY D W. HPLC separation of bitter peptides from Cheddar cheese[J]. Canadian Institute of Food Science and Technology Journal, 1982, 15(4): 283-288. DOI:10.1016/S0315-5463(82)72613-6.
[2] FALLICO V, MCSWEENEY P L H, HORNE J, et al. Evaluation of bitterness in Ragusano cheese[J]. Journal of Dairy Science, 2005,88(4): 1288-1300. DOI:10.3168/jds.S0022-0302(05)72795-8.
[3] GOMEZ M, GARDE S, GAYA P, et al. Relationship between level of hydrophobic peptides and bitterness in cheese made from pasteurized and raw milk[J]. Journal of Dairy Research, 1997, 64(2): 289-297. DOI:10.1017/S0022029996002129.
[4] PRIPP A H, ARD Y. Modelling relationship between angiotensin-(I)-converting enzyme inhibition and the bitter taste of peptides[J]. Food Chemistry, 2007, 102(3): 880-888. DOI:10.1016/ j.foodchem.2006.06.026.
[5] LEMIEUX L, SIMARD R E. Bitter flavour in dairy products. 1. A review of the factors likely to influence its development, mainly in cheese manufacture[J]. Le Lait, 1991, 71(6): 599-636. DOI:10.1051/ lait:1991647.
[6] GUIGOZ Y, SOLMS J. Isolation of a bitter tasting peptide from“Alpkase”, a Swiss mountain-cheese[J]. LWT Lebensmitt Wissensch Technol, 1974, 7(6): 356-357.
[7] BROADBENT J R, BARNES M, BRENNAND C, et al. Contribution of Lactococcus lactis cell envelope proteinase specificity to peptide accumulation and bitterness in reduced-fat Cheddar cheese[J]. Applied and Environmental Microbiology, 2002, 68(4): 1778-1785. DOI:10.1128/AEM.68.4.1778-1785.2002.
[8] TOELSTEDE S, DUNKEL A, HOFMANN T. A series of kokumi peptides impart the long-lasting mouthfulness of matured Gouda cheese[J]. Journal of Agricultural and Food Chemistry, 2009, 57(4): 1440-1448. DOI:10.1021/jf803376d.
[9] TOELSTEDE S, HOFMANN T. Quantitative studies and taste reengineering experiments toward the decoding of the nonvolatile sensometabolome of Gouda cheese[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5299-5307. DOI:10.1021/jf800552n.
[10] KARAMETSI K, KOKKINIDOU S, RONNINGEN I, et al. Identification of bitter peptides in aged Cheddar cheese[J]. Journal of Agricultural and Food Chemistry, 2014, 62(32): 8034-8041. DOI:10.1021/jf5020654.
[11] LIU Xiaowei, JIANG Deshou, PETERSON D G. Identification of bitter peptides in whey protein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2014, 62(25): 5719-5725. DOI:10.1021/ jf4019728.
[12] LI Haimei, MA Ying, DONG Aijun, et al. Protein composition of yak milk[J]. Dairy Science & Technology, 2010, 90(1): 111-117.
[13] HARWALKAR V R, ELLIOTT J A. Isolation of bitter and astringent fractions from Cheddar cheese[J]. Journal of Dairy Science, 1971,54(1): 8-11. DOI:10.3168/jds.S0022-0302(71)85772-7.
[14] NEY K H. Prediction of bitterness of peptides from their amino acid composition[J]. Zeitschrift fur Lebensmittel-Untersuchung und-Forschung, 1971, 147(2): 64-68.
[15] LEMIEUX L, SIMARD R E. Bitter flavour in dairy products. Il. A review of bitter peptides from caseins: their formation, isolation and identification, structure masking and inhibition[J]. Le Lait, 1992,72(4): 335-382. DOI:10.1051/lait:1992426 .
[16] 王立晖. 胃蛋白酶酶解酪蛋白制备酪啡肽的研究[D]. 成都: 西华大学, 2005: 3-4. DOI:10.7666/d.y906842.
[17] ENGEL E, NICKLAUS S, SEPTIER C, et al. Evolution of the taste of a bitter Camembert cheese during ripening: characterization of a matrix effect[J]. Journal of Agricultural and Food Chemistry, 2001,49(6): 2930-2939. DOI:10.1021/jf000967m.
[18] TOPCU A, SALDAMLI I. Determination of peptides caused bitterness in Turkish white cheese and Kasar cheese[J]. Journal of Food Technology, 2007, 5(2): 131-134.
[19] EDWARDS J, KOSIKOWSKI F V. Bitter compounds from Cheddar cheese[J]. Journal of Dairy Science, 1983, 66(4): 727-734. DOI:10.3168/jds.S0022-0302(83)81851-7.
[20] TOSHIKAZU N, SATOSHI Y, MICHIO F, et al. Debittering of enzymatic hydrolysates using all aminopeptidase from the edible basidiomycete Grifola frondosa[J]. Journal of Bioscience and Bioengineering, 2002, 93(1): 60-63. DOI:10.1016/s1389-1723(02)80055-x.
[21] FITZGERALD R J, O’CUINN, G. Enzymatic debittering of food protein hydrolysates[J]. Biotechnology Advances, 2006, 24(2): 234-237. DOI:10.1016/j.biotechadv.2005.11.002.
[22] 丁建明, 谢小冬, 宋礼, 等. 酶解蛋白产物脱苦技术研究进展[J]. 粮食与油脂, 2012(8): 5-7. DOI:10.3969/j.issn.1008-9578.2012.08.004.
[23] ISHIBASHI N, KUBO T, CHINO M, et al. Taste of proline-containing peptides[J]. Agricultural and Biological Chemistry, 1988, 52(1): 95-98. DOI:10.1271/bbb1961.37.2427.
[24] NAKATANI M, OKAI H. Convenient synthesis of flavor peptides[C]// ACS Symposium Series, 1993: 149-157. DOI:10.1021/bk-1993-0528. ch011.
[25] SINGH T K, YOUNG N D, DRAKE M, et al. Production and sensory characterization of a bitter peptide from β-casein[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 1185-1189. DOI:10.1021/jf049058d.
[26] BROADBENT J R. Peptide accumulation and bitterness in Cheddar cheese made using single-strain Lactococcus lactis starters with distince proteinase specificities[J]. Journal of Dairy Science, 1998,81(2): 327-337. DOI:10.3168/jds.s0022-0302(98)75581-x.
Separation and Characterization of Bitter Peptides from Hard Cheese Made from Yak Milk
SONG Xuemei
1,2, ZHANG Yan
1,2, YANG Min
2,3, LIANG Qi
1,2,*
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. Functional Dairy Product Engineering Laboratory of Gansu, Lanzhou 730070, China;3. College of Science, Gansu Agricultural University, Lanzhou 730070, China)
Abstract:The intention of this work was to investigate the structural characteristics of bitter peptides in hard cheese made from yak milk. Bitter peptides were extracted with chloroform-methanol mixture and isolated by using gel chromatography,and the more bitter fractions were identified by liquid chromatography-mass spectrometry (LC-MS-MS). The results showed that three fractions named as fractions I, II and III were obtained through Sephadex G-25 column chromatography and fraction II tasted the most bitter among these and had a flavor described as slightly bitter. Fourteen peptides were identified in fraction II and these peptides were composed of 7-17 amino acid residues in a molecular weight range less than 2 000 D. Hydrophobic amino acids such as proline, valine, leucine, phenylalanine and isoleucine constituted these bitter peptides. The bitter peptides in a molecular weight range of 800-1 500 D accounted for 64.29% and bitter peptides derived from β-casein(β-CN) accounted for 92.86%. Therefore, polypeptides derived from β-casein with high hydrophobicity and molecular weight below 2 000 D may have a significant influence on the bitterness of cheese.
Key words:hard cheese made from yak milk; bitter peptide; characteristic; β-casein
DOI:10.7506/spkx1002-6630-201615027
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2016)15-0160-05
收稿日期:2015-10-20
基金项目:国家自然科学基金地区科学基金项目(31260383)
作者简介:宋雪梅(1980—),女,博士,研究方向为乳品科学与技术。E-mail:springwinter110@126.com
*通信作者:梁琪(1969—),女,教授,博士,研究方向为食品品质、乳品科学。E-mail:liangqi@gsau.edu.cn
引文格式: