施文卫 1,王 伟 2,胡 冰 1,周 莉 1,曾晓雄 1,孙 怡 1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
摘 要:以碱溶酸沉法制备的鹰嘴豆分离蛋白为酶解底物,以超氧阴离子自由基清除率为响应值,采用响应面法优化胰蛋白酶制备鹰嘴豆抗氧化活性肽的条件。结果表明:在整个酶解过程中,所制备的鹰嘴豆抗氧化肽具有显著的抗氧化活性,胰蛋白酶制备鹰嘴豆抗氧化肽的最佳酶解条件为:底物质量分数2%、加酶量([E]/[S])1 800 U/g、温度32 ℃、pH 7.0、时间35 min。此条件下所制备的鹰嘴豆抗氧化肽的超氧阴离子自由基清除率为67.59%。鹰嘴豆分离蛋白水解液经超滤膜系统纯化获得了截留相对分子质量1 kD以下的水解液,并通过液相色谱-质谱联用分析,发现了一种相对分子质量为668.40、序列为RQLPR的亲水性五肽。
关键词:鹰嘴豆分离蛋白;胰蛋白酶;抗氧化;响应面法
施文卫, 王伟, 胡冰, 等. 胰蛋白酶制备鹰嘴豆抗氧化肽的条件优化[J]. 食品科学, 2016, 37(15): 185-191. DOI:10.7506/ spkx1002-6630-201615031. http://www.spkx.net.cn
SHI Wenwei, WANG Wei, HU Bing, et al. Optimal preparation of antioxidant peptides by enzymatic hysrolysis of chickpea protein isolate with trypsin[J]. Food Science, 2016, 37(15): 185-191. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201615031. http://www.spkx.net.cn
鹰嘴豆(chickpea),豆科鹰嘴豆属(Cicer arietinum L.),一年生或多年生草本植物,耐干旱、贫瘠 [1],在我国主要种植于新疆、甘肃、青海等雨水量较少的地区 [2]。鹰嘴豆外型独特,形如鹰头,在种脐附近有喙状突起而得名,维吾尔族人称其为奴乎特、诺胡提,别名鸡豆、鸡豌豆、脑豆子和桃豆等 [3-4]。鹰嘴豆的消费量居世界豆类第二,仅次于大豆,产量居世界豆类第三,仅次于大豆和豌豆 [5]。
鹰嘴豆因其独特的生长优势和高营养价值备受人们喜爱,国外研究较早。我国对于鹰嘴豆的科学研究大约始于20世纪80、90年代,且主要集中于栽培种植方面 [6-7]。2005年以后,学者们逐渐把目光转移到鹰嘴豆的营养成分、功能性质和开发利用等方面 [8-11],有关鹰嘴豆蛋白的报道也逐渐增多。鹰嘴豆种子中蛋白质含量约为20%~25%,氨基酸组成均衡 [12],且蛋白功效比和净蛋白利用率都高于大豆 [13-14]。学者们通过酶解鹰嘴豆蛋白制备了多种生物活性肽 [15-16],其中以具有抗氧化活性的肽的研究报道较多。鹰嘴豆蛋白本身就具有一定的抗氧化活性,是抗氧化肽的潜在来源 [17]。与鹰嘴豆蛋白相比,鹰嘴豆抗氧化肽不但具有更佳的清除自由基 [18]、金属螯合 [19]、预防细胞氧化损伤 [20]等功效,而且更易被人体吸收。可能由于考虑到蛋白的溶解性以及酶的高效水解性等问题,鹰嘴豆蛋白的水解多用碱性蛋白酶,而以促进人体肠道消化和吸收的消化酶水解鹰嘴豆蛋白却少有报道。因此,本研究拟以超氧阴离子自由基清除率为响应值,采用响应面分析法(response surface methodology,RSM)探寻以胰蛋白酶制备鹰嘴豆抗氧化肽的最佳条件,并对鹰嘴豆抗氧化肽的组成进行分析和探讨,为鹰嘴豆蛋白类功能产品的开发与鹰嘴豆精深加工提供一定的参考。
1.1 材料与试剂
鹰嘴豆(卡布里型) 新疆农业大学。
胰蛋白酶 索莱宝生物科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
AY-120电子精密天平 日本Shimadzu公司;HH-6型数显恒温水浴锅 上海国华电器有限公司;Avanti J-30I高效离心机 贝克曼库尔特商贸有限公司;KJELTEC 2300型Foss全自动凯氏定氮仪 丹麦Foss公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;Telstar LYOBETA 3PS中试冻干机 泰事达科技公司;Synergy-2型酶标仪 美国Biotek公司;Mini Pellicon膜过滤系统 密理博(中国)有限公司;LTQ Orbitrap XL TM液相色谱-质谱联用(liquid chromatographymass spectrometry,LC-MS)仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 常规指标的测定
蛋白质含量的测定方法按照GB 5009.5—2010《食品中蛋白质的测定》;水分的测定方法按照GB 5009.3—2010《食品中水分的测定》;灰分的测定方法按照GB 5009.4—2010《食品中灰分的测定》;脂肪的测定方法按照GB/T 5009.6—2003《食品中脂肪的测定》;多糖含量的测定参照苯酚-硫酸法 [21]。
1.3.2 鹰嘴豆分离蛋白(chickpea protein isolates,CPI)的制备
根据Zhang Tao等 [10]的方法略作改动:选取籽粒饱满、无虫害、无缺失的鹰嘴豆种子,去皮,粉碎机粉碎,100 目尼龙网过筛,石油醚脱脂,得到鹰嘴豆粉。将豆粉与水按照1∶10(m/V)的料液比混合,0.5 mol/L NaOH调pH值至8.5,室温搅拌1~2 h,离心(3 000×g,20 min),残渣用上述方法再提一次,合并上清液。0.5 mol/L的HCl调pH值至鹰嘴豆分离蛋白等电点4.6,静置30 min,离心(800×g,20 min),用pH 4.6的去离子水洗涤沉淀3 次。调沉淀的pH值至7.0,冷冻干燥,4 ℃冰箱保存备用。
1.3.3 CPI的酶解
根据Aarsen [22]的方法,略做改动:称取适量CPI溶于30 mL去离子水中,混匀。将溶液放置入酶解反应器中,80 ℃预热20 min,然后将混合液迅速调节到蛋白酶的最适温度和最适pH值范围内,缓慢搅拌的同时加入适量胰蛋白酶,通过滴加0.5 mol/L的NaOH溶液来维持反应液pH值不变。将制得酶解液放置于沸水中灭酶10 min,再放入冰浴中立即冷却,离心(10 000×g,10 min),上清液冻干。
1.3.4 水解度(degree of hydrolysis,DH)的测定
根据宁正祥 [23]的方法测定胰蛋白酶降解鹰嘴豆分离蛋白的DH。
式中:ρ i为甲醛滴定法测定的酶解产物中氨基氮含量/(mg/mL);ρ 1为甲醛滴定法测定的酶解前的溶液氨基氮含量/(mg/mL);ρ 0为凯氏定氮法测定的酶解液中蛋白质的总氮含量/(mg/mL)。
1.3.5 氨基氮含量的测定
采用甲醛滴定法 [23]测定氨基氮含量:取5 mL蒸馏水加入2 mL样品或蒸馏水(空白),添加中性甲醛溶液5 mL,滴入0.5%酚酞指示剂3~5 滴,用0.1 mol/L的NaOH标准溶液滴定至微红,记录每次消耗的标准NaOH溶液的量。平均测定3 次,取平均值。
式中:V 样品为样品所消耗NaOH标准溶液的体积/mL;V 空白为空白实验中所消耗NaOH标准溶液的体积/mL。
1.3.6 超氧阴离子自由基清除能力的测定
根据Wang Zhaojing等 [24]的方法略做改动:取2 mg/mL样品溶液50 ☒L,分别加入50 ☒L氯化硝基四氮唑蓝(nitrotetrazolium blue tetrazolium,NBT)溶液(156 ☒mol/L)、50 ☒L还原型辅酶Ⅰ(dihydronicotinamide adenine dinucleotide,NADH)溶液(468 ☒mol/L)和50 ☒L吩嗪硫酸甲酯(phenazine methosulfate,PMS)溶液(60 ☒mol/L)。混匀反应体系,25 ℃水浴5 min,用分光光度计于560 nm波长处测吸光度。NBT溶液、NADH溶液和PMS溶液都是用0.1 mol/L pH 7.4的磷酸盐缓冲液配制。以水代替样品溶液、0.1 mol/L pH 7.4磷酸盐缓冲液代替NBT溶液,作空白实验调零。按照下式计算超氧阴离子自由基(O 2 -·)清除率。
式中:A 0为对照实验体系(水代替样品溶液)的吸光度;A 1为样品实验体系的吸光度;A 2为样品干扰实验体系(0.1 mol/L pH 7.4 磷酸盐缓冲液代替NBT溶液)的吸光度。
1.3.7 酶解单因素对鹰嘴豆分离蛋白DH的影响
在酶促反应过程中,诸多因素影响着反应的进程,其中以底物质量分数、pH值、温度、酶解时间和加酶量对反应速率影响较大,因此首先采用单因素试验确定适当的单因素酶解条件。
1.3.8 响应面法优化鹰嘴豆蛋白酶解条件
以X 1加酶量([E]/[S])、X 2酶解温度和X 3酶解时间为自变量,O 2 -·清除率为响应值,采用Box-Behnken中心组合试验设计原理,设计了三因素三水平的RSM试验。试验以随机次序进行,重复2 次,获得O 2 -·清除率的平均值,采用Design-Expert V8.0.6软件中的RS(response surface)程序进行分析,应用Model Graph程序作响应曲面图和等高线图。RSM试验因素及水平表见表1。
表1 RSM试验因素水平
Table 1 Independent variables and levels used for RSM

试验水平X 1[E]/[S]/(U/g)X 2酶解温度/℃X 3酶解时间/min -11 0003020 0 2 0004030 1 3 0005040
1.3.9 鹰嘴豆抗氧化肽的LC-MS分析
大量研究表明 [16,25-26],抗氧化肽的分子质量一般在1 kD以下,因此将CPI的水解液过1 kD的聚砜超滤膜,截留1 kD以下的鹰嘴豆小肽,旋转蒸发浓缩,上Waters Sep-Pak ☒Vac 6cc C 18固相萃取小柱,用2~3 倍柱体积的超纯水洗去盐分,60%乙腈洗下鹰嘴豆小肽,旋蒸浓缩,冻干,纯化后的样品进行LC-MS分析。检测波长为280 nm,柱温为30 ℃,流速为0.2 mL/mi n,进样量20 ☒L。色谱柱:ACQUITYUPLC TM BEH C 18色谱柱(2.1 mm×100 mm,1.7 μm);流动相A:H 2O(含0.1%甲酸),流动相B:100%乙腈(含0.1%甲酸);梯度洗脱程序:0~2 min 5% B,2~18 min 5%~95% B,18~22 min 95% B;阳离子检测模式电喷雾质谱,喷雾电压为 4.5 kV,雾化气为N 2,扫描范围为m/z 300~1 000,通过在线二级串联质谱鉴定分子序列。
1.4 数据处理
响应面试验数据采用Design-Expert V8.0.6软件中的RS程序进行分析,应用Model Graph程序作响应曲面图和等高线图,对LC-MS分析图谱采用Peaks Studio 7.5软件分析鹰嘴豆抗氧化肽的组成及氨基酸序列。
2.1 鹰嘴豆分离蛋白的化学成分
鹰嘴豆种子中脂肪含量约为4%~6% [13],一定量的鹰嘴豆经筛选、去皮和磨粉后,需经石油醚反复浸泡脱脂。脱脂豆粉经碱液溶解并离心,去除淀粉等不溶性杂质,再经酸调节pH值至鹰嘴豆蛋白的等电点使蛋白析出,离心弃上清,除去糖类和酚类物质。而此时蛋白沉淀中仍残留一定的糖类和酚类,需要用pH 4.6的去离子水反复洗涤,同时保持鹰嘴豆蛋白的含量不受影响,最终制备的CPI纯度较高,经凯氏定氮法检测所制备的CPI中蛋白含量为93.29%(表2)。
表2 鹰嘴豆分离蛋白的化学成分组成
Table 2 Chemical components of chickpea protein isolate
成分蛋白质水分脂肪灰 分总糖含量/%93.29±0.57 4.00±0.060.07±0.042.79±0.021.61±0.25
2.2 单因素对胰蛋白酶水解CPI的影响
2.2.1 底物质量分数对胰蛋白酶水解CPI的影响
在温度37 ℃、pH 7.0、加酶量2 000 U/g的条件下,测定不同质量分数底物对CPI水解液DH的影响,由图1可知,随着酶解的进行,DH的总趋势为逐渐增加,但同一酶解时间时,底物质量分数为1%和2%的体系的DH相对高于对其他两体系。这可能是由于酶被底物饱和后,随着底物质量分数的增加,水解速率基本保持稳定。当底物质量分数过高时,体系流动性差,不利于酶与底物的接触,因此其水解速率反而下降 [27]。综合考虑底物利用率和产物得率,选择底物质量分数为2%。
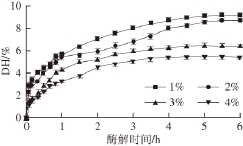
图1 底物质量分数对胰蛋白酶水解鹰嘴豆分离蛋白的影响
Fig. 1 Effect of substrate concentration on the hydrolysis degree of chickpea protein isolate by trypsin
2.2.2 pH值对胰蛋白酶水解CPI的影响
胰蛋白酶的最适pH值范围为7.0~8.0,选择pH 6.0~9.0的条件进行试验,结果如图2所示。胰蛋白酶在不同pH值条件下水解CPI,随着时间的延长,DH总趋势为逐渐增加。CPI酶解液的DH在不同pH值条件下差异较大,其中pH 7.0时效果最佳。pH值低于7时,推测由于pH值向鹰嘴豆蛋白等电点偏移,蛋白溶解度降低,降低了底物质量分数;pH值高于7时,同一水解时间,pH值高的体系DH反而低。因此,选择pH值为7.0。
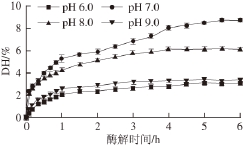
图2 pH值对胰蛋白酶水解鹰嘴豆分离蛋白的影响
Fig. 2 Effect of pH on the hydrolysis degree of chickpea protein isolate by trypsin
2.2.3 [E]/[S]对胰蛋白酶水解CPI的影响
当[E]<<[S]时,可以认为酶反应速率与[E]成正比。因此固定底物质量分数为2.0%,考察不同[E]/[S]对DH的影响。由图3可知,[E]/[S]越高,酶解越彻底,然而根据前期蛋白酶的筛选结果以及文献[18]报道,其O 2 -·清除活性的峰值在1 h以内,而在1 h以内,[E]/[S]为3 000 U/g较2 000 U/g时对DH的提高并不明显,从节约成本的角度考虑,选择[E]/[S]为2 000 U/g比较适宜。
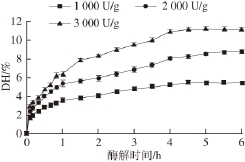
图3 [ 3 E]/[/S]对胰蛋白酶酶解鹰嘴豆分离蛋白的影响
Fig. 3 Effect of [E]/[S] ratio on the hydrolysis degree of chickpea protein isolate by trypsin
2.2.4 酶解温度对胰蛋白酶酶解CPI的影响
胰蛋白酶对底物的最适作用温度一般为37 ℃,试验中选择30、37、50 ℃ 3 个条件,CPI的酶解曲线见图4。30 ℃时,胰蛋白酶对CPI的酶解效果最差,可能是由于在低温条件下胰蛋白酶的活性受到抑制;37 ℃与50 ℃条件下的水解曲线较接近,考虑到长期高温会影响酶的活性,最终选择37 ℃为宜。

图4 酶解温度对胰蛋白酶酶解鹰嘴豆分离蛋白的影响
Fig. 4 Effect of temperature on the hydrolysis degree of chickpea protein isolate by trypsin
综合以上单因素试验结果,初步确定胰蛋白酶水解CPI的参数为:底物质量分数为2%、pH 7.0、[E]/[S] 2 000 U/g、酶解温度37 ℃,并以此设计响应面进行最适水解条件的优化。
2.3 响应面法优化CPI酶解条件
2.3.1 响应面试验设计与结果
为了获得具有较强抗氧化能力的CPI酶解物,在单因素试验的基础上,以O 2 -·清除率为响应值,采用Box-Behnken设计方法进行最适酶解条件的优化,试验设计与结果见表3。[E]/[S]、酶解温度和酶解时间3 个因素分别以X 1、X 2、X 3表示,并以+1、0、-1 分别代表自变量的高、中、低水平,按方程x i=(X i-X 0)/X对自变量进行编码,其中x i为自变量的编码值,X i为自变量的真实值,X 0为试验中心点处自变量的真实值,X为自变量的变化步长。
表3 响应面设计方案与结果
Tabl e 3 Experimental design and results of RSM
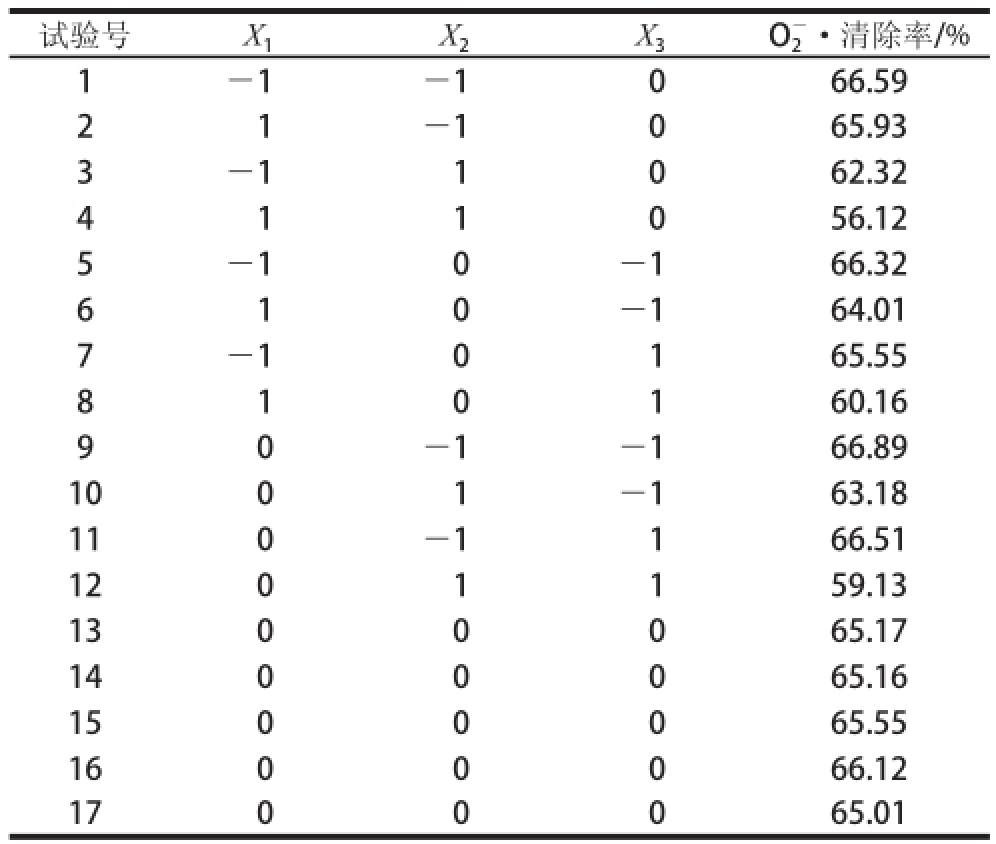
试验号X 1X 2X 3O 2 -·清除率/% 1-1-1066.59 2 1 -1065.93 3-1 1062.32 4 1 1 0 56.12 5-10-166.32 6 1 0 -164.01 7-10165.55 8 1 0 1 60.16 -1-166.89 1001-163.18 110-1166.51 1201159.13 1300065.17 1400065.16 1500065.55 1600066.12 1700065.01 9 0
2.3.2 响应面及等高线分析
三维响应面图可以显示响应面的变化趋势和最大值点。在等高线图中,可以预测到最大值点,它位于最小曲线中。图5为[E]/[S]和酶解温度的交互作用对O
2
-·清除活性的影响,在试验范围内,随着[E]/[S]的增大和酶解温度的升高,酶解液的
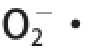 清除活性先增加后急剧下降。图6为酶解时间和[E]/[S]的交互作用对
清除活性先增加后急剧下降。图6为酶解时间和[E]/[S]的交互作用对
 清除活性的影响,在试验范围内,随着[E]/[S]的增大,酶解液的
清除活性的影响,在试验范围内,随着[E]/[S]的增大,酶解液的
 清除活性先增加后降低,趋势明显,而随着酶解时间的延长,清除活性亦先升高后降低,但幅度较小。图7为酶解时间和温度的交互作用对
清除活性先增加后降低,趋势明显,而随着酶解时间的延长,清除活性亦先升高后降低,但幅度较小。图7为酶解时间和温度的交互作用对
 清除活性的影响,随着时间和温度的上升,酶解液
清除活性的影响,随着时间和温度的上升,酶解液
 活性先增加后降低,40 ℃以后,温度越高活性明显降低。对比图5~7结果,[E]/[S]和酶解温度的交互作用对
活性先增加后降低,40 ℃以后,温度越高活性明显降低。对比图5~7结果,[E]/[S]和酶解温度的交互作用对
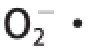 清除活性的影响最显著。
清除活性的影响最显著。
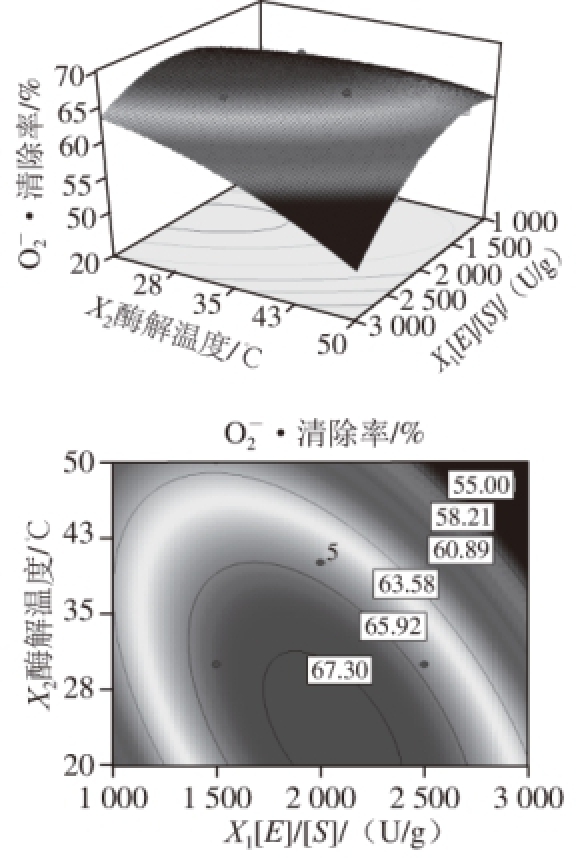
图5 [ 5 E]/[/S]和酶解温度的交互作用对OO
2
-·清除活性的响应面及等高线
Fig. 5 Response surface and contour plots for the effect of [E]/[S] ratio and temperature on superoxide radical scavenging activity
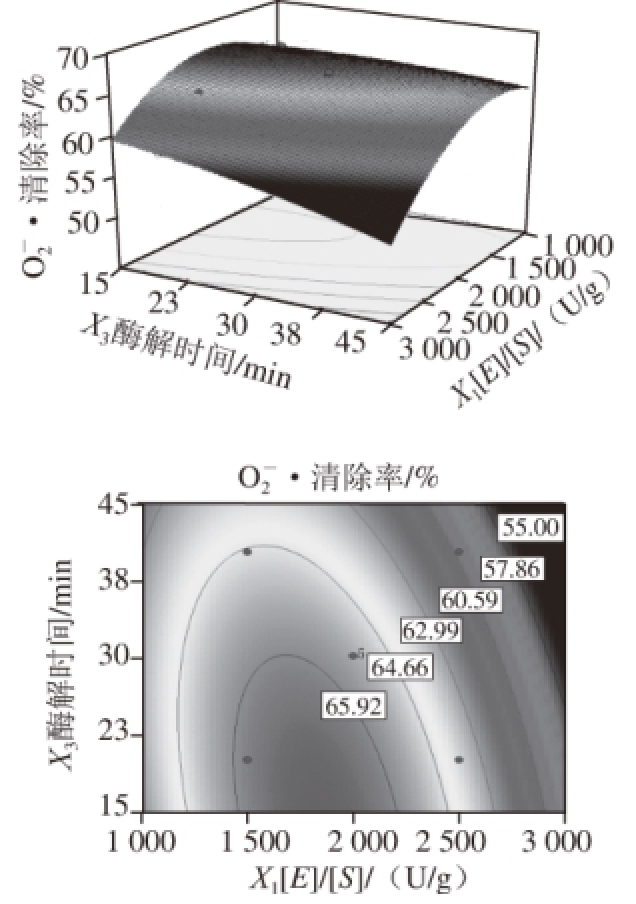
图6 酶解时间和[E]//[S]的交互作用对
 清除活性的响应面及等高线
清除活性的响应面及等高线
Fig. 6 Response surface and contour plots for the effect of [E]//[S] ratio and hydrolysis time on superoxide radical scavenging activity

图7 酶解时间和温度的交互作用对
 清除活性的响应面及等高线
清除活性的响应面及等高线
Fig. 7 Response surface and contour plots for the effect of hydrolysis time and temperature on superoxide radical scavenging activity
2.3.3 回归方程的建立与分析
试验结果釆用Design-Expert V8.0.6软件中的RS程序进行二次回归分析,计算回归方程中各系数,各因素回归拟合后,选择对响应值显著的各项,剔除不显著因子,得到鹰嘴豆抗氧化肽的
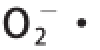 清除率Y对自变量(X
1、X
2、X
3)的二次多项回归方程为Y=65.40-1.82X
1-3.15X
2-1.13X
3-1.39X
1X
2-0.77X
1X
3-0.92X
2X
3-
清除率Y对自变量(X
1、X
2、X
3)的二次多项回归方程为Y=65.40-1.82X
1-3.15X
2-1.13X
3-1.39X
1X
2-0.77X
1X
3-0.92X
2X
3-
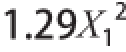 -1.37X
22。
-1.37X
22。
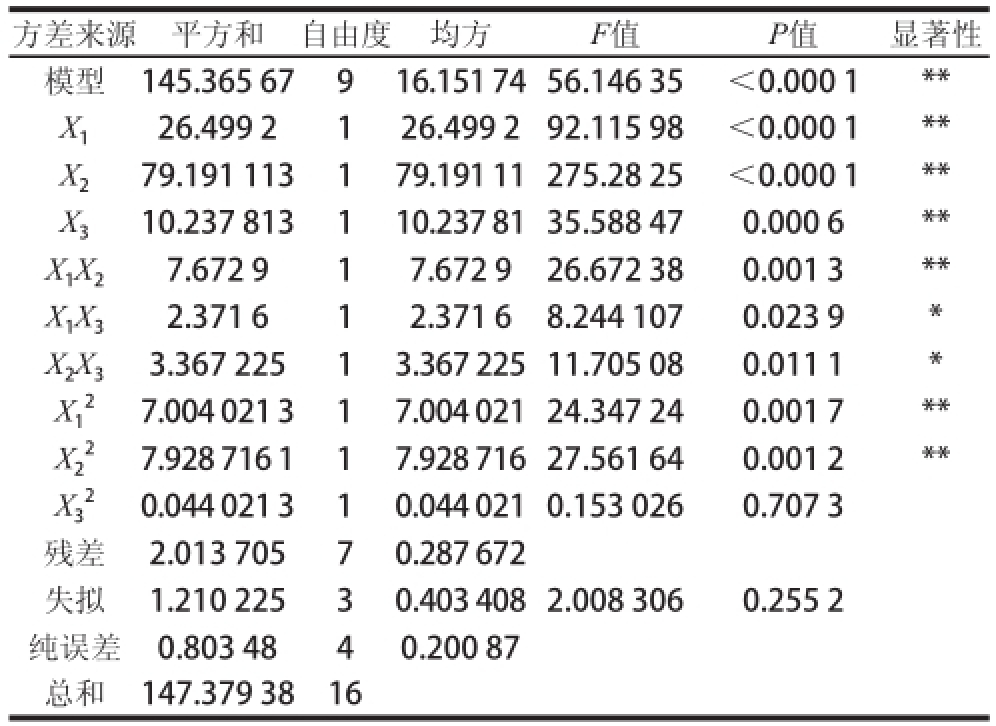
表4 响应面二次模型方差分析
Table 4 Analysis of variance for response surface quadratic model
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
方差来源平方和自由度均方F值P值显著性模型145.365 67916.151 74 56.146 35<0.000 1** X 126.499 2126.499 292.115 98<0.000 1** X 279.191 113179.191 11 275.28 25<0.000 1** X 310.237 813110.237 81 35.588 470.000 6** X 1X 27.672 917.672 926.672 380.001 3** X 1X 32.371 612.371 68.244 1070.023 9* X 2X 33.367 22513.367 225 11.705 080.011 1* 27.004 021 317.004 021 24.347 24 0.001 7** X2 27.928 716 117.928 716 27.561 640.001 2** X3 20.044 021 310.044 021 0.153 0260.707 3残差2.013 70570.287 672失拟1.210 22530.403 408 2.008 3060.255 2纯误差0.803 4840.200 87总和147.379 3816 X1
由表4可知,对回归方程进行方差分析,发现回归方程极显著,失拟检验为0.255 2(不显著),这说明此回归模型很理想,用方程拟合3 个因素与酶解产物的
 清除率之间的关系是可行的。试验误差小,故可用该回归模型代替试验真实点对试验结果进行预测。一次项X
1、X
2、X
3均对CPI酶解物的
清除率之间的关系是可行的。试验误差小,故可用该回归模型代替试验真实点对试验结果进行预测。一次项X
1、X
2、X
3均对CPI酶解物的
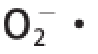 清除率有极显著影响,影响顺序为X
1>X
2>X
3;二次项
清除率有极显著影响,影响顺序为X
1>X
2>X
3;二次项
 、
、
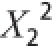 以及交互项中的X
1X
2项也对
以及交互项中的X
1X
2项也对
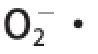 清除率有极显著影响,交互项X
1X
3和X
2X
3影响显著,表明各因素对
清除率有极显著影响,交互项X
1X
3和X
2X
3影响显著,表明各因素对
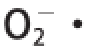 清除率的影响成二次关系,各因素间交互影响。李莹等
[28]在优化泥鳅蛋白酶法制备血管紧张素转化酶抑制肽的工艺时,发现pH值、温度、底物浓度以及酶的添加量等因素与血管紧张素转化酶抑制率之间不存在线性关系,只有在特定的DH时,其活性最佳,与本试验结果一致。
清除率的影响成二次关系,各因素间交互影响。李莹等
[28]在优化泥鳅蛋白酶法制备血管紧张素转化酶抑制肽的工艺时,发现pH值、温度、底物浓度以及酶的添加量等因素与血管紧张素转化酶抑制率之间不存在线性关系,只有在特定的DH时,其活性最佳,与本试验结果一致。
2.4 最佳酶解条件的验证
对回归模型进行优化后,得到最大响应值对应的最佳酶解条件为:底物质量分数2%、[E]/[S] 1 800 U/g、酶解温度32 ℃、pH 7.0、酶解时间35 min,代入方程得
 清除率为67.02%。在该条件下重复3 次实验,测得
清除率为67.02%。在该条件下重复3 次实验,测得
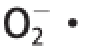 清除率为67.59%,与理论预测值的相对误差在±1%以内,说明建立的模型预测性能好,具有实际指导意义。此条件下所得CPI水解液的DH为4.23%。
清除率为67.59%,与理论预测值的相对误差在±1%以内,说明建立的模型预测性能好,具有实际指导意义。此条件下所得CPI水解液的DH为4.23%。
2.5 鹰嘴豆抗氧化肽的组成及序列
对CPI酶解液进行超滤处理,截留1 kD以下的酶解液,经LC-MS分析,发现其成分较为复杂(图8),美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库中共匹配出175 种肽段,主要来自于鹰嘴豆谷蛋白和球蛋白,而绝大部分亲水性短肽在前5 min已出峰。其中,在保留时间为3.77 min处的峰较为纯净,且含量相对较高,是一种亲水性五肽。由图8B、C可知,该肽的氨基酸序列为RQLPR,相对分子质量为668.40,与理论计算结果一致。
碱性氨基酸能够通过侧链的氨基螯合金属离子从而起到抗氧化作用,而本研究所得到的五肽具有两个碱性氨基酸(精氨酸)。此外,肽链中的亮氨酸和脯氨酸都是疏水性氨基酸,为其与疏水性自由基的结合提供了有利条件 [29]。由于谷氨酰胺含有两个氨基,与其形成的酰胺键的类型未知,得到的五肽的空间结构还有待进一步确认。
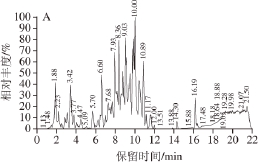
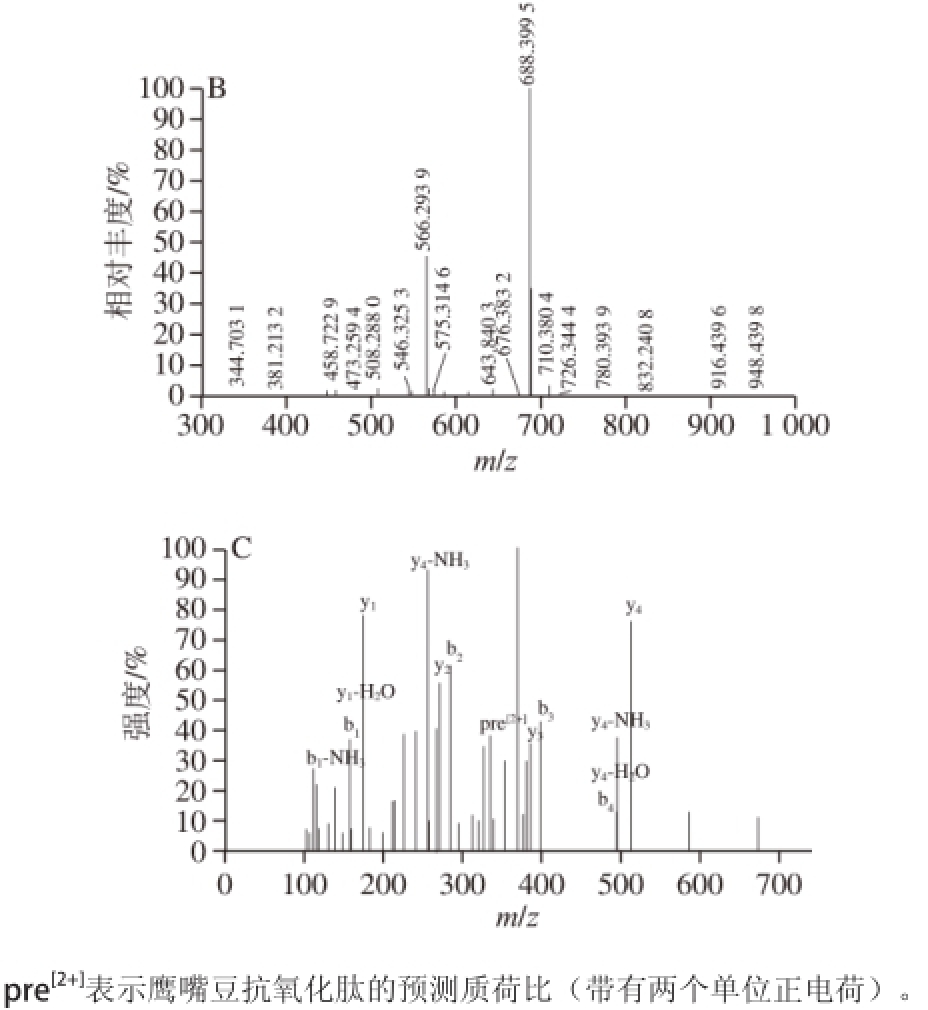
图8 鹰嘴豆抗氧化肽的LC图(A)、3.77 min处峰的MS图(B)和氨基酸序列图谱(C)C
Fig. 8 LC spectra of chickpea antioxidant peptides (A), and mass spectrum of the peak at 3.77 min (B) and amino acid sequence (C)
本实验以碱溶酸沉法制备了CPI,其蛋白质含量为93.29%;采用响应面法优化了得到了胰蛋白酶解制备鹰嘴豆抗氧化活性的最优酶解条件为:底物质量分数2%、[E]/[S] 1 800 U/g、酶解温度32 ℃、pH 7.0、酶解时间35 min。此条件下所制备的CPI水解液的
 清除率为67.59%,与理论预测值的相对误 差在±1%以内,说明建立的模型预测性能好,具有实际指导意义。1 kD以下的CPI水解液经LC-MS分析共检测出175 种肽,主要来自于鹰嘴豆谷蛋白和球蛋白,其中发现一种相对分子质量为668.40、序列为RQLPR的亲水性五肽。
清除率为67.59%,与理论预测值的相对误 差在±1%以内,说明建立的模型预测性能好,具有实际指导意义。1 kD以下的CPI水解液经LC-MS分析共检测出175 种肽,主要来自于鹰嘴豆谷蛋白和球蛋白,其中发现一种相对分子质量为668.40、序列为RQLPR的亲水性五肽。
参考文献:
[1] RUPELA O P. Natural occurrence and salient characters of nonnodulating chickpea plants[J]. Crop Science, 1992, 32(2): 349-35 2. DOI:10.2135/cropsci1992.0011183X00320 0020014x.
[2] 包兴国, 杨蕊菊, 舒秋萍. 鹰嘴豆的综合开发与 利用[J]. 草业科学,2006, 23(10): 34-37. DOI:10.3969/j.issn.1001-0629.2006.10.0 08.
[3] 刘勇民. 维吾尔药志[M]. 乌鲁木齐: 新疆人民出版社, 1986: 469.
[4] SINGH K B. Chickpea (Cicer arietinum L.)[J]. Field Crop Research,1997, 53: 161-170. DOI:10.1007/978-3-642-74448-8_5.
[5] POLTRONIERI F, A REAS J A G, COLLI C. Extrusion and iron bioavailability in chickpea (Cicer arietinum L.)[J]. Food Chemistry,2000, 70(2): 175-180. DOI:10.1016/S0956-7135(99)00113-9.
[6] 寇思荣,金维汉,王思慧. 鹰嘴豆种质资源丰产及抗性筛选试验[J].甘肃农业科技, 1995(12): 6-7.
[7] 李安金. 鹰嘴豆及其栽培[J]. 新疆农业科技, 1988(3): 5.
[8] 李朋收, 刘洋洋, 范冰舵, 等. 鹰嘴豆化学成分及药理作用研究进展[J]. 中国实验方剂学杂志, 2014, 20(11): 235-238. DOI:10.13422/ j.cnki.syfjx.2014110235.
[9] 肖俊松, 吴华, 张亚歌. 鹰嘴豆萌发过程中营养成分和抗营养因子的变化规律[J]. 食品科学, 2011, 32(23): 134-138.
[10] ZHANG T, JIANG B, MIAO M, et al. Combined effects of highpressure and enzymatic treatments on the hydrolysis of chickpea protein isolates and ant ioxidant activity of the hydrolysates[J]. Food Chemistry, 2012, 135(3): 904-912. DOI:10.1016/ j.foodchem.2012.05.097.
[11] 高捷, 王华, 寇晓虹, 等. 鹰嘴豆肽抑制肿瘤作用和对免疫功能的影响[J]. 食品科学, 2012, 33(3): 215-219.
[12] P A R E D E S L O P E Z O, O R D O R I C A F A L O M I R C,OLIVARESVAZQUEZ M R. Chickpea protein isolates: physicochemical, functional and nutritional characterization[J]. Journal of Food Science, 1991, 56(3): 726-729. DOI:10.1111/j.1365-2621.1991.tb05367.x.
[13] CHAVAN J K, KADAM S S, SALUNKHE D K. Biochemistry and technology of chickpea (Cicer Arietinum L.) seeds[J]. Critical Reviews in Food Science and Nutrition, 1986, 25(2): 107-158. DOI:10.1080/10408398709527449.
[14] CHAPMAN D G, CASTILLO R, CAMPBELL J A. Evaluation of protein in foods: 1. A method for the determination of protein efficiency ratios[J]. Canadian Journal of Biochemistry and Physiology,1959, 37(5): 679-686. DOI:10.1139/o59-074.
[15] ROY F, BOYE J I, SIMPSON B K. Bioactive proteins and peptides in pulse crops: pea, ch ickpea and lentil[J]. Food Research International,2010, 43(2): 432-442. DOI:10.1016/j.foodres.2009.09.002.
[16] TORRES-FUENTES C, CONTRERAS M D M, RECIO I, et al. Identification and characterization of antioxidant peptides from chickpea protein hydrolysates[J]. Food Chemistry, 2015, 180: 194-202. DOI:10.1016/j.foodchem.2015.02.046.
[17] 薛照辉, 刘珊娜, 李勇, 等. 鹰嘴豆蛋白的制备及其抗氧化活性[J]. 中国油脂, 2008, 33(8): 24-26. DOI:10.3321/ j.issn:1003-7969.2008.08.007.
[18] 李艳红. 鹰嘴豆蛋白酶解物的制备及其抗氧化肽的研究[D]. 无锡:江南大学, 2008: 41-53.
[19] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Chickpea chelating peptides inhibit copper-mediated lipid peroxidation[J]. Journal of the Science of Food and Agriculture, 2014, 94: 3181-3188. DOI:10.1016/ j.foodchem.2015.02.046.
[20] GUO Y J, ZHANG T, JIANG B, et al. The effects of an antioxidative pentapeptide derived from chickpea protein hydrolysates on oxidative stress in Caco-2 and HT-29 cell lines[J]. Journal of Functional Foods,2014, 7: 719-726. DOI:10.1016/j.jff.2013.12.013.
[21] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999: 11-12.
[22] AARSEN P N. Sensitization of guinea-pi g ileum to the action of bradykinin by trypsin hydrolysate of ox and rabbit plasma[J]. British Journal of Pharmacology and Chemotherapy, 1968, 32(3): 453-465. DOI:10.1111/j.1476-5381.1968.tb00446.x.
[23] 宁正祥. 食品成分分析手册[M]. 北京: 中国轻工业出版社, 1998: 119-120.
[24] WANG Z J, LUO D H. Antioxidant activities of different fractions of polysaccharide purified from Gynostemma pentaphyllum Makino[J]. Carbohydrate Polymers, 2007, 68(1): 54-58. DOI:10.1016/ j.carbpol.2006.07.022.
[25] 赵芳芳, 张日俊. 大豆肽研究进展[J]. 中国饲料, 2004(1): 22-23. DOI:10.3969/j.issn.1004-3314.2004.01.010.
[26] GHRIBI A M, SILA A, PRZYBYLSKI R, et al. Purification and identification of novel antioxidant p eptides from enzymatic hydrolysate of chickpea (Cicer arietinum L.) protein concentrate[J]. Journal of Functional Foods, 2015, 12: 516-525. DOI:10.1016/j.jff.2014.12.011.
[27] CLEMENTE A, VIOQUE J, SANCHEZ-VIOQUE R, et al. Production of extensive chickpea (Cicer arietinum L.) protein hydrolysates with reduced antigenic activity[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9): 3776-81. DOI:10.1021/jf981315p.
[28] 李莹, 曾晓雄, 周剑忠, 等. 泥鳅蛋白酶解工艺条件的优化[J]. 食品科学, 2013, 34(7): 190-195. DOI:10.7506/spkx1002-6630-201307040.
[29] SUETSUNA K, UKEDA H, OCHI H. Isolation and characterization of free radical scavenging activities peptides derived from casein[J]. Journal of Nutritional Biochemistry, 2000, 11(3): 128-131. DOI:10.1016/s0955-2863(99)00083-2.
Optimal Preparation of Antioxidant Peptides by Enzymatic Hysrolysis of Chickpea Protein Isolate with Trypsin
SHI Wenwei
1, WANG Wei
2, HU Bing
1, ZHOU Li
1, ZENG Xiaoxiong
1, SUN Yi
1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food Science and Pharmacy, Xinjiang Agricultural University, ☒rümqi 830052, China)
Abstract:Response surface methodology was employed to optimize the preparation conditions of antioxidant peptides by enzymatic hydrolysis of chickpea protein isolate (CPI), prepared by alkaline extraction and acid precipitation from chickpea seeds, with trypsin. The response variable was the percentage scavenging of superoxide anion radical. The results showed that all samples collected throughout the hydrolysis process had significant antioxidant activity and the optimal conditions were determined as substrate concentration 2%, enzyme/substrate ([E]/[S]) ratio 1 800 U/g, reaction time 35 min, temperature 32 ℃ and pH 7.0. Under these conditions, the percentage scavenging of superoxide anion radical by chickpea antioxidant peptides was 67.59%. Chickpea peptide fractions with molecular weight cut-off of 1 kD from chickpea protein hydrolysates by ultrafiltration were analyzed by liquid chromatography-mass spectroscopy (LC-MS). A pentapeptide with molecular weight of 668.40 in chickpea peptide fractions was achieved, whose amino acid sequence was determined to be RQLPR.
Key words:chickpea protein isolate; trypsin; antioxidant activity; response surface methodology
DOI:10.7506/spkx1002-6630-201615031
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)15-0185-07
收稿日期:2015-10-01
基金项目:江苏高校优势学科建设工程资助项目
作者简介:施文卫(1990—),男,硕士研究生,研究方向为食品生物技术。E-mail:2013108029@njau.edu.cn
*通信作者:孙怡(1966—),女,高级实验师,博士,研究方向为食品营养与化学。E-mail:sunyi01@njau.edu.cn
引文格式: